卡博替尼抵抗产单核细胞李斯特菌感染的体内实验研究
2017-12-19刘一帆广州医科大学附属第三医院检验科广州5055南方医科大学公共卫生与热带医学学院微生物学系广州医科大学附属第五医院通讯作者maillongminsmueducn共同通讯作者mail48840qqcom
肖 晴,龙 敏,刘一帆(广州医科大学附属第三医院检验科,广州 5055;南方医科大学公共卫生与热带医学学院微生物学系;广州医科大学附属第五医院;通讯作者,E-mail:longmin@smu.edu.cn;共同通讯作者,E-mail:48840@qq.com)
卡博替尼抵抗产单核细胞李斯特菌感染的体内实验研究
肖 晴1,龙 敏2*,刘一帆3#
(1广州医科大学附属第三医院检验科,广州 510515;2南方医科大学公共卫生与热带医学学院微生物学系;3广州医科大学附属第五医院;*通讯作者,E-mail:longmin@smu.edu.cn;#共同通讯作者,E-mail:2482840@qq.com)
目的 探究卡博替尼抗产单核细胞李斯特菌(Listeria monocytogenes,LM)感染的作用。 方法 24只6周龄C57BL/6小鼠随机分为不同剂量卡博替尼组,每组6只,腹腔注射LM菌液后,分别灌胃给予0,10,15,20 μg/g卡博替尼,比较四组小鼠肝脾细菌载量。另将6周龄C57BL/6小鼠随机分为卡博替尼组、氨苄青霉素(Ampicillin, Amp)组、卡博替尼和Amp联合用药组以及PBS对照组,腹腔注射LM菌液后,分别灌胃给予卡博替尼20 μg/g、腹腔注射氨苄青霉素20 μg/g、灌胃卡博替尼20 μg/g后腹腔注射20 μg/g氨苄青霉素、以及腹腔注射等量PBS,比较四组小鼠的生存曲线、肝脾细菌载量以及肝脏病理改变。 结果 随着卡博替尼剂量增加,肝脾细菌载量逐渐降低,其中20 μg/g剂量组相比PBS组,肝脾细菌载量显著降低(P<0.01);卡博替尼单独用药组小鼠相比PBS对照组小鼠,生存率较高、肝脏和脾脏的细菌载量较低(P<0.05)、肝脏炎症病变程度轻,联合用药组比卡博替尼单独用药组小鼠的肝脾细菌载量均显著降低(P<0.05)。 结论 体内实验研究结果提示卡博替尼具有抵抗产单核细胞李斯特菌感染的作用。
卡博替尼; 产单核细胞李斯特菌; 小鼠
产单核细胞李斯特菌(Listeria monocytogenes,LM)是一种对人类致病的胞内寄生菌,它广泛分布于自然界,如土壤、污水、屠宰场、青饲料、食品生产加工器具及多种食品,动物和人体也可带有此菌[1]。LM可引起人和动物多种李斯特菌病,包括败血症、脑炎、脑膜脑炎等,特别是孕妇以及免疫缺陷者。
目前治疗LM感染大多依赖于抗生素的应用,曲伐沙星、阿莫西林等抗生素虽然可以在一定程度上抵抗细胞外LM感染,但是对细胞内LM感染作用极其有限[2,3]。LM引起的细胞内感染仍然是医学上一个严峻的挑战,其主要原因是药物无法进入细胞内杀菌和相对忽视了宿主的抗菌机制。因此,发展新型抗胞内感染药物是目前亟待解决的医学问题之一。
LM重要毒力因子-内化素B(internalin B,InlB)是一种侵袭蛋白,大小约67 kDa,属于内化素蛋白家族,可模拟天然宿主细胞配体肝细胞生长因子/分散因子(HGF/SF),特异性结合HGF/SF受体(HGF/SF-R或c-Met),激活与细菌内吞相关的c-Met介导的信号级联放大,诱发细菌内吞[4]。卡博替尼(cabozantinib)是一种口服的多种受体酪氨酸激酶抑制剂,美国食品药品管理局(FDA)已批准卡博替尼用于转移性甲状腺髓样癌的[5]。本研究拟运用动物体内模型,验证c-Met抑制剂卡博替尼对李斯特菌体内感染的阻断作用,探讨卡博替尼作为LM感染治疗药物的可行性。
1 材料和方法
1.1 菌株和主要试剂
采用的产单核细胞李斯特菌ATCC株13932(血清型4b)由美国南加州大学keck医学院血液和感染性疾病系提供;卡博替尼(XL-184)购自美国Santa公司;氨苄青霉素(Amp)购自美国Sigma;其他试剂均购自广州鼎国生物科技有限公司。
1.2 实验动物
6周龄雌性C57BL/6小鼠,SPF级,体质量18-22 g,购买于南方医科大学动物实验中心(SYXK(粤)2016-0167)。
1.3 菌株培养
将产单核细胞李斯特菌划线接种于BHI固体培养基,37 ℃恒温培养16 h,挑取单一菌落于BHI液体培养基中37 ℃、180 r/min振荡培养2代,再重新接种于新鲜的BHI液体培养基中,摇至对数生长期,10 000 r/min离心1 min,用高压灭菌PBS洗涤3次,然后稀释菌液至5×106CFU/ml备用。
1.4 不同剂量卡博替尼处理的肝脾活菌计数
取24只小鼠,随机分为不同剂量卡博替尼组:0,10,15,20 μg/g,每组各6只。每组小鼠腹腔注射产单核细胞李斯特菌菌液100 μl(5×106CFU/ml),在给菌前2 h和给菌后的第24小时分别灌胃给予相应剂量的卡博替尼。给菌后的第48小时,给予小鼠10%水合氯醛200 μl,麻醉后无菌打开其胸腔,暴露心肺,用1 ml注射器从心尖处抽取200 μl血液,然后用剪刀或针尖刺破心脏右心耳,并从心尖处注入30 ml预冷PBS,直到小鼠肺部变白为止,说明体循环灌注冲洗效果良好。取其肝脏和脾脏。一半组织称重后,加入1 ml PBS研磨成匀浆,倍比梯度稀释后,涂布于BHI固体培养基中,放入37 ℃恒温培养箱中过夜,次日计数平板菌落数,计算出各组小鼠肝脏、脾脏中的活菌数。另一半肝脏组织固定于10%甲醛中,4 ℃保存,HE染色以进行组织病理学检查。48 h内死亡小鼠立即解剖取其肝、脾。
1.5 小鼠生存曲线分析
将36只小鼠随机分为4组:卡博替尼组、氨苄青霉素组、卡博替尼联合氨苄青霉素组、PBS对照组,每组各9只,每只小鼠腹腔注射1×106CFU LM,并分别在感染后第6,12,24小时给药,卡博替尼组小鼠灌胃给予卡博替尼20 μg/g,氨苄青霉素组小鼠腹腔注射氨苄青霉素20 μg/g、联合用药组小鼠灌胃卡博替尼20 μg/g后腹腔注射20 μg/g氨苄青霉素,对照组小鼠腹腔注射等量PBS。每天记录观察小鼠的临床症状和生存情况,共5 d。
1.6 肝脏HE染色
采集的肝脏组织于10%甲醛固定后,经水洗、脱水、透明、浸蜡、包埋、修块、切片、贴片、烤片、HE染色、封片后,于显微镜下进行病理观察。
1.7 卡博替尼与Amp 协同作用分析
取24只小鼠,随机分为卡博替尼组、Amp组、卡博替尼+Amp组、PBS组,每组各6只。每组小鼠腹腔给予产单核细胞李斯特菌菌液100 μl(5×106CFU/ml),分别在感染后第2,6,24小时给药,给药方式同1.4,给菌后第48小时无菌取其肝、脾进行活菌计数。48 h内死亡小鼠,于死亡2 h内解剖。
1.8 统计学分析
2 结果
2.1 卡博替尼的抑菌作用
解剖小鼠,取其肝脾进行活菌计数。结果显示,随着卡博替尼剂量增加,肝脾细菌量有所减少,15 μg/g剂量组和20 μg/g剂量组相比于PBS对照组,肝脏细菌载量均显著降低[(5.78±0.28)log10CFUvs(8.28±0.20)log10CFU,P<0.001;(4.33±0.29)log10CFUvs(8.28±0.20)log10CFU,P<0.01], 脾脏细菌载量也显著减少[(4.24±0.45)log10CFUvs(7.35±0.30)log10CFU,P<0.01;(4.08±0.27)log10CFUvs(7.35±0.30)log10CFU,P<0.01,见图1]。
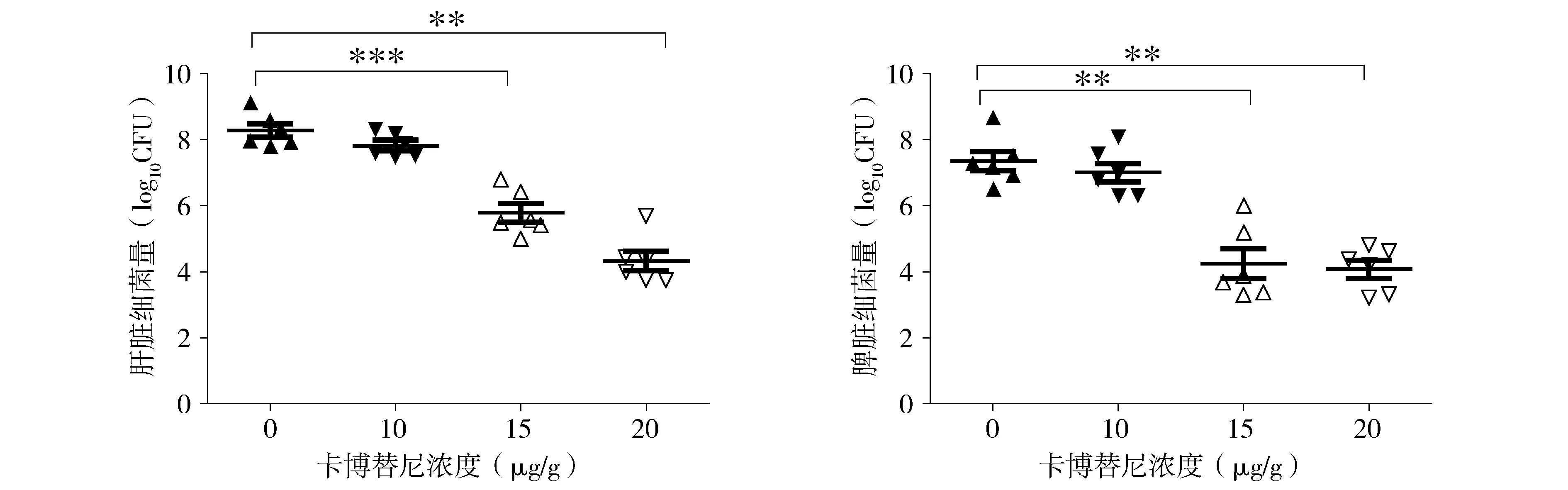
组间比较,**P<0.01,***P<0.001图1 不同剂量卡博替尼处理的肝、脾细菌载量Figure 1 Liver and spleen bacterial loads in different dosage groups of cabozantinib
2.2 小鼠生存率比较
注射1×106CFU LM后第12小时,PBS组个别小鼠开始出现明显的发抖、蜷缩、抱团等临床症状,食欲下降,精神萎靡,给菌后24 h内死亡3只小鼠,5 d内共死亡7只小鼠,120 h内小鼠生存率为22.3%;卡博替尼组小鼠在给菌后24 h内死亡3只小鼠,之后无小鼠死亡,比对照组小鼠的生存率明显增加,达到66.7%;氨苄青霉素单独用药组生存率为88.9%;卡博替尼联合氨苄青霉素组小鼠的生存率为100%(见图2)。
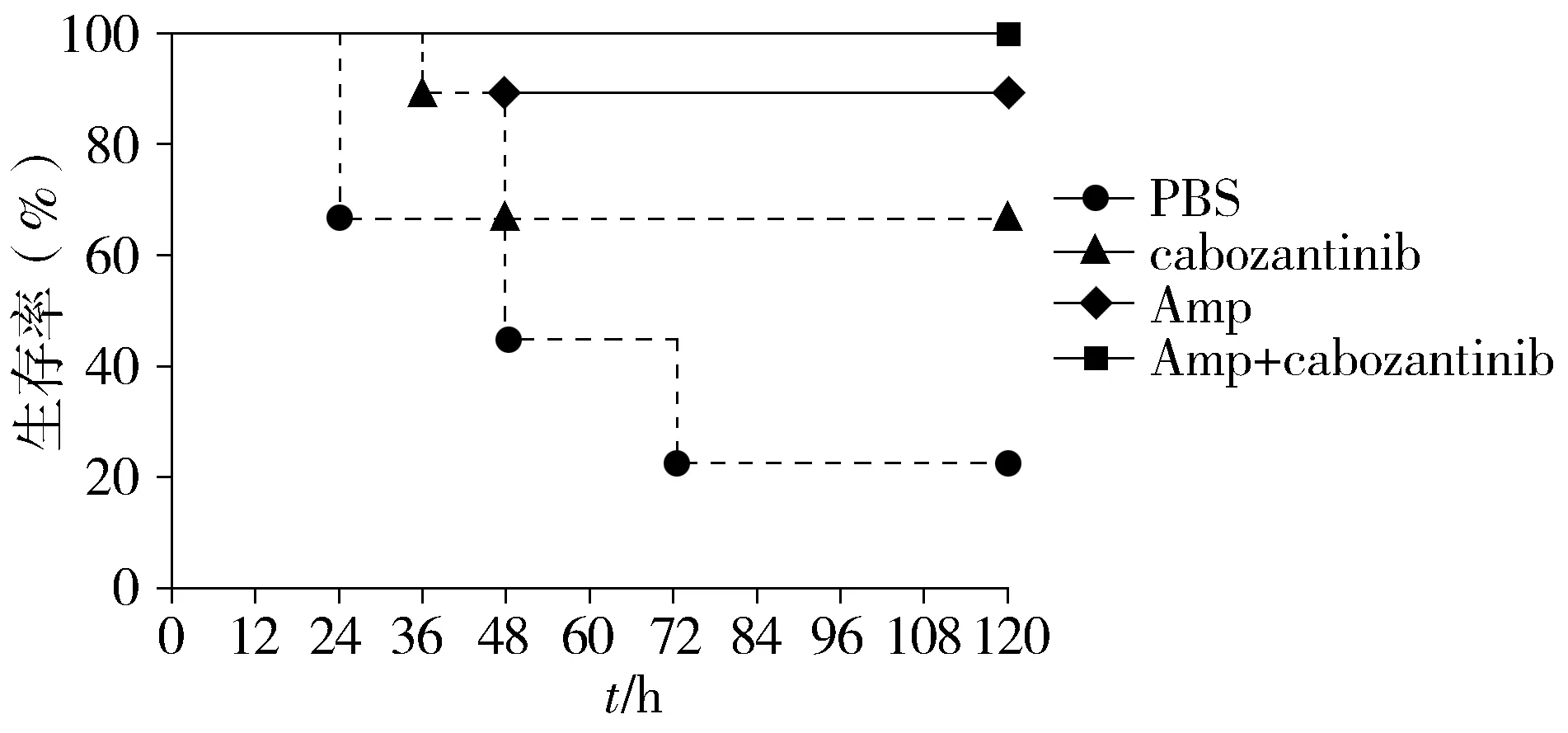
图2 各组生存曲线比较Figure 2 Comparison of survival curve among four groups
2.3 肝脏病理观察
取卡博替尼处理组和PBS组小鼠肝脏进行HE染色,结果显示PBS组小鼠肝脏出现大量中性粒细胞浸润,水肿,且有明显的脓肿组织,炎症程度比较严重,而卡博替尼组小鼠肝脏未见明显的炎性粒细胞,未出现水肿,炎症变化较轻(见图3)。
2.4 卡博替尼联合Amp的抑菌作用
把小鼠分为PBS组、卡博替尼组、Amp组以及卡博替尼和Amp联合用药组,解剖小鼠后,取其肝脾匀浆计数,结果显示卡博替尼组肝脏细菌载量显著低于PBS组[(4.68±0.99)log10CFUvs(7.71±0.45)log10CFU,P<0.05],联合用药组肝脏细菌载量亦明显低于卡博替尼单独用药组[(0.66±0.66)log10CFUvs(4.68±0.99)log10CFU,P<0.05],差异具有统计学意义;且联合用药组相比卡博替尼组,脾脏细菌载量显著减少[(0.41±0.41)log10CFUvs(3.98±0.82)log10CFU,P<0.05,见图4],表明卡博替尼与氨苄青霉素联合用药可增强对LM感染的抵抗作用。
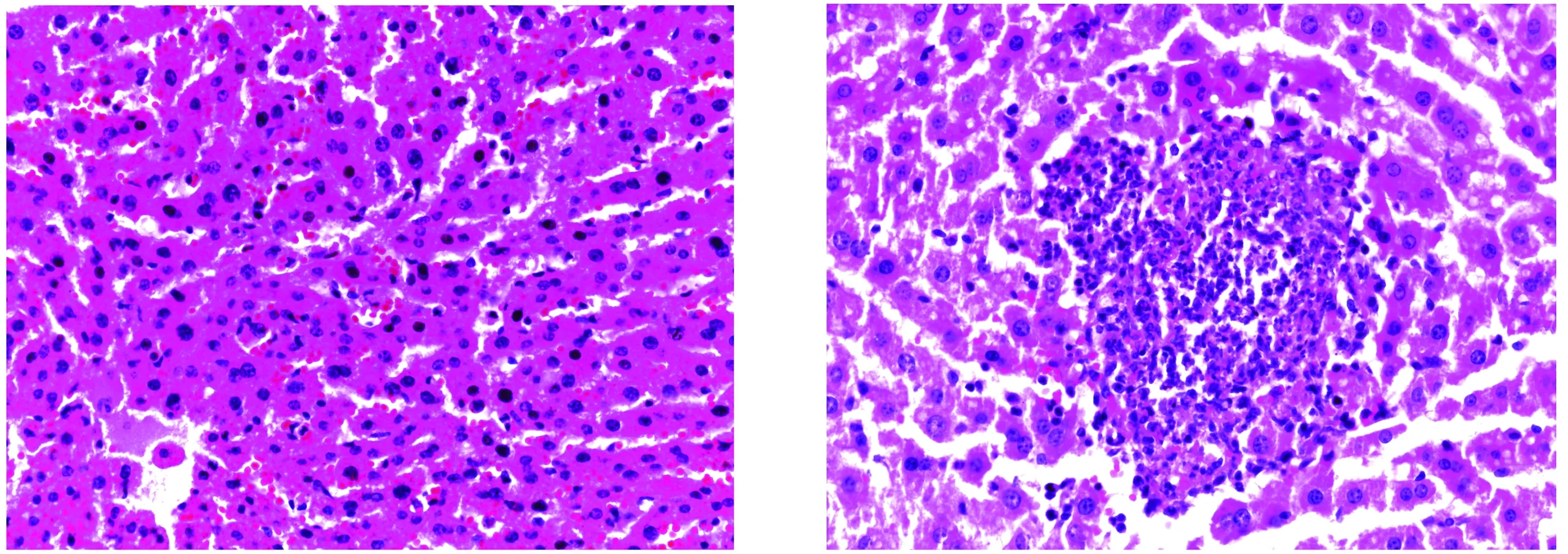
A.卡博替尼组 B. PBS组图3 卡博替尼处理后肝脏病理变化(10×40)Figure 3 Pathological changes of the liver tissues after treatment with cabozantinib(10×40)
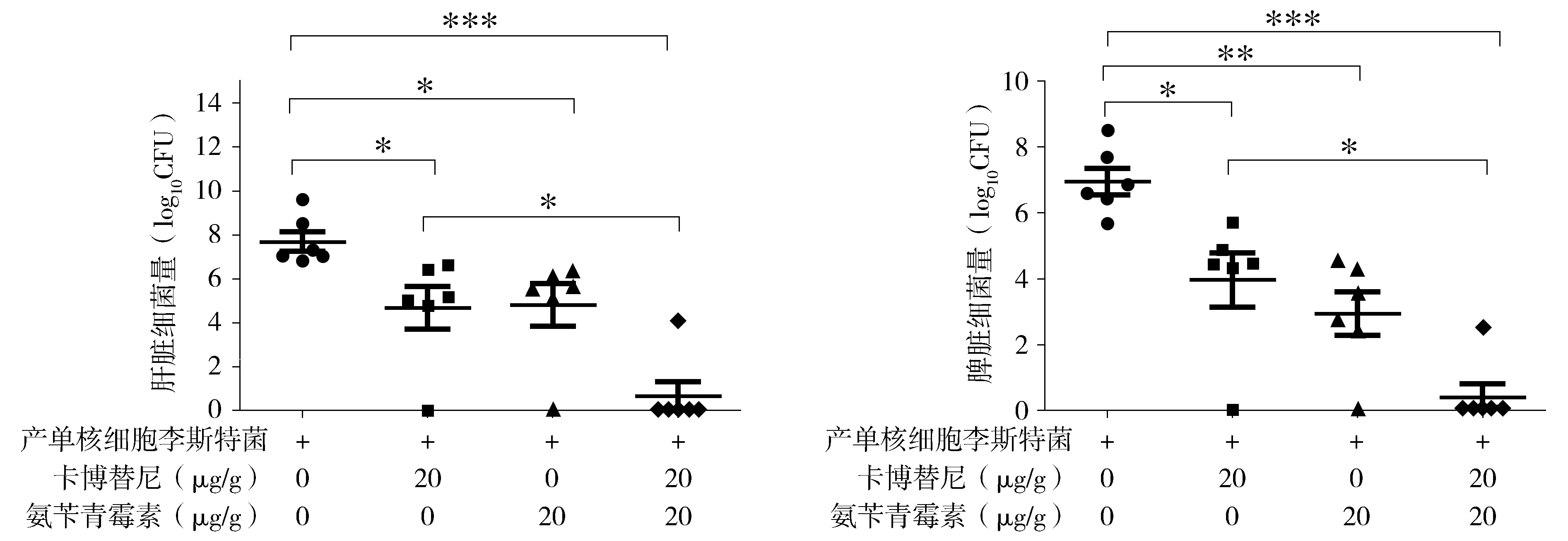
*P<0.05,**P<0.01,***P<0.001图4 卡博替尼联合氨苄青霉素用药下肝脾细菌载量Figure 4 Changes of liver, spleen bacterial loads after treated with cabozantinib and ampicillin
3 讨论
产单核细胞李斯特菌入侵宿主细胞是通过“拉链式”机制,即细胞表面配体与宿主细胞膜受体结合,激活胞内信号通路,造成肌动蛋白骨架重排引发细胞膜对细菌的渐进包裹吞噬,介导该过程的李斯特菌表面配体为内化素(internalin,Inl),其中Inl A和Inl B是非吞噬细胞内化所必需的内化素,为LM所特有。Inl B与宿主细胞膜肝细胞生长因子(HGF-R/Met)结合后,诱发胞内酪氨酸位点磷酸化,促进信号级联放大诱导细菌内吞[6]。目前,针对包括LM在内的细胞内感染菌,宿主介导地抑制细胞信号通路激活的抗菌治疗方法日益广泛[7-9]。在人类肿瘤的形成和转移过程中,c-Met被异常激活所产生的异常信号是最常见的改变之一,c-Met介导的信号传导通路在LM入侵宿主细胞过程中同样重要[10]。c-Met抑制剂卡博替尼已获PDA批准用于多种临床疾病的治疗[11,12],作为可能的新型抗菌药物具有两个优点,一方面卡博替尼是一种小分子抑制剂,可以穿过血脑屏障,在治疗LM引发的中枢神经系统感染上很有优势。另一方面,InlB是LM侵入细胞所必需的。
LM早期能通过肠道屏障进入深层组织,并迅速转移至淋巴结、肝脏和脾脏中,转移的数量与感染的数量成正比,肝脏和脾脏中LM细菌载量可以反应机体感染LM的程度,而Inl B在LM定植肝脾过程中,起着重要作用,靶向InlB介导的侵袭对于发展特异性阻断LM细感染的新型治疗手段非常重要[13]。卡博替尼可以阻断InlB与c-Met的结合,因此在一定程度上可降低肝脾中LM的细菌载量。本研究表明,随着卡博替尼剂量增加,肝脾细菌量逐渐降低,说明卡博替尼能够抵抗产单核细胞李斯特菌在肝脾的定植。而比较不同处理组小鼠的生存率、肝脾细菌载量以及肝脏病理变化,结果显示:卡博替尼组、Amp组、卡博替尼+Amp组三组小鼠的生存率较PBS组高;注射卡博替尼的小鼠肝脾细菌量显著地低于对照组;通过肝脏HE染色结果可以判断,卡博替尼能够减轻肝脏的炎性病变。目前青霉素类抗生素是治疗LM胞内感染的首选药物,可阻断细菌肽聚糖的合成从而抑制细胞外细菌的生长,而卡博替尼可阻断LM与细胞表面受体的结合,阻止细菌进入细胞,而LM是一种胞内寄生菌,故卡博替尼和青霉素的联合使用会降低LM对宿主细胞的感染。本研究的数据显示卡博替尼和氨苄青霉素联合使用,其肝脾细菌量最少,在一定程度上证明了卡博替尼能够协同抗生素治疗LM感染,具有一定的临床使用价值。
综上所述,本研究通过体内试验证明了卡博替尼能抵抗产单核细胞李斯特菌在肝脾的定植,并与氨苄青霉素联合使用可增强对LM的抑菌作用,对研究新型治疗胞内细菌感染的药物具有一定积极作用。
[1] 朱献忠. 单核细胞增生性李斯特菌研究进展[J]. 中国卫生检验杂志, 2007, 17(7):1333-1335.
[2] Michelet C,Leib SL,Bentue-Ferrer D,etal. Comparative efficacies of antibiotics in a rat model of meningoencephalitis due to Listeria monocytogenes[J]. Antimicrob Agents Chemother, 1999, 43(7):1651-1656.
[3] van Ogtrop ML. The antibacterial efficacy of trovafloxacin against an experimental infection with Listeria monocytogenes in hydrocortisone-treated mice[J]. J Antimicrob Chemother, 1999, 44(2): 229-234.
[4] Bierne H, Cossart P. InlB, a surface protein of Listeria monocytogenes that behaves as an invasin and a growth factor[J]. J Cell Sci, 2002, 115(Pt 17):3357-3367.
[5] 张秀颖, 刘尧, 白秋江, 等. 新型分子靶向抗癌药物卡博替尼[J]. 医药导报, 2013, 32(11): 1468-1470.
[6] 崔焕忠, 乔立桥, 王义冲. 单核细胞增生性李斯特菌的主要毒力因子及其致病机理[J]. 中国畜牧兽医, 2010, 37(1): 128-133.
[8] Chiu HC, Soni S, Kulp SK,etal. Eradication of intracellular Francisella tularensis in THP-1 human macrophages with a novel autophagy inducing agent[J]. J Biomed Sci, 2009, 16(1): 110.
[9] Collier MA, Gallovic MD, Peine KJ,etal. Delivery of host cell-directed therapeutics for intracellular pathogen clearance[J]. Expert Rev Anti Infect Ther, 2013, 11(11):1225-1235.
[10] Banerjee M, Copp J, Vuga D,etal. GW domains of the Listeria monocytogenes invasion protein InIB are required for potentiation of Met activation[J]. Mol Microbiol, 2004, 52(1):257-271.
[11] Zhang B, Zhang X,Zhou T,etal. Clinical observation of liver cancer patients treated with axitinib and cabozantinib after failed sorafenib treatment:a case report and literature review[J].Can-cer Biol Ther, 2015,16(2):215-218.
[12] Fallahi P, Ferrari SM, Bari FD,etal. Cabozantinib in thyroid cancer[J].Recent Pat Anticancer Drug Discov,2015,10(3):259-269.
[13] 焦颖,张巍. 李斯特菌生物学特征与临床相关性[J]. 中国感染与化疗杂志, 2015,15(5): 491-495.
ExperimentalstudyoncabozantinibagainstinfectioncausedbyListeriamonocytogenesinmice
XIAO Qing1, LONG Min2*, LIU Yifan3#
(1ClinicalLaboratory,ThirdAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510515,China;2DepartmentofMicrobiology,SchoolofPublicHealthandTropicalMedicine,SouthernMedicalUniversity;3FifthAfficiatedHospitalofGuangzhouMedicalUniversity;*Correspondingauthor,E-mail:longmin@smu.edu.cn;#Co-correspondingauthor,E-mail:2482840@qq.com)
ObjectiveTo explore the effect of cabozantinib on the infection of Listeria monocytogenes(LM).MethodsThe 24 6-week-old mice(C57BL/6) were randomized into four groups(n=6 each) and treated with 0,10,15,20 μg/g cabozantinib by intragastric injection after intraperitoneal injection of LM,respectively, and then the bacterial counts in liver and spleen were compared among four groups. The 6-week-old mice were randomized into cabozantinib group, ampicillin(Amp) group, combination group and PBS control group, and were respectively treated with cabozantinib(20 μg/g) by intragastric injection, Amp(20 μg/g) by intraperitoneal injection, cabozantinib in combination with Amp, and equal PBS by intraperitoneal injection after intraperitoneal injection of LM. And then the survival curve,the number of bacteria in liver and spleen and pathological changes of liver tissue were compared.ResultsThe bacterial load in liver and spleen was decreased gradually with the increase of cabozantinib. And the bacteria load in liver and spleen was lower in 20 μg/g cabozantinib group than in PBS group(P<0.01). The survival rate was higher and the bacterial load in liver and spleen was lower in 20 μg/g cabozantinib group than in PBS group(P<0.05), and the pathological changes was lighter. The bacterial load in liver and spleen in combination group was lower than that in cabozantinib group(P<0.05).ConclusionThe vivo experiment indicates that cabozantinib could resist the infection of LM.
cabozantinib; Listeria monocytogenes; mice
肖晴,女,1990-05生,硕士,初级检验技师,E-mail:972740185qq.com
2017-06-02
R446.5
A
1007-6611(2017)12-1255-05
10.13753/j.issn.1007-6611.2017.12.012
