老年慢性肾衰大鼠心肌缺血预处理后胎盘生长因子的表达及其意义
2017-12-19董星彤付文静邓英辉首都医科大学宣武医院肾内科北京100053通讯作者Email2008happyqiangsinacom
董星彤,贾 强,付文静,邓英辉,刘 华,林 娜(首都医科大学宣武医院肾内科,北京 100053;通讯作者,Email:2008happyqiang@sina.com)
老年慢性肾衰大鼠心肌缺血预处理后胎盘生长因子的表达及其意义
董星彤,贾 强*,付文静,邓英辉,刘 华,林 娜
(首都医科大学宣武医院肾内科,北京 100053;*通讯作者,E-mail:2008-happyqiang@sina.com)
目的 观察老年慢性肾衰大鼠经过心肌缺血预处理(ischemic preconditioning,IPC)后心肌组织胎盘生长因子(placental growth factor,PlGF)的表达,探讨PlGF在老年慢性肾衰大鼠心肌损伤修复中可能的作用。 方法 20月龄雄性SD大鼠16只,全部进行肾大部分切除(Platt法)制备慢性肾衰模型,随即分成IPC组和假手术组,每组8只。IPC组:结扎冠状动脉前降支使其缺血6 min,随后再灌注6 min,反复4次;假手术(sham)组:开胸操作同IPC组,但不阻断冠脉血流。术后12 h,麻醉后取两组大鼠心脏组织,分别用Western blot及免疫组化法检测PlGF在心肌组织中蛋白表达水平。 结果 Western blot方法测定IPC组中边缘区心肌组织中、缺血区域心肌组织中PlGF表达水平均较假手术组及IPC组非缺血区明显增高(P<0.01)。免疫组化染色显示IPC组心肌组织中PlGF表达水平较假手术组明显增高(P<0.01)。 结论 经IPC处理后,老年慢性肾衰大鼠心肌组织中PlGF表达增高,提示IPC在老年慢性肾衰大鼠中PlGF可能在缺血心肌保护过程中的一个重要作用。
心肌缺血预处理; 胎盘生长因子; 慢性肾衰竭; 大鼠
冠状动脉硬化性心脏病(冠心病)是在我国城镇居民除恶性肿瘤及脑血管病以外的主要死亡原因之一,而在老年人更是冠心病的高发人群。患有慢性肾衰的冠心病老年患者,由于其肾功能的受损,冠脉内支架植入术、冠状动脉旁路移植术、经皮冠状动脉血管成形术等各种冠心病的治疗手段的使用受到限制,往往得不到及时有效的治疗,最终影响生活质量甚至危及生命。作为目前机体内较强大的心肌缺血损伤自我防御机制,缺血预处理(ischemic preconditioning,IPC)对心肌缺血性损伤的内源性保护是目前冠心病临床治疗的新思路。因此,研究冠心病高发的老年慢性肾衰患者的心肌缺血损伤防御机制也可能为这部分患者的临床治疗提供新的可能。IPC是指短暂的、非致死性的心肌缺血,通过促发机体自身的血管生成过程,增加缺血区心肌的单位面积毛细血管密度,可以使心肌对随后致死性的心肌缺血的抵抗力增强[1-3]。缺血预处理现象,是指短暂的、非致死性的心肌缺血可以使心肌对随后致死性的心肌缺血的抵抗力增强。研究发现,IPC存在早期相(early IPC,EIPC)和延迟相(delayed IPC,DIPC),早期相在IPC后立即开始,持续1-2 h;延迟相在IPC后6-12 h开始,24-48 h作用达高峰,且DIPC可以提供比EIPC更持久和强大的保护作用。研究表明IPC的促血管生成作用有多种因子参与,如血管内皮生长因子(vascular endothelial growth factor,VEGF),而胎盘生长因子(placental growth factor,PlGF)是VEGF家族中的一个成员。它于1991年由Maglione等[4]在人类胎盘中发现。PlGF在正常妊娠胎盘及母血中呈高表达状态[5-8]。此外,心肌细胞[9,10]、血管内皮细胞和平滑肌细胞[11,12]中也均有PlGF的表达;激活或者应激状态下肿瘤细胞、骨髓细胞、炎症细胞、神经元细胞及平滑肌细胞在也产生大量P1GF[9,13],PlGF可通过一系列复杂的信号转导过程促进内皮细胞迁移、生长和存活直接刺激血管新生[14],促进平滑肌细胞增殖和募集使血管成熟[15]等进而促进血管生成。此外,PlGF能够通过调高Flt-1、VEGF-A和VEGF-2的表达,协同VEGF-A产生重要的血管生成效应[5]。由于IPC与PlGF均有刺激血管生成的作用,目前对于PlGF与IPC的缺血心肌保护作用是否直接相关,IPC是否会启动这一因子对缺血心肌的保护作用,迄今尚无相关的研究。
本研究旨在观察老年慢性肾衰大鼠中IPC后PlGF表达的变化,并探讨其是否可能为老年慢性肾衰患者合并冠心病的治疗提供新思路。
1 对象与方法
1.1 研究对象及实验分组
16只20月龄雄性SD大鼠,SPF级,由北京维通利华公司[SCXK(京)2012-0001]提供,体质量(600±20)g。
老年大鼠随机分为2组:IPC组(n=8,于IPC后12 h麻醉后摘除心脏取材);假手术(sham)组(n=8,于模型制备完成后12 h麻醉后摘除心脏取材)。
1.2 结扎老年慢性肾衰大鼠冠脉前降支建立心肌缺血预处理模型
按照经典Platt法[6]制作慢性肾衰模型。用2%戊巴比妥钠按40 mg/kg剂量腹腔注射麻醉。大鼠左肾切除2/3,术后10 d行右肾全切除。在老年慢性肾衰大鼠建立成功后将大鼠随机分为IPC组及sham组。IPC模型的制作参照文献[9]的方法并稍作修改。抽取1%的戊巴比妥钠,按照50 mg/kg对大鼠进行腹腔注射麻醉,进行气管插管连接呼吸机辅助呼吸,连接心电监护仪并以Ⅱ导联进行心电监护。开胸,暴露出心脏,在冷光源聚光灯照射下找到冠状动脉前降支(left anterior descending artery,LAD),用细针穿线于左心耳下缘约2 mm处后将缝线穿过中心有孔的圆形塑料片及中心为空的小圆柱形塑料管,将缝线提起,用止血钳夹紧缝线并下压塑料管以阻断冠脉血流6 min,然后松开止血钳,使血流再通6 min,如此反复4次完成IPC过程。以心电图ST段逐渐抬高作为缺血成功的标志,以心电图出现再灌注心律失常作为心肌再灌注成功标志。完成IPC后,保留缝线并关胸。IPC组只进行IPC处理,操作完成后保留缝线并关胸。假手术组开胸后于冠状动脉前降支下穿线,但不阻断冠状动脉血流即不造成心肌缺血,将心脏曝露约48 min后关胸。
1.3 大鼠心脏标本留取

1.4 Western blot方法检测心肌组织中PlGF的蛋白表达
在研钵内倒入少量液氮,放入心肌组织100 mg研碎,随后进行离心。然后用BCA法测蛋白浓度。制备15% SDS-PAGE分离胶及5% SDS-PAGE浓缩胶。加入PlGF样品,随后进行电泳及电转。电转结束后将取下NC膜,在摇床上室温封闭1 h,进行一抗、二抗反应,用Odyssey红外成像系统检测荧光条带并分析条带灰度。
1.5 免疫组织化学法检测缺血心肌中PlGF的表达

1.6 统计学分析
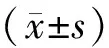
2 结果
2.1 老年慢性肾衰大鼠术后12 h心肌组织中PlGF蛋白表达情况
本研究用Western blot方法检测了IPC组及假手术组老年慢性肾衰大鼠术后12 h这一时间点的心肌组织中PlGF蛋白的表达情况,以β-actin为内参。sham老年慢性肾衰大鼠术后12 h PlGF表达水平极低,IPC组中的非缺血区域的心肌组织PlGF蛋白表达水平与sham组近似,而IPC组中边缘区心肌组织中、缺血区域心肌组织中PlGF表达水平均较假手术组及IPC组非缺血区明显增高(P<0.01,见图1)。2.2 免疫组织化学法测定老年慢性肾衰大鼠IPC组缺血心肌组织中PlGF表达IPC组心肌组织中PlGF表达水平均较假手术组明显增高(P<0.01,见图2)。
3 讨论
临床研究发现,如果患者在发生心肌梗死之前出现前驱心绞痛症状,那么这类患者的心梗面积会比发生心肌梗死前未发生前驱心绞痛症状的患者的心梗面积小,预后也较好,这是IPC对缺血的心肌进行保护的表现之一[8-11]。在大量的基础实验中,IPC也被证实具有减少心肌细胞的凋亡和坏死、缩小心肌梗死面积的作用。Kawata等[1]通过大鼠心肌梗死模型研究发现缺血预处理通过增加心肌缺血区VEGF的表达,促进血管生成发挥心肌保护作用。
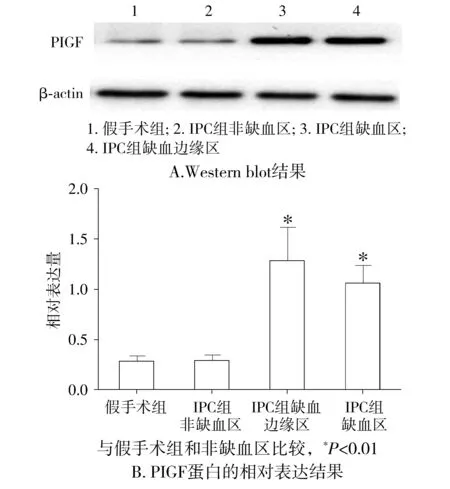
图1 老年慢性肾衰大鼠IPC和假手术组术后12 h心肌组织中PlGF蛋白的表达 (n=8)Figure 1 Expression of PlGF in senior CRF rats at 12 h after operation in sham group and IPC group (n=8)
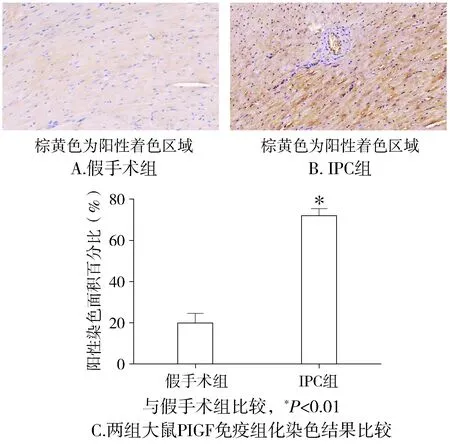
图2 老年慢性肾衰大鼠术后12 h心肌组织PlGF表达的免疫组化染色(DAB显色,苏木素复染,×200)Figure 2 Immunohistochemical staining for PlGF in myocardial tissue of senior CRF rats at 12 h after ope-ration (DAB,×200)
另一研究表明抑制VEGF的表达及VEGF介导的信号反应,血管生成明显减少,缺血预处理的心肌保护作用显著减弱[12]。
VEGF家族中的PlGF在各个生理或病理条件下的促血管新生作用受到广泛研究。目前的研究表明,在恶性肿瘤[13]、缺血性疾病、软骨和骨修复类风湿性关节炎等多种疾病中PlGF都通过促血管新生发挥作用。PlGF通过结合其相应受体Flt-1[12],激活一系列下游信号转导通路,最终促进血管生成。此外,PlGF还能协同VEGF-A产生重要的血管生成效应[7]。Wu等[16]在给予猪心肌缺血模型应用重组PlGF-2后观察到PlGF-2不仅可以促进局部心肌的血供,还可以增强心肌收缩力以及改善心功能。Pan等[17]对急性心梗大鼠模型给予外源性PlGF注射,结果证明大鼠心肌血管再生增强,心肌细胞凋亡减少。
既往关于PlGF与心肌缺血的研究均在单纯心肌缺血条件下进行,本研究的新颖之处在于利用制备的在体老年慢性肾衰IPC模型观察经IPC处理后的老年慢性肾衰大鼠心肌组织中PlGF的表达情况。实验表明:经过IPC处理的老年慢性肾衰大鼠的心肌组织中PlGF的表达明显较假手术组高。其中Western blot结果显示在术后12 h这个时间点,IPC组老年慢性肾衰大鼠心肌组织中缺血心肌的边缘区域及缺血区域的心肌组织中PlGF的表达水平均较远离缺血区域的心肌组织及假手术组高。免疫组织化学法测定假手术组和IPC组心肌组织PlGF表达情况显示在术后12 h,IPC组老年慢性肾衰大鼠心肌组织着色较假手术组深,提示IPC组PlGF表达高于假手术组。上述现象显示对老年肾衰大鼠给予缺血预处理刺激后,具有血管再生作用的PlGF表达增多,提示PlGF可能通过促进血管新生对对缺血心肌产生保护作用,即PlGF可能是IPC对心肌缺血保护过程的一个重要因子。此外,也为心血管疾病高发的老年肾衰患者提供了临床治疗的新思路。
[1] Kawata H, Yoshida K, Kawamoto A,etal. Ischemic preconditioning upregulates vascular endothelial growth factor mRNA expression and neovascularization via nuclear translocation of protein kinase C epsilon in the rat ischemic myocardium[J]. Circ Res, 2001, 88(7):696-704.
[2] Maulik N. Ischemic preconditioning mediated angiogenic response in the heart[J]. Antioxid Redox Signal, 2004, 6(2):413-421.
[3] Thirunavukkarasu M, Han Z, Zhan L,etal. Adeno-sh-b-Cat-enin abolishes ischemic preconditioning-mediated cardioprotection by down-regulation of its target genes VEGF, Bcl-2, and Survivin in ischemic rat myocardium[J]. Antioxid Redox Signal, 2008, 10(8):1475-1485.
[4] Cao Y, Ji WR, Qi P,etal. Placental growth factor: identification and characterization of a novel isoform generated by RNA alternative splicing[J]. Biochem Biophys Res Commun, 1997, 235(3):493-498.
[5] Roy H, Bhardwaj S, Babu M,etal. Adenovirus-mediated gene transfer of placental growth factor to perivascular tissue induces angiogenesis via upregulation of the expression of endogenous vascular endothelial growth factor-A[J]. Hum Gene Ther, 2005, 16(12):1422-1428.
[6] Sanchez-Lozada LG, Tapia E, Soto V,etal. Effect of febuxostat on the progression of renal disease in 5/6 nephrectomy rats ith and without hyperuriceia[J]. Nephron Physiol, 2008, 108(4):69-78.
[7] Zheng J, Chin A, Duignan I,etal. Growth factor-mediated reversal of senescent dysfunction of ischemia-induced cardioprotection[J]. Am J Physiol Heart Circ Physiol,2006,290(2):H525-530.
[8] Bartling B, Friedrich I, Silber RE,etal. Ischemic preconditioning is not cardioprotective in senescent human myocardium[J]. Ann Thorac Surg, 2003, 76(1):105-111.
[9] Wojtovich AP, Nadtochiy SM, Brookes PS,etal. Ischemic preconditioning: the role of mitochondria and aging[J]. Exp Gerontol, 2012, 47(1):1-7.
[10] Liu L, Zhu J, Glass PS,etal. Age-associated changes in cardiac gene expression after preconditioning[J]. Anesthesiology, 2009, 111(5):1052-1064.
[11] Xaymardan M, Zheng J, Duignan I,etal. Senescent impairment in synergistic cytokine pathways that provide rapid cardioprotection in the rat heart[J]. Exp Med, 2004, 199(6):797-804.
[12] Malik A, Baldwin ME, Peale F,etal. Redundant roles of VEGF-B and PlGF during selective VEGF-A blockade in mice[J]. Blood, 2006, 107(2):550-557.
[13] Tarallo V, Tudisco L, De Falco S. A placenta growth factor 2 variant acts as dominant negative of vascular endothelial growth factor A by heterodimerization mechanism[J]. Am J Cancer Res, 2011, 1(2):265-274.
[14] Torry RJ, Tomanek RJ, Zheng W,etal. Hypoxia increases placental growth factor expression in human myocardium and cultured neonatal rat cardiomyocytes[J], Heart Lung Transplant, 2009, 28(2):183-190.
[15] Bellik L, Vinic MC, Filippi S,etal. Intracellular pathways triggered by the selective FLT-1-agonist placental growth factor in vascular smooth muscle cells exposed to hypoxia[J]. Br J Pharmacol, 2005, 146(4):568-575.
[16] Wu M, Claus P, Vanden Driessche N,etal. Placental growth factor 2-A potential therapeutic strategy for chronic myocardial ischemia[J]. Int J Cardiol, 2016(203):534-542
[17] 泮辉,吕望,王一青,等.胎盘生长因子恢复急性心肌梗死大鼠心功能及其机制[J].浙江大学学报(医学版),2012,43(4):441-447.
Expressionofplacentalgrowthfactoraftermyocardialischemicpreconditioninginseniorratswithchronicrenalfailureanditspotentialrole
DONG Xingtong,JIA Qiang*,FU Wenjing,DENG Yinghui,LIU Hua,LIN Na
(DepartmentofNephrology,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China;*Correspondingauthor,E-mail:2008-happyqiang@sina.com)
ObjectiveTo observe the expression of placental growth factor(PlGF) after myocardial ischemic preconditioning(IPC) in rats with chronic renal failure(CRF), and to explore the potential protective role of placental growth factor in myocardial damage repair of senior rats with CRF.MethodsSixteen senior rats(20 months old) underwent 5/6 nephrectomy(Platt method), then were randomly divided into IPC group(n=8) and sham group(n=8). The rats were given LAD ligation for 6 min and reperfusion for 6 min, and then repeated four times in IPC group.The rats only underwent thracotomy but no blood flow blocking in sham group. Rat hearts were collected at 12 h after surgery to detect the expression of PlGF protein by Western blot and immunohistochemistry.ResultsWestern blot results showed the expression level of placental growth factor protein in peri-ischemia area and ischemic area at 12 h after IPC was significantly higher in IPC group than in sham group(P<0.01). Immunohistochemical staining revealed that the expression level of placental growth factor protein at 12 h after IPC was significantly higher in IPC group than in sham group(P<0.01).ConclusionThe expression level of placental growth factor increases in senior CRF rats after IPC, which suggests that placental growth factor might be a critical factor in the protective process of IPC to ischemic heart in senior rats with CRF.
ischemic preconditioning; placental growth factor; chronic renal failure; rats
董星彤,女,1986-03生,硕士,住院医师,E-mail:923209667@qq.com
2017-03-13
R692.5
A
1007-6611(2017)12-1217-04
10.13753/j.issn.1007-6611.2017.12.003
