晚期非小细胞癌的治疗进展
2017-12-18孔垂秀
孔垂秀
(临汾市中心医院肿瘤科,山西 临汾 041000)
晚期非小细胞癌的治疗进展
孔垂秀
(临汾市中心医院肿瘤科,山西 临汾 041000)
目的研究探讨晚期非小细胞癌治疗的最新进展。方法选取2014年1月~2017年5月我院收治的住院治疗的晚期非小细胞癌患者50例作为本次实验的对象,将所选取的患者随机分为两组,即对照组和观察组,对照组采用多西他赛进行治疗,观察组采用培美曲塞联合靶向药物进行治疗,观察两组患者的治疗效果以及并发症的发生情况。结果晚期非小细胞癌的患者经过治疗后,大多数都起到了比较好的治疗效果,观察组的治疗效果比对照组的要显著,并发症的发生率也明显的比对照组的要少,两组间进行比较,P<0.05,有统计学意义。结论对于肺癌晚期的患者,采取培美曲塞联合靶向药物进行治疗,疗效要比多西他赛的好,而且可以有效减少不良反应的发生,值得在今后的临床晚期非小细胞癌患者的治疗过程中应用。
晚期肺癌;治疗;最新进展
肺癌是目前临床上死亡率最高的恶性肿瘤之一,肺癌的发病率每年都呈现出不断上升的趋势,不但给患者带来极大的负担,大大降低了患者的生活质量,还会给患者及其家属带来极大的精神和经济压力[1]。肺癌可以分为小细胞癌和非小细胞癌,一般情况下,在非小细胞癌被发现确诊的时候,已经是晚期,一线治疗失败后,通常情况下会选择二线进行治疗。现在靶向药物是治疗肿瘤的研究重点,有研究显示,靶向药物可以使患者的生存时间得到延长,帮助患者提高了生活质量[2]。为此,选取2014年1月~2017年5月我院收治的住院治疗的晚期非小细胞癌患者50例作为本次实验的对象,对其使用培美曲塞联合靶向药物进行治疗,取得了很不错的治疗效果,现把具体结果进行如下报道。
1 资料与方法
1.1 一般资料
选取2014年1月~2017年5月我院收治的住院治疗的晚期非小细胞癌患者50例作为本次实验的对象,将所选取的患者随机分为两组,即对照组和观察组,对照组30例,观察组20例,其中对照组男性12例,女性18例,年龄38~70岁,平均年龄(50.3±1.9)岁;观察组男性11例,女性6例,年龄39~71岁,平均年龄(50.1±1.8)岁。两组患者在年龄、性别等一般资料上不存在任何明显的差异(P>0.05),可进行对比分析。
1.2 临床纳入与排除标准
纳入标准(1)所有患者均符合我国晚期非小细胞癌的诊断标准;(2)均取得所有患者的知情同意,并且是自愿参与此次研究;(3)肝肾功以及各项血常规检查指标正常的患者;(4)生存期大于三个月的患者。
排除标准:(1)排除有精神疾病不能进行正常沟通的患者;(2)排除有其它严重的合并症以及各项体征不正常的患者;(3)排除对本次实验所使用的药物过敏患者以及以前使用过培美曲塞或者是多系他塞治疗的患者。
1.3 治疗方法
对照组采用多西他赛进行治疗,观察组采用培美曲塞联合靶向药物进行治疗,多西紫杉醇75 mg/m2静滴,治疗三个星期为一个疗程,在用药当天给予患者口服地塞米松7.5 mg,一天两次,进行治疗前给予患者托烷司琼,以避免患者出现呕吐或者是其它的不良反应。观察组采取培美曲塞联合靶向药物(吉非替尼)进行治疗,具体的治疗措施如下:培美曲塞500 mg/m2一天,静脉滴注,三个星期为一个疗程,在开始使用前一个星期给予患者口服叶酸,每三个周期给予患者注射维生素B121000 ug,在使用培美曲塞的前一天,以及第二天给予患者口服地塞米松。吉非替尼治疗晚期非小细胞癌的研究是现在临床上讨论的热点,使用最为广泛,有相关研究发现,吉非替尼的效果较为显著,治疗的安全性极高,可以帮助患者稳定病情,控制病情的发展,延长患者的生存。
1.4 观察指标
观察两组患者采取不同的治疗方法后,患者的治疗效果以及不良反应的发生情况。
1.5 统计学方法
采用SPSS 18.0系统软件统计分析资料;其中计量资料用(±s)表示,并用t检验;计数资料用(n,%)表示,并用x2检验;P<0.05表示有统计学意义。
2 结 果
2.1 两组患者治疗效果的比较
观察组患者的治疗效果明显的比对照组的要好,两组治疗总有效率比较,P<0.05,有统计学意义,结果见表1。
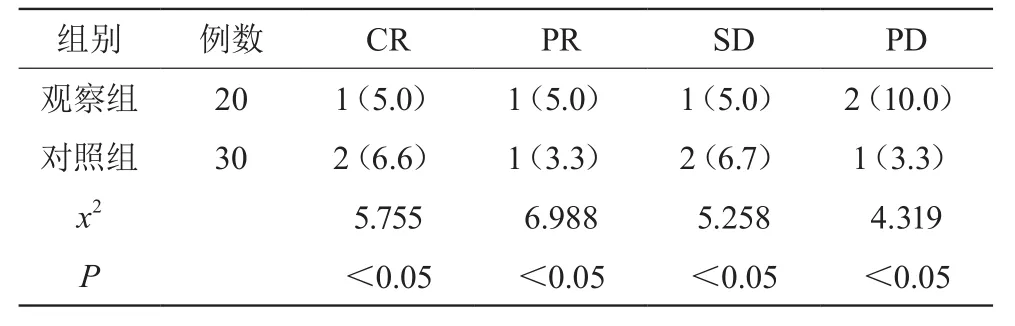
表1 两组病例在治疗效果上的比较(n,%)
2.2 两组患者发生不良反应的情况比较
观察组发生并发症的发生率为8.0%,对照组发生并发症的发生率为28.0%,两组发生率进行比较,P<0.05,有统计学意义,结果见表2。

表2 两组患者发生不良反应的情况比较(n,%)
3 讨 论
肺癌的发病率一直在不断上升,就目前我国医疗水平发展的现状来看,全身化疗是最主要的治疗措施之一,而一线治疗一般疗效不是特别好[3]。因此,采取二线治疗晚期肺癌,是现在比较安全有效的治疗方法,可以提高患者的生活质量,为今后二线治疗提供比较有价值的参考依据。多西他赛是现在二线治疗肺癌的标准药物之一,可以促进患者小管的聚合,形成一个比较稳定的微管,抑制其进行游离[4]。培美曲塞是一种多靶点的叶酸拮抗剂,可以抑制胸苷酸合成酶,阻止嘧啶和嘌呤的合成,从而抑制了肿瘤细胞的生长,联合靶向药物进行治疗,更是可以使得治疗效果得到明显的提高。在靶向治疗和化疗方面,吉非替尼和多西紫杉醇的治疗效果相似度较高,但是吉非替尼的耐受性以及安全性要比多西紫杉醇的要高。目前,新出现的基因变异患者靶向药物有:威罗非尼[1,2]、达拉非尼[2,3]、达拉非尼+曲美替尼[4],其主要针对BRAF V600E突变;克唑替尼[5-9],其主要针对高水平MET扩增或MET外显子14跳跃突变;卡博替尼[10,11]、凡德他尼[12],其主要针对RE重排;曲妥珠单抗[13](2B类)、阿法替尼[14](2B类),其主要针对HER2突变。培美曲塞自从被美国批准为晚期肺癌的二线主要治疗药物以来,已经被广泛使用到临床治疗上[5]。所以新版的NCCN指南推荐支持进行基因检测。EGFR和KRAS基因:普遍认为EGFR突变在西方腺癌中占10%,而在亚洲腺癌患者中高达50%,而在不吸烟、女性和非粘液癌患者中的EGFR突变率更高。KRAS突变在非亚裔、吸烟和粘液腺癌中最常见。最常见的EGFR突变导致21外显子(L858R)第858位氨基酸的亮氨酸取代了精氨酸和19外显子框架内缺失。突变在贴壁生长模式(原细支气管肺泡癌)的非黏液性肺腺癌和乳头状(和/或微乳头状)肺腺癌中更常见。KRAS突变与对EGFR TKI治疗原发性耐药有关。获得性耐药与EGFR激酶结构域内的第二位点突变(如T790M)、另一种激酶扩增(如MET)、非小细胞肺癌组织学转化为小细胞肺癌以及上皮-间质转化(EMT)有关。ALK:(ALK)基因重排是ALK和各伴侣基因之间的融合,包括棘皮动物微管结合蛋白4(EML4)。ALK融合已在非小细胞肺癌患者的一个亚型中识别出来,代表非小细胞肺癌患者一个独特亚型,ALK抑制剂对其可能是一种非常有效的治疗策略。大多数情况下,ALK重排和EGFR突变是互相排斥的。 但在ALK非小细胞肺癌最常出现在一个独特的非小细胞肺癌患者亚组中,同时伴有许多共同临床特征的非小细胞肺癌患者可能存在EGFR突变。目前检测ALK非小细胞肺癌的标准方法是荧光原位杂交(FISH)。PD-1:免疫检查点抑制剂的靶点是程序性死亡受体1(PD-1)或其配体——程序性死亡配体1(PD-L1)。PD-1表达于T细胞,并调节外周组织中T细胞的活化。PD-1有两个配体,PD-L1(也称为B7-H1或CD274)和PD-L2(B7-DC或CD273)。这些配体广泛表达于各种免疫效应细胞、抗原呈递细胞和肿瘤细胞。肿瘤细胞上的PD-L1配体与PD-1结合并激活,产生一系列的细胞间作用,引起T细胞失活并降低增殖。在非小细胞肺癌中治疗的重点是用抗PDL1或PD-1的单克隆抗体阻断PD-1与肿瘤细胞和免疫效应细胞的配体PD-L1之间的相互作用。抗PD-L1免疫组化可能是一个用于选择更可能对免疫检查点抑制剂应答的非小细胞肺癌患者生物标志物,但是开发的各种疗法,每一种都使用不同的抗PD-L1 IHC检测,加剧了病理学家和肿瘤学家的困扰。PD-L1检测结果阳性的定义取决于使用的生物标记法。PD-L1表达水平≥50%为阳性检测结果。ROS1:尽管ROS1是一个独特的受体酪氨酸激酶,但是ROS1与ALK具有高度的同源性(在激酶结构域中约50%,在ATP结合位点中约75%)。大多数ROS1阳性的非小细胞肺癌患者对第一代ALK抑制剂克唑替尼应答;然而,某些其他ALK抑制剂如艾乐替尼对ROS1阳性的非小细胞肺癌似乎无效。1%~2%的非小细胞肺癌患者存在ROS1基因重排。与ALK重排检测相似,ROS1也用FISH检测。
一线治疗主要还是以两药联合进行治疗,其中铂类药物为联合治疗的基础药。NCCN指南推荐若一线化疗检测出EGFR突变,则临床用药推荐厄洛替尼,阿法替尼,吉非替尼。如果病情进展,则进行考虑进行EGFR耐药性检测T790M检测,T790M检测阳性,推荐用药奥希替尼。若一线化疗检测出ALK基因重排阳性,推荐临床用药克唑替尼(1类推荐)。若一线化疗检测PD-L1表达水平≥50%为阳性,推荐临床用药派姆单抗。若一线化疗检测出ROS1基因重排阳性,推荐临床用药克唑替尼(2A推荐)。本次实验的结果表明,观察组患者的治疗效果明显的比对照组的要好,观察组发生不良反应的发生率为10.0%,对照组发生不良反应的发生率为23.4%,两组发生率进行比较,P<0.05,有统计学意义,观察组发生不良反应的情况优于对照组,说明培美曲塞联合靶向药物进行治疗,对于减少不良反应的发生起到了积极的作用。综上所述,对于肺癌晚期的患者,采取培美曲塞来联合靶向药物进行治疗,疗效要比多西他赛的好,而且可以有效减少不良反应的发生,值得在今后的临床晚期非小细胞癌患者的治疗过程中应用。
[1] 翟浩然,钟文昭.ASCO2015局晚期肺癌治疗进展[J].浙江医学,2015,37(18):1490-1492.
[2] 包 晨,杨 冬.COPD合并肺癌的发病机制与治疗进展[J].国际呼吸杂志,2016,36(8):607-611.
[3] 姚舒洋,支修益.非小细胞肺癌术后辅助EGFR-TKI的治疗进展[J].首都医科大学学报,2016,37(6):773-776.
[4] 黄萍萍,赵大海.肺癌的免疫治疗进展[J].国际呼吸杂志,2017,37(8):625-629.
[5] 苗 欣,韩一平.肺癌引起的恶性胸腔积液的研究和治疗进展[J].国际呼吸杂志,2016,36(15):1170-1174.
[6] 赵 军.肺癌靶向治疗进展[J].临床外科杂志,2016,24(7):514-517.
[7] 刘 斌,秦建文,周静敏,等.复发性小细胞肺癌治疗进展[J].中国肺癌杂志,2017,20(3):192-198.
[8] 黎小龙.EGFR-TKIs治疗非小细胞肺癌耐药后的治疗进展[J].重庆医学,2016,45(34):4860-4863.
[9] 尚聪聪,张 力.肺癌新靶向治疗进展[J].中华内科杂志,2017,56(6):447-449.
[10] 刘成武,刘伦旭.肺癌微创外科治疗进展[J].中华胸部外科电子杂志,2016,3(2):65-69.
[11] Felip E,Gridelli C,Baas P et al.Metastatic non-smallcell lung cancer: consensus on pathology and molecular tests, first-line,second-line,and third-line therapy: 1st ESMO Consensus Conference in Lung Cancer;Lugano 2010.[J].Annals of oncology: official journal of the European Society for Medical Oncology,2011,22(7):1507-1519.
[12] Gridelli C,Butts C,Ciardiello F et al.An international,mu lticenter,randomized phase III study of first-line erlotinib followed by second-line cisplatin/gemcitabine versus first line cisplatin/gemcitabine followed by second-line erlotinib in advanced non-small-cell lung cancer: treatment rationale and protocol dynamics of the TORCH trial.[J].Clinical lung cancer,2008,9(4):235-238.
R734.2
B
ISSN.2095-8242.2017.066.12883.03
孔垂秀,女,(1987-),硕士,医师,研究方向:实体瘤诊治
王雨辰
