饲粮菊糖添加水平对肉仔鸡盲肠、直肠菌群结构及主要菌群数量的影响
2017-12-16杨桂芹刘海英董维国
杨桂芹 王 琪 刘海英 董维国 朱 鑫
(沈阳农业大学畜牧兽医学院,沈阳 110866)
饲粮菊糖添加水平对肉仔鸡盲肠、直肠菌群结构及主要菌群数量的影响
杨桂芹 王 琪 刘海英 董维国 朱 鑫
(沈阳农业大学畜牧兽医学院,沈阳 110866)
本试验旨在研究饲粮菊糖添加水平对肉仔鸡盲肠和直肠菌群结构和主要菌群数量的影响。采用单因素完全随机化设计,选用300只1日龄爱拔益加肉仔鸡,随机分成5组,每组6个重复,每个重复10只。5组肉仔鸡分别饲喂在基础饲粮中添加0(对照组)、0.5、1.5、2.5和5.0 g/kg菊糖的试验饲粮。试验期为6周。采用PCR-变性梯度凝胶电泳(DGGE)和定量PCR(qPCR)技术对42日龄肉仔鸡盲肠和直肠菌群结构及主要菌群数量进行测定。结果表明:1)饲粮菊糖添加水平对肉仔鸡盲肠和直肠菌群丰富度、盲肠菌群香农指数以及直肠菌群均匀度均无显著影响(P>0.05),但显著降低了盲肠菌群均匀度和直肠菌群香农指数(P<0.05)。PCR-DGGE图谱上部分优势条带序列分析表明,饲粮添加菊糖促进了肉仔鸡盲肠和直肠厚壁菌门(Firmicutes)中产粪甾醇真细菌(Eubacteriumcoprostanoligenes)、肠单胞球菌(Intestinimonassp.)和盲肠肠球菌(Enterococcuscecorum)等细菌的增殖。2)饲粮菊糖添加水平显著影响了肉仔鸡盲肠、直肠总细菌和大肠杆菌数量(P<0.05)。二次曲线分析显示,当菊糖添加水平分别为2.71和2.66 g/kg时,盲肠总细菌和大肠杆菌数量最少;与对照组相比,饲粮添加1.5、2.5、5.0 g/kg菊糖显著降低了盲肠乳酸菌数量(P<0.05),饲粮添加0.5 g/kg菊糖显著增加了直肠乳酸菌数量(P<0.05);饲粮添加5.0 g/kg菊糖时肉仔鸡盲肠、直肠双歧杆菌数量及直肠产气荚膜梭菌数量均为最高,且与对照组差异显著(P<0.05)。综上,在本试验条件下,有利于改善肉仔鸡肠道菌群结构和促进有益菌增殖的菊糖添加水平为2.5~5.0 g/kg。
菊糖;菌群结构;菌群数量;肠道;肉仔鸡
肠道微生物及其代谢对肉仔鸡的营养、健康与疾病具有重要的影响和调控作用,通过营养方式干预宿主肠道微生物健康已经成为动物营养学研究的热点[1]。菊糖对肉仔鸡肠道的有益功能已经得到广泛证实,其应用也日益受到重视[2-3]。菊糖,也称菊粉,是通过D-果糖分子经β(1→2)糖苷键连接而成(果聚糖),主要来源于菊芋和菊苣块根中。菊糖无味、无固定形态,易溶于水,熔点高达178 ℃,相对体积质量1.35,有较强的热稳定性。孙瑞锋等[4]研究表明,饲粮添加3 g/kg的菊糖可使肉仔鸡盲肠大肠杆菌和沙门氏菌数量分别降低14.50%和36.42%,有效减少了肉仔鸡排泄物氨气散发量。研究发现,来源于菊苣根中的菊糖显著促进了肉仔鸡回肠和盲肠双歧杆菌、乳酸杆菌等有益菌的繁殖[5];随着菊糖添加量的增加,公猪大肠和粪中粪臭素浓度随之减少,而产气荚膜梭菌在结肠和直肠的数量降低,并推测粪臭素浓度的减少可能与产气荚膜梭菌数量的减少、中短链脂肪酸含量的增加有关[6]。然而,另外的研究表明,饲粮添加菊糖对肉仔鸡肠道菌群无显著影响[7]。本课题组前期研究结果表明,饲粮添加菊糖不影响肉仔鸡的生产性能,但添加5.0 g/kg的菊糖显著降低了肉仔鸡排泄物、盲肠和直肠吲哚和粪臭素浓度[8],为进一步研究其对肉仔鸡肠道菌群的影响,特进行饲粮菊糖添加水平对肉仔鸡盲肠、直肠菌群结构及主要菌群数量影响的研究。
1 材料与方法
1.1 试验材料及饲粮
试验用菊糖为上海某公司生产,纯度>92%,相对分子质量近似5 000,为白色结晶粉末,无味。基础饲粮为玉米-豆粕型粉状料,其组成及营养水平同文献[8]。
1.2 试验设计及饲养管理
试验采用单因素完全随机化设计,选取300只1日龄爱拔益加肉仔鸡,随机分为5组,每组6个重复,每个重复10只。Ⅰ组为对照组,饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ和Ⅴ组分别饲喂在基础饲粮中添加0.5、1.5、2.5、5.0 g/kg菊糖的试验饲粮。试验鸡采用3层全阶梯笼养,热风炉供暖,人工喂料,乳头饮水器供水,机械清粪,自由采食和饮水,试验期为6周。按常规方法进行疫苗接种和饲养管理。
1.3 样品采集
肉仔鸡饲养至42日龄时,每个重复取1只鸡(确保每组3雄3雌),颈静脉放血处死,迅速解剖,分离盲肠和直肠,液氮速冻后,保存在-80 ℃条件下,备测。
1.4 测定指标和方法
1.4.1 菌群结构
1)DNA提取。盲肠和直肠样本在4 ℃冰箱解冻后,每2只鸡(1雌1雄)的盲肠、直肠分别混合后,采用十六烷基三甲基溴化铵(CTAB)手提法分别提取15个盲肠、15个直肠样本基因组DNA。
2)细菌16S rDNA片段的PCR扩增:以样品基因组DNA为模板,采用细菌通用引物GC-338F(5′-CGCCCGGGGCGCGCCCCGGGGCGGGGCGGGGGCGCGGGGGGCCTACGGGAGGCAGCAG-3′,下划线部分为GC夹)和518R(5′-ATTACCGCGGCTGCTGG-3′)扩增样品16S rDNA的V3区序列。PCR扩增体系(50 μL)为:10×PCR buffer 5 μL、dNTP(2.5 mmol/L)3.2 μL、rTaq(5 U/μL)0.4 μL、GC-338F(20 μmol/L)1 μL、518R(20 μmol/L)1 μL、模板DNA 50 ng,补双蒸水(ddH2O)至50 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃复性45 s,72 ℃延伸1 min,30个循环;最终72 ℃延伸10 min。
3)PCR产物的变性梯度凝胶电泳(DGGE)分析。取10 μL PCR的产物进行DGGE分析。采用变性梯度为35%~55%、浓度为7%的聚丙烯酰胺凝胶在1×TAE缓冲液中56 V、60 ℃条件下电泳16 h。DGGE完毕后,采用银染法染色。PCR产物采用OMEGA公司DNA Gel Extraction试剂盒纯化回收。采用Quantity one分析软件包对DGGE图谱的电泳条带数目、条带密度进行数字化分析。依据戴斯系数(Cs)构建聚类图,主成分分析(PCA)采用CANOCO 4.5软件进行。
计算公式如下:
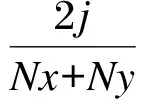
式中:Cs、H、S和E分别代表戴斯系数、香农指数、丰富度和均匀度;Nx为x泳道条带数;Ny为y泳道条带数;j为2个泳道共有的条带数;pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率;N为单一泳道上所有条带的密度;Ni为第i条带的密度;Hmax是H的最大值。
4)DGGE图谱中优势条带的回收与测序。用灭菌手术刀完整切下DGGE图谱中条带清晰、分离明显的优势条带。以2 μL回收产物为模板,338F/518R为引物进行PCR扩增。将重新扩增的DNA片段切胶回收、纯化后,连接到PMD18-T载体上,并转化至DH5α感受态细胞中,筛选阳性克隆进行序列测定,测序结果与GenBank中的序列进行比对,得到条带所代表的细菌类型。
1.4.2 主要菌群数量
总细菌、大肠杆菌、乳酸菌和双歧杆菌引物序列同文献[9]。产气荚膜梭菌引物序列为:上游引物5′-GGGTTTCAACACCTCCGTG-3′,下游引物5′-CGATTAAGAGTAATGCAAGG-3′。取0.5 μL基因组DNA进行定量PCR(qPCR)反应。采用20 μL体系(10 μL 2×SG PCR MasterMix,上游引物、下游引物(10 μmoL/L)各0.5 μL,0.5 μL基因组DNA,8.5 μL ddH2O),在StepOnePlusTM实时荧光定量PCR仪(美国)上扩增。
反应程序为预变性95 ℃ 10 min,40个循环的95 ℃ 20 s,60 ℃ 30 s。用1%的琼脂糖凝胶电泳确定有特异扩增后,再扩增2个50 μL体系的PCR,进行PCR产物回收。扩增产物连接T载体。测序正确的质粒测定浓度,根据分子质量计算拷贝数,并进行梯度稀释,作为标准品,制备标准曲线。将1.4.1中提取的样本DNA稀释10倍后上荧光定量PCR仪上检测,操作过程同标准曲线构建。根据样品Ct值和标准曲线计算出各样品菌群数量,再换算成每克样品中细菌拷贝数的lg值。
1.5 数据统计分析
以重复为单位进行数据处理和统计,采用SPSS 17.0软件的单因素方差分析(one-way ANOVA)过程进行方差分析,采用Duncan氏法进行多重比较,并利用Contrast中的线性和二次项进行趋势分析。P<0.05为差异显著。试验数据用“平均值±标准差”表示。
2 结果与分析
2.1 肉仔鸡盲肠菌群结构
由图1可知,15个盲肠样品共有50条条带。M1-1~M5-3样本中含有的条带数目分别为20、18、20、18、19、21、19、16、11、19、15、21、18、18、18条。由表1可知,饲粮菊糖添加水平对盲肠菌群香农指数和丰富度无显著影响(P>0.05),Ⅲ、Ⅳ组盲肠菌群均匀度显著低于对照组和Ⅱ组(P<0.05)。饲粮菊糖添加水平(x)与肉仔鸡盲肠菌群均匀度(y)呈显著的二次曲线关系(P<0.05),回归方程为y=0.243x2-0.136x+0.974(R2=0.671 7),当饲粮菊糖添加水平为2.8 g/kg时,肉仔鸡盲肠菌群均匀度最小,为0.950。

M1-1、M1-2、M1-3来自Ⅰ组 M1-1, M1-2 and M1-3 come from group Ⅰ;M2-1、M2-2、M2-3来自第Ⅱ组 M2-1, M2-2 and M2-3 come from group Ⅱ;M3-1、M3-2、M3-3来自Ⅲ组 M3-1, M3-2 and M3-3 come from group Ⅲ;M4-1, M4-2 and M4-3来自Ⅳ组 M4-1, M4-2 and M4-3 come from group Ⅳ;M5-1、M5-2、M5-3来自Ⅴ组 M5-1, M5-2 and M5-3 come from group Ⅴ。图2、图3同 The same as Fig.2 and Fig.3。
图1肉仔鸡盲肠菌群PCR-DGGE指纹图谱
Fig.1 PCR-DGGE fingerprints of microbiota in cecum of broilers
2.2 肉仔鸡盲肠菌群相似性
PCR-DGGE图谱的PCA见图2。主成分1(PC1)和主成分2(PC2)的贡献率分别为21.4%、15.6%,二者共解释了37.0%的DGGE图谱信息。PC1将样本分为左右两部分,Ⅲ组和Ⅳ组样本被分在左半部分,对照组和Ⅴ组样本被分在右半部分,Ⅱ组样本存在于两侧。PC2将样本分为上下两部分,Ⅱ组样本被分在上半部分,Ⅲ组样本被分在下半部分,对照组样本除M1-2在中间外全部在上边,Ⅳ组样本除M4-1外全部在下边,Ⅴ组除M5-3外全部在下边。结合PC1与PC2进行分析,与其他样本离散性最大的是M1-1,说明该样本与其他样本肠道菌群相似性最低。
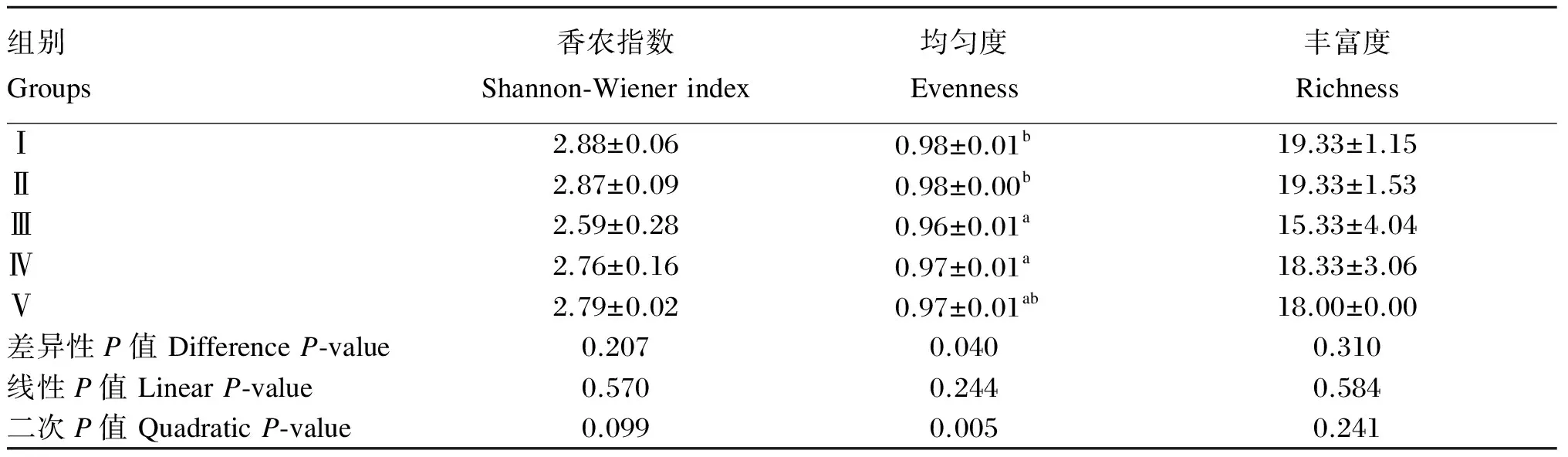
表1 饲粮菊糖添加水平对肉仔鸡盲肠菌群结构的影响
同列数据肩标相同字母或无字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same column, values with the same or without letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
图3为依据样本的Cs构建的聚类图,在15个样本中,来自对照组的样本M1-1与其他样本相似性最低,相似性系数为0.44。相似性高的有4簇,分别为M1-2与M1-3、M2-2与M2-3、M5-1与M5-3、M3-3与M4-1,相似性系数分别为0.73、0.76、0.66、0.65。样本M1-2、M1-3为同一簇(来自对照组),M5-1、M5-3为同一簇(来自Ⅴ组),这两簇的相似性较低(相似性系数为0.59),说明菊糖对肉仔鸡盲肠菌群结构产生了一定的影响。这与PCA结果相似。

图2 盲肠菌群DGGE图谱条带的PCA
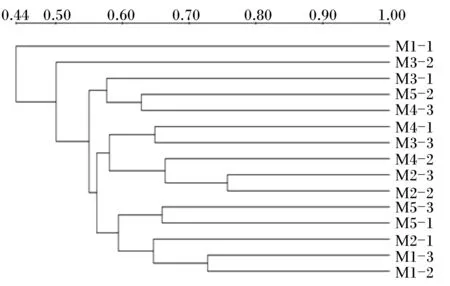
图3 盲肠菌群UPGMA相似性分析
2.3 肉仔鸡盲肠菌群DGGE图谱优势条带序列分析
试验对盲肠DGGE指纹图谱中具有共性、特异性的10条条带进行了回收、克隆和测序。由表2可知,所有序列与GenBank中16S rDNA序列的相似性在87%~100%。除15号条带的相似菌来自拟杆菌门(Bacteroidetes)外,其余均来自厚壁菌门(Firmicutes)。37号条带为M4-1、M4-3、M5-2共有条带,其所代表的序列的最相似菌为真细菌属中的产粪甾醇真细菌(Eubacteriumcoprostanoligenes),相似度为95%。16、18号条带为各组共有条带,其所代表的相似菌分别是Dielmafastidiosa和Faecalibacteriumprausnitzii,相似度分别为87%和96%。
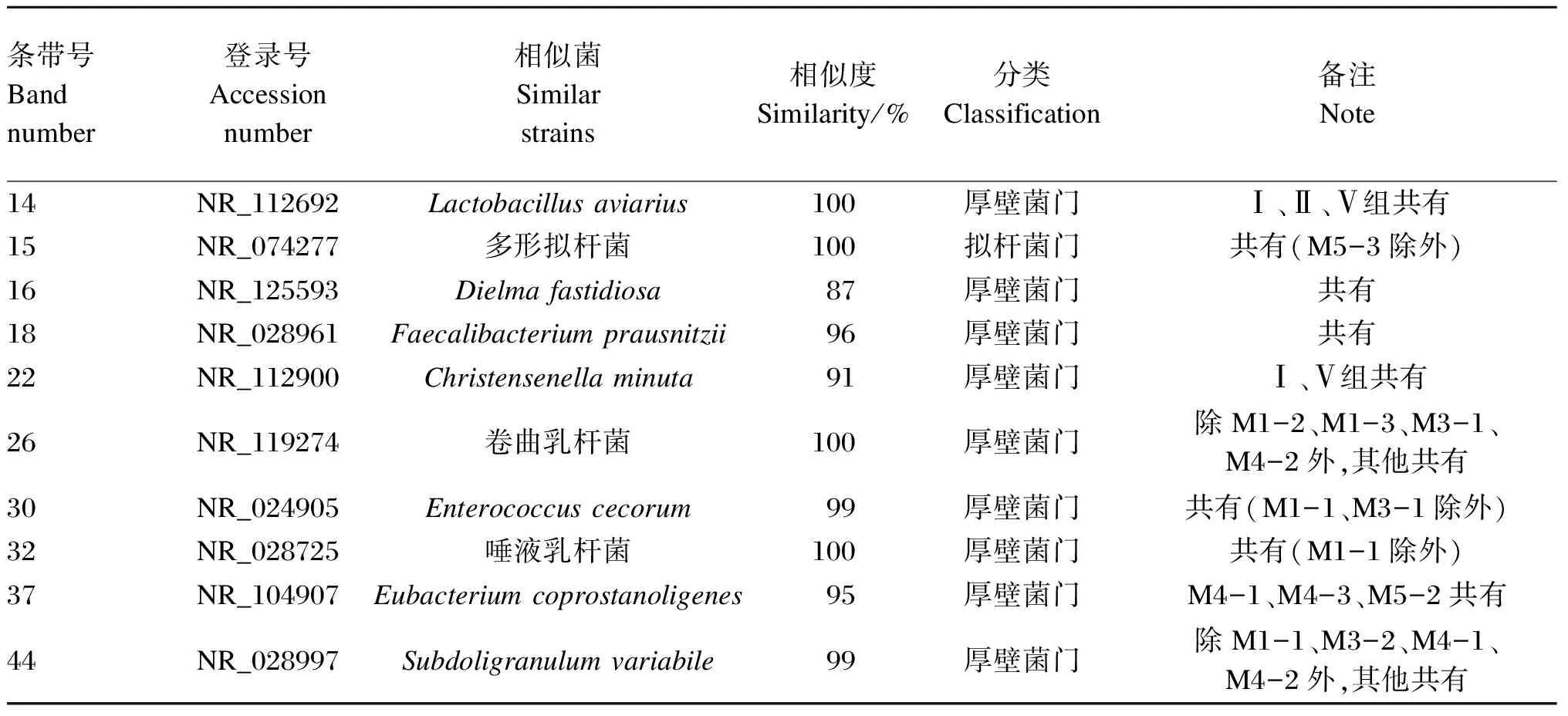
表2 肉仔鸡盲肠菌群DGGE图谱优势条带的序列分析结果
2.4 肉仔鸡直肠菌群结构
由图4可知,Z1-1~Z5-3样本中含有的条带数目分别是24、21、19、15、19、19、11、9、14、17、13、27、18、14、15条。由表3可知,饲粮菊糖添加水平对直肠菌群均匀度和丰富度均无显著影响(P>0.05),Ⅲ组直肠菌群香农指数显著低于除Ⅴ组之外的其余各组(P<0.05)。
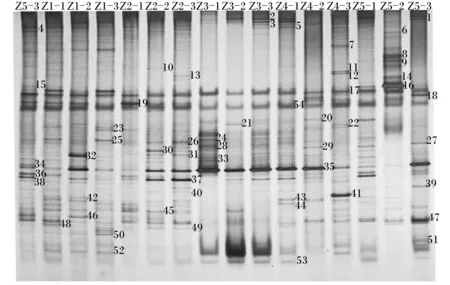
Z1-1、Z1-2、Z1-3来自Ⅰ组 Z1-1, Z1-2 and Z1-3 come from group Ⅰ;Z2-1、Z2-2、Z2-3来自Ⅱ组 Z2-1, Z2-2 and Z2-3 come from group Ⅱ;Z3-1、Z3-2、Z3-3来自Ⅲ组 Z3-1, Z3-2 and Z3-3 come from group Ⅲ;Z4-1、Z4-2、Z4-3来自Ⅳ组 Z4-1, Z4-2 and Z4-3 come from group Ⅳ;Z5-1、Z5-2、Z5-3来自Ⅴ组 Z5-1, Z5-2 and Z5-3 come from group Ⅴ。图5、图6同 The same as Fig.5 and Fig.6。
图4肉仔鸡直肠菌群PCR-DGGE指纹图谱
Fig.4 PCR-DGGE fingerprints of microbiota in rectum of broilers
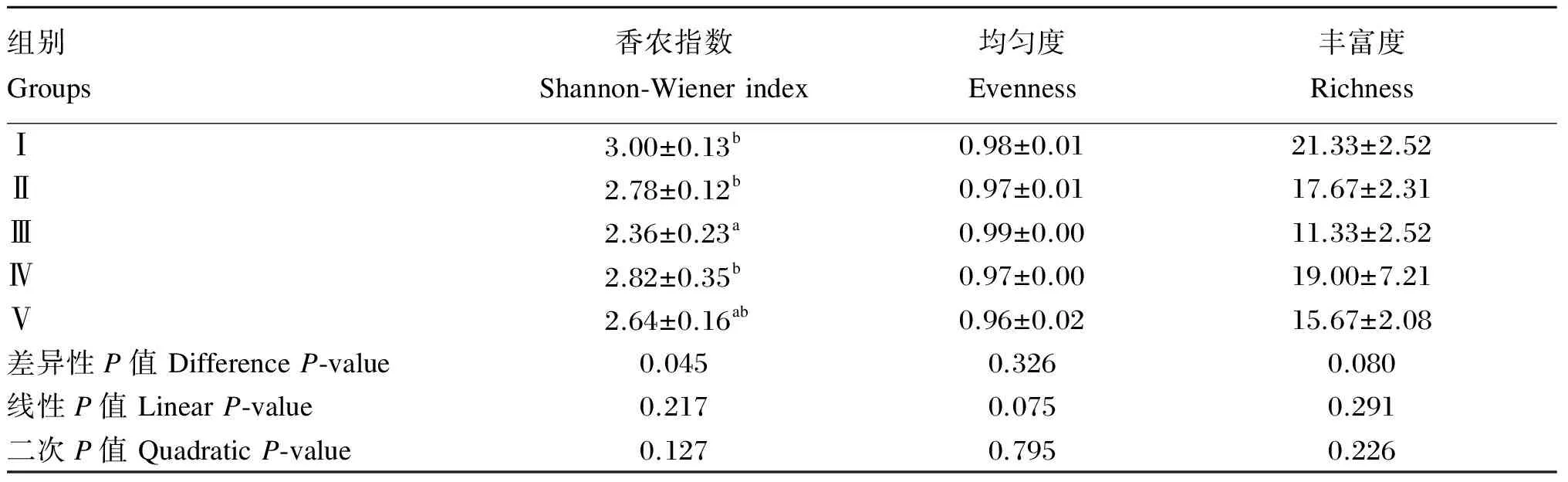
表3 饲粮菊糖添加水平对肉仔鸡直肠菌群多样性的影响
2.5 肉仔鸡直肠菌群相似性
肉仔鸡直肠菌群PCR-DGGE图谱PCA见图5。PC1和PC2的贡献率分别为20.6%、14.6%,共解释了34.60%的DGGE图谱信息。PC1将样本分为左右两部分,对照组、Ⅱ组全部在右侧,Ⅲ、Ⅴ组全部在左侧,Ⅳ组两侧都存在。PC2将样本分为上下两部分,对照组全部在上边,Ⅱ和Ⅴ组全部在下边,Ⅲ和Ⅳ组上下都存在。Z3-3和Z4-1距离最为紧密。距离最远的是Z5-2和Z1-2(分别来自Ⅴ组和对照组)。由图6可知,15个样本中,相似性较高的有3簇,分别为Z4-1与Z3-3、Z1-1与Z1-3、Z3-1与Z4-1、Z3-3,相似系数分别为0.72、0.64、0.60。与其余样本相似系数最低的是Z5-2,相似系数仅为0.27。上述结果表明Ⅴ组与其余4个组直肠菌群相似性最低。

图5 直肠菌群DGGE图谱条带的PCA
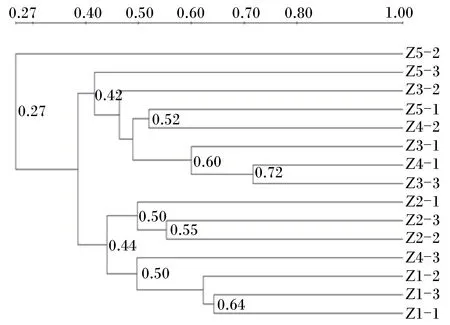
图6 直肠菌群UPGMA相似性分析
2.6 肉仔鸡直肠菌群DGGE图谱优势条带序列分析
本试验回收了6条直肠菌群DGGE图谱具有共性、特异性的条带,进行克隆和测序。由表4可知,各序列和GenBank中16S rDNA序列的相似性在95%~100%。2号条带为Z3-1、Z3-3、Z4-1共有的条带,其所代表的最相似菌为肠单胞球菌(Intestinimonassp.),相似度为95%。33号条带为Z2-3、Z3-1、Z4-3、Z5-1共有条带,其序列所代表的最相似菌为盲肠肠球菌(Enterococcuscecorum),相似度为100%。36号条带为Z2-2、Z2-3、Z4-3共有条带,其所代表的最相似菌为普拉梭菌(Faecalibacteriumprausnitzii),相似度为96%。45号条带为Z2-3、Z5-3共有条带,其序列所代表的最相似菌为苏德式芽孢梭菌(Clostridiumsordelli),相似度为100%。
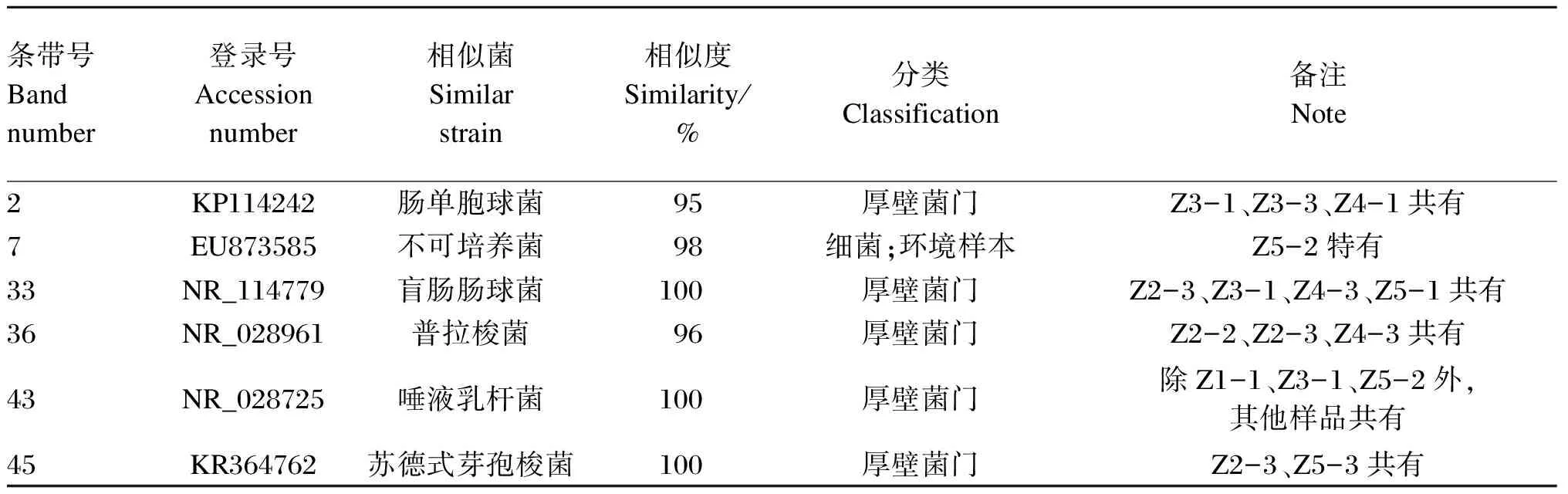
表4 直肠菌群DGGE图谱优势条带的序列分析结果
2.7 肉仔鸡盲肠菌群数量
由表5可知,各试验组盲肠总细菌、大肠杆菌数量均显著低于对照组(P<0.05)。Ⅲ、Ⅳ、Ⅴ组盲肠乳酸菌数量显著低于对照组和Ⅱ组(P<0.05);Ⅱ、Ⅴ组盲肠双歧杆菌数量显著高于对照组及Ⅲ、Ⅳ组(P<0.05),以Ⅴ组盲肠双歧杆菌数量最多。饲粮菊糖添加水平对盲肠产气荚膜梭菌数量无显著影响(P>0.05)。除双歧杆菌外,盲肠各细菌数量与饲粮菊糖添加水平均呈显著的线性关系(P<0.05);同时,盲肠总细菌和大肠杆菌数量与饲粮菊糖添加水平呈显著的二次曲线关系(P<0.05),当饲粮菊糖添加水平分别为2.71和2.66 g/kg时,盲肠总细菌和大肠杆菌数量最少。

表5 饲粮菊糖添加水平对肉仔鸡盲肠主要菌群数量的影响
2.8 肉仔鸡直肠菌群数量
由表6可知,Ⅲ、Ⅴ组直肠总细菌和大肠杆菌数量显著低于对照组及Ⅱ、Ⅳ组(P<0.05)。Ⅱ组直肠乳酸菌数量显著高于其他各组(P<0.05)。Ⅴ组直肠双歧杆菌数量最多,显著高于对照组及Ⅲ、Ⅳ组(P<0.05)。Ⅴ组直肠产气荚膜梭菌数量显著高于其余各组(P<0.05)。除大肠杆菌外,直肠各细菌数量与菊糖添加水平均呈显著的线性关系(P<0.05);同时,直肠双歧杆菌、产气荚膜梭菌数量与饲粮菊糖添加水平呈显著的二次曲线关系(P<0.05),当饲粮菊糖添加水平为2.96 g/kg时,直肠双歧杆菌数量最少。

表6 饲粮菊糖添加水平对肉仔鸡直肠主要菌群数量的影响
3 讨 论
3.1 饲粮菊糖添加水平对肉仔鸡盲肠和直肠菌群结构的影响
通过PCR-DGGE图谱中条带的位置、数量和亮度等可综合反映肠道菌群的多样性。Rehman等[7]研究表明,在玉米-豆粕型饲粮中添加10 g/kg的菊糖对42日龄肉仔鸡空肠和盲肠菌群DGGE图谱条带数量及菌群多样性指数无显著影响。Yang等[10]研究表明,饲粮添加1.2 g/kg的菊糖不显著影响肉仔鸡盲肠菌群多样性、丰富度和均匀度。体外试验也证实,添加菊糖对肉仔鸡盲肠、直肠食糜发酵液中菌群多样性和丰富度的影响均不显著,但发酵液中DGGE图谱条带数量有所降低[11]。本试验结果表明,饲粮添加菊糖对肉仔鸡盲肠、直肠菌群DGGE图谱条带数量均无显著影响,但各菊糖添加组条带数不同程度低于对照组,且多样性指数均有所降低;但添加一定量的菊糖后显著降低了肉仔鸡盲肠菌群均匀度和直肠菌群香农指数,该结论与以上报道略有差异。这与PCR-DGGE技术的局限性(如DNA的提取效率、DNA的提取和纯化方法以及PCR扩增过程的误差等)有关。另外,采用DGGE技术只能对优势菌群进行检测与分析。本试验聚类分析和PCA表明,盲肠菌群对照组的M1-2、M1-3与5.0 g/kg菊糖添加组的M5-1、M5-3样本的相似性仅为0.59;而直肠菌群中,与其余样本相似性系数最低的是Z5-2,仅为0.27。上述结果说明饲粮添加菊糖影响了肉仔鸡盲肠和直肠菌群的组成。本试验对DGGE图谱优势菌群序列分析表明,饲粮添加菊糖后,DGGE图谱出现了不同的优势条带。盲肠样本的37号条带仅存在于菊糖添加组,其序列所代表的是厚壁菌门的Eubacteriumcoprostanoligenes,说明添加菊糖能促进该菌生长。直肠样本2、33、36、45号条带也只存在于菊糖添加组,其序列所代表的是厚壁菌门的球菌或梭菌类细菌,说明添加菊糖促进了直肠中以上细菌的生长,此结果与Yang等[10]报道的饲粮添加1.2 g/kg的菊糖有助于不可培养的厚壁菌门毛螺菌科(uncultured Lachnospiraceae)及不可培养的拟杆菌门(uncultured Bacteroidetes)细菌增殖的结果基本一致。
3.2 饲粮菊糖添加水平对肉仔鸡盲肠和直肠主要菌群数量的影响
家禽肠道微生物一般分为两大类,即有害菌(病源菌)和有益菌(病源菌抑制菌)。有害菌主要包括大肠杆菌、沙门氏菌和产气荚膜梭菌等,而乳酸菌和双歧杆菌被认为是肠道有益菌[12-13]。有益菌的增加会降低有害菌在肠道中的发酵[14]。有关饲粮添加菊糖对肉仔鸡肠道菌群数量影响的结果不完全一致。林晨[15]发现,菊糖能够调节肉仔鸡肠道内微生物菌群,且菊粉添加水平越高,大肠杆菌数量越少,双歧杆菌和乳酸菌数量越多。Nabizadeh[16]研究表明,饲粮添加10 g/kg的菊糖显著降低了肉仔鸡盲肠大肠杆菌数量。Zhao等[17]研究表明,饲粮添加2.5和5.0 g/kg的果聚糖显著提高了31日龄肉公鸡盲肠乳酸菌和双歧杆菌数量,降低了盲肠大肠杆菌和产气荚膜梭菌的数量,并降低了排泄物氨的散发量。Kareem等[18]研究表明,乳酸菌代谢物——益生素(postbiotics)分别与0.8%、1.0%的菊糖混合添加显著提高了42日龄肉仔鸡排泄物乳酸菌的数量,降低了肠杆菌(Enterobacteriaceae)数量。但另外的研究则表明菊糖对肠道菌群数量无显著影响,如Biggs等[19]报道,在玉米-豆粕型饲粮中添加4 g/kg的菊糖对21日龄肉仔鸡盲肠乳酸菌、双歧杆菌、产气荚膜梭菌和大肠杆菌数量均无显著影响。Abdel-Raheem等[20]也证明,益生素和合生素对肉仔鸡盲肠乳酸菌和大肠杆菌数量无显著影响。不过,Abdelqader等[21]研究表明,菊糖虽然没有显著增加产蛋鸡回肠、盲肠中乳酸菌、双歧杆菌数量,但显著减少了回肠、盲肠大肠杆菌数量。本试验结果表明,饲粮添加1.5、2.5、5.0 g/kg菊糖显著降低了盲肠乳酸菌数量,但添加0.5 g/kg菊糖显著增加了直肠乳酸菌数量;饲粮添加1.5、5.0 g/kg菊糖显著降低了盲肠、直肠总细菌和大肠杆菌数量,但添加5.0 g/kg菊糖显著增加了盲肠、直肠双歧杆菌数量;饲粮添加菊糖对肉仔鸡盲肠产气荚膜梭菌数量无显著影响,但添加5.0 g/kg菊糖显著增加了直肠产气荚膜梭菌数量。本试验所得结果与上述报道不完全一致,这与试验所用鸡的日龄、性别、取样部位、菊糖来源、结构与剂量等不同有关。另外,菊糖的益生效果也与肉仔鸡的饲养环境和个体因素有很大的关系[5]。本试验中,5.0 g/kg菊糖添加组在促进有益菌增殖的同时,也同样促进了直肠有害菌(产气荚膜梭菌)的增殖,说明饲粮中添加高水平的菊糖不利于控制有害菌的增殖。菊糖的益生作用主要是源于其特殊的结构不能被家禽的胃和胰分泌的消化酶所消化,而是进入后肠被有益菌如乳酸菌、双歧杆菌所利用,产生短链脂肪酸和乳酸[22-23],进而降低了有毒代谢物(氨、吲哚、酚类等)的产生[24]。
综上,饲粮添加菊糖降低肉仔鸡排泄物、盲肠和直肠吲哚和粪臭素浓度[8]主要是通过调整菌群结构,降低肠道总细菌、大肠杆菌数量,增加乳酸菌和双歧杆菌的数量来实现的。
4 结 论
① 饲粮添加适宜水平的菊糖显著降低了肉仔鸡盲肠菌群均匀度和直肠菌群香农指数,促进了肉仔鸡盲肠和直肠厚壁菌门Eubacteriumcoprostanoligenes、Intestinimonassp.和Enterococcuscecorum等细菌增殖。
② 饲粮添加适宜水平的菊糖显著降低了肉仔鸡盲肠、直肠总细菌和直肠大肠杆菌数量,增加了直肠乳酸菌、盲肠和直肠双歧杆菌及直肠产气荚膜梭菌数量。
③ 在本试验条件下,肉仔鸡饲粮菊糖适宜添加水平为2.5~5.0 g/kg。
[1] 马曦,韩萌,李德发.猪肠道微生物代谢与思考[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.北京:中国农业大学出版社,2016:3-14.
[2] DANKOWIAKOWSKA A,KOZOWSKA I,BEDNARCZYK M.Probiotics,prebiotics and snybiotics in poultry-mode of action,limitation,and achievements[J].Journal of Central European Agriculture,2013,14(1):467-478.
[4] 孙瑞锋,步长英,李同树.菊糖和枯草芽孢杆菌对肉鸡肠道菌群数量及排泄物氨气散发量的影响[J].华北农学报,2008,23(S1):252-256.
[5] REBOLÉ A,ORTIZ L T,RODRGUEZ M L,et al.Effects of inulin and enzyme complex,individually or in combination,on growth performance,intestinal microflora,cecal fermentation characteristics,and jejunal histomorphology in broiler chickens fed a wheat and barley-based diet[J].Poultry Science,2010,89(2):276-286.
[6] VHILE S G,KJOS N P,SØRUM H,et al.Feeding jerusalem artichoke reduced skatole level and changed intestinal microbiota in the gut of entire male pigs[J].Animal,2012,6(5):807-814.
[7] REHMAN H,HELLWEG P,TARAS D,et al.Effects of dietary inulin on the intestinal short chain fatty acids and microbial ecology in broiler chickens as revealed by denaturing gradient gel electrophoresis[J].Poultry Science,2008,87(4):783-789.
[8] 王琪,管倩侽,杨桂芹,等.饲粮添加菊糖对肉仔鸡生长性能、排泄物及肠道主要臭气化合物浓度的影响[J].动物营养学报,2016,28(12):3875-3884.
[9] 张沛.肉仔鸡粪臭素产生的基本规律及与肠道微生物组成的变化关系研究[D].硕士学位论文.沈阳:沈阳农业大学,2016.
[10] YANG G Q,YIN Y,LIU H Y,et al.Effects of dietary oligosaccharide supplementation on growth performance,concentrations of the major odor-causing compounds in excreta,and the cecal microflora of broilers[J].Poultry Science,2016,95(10):2342-2351.
[11] 侯瑞.菊糖和大豆寡糖对体外条件下肉仔鸡粪臭素产量及肠道菌群的影响[D].硕士学位论文.沈阳:沈阳农业大学,2015.
[12] LOPES M,ROLL V F B,LEITE F L,et al.Quicklime treatment and stirring of different poultry litter substrates for reducing pathogenic bacteria counts[J].Poultry Science,2013,92(3):638-644.
[13] DE PAIVA J B,LEITE J L,DA SILVA L P M,et al.Influence of the major nitrite transporter NirC on the virulence of a Swollen Head Syndrome Avian PathogenicE.coli(APEC) strain[J].Veterinary Microbiology,2015,175(1):123-131.
[14] HAJATI H,REZAEI M.The application of prebiotics in poultry production[J].International Journal of Poultry Science,2010,9(3):298-304.
[15] 林晨.菊粉对断奶仔猪和肉仔鸡后肠微生物作用的研究[D].硕士学位论文.武汉:华中农业大学,2004.
[16] NABIZADEH A.The effect of inulin on broiler chicken intestinal microflora,gut morphology,and performance[J].Animal Feed Science and Technology,2012,21(4):725-734.
[17] ZHAO P Y,WANG J P,KIM I H.Effect of dietary levan fructan supplementation on growth performance,meat quality,relative organ weight,cecal microflora,and excreta noxious gas emission in broilers[J].Journal of Animal Science,2013,91(11):5287-5293.
[18] KAREEM K Y,LOH T C,FOO H L,et al.Effects of dietary postbiotic and inulin on growth performance,IGF1 andGHRmRNA expression,faecal microbiota and volatile fatty acids in broilers[J].BMC Veterinary Research,2016,12:163.
[19] BIGGS P,PARSONS C M,FAHEY G C.The effects of several oligosaccharides on growth performance,nutrient digestibilities,and cecal microbial populations in young chicks[J].Poultry Science,2007,86(11):2327-2336.
[20] ABDEL-RAHEEM S M,ABD-ALLAH S M S,HASSANEIN K M A.The effects of prebiotic,probiotic and synbiotic supplementation on intestinal microbial ecology and histomorphology of broiler chickens[J].International Journal for Agro Veterinary and Medical Sciences,2012,6(4):277-289.
[21] ABDELQADER A,AL-FATAFTAH A R,DAG,et al.Effects of dietaryBacillussubtilisand inulin supplementation on performance,eggshell quality,intestinal morphology and microflora composition of laying hens in the late phase of production[J].Animal Feed Science and Technology,2013,179(1/2/3/4):103-111.
[22] SAMANTA A K,SENANI S,KOLTE A P,et al.Effect of prebiotic on digestibility of total mixed ration[J].Indian Veterinary Journal,2012,89(1):41-42.
[23] MIREMADI F,SHAH N P.Applications of inulin and probiotics in health and nutrition[J].International Food Research Journal,2012,19(4):1337-1350.
[24] SAMANTA A K,JAYAPAL N,SENANI S,et al.Prebiotic inulin:useful dietary adjuncts to manipulate the livestock gut microflora[J].Brazilian Journal of Microbiology,2013,44(1):1-14.
EffectsofInulinSupplementalLevelonMicrobialCommunityStructureandMainMicrobialPopulationsinCecumandRectumofBroilers
YANG Guiqin WANG Qi LIU Haiying DONG Weiguo ZHU Xin
(CollegeofAnimalHusbandryandVeterinary,ShenyangAgriculturalUniversity,Shenyang110866,China)
The purpose of this experiment was to study the effects of inulin supplemental level on microbial community structure and main microbial populations in cecum and rectum of broilers. Three hundred 1-day-old Arbor Acres broilers were selected and randomly distributed into five groups with six replicates per group and ten broilers per replicate by single-factor completely random design. Broilers in those five groups were fed a basal diet supplemented with 0 (control group), 0.5, 1.5, 2.5 and 5.0 g/kg inulin, respectively. The experiment lasted for 6 weeks. The microbial community structure and the main microbial populations in cecum and rectum of 42-day-old broilers were measured using the PCR-denaturing gradient gel electrophoresis (DGGE) and quantitative PCR (qPCR) techniques. The results showed as follows: 1) inulin supplemental level had no significant effects on the cecal and rectal microbial richness, the cecal microbial Shannon-Wiener index and the rectal microbial evenness of broilers (P>0.05), but significantly decreased the cecal microbial evenness and rectal microbial Shannon-Wiener index (P<0.05). Based on the analysis of some dominant bands in PCR-DGGE fingerprint, diet supplemented with inulin promoted the growth ofEubacteriumcoprostanoligenes,Intestinimonassp.,Enterococcuscecorumand so on from Firmicutes in cecum and rectum of broilers. 2) Diet supplemented with inulin significantly affected the populations of total bacteria andEscherichiacoliin cecum and rectum of broilers (P<0.05). Quadratic curve analysis showed that the populations of total bacteria andEscherichiacoliwere the fewest in cecum of broilers when inulin supplemental levels were 2.71 and 2.66 g/kg, respectively. Compared with control group, diet supplemented with 1.5, 2.5 and 5.0 g/kg inulin significantly decreased the population of cecalLactobacillus(P<0.05), while diet supplemented with 0.5 g/kg inulin significantly increased the population of rectalLactobacillus(P<0.05). The populations of cecal and rectalBifidobacteriaand rectalClostridiumperfringenswere the most when diet supplemented with 5.0 g/kg inulin, and the differences were significant compared with control group (P<0.05). Thus, results from the current study suggest that supplementation of 2.5 to 5.0 g/kg inulin to basal diet may have the beneficial effects on improving the microbial community and promoting the growth of beneficial bacteria in intestine of broilers under this experimental condition.[ChineseJournalofAnimalNutrition,2017,29(12):4408-4418]
inulin; microbial community; microbial population; intestine; broilers
10.3969/j.issn.1006-267x.2017.12.021
S831.5
A
1006-267X(2017)12-4408-11
2017-06-05
国家自然科学基金项目(31372328)
杨桂芹(1966—),女,辽宁凌源人,教授,博士,从事家禽营养与饲料科学研究。E-mail: guiqiny@126.com
Author, YANG Guiqin, professor, E-mail: guiqiny@126.com
(责任编辑 菅景颖)
