饲粮中添加不同生物制剂对杜寒杂交肉羊生产性能和屠宰性能的影响
2017-12-16王文义王韵斐郭宝林赵丽芳刁其玉杨开伦
贾 鹏 万 凡 马 涛 王文义 杨 东, 王韵斐 郭宝林 赵丽芳 刁其玉* 杨开伦
(1.新疆农业大学,乌鲁木齐 830052;2.中国农业科学院饲料研究所,北京 100081;3.巴彦淖尔市农牧业科学研究院,巴彦淖尔 015000;4.北京昕大洋科技有限公司,北京 100081)
饲粮中添加不同生物制剂对杜寒杂交肉羊生产性能和屠宰性能的影响
贾 鹏1,2万 凡1,2马 涛2王文义3杨 东2,3王韵斐3郭宝林4赵丽芳4刁其玉2*杨开伦1*
(1.新疆农业大学,乌鲁木齐 830052;2.中国农业科学院饲料研究所,北京 100081;3.巴彦淖尔市农牧业科学研究院,巴彦淖尔 015000;4.北京昕大洋科技有限公司,北京 100081)
本试验旨在比较饲粮添加不同生物制剂对杜寒杂交肉羊生产性能、屠宰性能、组织器官发育及肉品质的影响。采用单因素试验设计,选取平均体重约为32 kg的杜寒杂交F1代肉羊160只,随机分为5组,每组4个重复,每个重复8只。对照组采用基础饲粮,试验组分别添加21 mg/kg莫能菌素、4×109CFU/kg地衣芽孢杆菌、3.2×109CFU/kg酿酒酵母菌、1.1 g/kg复合生物制剂(地衣芽孢杆菌≥6×109CFU/g 、酿酒酵母菌≥4×109CFU/g、碱性蛋白酶≥1 000 U/g)。预试期10 d,正试期56 d,每2 d记录1次采食量,每20 d进行1次称重,当复合生物制剂组羊只的平均体重达到约50 kg时,每组选取10只羊进行屠宰,测定其屠宰性能、组织器官重量和肉品质指标。结果表明:1)复合生物制剂组平均日增重、屠宰率显著高于对照组(P<0.05);地衣芽孢杆菌组和复合生物制剂组料重比显著低于对照组(P<0.05)。2)地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组复胃重量均显著高于对照组(P<0.05),复合生物制剂组复胃重量占宰前活重比例显著高于对照组和莫能菌素组(P<0.05);地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组小肠重量及其占宰前活重比例均显著高于对照组、莫能菌素组(P<0.05)。3)酿酒酵母菌组肾脏重量占宰前活重比例显著高于对照组(P<0.05),其他内脏器官重量占宰前活重比例在各组间无显著差异(P>0.05)。4)各组肉品质指标差异不显著(P>0.05)。综合得出,从作为饲料添加剂对肉羊生产性能作用效果来看,地衣芽孢杆菌、酿酒酵母菌、复合生物制剂可以替代莫能菌素,地衣芽孢杆菌好于酿酒酵母菌,复合生物制剂最佳。
肉羊;生物制剂;生产性能;屠宰性能;器官指数
随着人们生活水平的提高,对肉制品需求量逐渐增大,但细菌耐药性及兽药残留极大地影响了肉制品的安全和环境的生态平衡,最终影响人类的健康。目前,世界上许多国家已经颁布法令,禁止在动物饲粮中添加抗生素,抗生素在畜牧业中的使用将被控制得更加严格。因此,新型无公害、无残留、无污染的益生菌添加剂的应用逐渐被人们重视。很多畜禽养殖将微生态制剂作为饲料添加剂,收益较高。益生菌是微生态制剂的一部分,是自然界中非致病性和无毒的微生物,被动物通过消化道摄入后,能够改善动物胃肠道微生物区系、形态结构,从而提高机体免疫机能、饲料利用率和动物生产性能,降低动物发病率,改善生态环境,保证了畜牧业的养殖效益和持续健康发展[2-4]。农业部公告第2045号《饲料添加剂品种目录(2013)》允许将33种益生菌作为饲料添加剂。莫能菌素常作为动物生长促进剂添加在饲粮中,但作为抗生素将带来不可避免的菌群失调、耐药和药物残留等弊端。已有研究结果表明,分别属于细菌和真菌的地衣芽孢杆菌和酿酒酵母菌均能够提高动物生产性能[6-7],但将芽孢杆菌和酿酒酵母菌混合,并与酶制成复合生物制剂的效果还不明确。本试验在杜寒杂交肉羊饲粮中添加莫能菌素、地衣芽孢杆菌、酿酒酵母菌及复合生物制剂,研究不同生物制剂对育肥羊生产性能和屠宰性能的影响,为益生菌制剂替代抗生素及其发展趋势提供理论依据,促进羊产业健康绿色生态发展。
1 材料与方法
1.1 时间和地点
试验于2016年9—11月在内蒙古自治区富川饲料科技股份有限公司现代化肉羊养殖基地进行,历时66 d。
1.2 试验设计
本试验采用单因素试验设计,以杜寒杂交肉羊为试验动物,选取体况良好、体重约32 kg的4~6月龄公羔160只,随机分为5组,每组4个重复,每个重复8只羊。对照组采用基础饲粮,试验组在基础饲粮中分别添加莫能菌素、地衣芽孢杆菌、酿酒酵母菌、复合生物制剂。当复合生物制剂组羊只的平均体重达到约50 kg时,每组选取健康、体重接近平均体重的10只羊,共50只羊进行屠宰,测定其屠宰性能、组织器官发育和肉品质指标。预试期10 d,正试期56 d。
1.3 添加剂主要来源与特性
莫能菌素(有效成分含量≥90%)添加量为21 mg/kg,购自无棣瑞利康生物工程有限公司。地衣芽孢杆菌(活菌含量≥2×1011CFU/g),添加量为4×109CFU/kg;酿酒酵母菌(活菌含量1×1010CFU/g),添加量为3.2×109CFU/kg;复合生物制剂[地衣]芽孢杆菌(活菌含量≥6×109CFU/g)、酿酒酵母菌(活菌含量≥4×109CFU/g)、碱性蛋白酶(活性≥1 000 U/g)〗,添加量为1.1 g/kg。地衣芽孢杆菌、酿酒酵母菌、复合生物制剂均由北京昕大洋科技发展有限公司提供。
1.4 基础饲粮
根据本课题组提出的30~40 kg、41~50 kg肉羊日增重300 g的营养需要量[8-12]标准配制基础饲粮,并将生物制剂与饲粮原料混匀制成颗粒料,以全混合颗粒料形式饲喂,30~40 kg时期补饲占总饲喂量20%的羊草。基础饲粮自行配制,预混料由北京精准动物营养研究中心提供。基础饲粮组成及营养水平见表1。
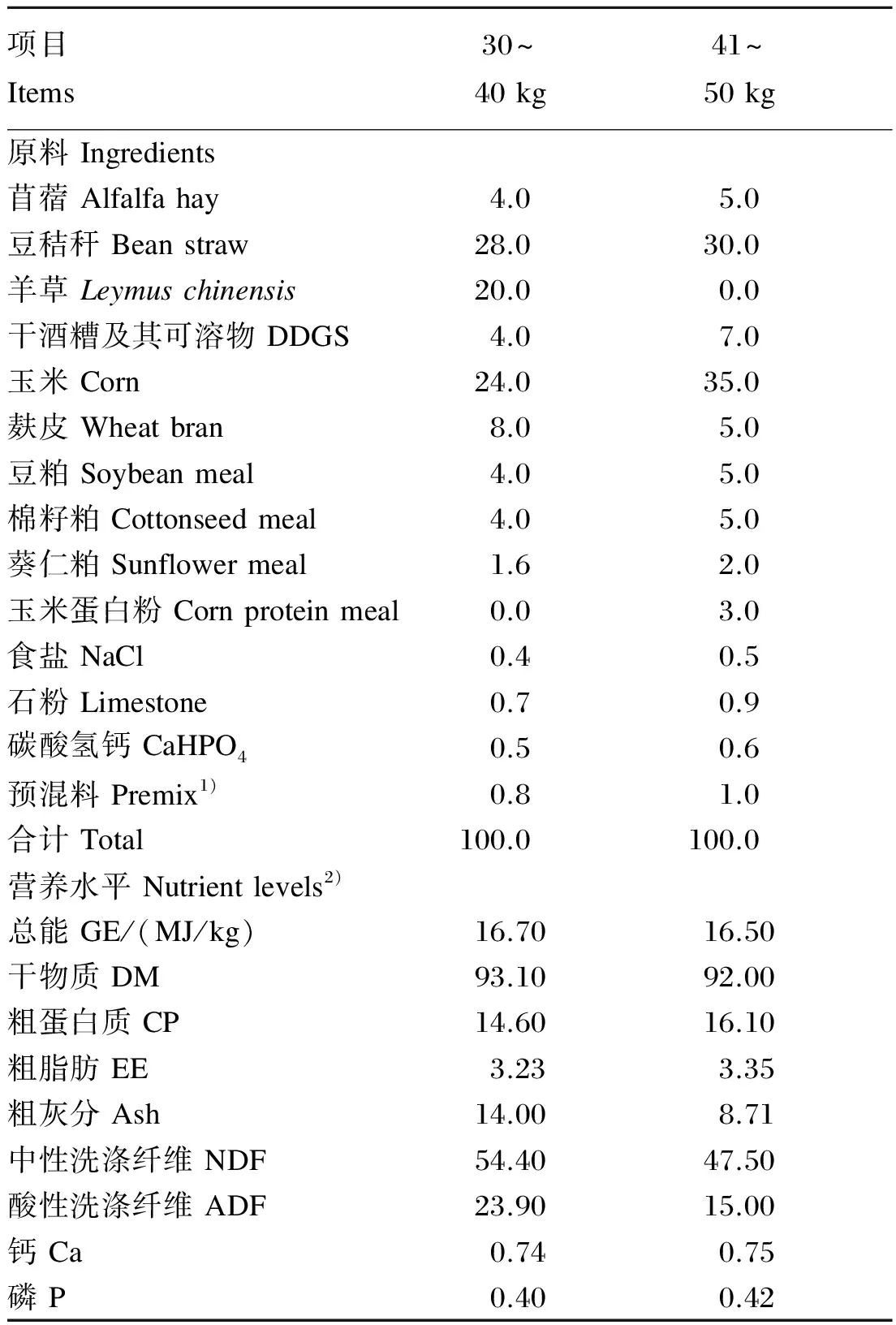
表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of diets:VA 15 000 IU,VD 2 200 IU,VE 50 IU,Fe 55 mg,Cu 12.5 mg,Mn 47 mg,Zn 24 mg,Se 0.5 mg,I 0.5 mg,Co 0.1 mg。
2)营养水平为实测值。Nutrient levels were measured values.
1.5 饲养管理
试验羊舍为半开放式圈舍。试验羊试验前剪毛和打好耳号,免疫程序按羊场正规程序进行。试验前用强力消毒灵溶液对羊舍的地面、羊栏、运动场等喷洒消毒。每个重复单独圈舍饲养,试验羊每天08:00和18:00各饲喂1次。试验全期自由采食、饮水。正试期开始后,每2 d收集1次剩料,计算羊只在此阶段的平均采食量,按照自由采食的要求(剩料占饲喂量的10%),调整饲喂量。
1.6 测定指标及方法
每天饲喂前记录饲喂量,每2 d收集记录1次剩料量,根据剩料量占饲喂量的比例,计算后续饲喂量,保证均为自由采食。对采食量和饲喂量均严格执行,做好记录,用于计算整个试验期各组羊的干物质采食量。每20 d对试验羊进行1次称重,记录体重变化。
1.6.2 屠宰性能
待宰试验羊当日16:00称重,禁食、禁水16 h,次日07:00屠宰前再次称重,经二氧化碳至晕后,颈静脉放血屠宰。
屠宰前称取所有待宰羊宰前活重。屠宰后去头、蹄、内脏,剥皮后称出胴体重和内脏各器官重量。消化道清除内容物并冲洗干净后,分别称取瘤胃、网胃、瓣胃、皱胃、小肠、大肠重量,进行记录。
用硫酸纸描绘倒数第1与第2肋骨之间脊椎上眼肌(背最长肌)的轮廓,待测眼肌面积;用游标卡尺测量在第12与第13肋骨之间、距离背脊中线11 cm处的组织厚度,即GR值。
主要指标计算公式如下:
因此,在尺度代表性上,遥感手段和传统点测方法还不够全面,还缺少一个中间尺度的方法,有必要在中间尺度上探讨一套客观、快速、实时、准确的土壤水分监测方法。探地雷达(Ground Penetrating Radar,简称GPR),则为小尺度和大尺度之间搭起了一座桥梁。该技术具有分辨率高、探测速度快、抗干扰能力和穿透能力强、可重复、适合大面积测量等特点,在几米至几公里的尺度上测定土壤水分分布和地下结构等方面的潜力已被多次证明。利用GPR对土壤水分进行测量,是目前国际上开展土壤水分探测的最先进技术之一。
胴体重(kg)=宰前活重-头、蹄、皮、尾、生殖器官及周围脂肪、内脏(保留肾脏和周围脂肪)的重量;屠宰率(%)=100×胴体重/宰前活重。
1.6.3 肉品质
熟肉率:取2块背最长肌,规格为6 cm×3 cm×3 cm,称取重量(m1),放在蒸煮袋中在80 ℃水浴锅中加热30 min后,置于4 ℃冰箱中过夜,之后取出肉样,用吸水纸吸干表面水分后称重(m2)。熟肉率计算公式如下:
熟肉率(%)=100×m2/m1[13]。
滴水损失:屠宰后取肉羊眼肌2块,规格为5 cm×3 cm×2 cm,称取初样重,之后分别悬挂于一次性纸杯中密闭且肉样不与纸杯接触,置于4 ℃的冰箱中24 h后取出用吸水纸吸干表面水分并称取末样重。滴水损失计算公式如下:
滴水损失(%)=100×(初样重-
末样重)/初样重[14]。
肉色指标:现场采用柯尼卡美能达CR-10色差计测定每只羊相同部位背最长肌的亮度(L*)、红度(a*)和黄度(b*)值(每个样品测定3次后取平均值作为最终结果)。
1.7 数据处理分析
试验数据采用Excel 2010进行整理,采用SAS 9.1统计软件的ANOVA过程进行单因素方差分析(one-way ANOVA),差异显著则用Duncan氏法进行多重比较检验。
2 结 果
2.1 不同生物制剂对杜寒杂交肉羊生产性能的影响
由表2可知,各组间干物质采食量的差异均不显著(P>0.05)。平均日增重,莫能菌素组、地衣芽孢杆菌组、酿酒酵母菌组与对照组差异不显著(P>0.05),但在数值上有升高的趋势,复合生物制剂组显著高于对照组(P<0.05),试验组间差异均不显著(P>0.05)。地衣芽孢杆菌组和复合生物制剂组料重比显著低于对照组(P<0.05),莫能菌素组和酿酒酵母菌组在数值上低于与对照组。
2.2 不同生物制剂对杜寒杂交肉羊屠宰性能的影响
由表2可知,各组的屠宰率在40.67%和44.30%之间,其中复合生物制剂组最高,为44.30%,与对照组差异达到显著水平(P<0.05),其他各生物制剂组与对照组相比有升高的趋势,但差异不显著(P>0.05)。复合生物制剂组GR值显著高于对照组(P<0.05)。各组眼肌面积在16.90~17.90 cm2,差异均不显著(P>0.05),但在数值上试验组均高于对照组,复合生物制剂组最高。
2.3 不同生物制剂对杜寒杂交肉羊内脏器官发育的影响
由表4可知,各组之间心脏和肝脏重量及其占宰前活重比例差异均不显著(P>0.05)。肺脏重量占宰前活重比例各组间差异均不显著(P>0.05),地衣芽孢杆菌组和复合生物制剂组肺脏重量均显著高于对照组(P<0.05),试验组间肺脏重量差异均不显著(P>0.05)。地衣芽孢杆菌组、酿酒酵母菌组和复合生物制剂组肾脏重量均显著高于对照组(P<0.05),试验组间肾脏重量及肾脏重量占宰前活重比例差异均不显著(P>0.05)。各组间肾周脂重量及其占宰前活重比例差异均不显著(P>0.05)。

表2 不同生物制剂对杜寒杂交肉羊生产性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.

表3 不同生物制剂对杜寒杂交肉羊屠宰性能的影响
2.4 不同生物制剂对杜寒杂交肉羊胃肠道发育的影响
由表5可知,对于瘤胃重量占宰前活重比例,地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组均显著高于莫能菌素组(P<0.05),复合生物制剂组瘤胃重量显著高于其他各组(P<0.05),地衣芽孢杆菌组、酿酒酵母菌组显著高于对照组和莫能菌素组(P<0.05)。复合生物制剂组网胃、瓣胃重量显著高于对照组和莫能菌素组(P<0.05)。复合生物制剂组复胃重量显著高于其他各组(P<0.05),地衣芽孢杆菌组、酿酒酵母菌组显著高于对照组(P<0.05),复合生物制剂组复胃重量占宰前活重比例显著高于对照组和莫能菌素组(P<0.05)。酿酒酵母菌组、复合生物制剂组小肠重量均显著高于其他各组(P<0.05),地衣芽孢杆菌组显著高于对照组、莫能菌素组(P<0.05),地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组小肠重量占宰前活重比例均显著高于对照组和莫能菌素组(P<0.05)。地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组大肠重量显著高于对照组(P<0.05),大肠重量占宰前活重比例各组间差异均不显著(P>0.05)。
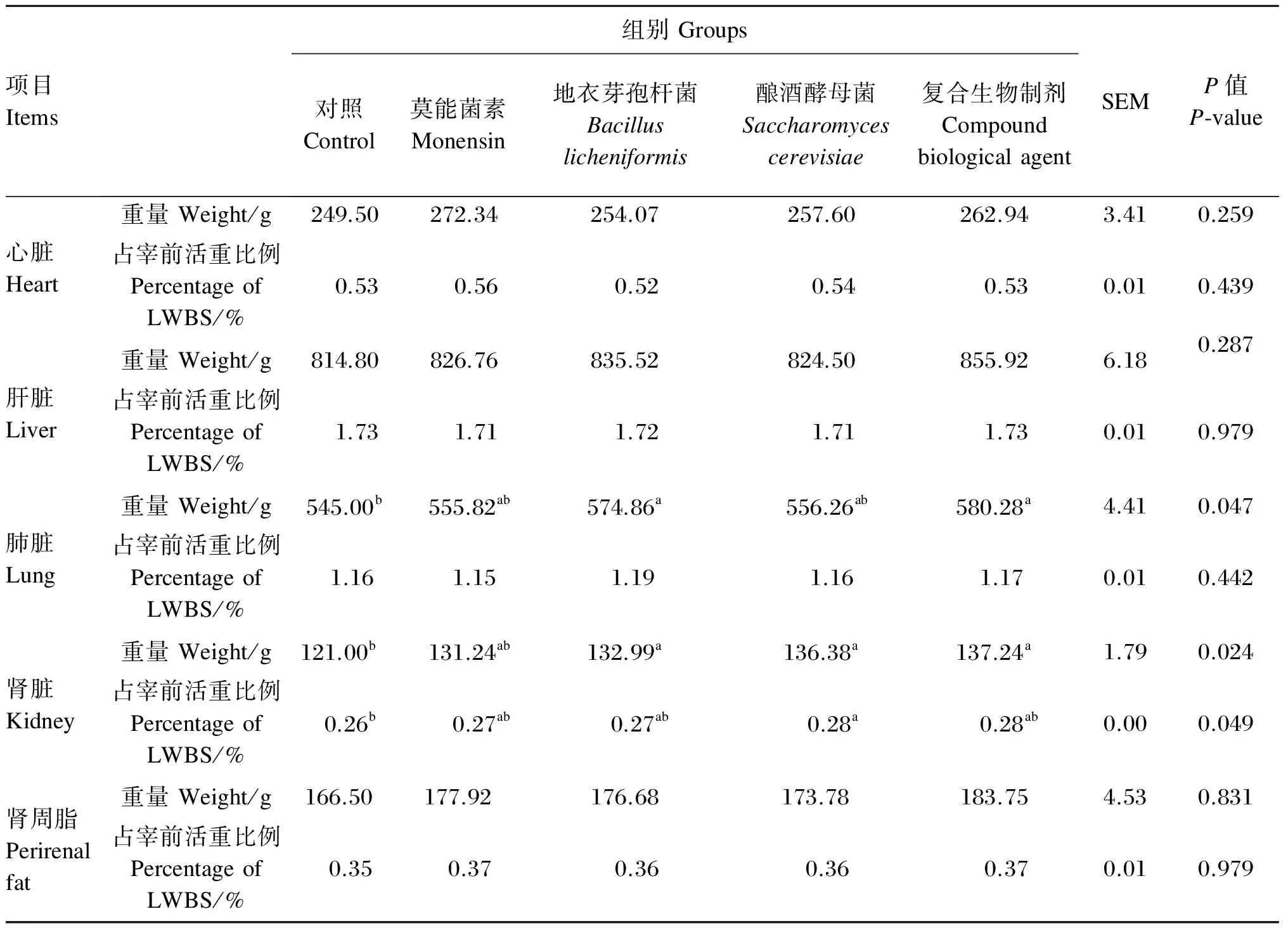
表4 不同生物制剂对杜寒杂交肉羊内脏器官发育的影响
2.5 添加不同生物制剂对杜寒杂交肉羊肉品质的影响
由表6可知,对于熟肉率和滴水损失2项指标,复合生物制剂组有升高的趋势,各组间差异不显著(P>0.05);3种肉色指标,各组间的差异也均不显著(P>0.05)。
3 讨 论
3.1 不同生物制剂对杜寒杂交肉羊生产性能的影响
益生菌进入机体后,通过竞争性排斥和提高机体免疫力,减少病原微生物在机体内的定植,增加有益菌的数量,改善肠道微生物平衡[15-16]。还能通过合成多种消化酶、改善消化道生理及生成有机酸降低肠道pH从而促进营养物质的吸收,最终提高动物生产性能[16]。本试验结果表明,各组间干物质采食量没有显著差异,各组生物制剂均不影响饲粮的适口性。Mirzaei-Alamouti等[17]研究表明,莫能菌素对羔羊干物质采食量没有显著影响;Titi等[18]研究表明,酵母菌培养物对羔羊采食量没有显著影响;Hernández等[19]研究表明,在青饲料中添加益生菌对羔羊采食量没有显著影响;李忠玲等[20]研究表明,复合酶菌制剂对内蒙古绒山羊采食量没有显著影响,均与本试验结果一致。但也有研究表明,在饲粮中添加益生菌能提高羔羊采食量[21]。肖怡等[22]研究表明,不同剂量的益生菌,对肉羊干物质采食量影响不同。试验结果的不一致,可能是因为生物制剂品种和添加剂量的不同造成。在本试验条件下,各组生物制剂均对肉羊的干物质采食量没有显著影响。
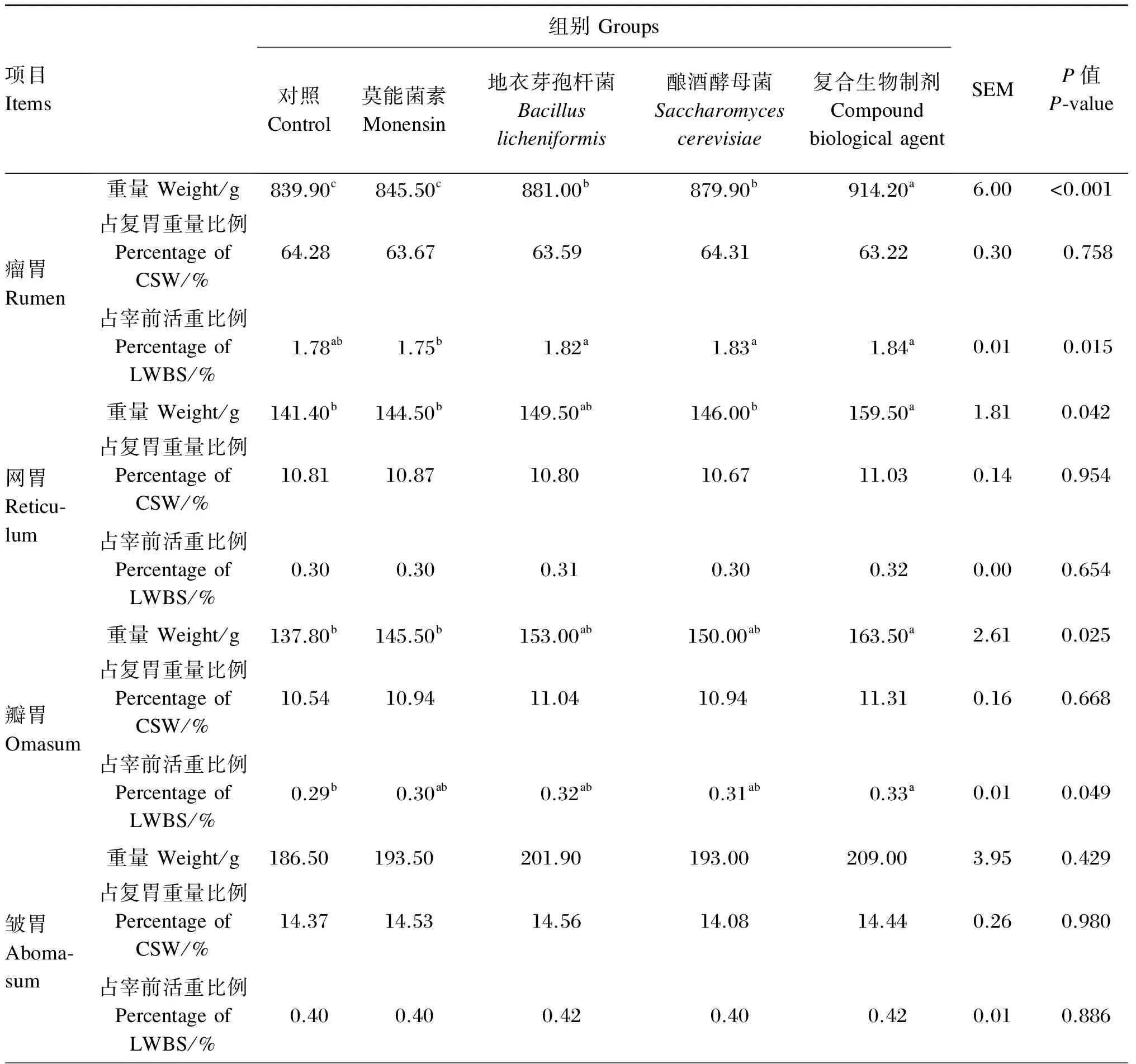
表5 不同生物制剂对杜寒杂交肉羊胃肠道发育的影响
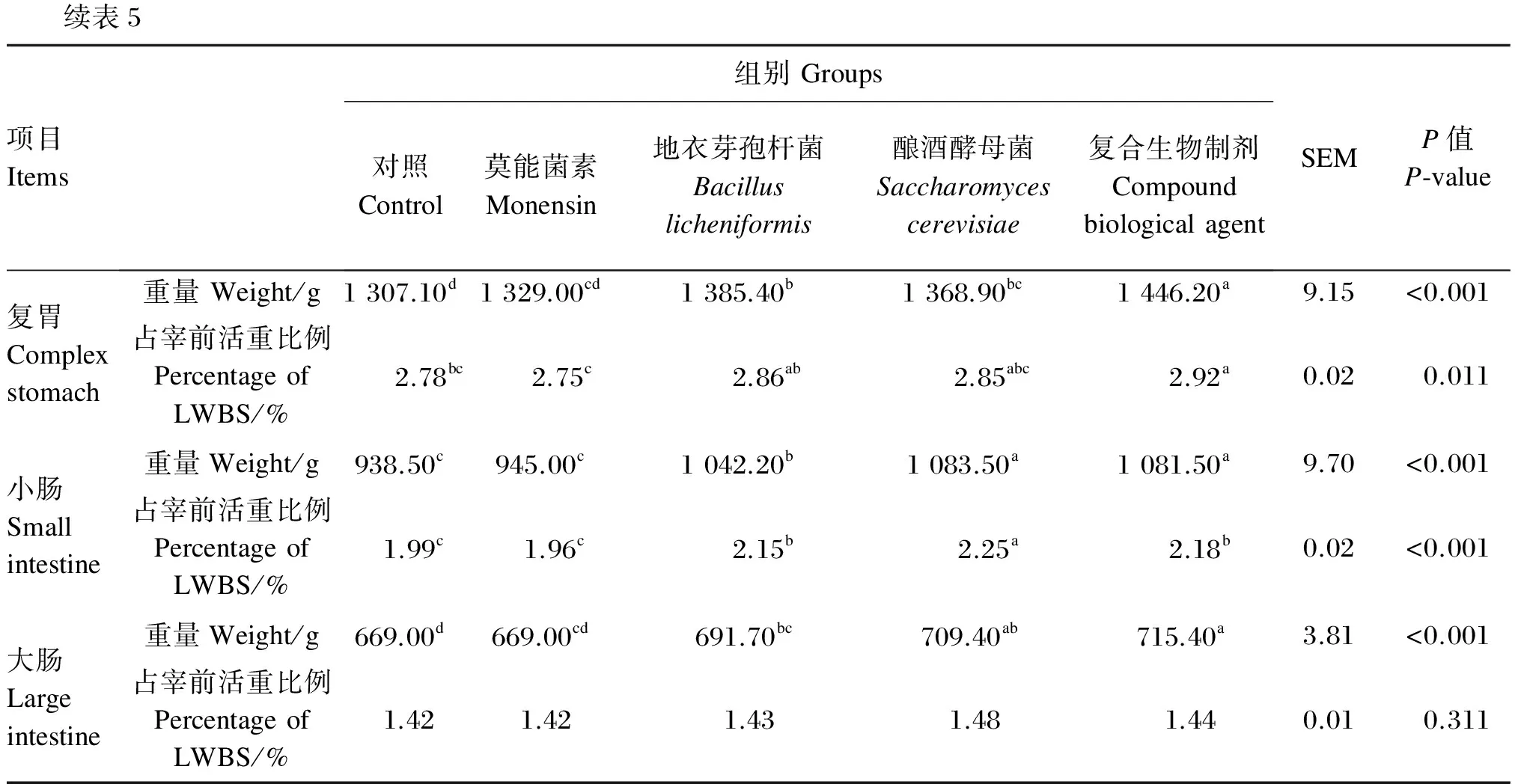
续表5项目Items组别Groups对照Control莫能菌素Monensin地衣芽孢杆菌Bacilluslicheniformis酿酒酵母菌Saccharomycescerevisiae复合生物制剂CompoundbiologicalagentSEMP值P⁃value复胃Complexstomach重量Weight/g1307.10d1329.00cd1385.40b1368.90bc1446.20a9.15<0.001占宰前活重比例PercentageofLWBS/%2.78bc2.75c2.86ab2.85abc2.92a0.020.011小肠Smallintestine重量Weight/g938.50c945.00c1042.20b1083.50a1081.50a9.70<0.001占宰前活重比例PercentageofLWBS/%1.99c1.96c2.15b2.25a2.18b0.02<0.001大肠Largeintestine重量Weight/g669.00d669.00cd691.70bc709.40ab715.40a3.81<0.001占宰前活重比例PercentageofLWBS/%1.421.421.431.481.440.010.311

表6 不同生物制剂对杜寒杂交肉羊肉品质的影响
各组生物制剂均可提高肉羊平均日增重,降低料重比,并且复合生物制剂组与对照组差异显著,说明在饲粮中添加生物制剂对羊只生长具有促进作用。Mirzaei-Alamouti等[17]研究表明,莫能菌素提高了羔羊平均日增重并降低了羔羊料重比,但差异均不显著,与本试验结果一致。芽孢杆菌为好氧细菌,在动物体内定植可产生大量的淀粉酶、纤维素酶和蛋白酶等,减少饲料中的抗营养因子,还可产生细菌素及乙酸、丙酸、丁酸等挥发性脂肪酸,抑制病原菌生长,提高免疫,最终提高动物的平均日增重和饲料利用率[23-24]。酵母菌为兼性厌氧真菌,可产生乳酸,改善胃肠道环境和菌群结构;内含超氧化物歧化酶和谷胱甘肽,提高动物抗氧化性;有利于瘤胃微生物对氨的利用,增加菌体蛋白含量[23,25];富含多种营养物质并具有很强的产酶活性,能增加瘤胃中纤维分解菌数量,有利于胃肠道对营养物质的消化、吸收和利用,最终促进动物的生长和改善饲料利用率[26-27]。刘国仕[23]研究表明,在饲粮中添加芽孢杆菌、酵母菌均可提高羔羊的平均日增重;单达聪等[28]研究表明,枯草芽孢杆菌和酵母菌的复合菌制剂可提高羔羊的平均日增重,降低料重比。本试验中,地衣芽孢杆菌组、酿酒酵母菌组与对照组、莫能菌素组相比,虽然提高了平均日增重和降低了料重比,但组间差异不显著,可能因为添加量不足以在动物体内稳定定植和彻底改善胃肠道环境与菌群结构。外源性蛋白酶制剂能够消除饲粮中的抗营养因子和抵抗消除炎症,补充内源酶的不足和刺激内源酶的分泌,提高营养物质的消化利用率,最终起到促进动物生长和提高饲料利用率的作用[29-31]。本试验中由地衣芽孢杆菌、酿酒酵母菌和碱性蛋白酶组成的复合生物制剂对羊只的平均日增重和料重比效果最佳。复合菌制剂更易产生乳酸菌,能适应多种条件和宿主,比单一菌制剂更能促进畜禽的生长和改善料重比[32];蛋白酶制剂由益生菌加工产生,二者具有协同作用。俄木曲者等[33]研究表明,酶菌制剂显著提高了4月龄羔羊平均日增重和饲料利用率;李忠玲等[20]研究表明,复合酶菌制剂能够显著提高内蒙古绒山羊平均日增重,酶制剂和益生素配伍能够在畜禽生产中表现较好效果[34],与本试验结果一致。从羊只生产性能来看,地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组优于莫能菌素组和对照组,并且复合生物制剂组效果最佳。
3.2 不同生物制剂对杜寒杂交肉羊屠宰性能和肉品质的影响
屠宰性能是动物生产性能的一项重要指标,屠宰性能的高低主要通过屠宰率、眼肌面积和GR值来测定[35]。本试验结果表明,在饲粮中添加生物制剂均能显著提高羊只胴体重,并能提高屠宰率,但只有复合生物制剂组效果显著。有研究结果表明,宰前活重对胴体重和屠宰率的影响最为显著[35];Dhanda[36]报道,绵羊的屠宰率随着日龄和宰前活重的增加而呈上升趋势。本试验中各组羊只也表现出宰前活重越高胴体重、屠宰率越高的趋势。各组生物制剂对羊只眼肌面积均无显著影响,GR值是代表胴体脂肪含量的重要指标,复合生物制剂组显著提高羊只GR值。复合生物制剂组试验羊宰前活重和胴体重均高于其他4组,胴体脂肪含量也得到提高。本试验结果表明,复合生物制剂能显著提高杜寒杂交肉羊屠宰性能。
羔羊胴体的肉色决定消费者对肉的可接受性[37],滴水损失影响着肉品的多汁性[38]。熟肉率是测定肌肉在烹煮过程中保水情况的主要指标,熟肉率越高,肌肉的保水性越强,肌肉越嫩,肉品质就越好[39]。在本试验中,各组之间羊只背最长肌熟肉率、滴水损失、肉色差异均不显著,复合生物制剂组各项指标均高于其他各组。羔羊的饲养管理及饲粮中能量和蛋白质水平是影响胴体品质的重要因素[39-40]。本试验中,在饲粮中添加莫能菌素、地衣芽孢杆菌、酿酒酵母菌和复合生物制剂对羊只肉品质均没有显著影响。
3.3 不同生物制剂对杜寒杂交肉羊内脏器官和胃肠道重量及发育的影响
组织重量和器官重量的改变,是动物自身生长发育的一部分,在一定程度上反映了动物机体的机能状况,对理论研究和生产实践具有重要的意义[41-42]。在本试验中,羊只内脏器官重量占宰前活重比例均在正常数值范围内[43-45]。各组之间羊只心脏、肝脏、肾周脂重量及其占宰前活重比例均没有显著差异;地衣芽孢杆菌组和复合生物制剂组虽然显著提高了肺脏重量,但对肺脏重量占宰前活重比例没有显著影响,说明羊只组织器官的发育与机体增长相协调。肾脏重要功能是通过尿液的形式排泄代谢废物[44],地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组显著提高了肾脏重量,但只有酿酒酵母菌组显著提高了肾脏重量占宰前活重比例。其原因可能是酿酒酵母菌组干物质采食量较高,使代谢废物增加,促进了肾脏生长发育,而宰前活重与地衣芽孢杆菌组和复合生物制剂组相比较低,最终导致酿酒酵母菌组肾脏重量占宰前活重比例的升高。本试验条件下,在饲粮中添加不同生物制剂不会影响羊只内脏器官的正常生长发育,符合动物具有调控内脏器官与机体生长发育相适应的本能[46]。
反刍动物胃肠道的发育程度直接关系到动物的采食能力和消化能力,其中以瘤胃的发育最为重要,直接关系着动物成年以后的生产性能[47]。本试验结果表明,莫能菌素组羊只瘤胃、网胃、瓣胃、皱胃、复胃重量及其占宰前活重比例与对照组差异均不显著,羊只胃部发育与机体的增长相协调。地衣芽孢杆菌组、酿酒酵母菌组和复合生物制剂组瘤胃、复胃重量显著高于对照组,各个胃室和复胃重量占宰前活重比例均高于对照组和莫能菌素组,在饲粮中添加地衣芽孢杆菌、酿酒酵母菌和复合生物制剂对羊只胃部发育均有促进作用。益生菌能够提高饲粮的消化代谢[48],而饲粮消化与代谢产生的刺激能够增加瘤胃的重量和促进瘤胃肌的发育。因此,益生菌可能通过提高饲粮的消化代谢促进瘤胃的发育,进而影响整个胃部的发育。本试验中,地衣芽孢杆菌组、酿酒酵母菌组、复合生物制剂组与对照组、莫能菌素组相比均显著提高了小肠重量和小肠重量占宰前活重比例。益生菌有促进肠道菌群增殖的作用,肠道微生物经发酵作用产生的短链脂肪酸能够通过提供给肠黏膜能量,改善组织局部供血,进而促进肠上皮细胞的修复以及提高胰液中胰酶的分泌来促进肠道的发育[49]。因此,益生菌可能通过间接提高短链脂肪酸含量促进了小肠发育。
4 结 论
本试验条件下:
① 由益生菌和酶制成的复合生物制剂对肉羊的平均日增重和料重比的影响优于单一的益生菌及莫能菌素。
② 单一生物制剂对肉羊提高生产性能和屠宰性能的效果为:地衣芽孢杆菌>酿酒酵母菌>莫能菌素>无添加。
③ 生物制剂对杜寒杂交肉羊的肉品质无显著影响。
[1] 刁其玉.微生物制剂在幼龄反刍动物营养与饲料中的应用.动物营养学报,2014,26(10):3159-3167.
[2] 刁其玉.益生菌在幼龄家畜营养与饲料中的应用.饲料工业,2014,35(16):1-4.
[3] 符运勤.地衣芽孢杆菌及其复合菌对后备牛生长性能和瘤胃内环境的影响.硕士学位论文.北京:中国农业科学院,2012.
[4] 周盟.植物乳杆菌和枯草芽孢杆菌及其复合菌在断奶仔猪和犊牛日粮中的应用研究.硕士学位论文.乌鲁木齐:新疆农业大学,2013.
[5] 万凡,马涛,杨开伦,等.微生态制剂在肉羊营养与饲粮中的应用.家畜生态学报,2016,37(9):71-75.
[6] 张仁义.地衣芽孢杆菌对肉鸡生长性能的影响及其作用机理的研究.硕士学位论文.福州:福建农林大学,2010.
[7] 耿春银.活性酵母与酵母培养物饲喂育肥牛生长性能、胴体指标和牛肉品质的比较.博士学位论文.北京:中国农业大学,2015.
[8] MA T,DENG K,TU Y,et al.Effect of dietary concentrate:forage ratios and undegraded dietary protein on nitrogen balance and urinary excretion of purine derivatives in Dorper×thin-tailedhancrossbred lambs.Asian-Australasian Journal of Animal Sciences,2014,27(2):161-168.
[9] MA T,DENG K D,TU Y,et al.Effect of feed intake on metabolizable protein supply in Dorper × thin-tailedHancrossbred lambs.Small Ruminant Research,2015,132:133-136.
[10] DENG K D,DIAO Q Y,JIANG C G,et al.Energy requirements for maintenance and growth of Dorper crossbred ram lambs.Livestock Science,2012,150(1/2/3):102-110.
[11] 邓凯东.育肥绵羊的能量和蛋白质需要量研究//中国农业科学院博士后研究工作报告.北京:中国农业科学院,2010.
[12] XU G S,MA T,JI S K,et al.Energy requirements for maintenance and growth of early-weaned Dorper crossbred male lambs.Livestock Science,2015,177:71-78.
[13] 徐平.羔羊早期断奶应用研究.硕士学位论文.兰州:甘肃农业大学,2008.
[14] 周利华,郭源梅,段艳宇,等.在白色杜洛克×二花脸资源家系中定位影响猪肉滴水损失的QTL.中国农业科学,2011,44(10):2131-2138.
[15] 徐鹏,董晓芳,佟建明.微生物饲料添加剂的主要功能及其研究进展.动物营养学报,2012,24(8):1397-1403.
[16] 雷燕.益生菌对肉鸡生产性能、消化道生理及肠道微生物区系的影响.硕士学位论文.成都:四川农业大学,2009.
[17] MIRZAEI-ALAMOUTI H,MORADI S,SHAHALIZADEH Z,et al.Both monensin and plant extract alter ruminal fermentation in sheep but only monensin affects the expression of genes involved in acid-base transport of the ruminal epithelium.Animal Feed Science and Technology,2016,219:132-143.
[18] TITI H H,DMOUR R O,ABDULLAH A Y.Growth performance and carcass characteristics of Awassi lambs andShamigoat kids fed yeast culture in their finishing diet.Animal Feed Science and Technology,2008,142(1/2):33-43.
[20] 李忠玲,杜忍让,武和平,等.复合酶制剂对陕北绒山羊增重效果的研究.畜牧兽医杂志,2014,33(6):4-7.
[22] 肖怡,陶大勇,赵明明,等.地衣芽孢杆菌对肉羊甲烷排放及消化代谢的影响.动物营养学报,2016,28(2):515-523.
[23] 刘国仕.微生态制剂对羔羊育肥和屠宰性能的影响.硕士学位论文.乌鲁木齐:新疆农业大学,2008.
[24] 李震.抑菌微生态制剂替代饲用抗生素技术研究.硕士学位论文.济南:山东农业大学,2012.
[25] 李冬野,吴凌.反刍动物微生态制剂的研究进展.黑龙江八一农垦大学学报,2011,23(1):40-44.
[26] 孙晴.微生态制剂对反刍动物生产性能及肉品质的影响.饲料研究,2011(7):66-67.
[27] 吴凤笋,张桂云.动物微生态制剂在养殖业中的作用机理及应用.上海畜牧兽医通讯,2012(3):68-69.
[28] 单达聪,王雅民,魏元斌.用益生菌与酶制剂饲喂育肥羔羊效果的研究.当代畜牧,2008(11):33-35.
[29] 周芬.断奶日龄和外源中性蛋白酶对仔猪生产性能、消化器官生长和消化酶活性的影响.硕士学位论文.南京:南京农业大学,2008.
[30] 王雄,陈清华.饲用蛋白酶及其在肉鸡日粮中应用的研究进展.饲料研究,2016(21):10-14.
[31] 白燕.饲用蛋白酶体外评价及其在肉仔鸡日粮中的应用研究.硕士学位论文.呼和浩特:内蒙古农业大学,2015.
[32] 李旋亮,吴长德,龚商羽.微生态制剂的研究进展及应用.饲料研究,2009(5):13-15.
[33] 俄木曲者,熊朝瑞,范景胜.饲料中添加益生素对羔羊育肥效果和肉品质的影响.四川畜牧兽医,2016,43(3):33-34,37.
[34] 张利娟,刁新平.益生素的研究和应用现状.黑龙江畜牧兽医,2010(11):42-44.
[35] 荷花.饲养模式对绒山羊成年母羊育肥和屠宰性能的影响.硕士学位论文.呼和浩特:内蒙古农业大学,2013.
[36] DHANDA J S.Evaluation of crossbred goat and sheep production in the tyopics.London:Longman Group Ltd.,2001.
[37] MANCINI R A,HUNT M C.Current research in meat color.Meat Science,2005,71(1):100-121.
[38] AGUAYO-ULLOA L A,LA LAMA M D,PASCUAL-ALONSO M,et al.Effect of feeding regime during finishing on lamb welfare,production performance and meat quality.Small Ruminant Research,2013,111(1/2/3):147-156.
[39] 李秋凤,李春芳,曹玉凤,等.不同营养水平对淘汰荷斯坦奶牛消化代谢、肉品质的影响.草业学报,2014,23(6):126-135.
[40] NAPOLITANO F,CIFUNI G F,PACELLI C,et al.Effect of artificial rearing on lamb welfare and meat quality.Meat Science,2002,60(3):307-315.
[41] 张晋青,岳度兵,罗海玲,等.日粮中维生素E水平对敖汉细毛羊内脏器官生长发育的影响.中国畜牧杂志,2010,46(17):43-46.
[42] 柴建民,刁其玉,屠焰,等.早期断奶时间对湖羊羔羊组织器官发育、屠宰性能和肉品质的影响.动物营养学报,2014,26(7):1838-1847.
[43] 万凡,马涛,马晨,等.不同饲养标准对杜寒杂交肉用绵羊生产和屠宰性能的影响.动物营养学报,2016,28(11):3483-3492.
[44] 许贵善.20~35 kg杜寒杂交羔羊能量与蛋白质需要量参数的研究.博士学位论文.北京:中国农业科学院,2013.
[45] 邓凯东.育肥绵羊的能量和蛋白质需要量研究//中国农业科学院博士后研究工作报告.北京:中国农业科学院,2010.
[46] 祁敏丽,柴建民,王波,等.饲粮营养限制对早期断奶湖羊羔羊生长性能以及内脏器官发育的影响.动物营养学报,2016,28(2):444-454.
[47] 岳喜新,刁其玉,邓凯东,等.饲喂代乳粉对羔羊生长性能和体组织参数的影响.饲料工业,2010,31(19):43-46.
[48] 肖怡.三种益生菌对肉羊甲烷排放、物质代谢和瘤胃发酵的影响.硕士学位论文.阿拉尔:塔里木大学,2016.
[49] 王丽凤.益生菌L.plantarumP-8对肉鸡肠道菌群、肠道免疫和生长性能影响的研究.博士学位论文.呼和浩特:内蒙古农业大学,2014.
EffectsofDietarySupplementationofDifferentBiologicalAgentsonProductionPerformanceandSlaughterPerformanceofDorper×Thin-TailedHanCrossbredMuttonLambs
JIA Peng1,2WAN Fan1,2MA Tao2WANG Wenyi3YANG Dong2,3WANG Yunfei3GUO Baolin4ZHAO Lifang4DIAO Qiyu2*YANG Kailun1*
(1.XinjiangAgriculturalUniversity,Urumqi830052,China; 2.KeyLaboratoryofFeedBiotechnologyoftheMinistryofAgriculture,FeedResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China; 3.ScientificResearchInstituteofAgriculturalandAnimalHusbandryinBayannaoer,Bayannaoer015000,China; 4.BeijingXindayangTechnologicalCo.,Ltd.,Beijing100081,China)
This experiment was conducted to study the effects of dietary supplementation of different biological agents on production performance, slaughter performance, tissue and organ development and meat quality of Dorper×thin-tailedHancrossbred mutton lambs. One hundred and sixty Dorper×thin-tailedHancrossbred F1 mutton lambs (weighted about 32 kg) were randomly assigned into 5 groups with 4 replicates in each group and 8 mutton lambs per replicate according to a single factor experimental design. Control group used a basal diet, 21 mg/kg monensin, 4×109CFU/kgBacilluslicheniformis, 3.2×109CFU/kgSaccharomycescerevisiaeand 1.1 g/kg compound biological agents (Bacilluslicheniformis≥6×109CFU/g,Saccharomycescerevisiae≥4×109CFU/g and alkaline proteinase≥1 000 U/g) were supplemented in experimental groups. The pretest lasted for 10 d, and the test lasted for 56 d. Feed intake was recorded every 2 d and lambs were weighed every 20 d. Ten lambs from each group were slaughtered to determine slaughter performance, tissue and organ weight and meat quality after body weight of lambs in compound biological agents group reached about 50 kg. The results showed as follows: 1) for average daily gain and dressing percentage, compound biological agents group was significantly higher than control group (P<0.05); feed to gain ratio inBacilluslicheniformisgroup and compound biological agents group was significantly lower than that in control group (P<0.05). 2) Complex stomach weight inBacilluslicheniformisgroup,Saccharomycescerevisiaegroup and compound biological agents group was significantly higher than that in control group (P<0.05), and the percentage of complex stomach weight of live weight before slaughter (LWBS) in compound biological agents group was significantly higher than that in control group and monensin group (P<0.05); small intestine weight and its percentage of LWBS inBacilluslicheniformisgroup,Saccharomycescerevisiaegroup and compound biological agents group were significantly higher than those in control group and monensin group (P<0.05). 3) The percentage of kidney weight of LWBS inSaccharomycescerevisiaewas significantly higher than that in control group, while the other internal organ weight percentages of LWBS were not significantly different among groups (P>0.05). 4) Meat quality indexes had no significant difference among groups (P>0.05). In conclusion, from the effects as feed additives on production performance of mutton lambs,Bacilluslicheniformis,Saccharomycescerevisiaeand compound biological agents can replace monensin, andBacilluslicheniformisis better thanSaccharomycescerevisiae, and compound biological agents has the best effect.[ChineseJournalofAnimalNutrition,2017,29(12):4621-4631]
mutton lamb; biological agents; production performance; slaughter performance; organ index
10.3969/j.issn.1006-267x.2017.12.045
S826
A
1006-267X(2017)12-4621-11
2017-06-12
内蒙古自治区科技重大专项“巴美肉羊产业化技术研究集成应用”;国家肉羊产业技术体系建设专项资金(CARS-39)
贾 鹏(1993—),男,新疆库尔勒人,硕士研究生,从事动物营养与饲料科学研究。E-mail: jiazhenpeng123123@163.com
*通信作者:刁其玉,研究员,博士生导师,E-mail: diaoqiyu@caas.cn;杨开伦,教授,博士生导师,E-mail: yangkailun2002@aliyun.com
*Corresponding authors: DIAO Qiyu, professor, E-mail: diaoqiyu@caas.cn; YANG Kailun, professor, E-mail: yangkailun2002@aliyun.com
(责任编辑 王智航)
