本草乳炎清散抑菌效果及抗炎作用研究
2017-12-15冶冬阳李林育左儒楠孟德兰王怡然刘晓强李引乾杨鸣琦
秦 鹏,冶冬阳,李林育,陈 强,左儒楠,孟德兰,佟 昱,王怡然,刘晓强,李引乾,杨鸣琦
(西北农林科技大学动物医学院,陕西杨凌 712100)
本草乳炎清散抑菌效果及抗炎作用研究
秦 鹏,冶冬阳,李林育,陈 强,左儒楠,孟德兰,佟 昱,王怡然,刘晓强,李引乾*,杨鸣琦*
(西北农林科技大学动物医学院,陕西杨凌 712100)
采用牛津杯法和试管二倍稀释法分别测定本草乳炎清散抑菌圈、最低抑菌浓度(MIC)和最低杀菌浓度(MBC);利用二甲苯致小鼠耳廓肿胀试验、小鼠棉球肉芽肿试验和醋酸致小鼠腹腔毛细血管通透性试验观察本草乳炎清散的抗炎作用。结果表明,本草乳炎清散对金黄色葡萄球菌、大肠埃希菌、无乳链球菌的MIC分别为0.062 5、0.125、0.062 5 g/mL,MBC分别为0.125、0.250、0.125 g/mL;本草乳炎清散(0.50 g/mL)对金黄色葡萄球菌、大肠埃希菌、无乳链球菌的抑菌圈直径分别为22.83、21.60、24.51 mm,均大于20 mm,极敏感。本草乳炎清散高、中、低剂量组耳廓肿胀抑制率分别为39.74%、36.78%和28.84%,与生理盐水对照组相比,高、中剂量组存在极显著差异(P<0.01),低剂量组存在显著差异(P<0.05);本草乳炎清散高、中、低剂量组小鼠肉芽肿增生抑制率分别为53.53%、51.69%和35.89%,与生理盐水对照组相比,高、中、低剂量组均存在极显著差异(P<0.01);本草乳炎清散高、中、低剂量组对小鼠腹腔毛细血管通透性升高抑制率分别为51.06%、46.81%和34.04%,与生理盐水对照组相比,高、中剂量组存在极显著差异(P<0.01),低剂量组存在显著差异(P<0.05)。说明本草乳炎清散对奶牛乳房炎3种主要致病菌有明显的抑制作用,同时具有显著的抗炎效果,并且两种抑制效果在一定范围内与给药剂量呈正相关。
奶牛乳房炎;本草乳炎清散;体外抑菌作用;抗炎作用
奶牛乳房炎是影响奶牛业发展的主要疾病之一,全世界约有1/3的奶牛患有各种类型的乳房炎[1],这给奶牛业带来了巨大的经济损失,严重影响了奶牛业的健康发展。目前,国内外主要使用抗生素进行临床治疗,能够达到一定的治疗效果,但同时也带来了病情易复发、细菌出现耐药性、牛乳中药物残留等诸多问题[2]。因此,研究和开发出高效、低毒、低残留的药物制剂已成为国内学者关注的焦点[3]。
本草乳炎清散是由内蒙古华天制药有限公司研发,用于治疗奶牛乳房炎的中药复方制剂,组方包含蒲公英、连翘、黄芩等12味中草药。本文采用牛津杯法和试管二倍稀释法分别测定抑菌圈、最低抑菌浓度(MIC)和最低杀菌浓度(MBC),评价本草乳炎清散对奶牛乳房炎主要致病菌的体外抑制效果;利用二甲苯致小鼠耳廓肿胀试验、小鼠棉球肉芽肿试验和小鼠腹腔毛细血管通透性试验对本草乳炎清散的抗炎作用进行研究,旨在为临床应用提供参考和理论依据。
1 材料与方法
1.1 材料
1.1.1 药物 本草乳炎清散(由内蒙古华天制药有限公司提供,批号:151101);公英散(格润动物药业有限公司,批号:20150801);阿司匹林(天津力生制药股份有限公司,批号:150601);陆眠宁Ⅱ(吉林省华牧动物保健品有限公司,批号:150310)。
1.1.2 菌种与培养基 金黄色葡萄菌、大肠埃希菌、无乳链球菌,由本实验室从患乳房炎的奶牛乳样中分离鉴定,并在普通肉汤试管中保存于4℃冰箱,乳样取自河南某牛场。肉汤培养基、普通琼脂培养基、麦康凯培养基及50 mL/L绵羊血培养基均按微生物教材配制。
1.1.3 试剂和仪器 伊文思兰(Evans Blue)(Biosharp公司,批号:150901);二甲苯(分析纯)等。旋转蒸发仪(上海亚荣生化仪器厂,型号:RE 52-98);分光光度仪(日本岛津公司,型号:UV-2201);电子分析天平(上海天美天平仪器有限公司,型号:FA1204B)等。
1.1.4 实验动物 昆明种小鼠,雌雄各半,体重18 g~22 g(购自第四军医大学实验动物中心)。
1.2 方法
1.2.1 水煎液制备 取散剂100 g加蒸馏水1 000 mL,充分混匀,浸泡30 min后煎煮,煮沸后改用文火煎30 min,用四层纱布过滤,滤渣加蒸馏水1 000 mL煎煮,煮沸后改用文火煎30 min,用四层纱布过滤,合并两次滤液,用旋转蒸发仪浓缩至100 mL(含药量1 g/mL),121℃高压灭菌15 min,4℃密封保存备用[4]。
1.2.2 体外抑菌作用
1.2.2.1 细菌悬液制备 取9支盛有9 mL 9 g/L无菌氯化钠溶液的试管,依次标记10-1~10-9。超净台中无菌操作,移液枪吸取1.0 mL菌液至10-1试管中,在旋涡混合器上混匀此试管菌液,从10-1试管中吸取1.0 mL至10-2试管中,同样方法混匀,依次稀释至10-9试管[5]。
取无菌培养皿20套,分别标注10-5、10-6、10-7、10-8、10-9各4套。每套平皿中加入15 mL琼脂培养基,待冷却凝固后,分别吸取10-5~10-9试管内菌液100 μL于相应的培养皿中,用无菌棉签将菌液涂布均匀,置于37℃恒温箱中培养24 h,对菌落个数在30~300之间的培养皿进行计数,取平均值,单位为CFU/mL。最终配成菌液浓度为5×106CFU/mL的菌悬液,4℃保存备用[6]。
1.2.2.2 牛津杯法 配制普通琼脂平板、麦康凯平板和50 mL/L绵羊血平板,培养基厚度约为4 mm,分别吸取各菌悬液100 μL加到平板内,用高压灭菌后的棉签涂布均匀[7]。将4个牛津杯分别置于平板中,其中3个加入本草乳炎清散3个药液浓度,浓度分别为1.0、0.5、0.25 g/mL,另外一个加入对照药物公英散,浓度为0.5 g/mL,各加入250 μL,且每种细菌重复4次[8]。4℃冰箱放置30 min,然后再放入37℃恒温培养箱中,恒温培养24 h,用游标卡尺以十字交叉法测量抑菌圈直径,并以抑菌圈的大小及有无来评价药物抑菌活性。
效果判定:抑菌圈直径≥20 mm为极敏感,20 mm>抑菌圈直径≥15 mm为高度敏感,15 mm>抑菌圈直径≥10 mm为中度敏感,抑菌圈直径<10 mm为低度敏感或无效[9]。
1.2.2.3 试管二倍稀释法 超净台中无菌操作,将10支有棉塞的灭菌试管依次编号,1~9号试管均加入无菌肉汤2.0 mL,用移液枪在1号试管中加入本草乳炎清散2.0 mL,多次吹吸至混合均匀后,吸出2.0 mL加入2号试管中,依次类推进行稀释,直到从8号管中取出2.0 mL弃去[10]。9号管中不加入药物,作为阳性对照管;10号管中只加入2.0 mL本草乳炎清散,不加肉汤和细菌,作为阴性对照试管;各试管平行3份[11]。用移液枪吸取制备好的细菌悬液(浓度为5×106CFU/mL)100 μL分别加入到上述1~9号管中混合摇匀,10号试管加入100 μL灭菌生理盐水,将各试管放于37℃恒温培养箱中恒温培养24 h,观察并记录结果。
结果判定:在9号阳性对照管肉汤培养液呈浑浊状,而10号阴性对照管肉汤培养液呈透明状的前提下,观察其他试管中肉汤培养液的浑浊情况,以不发生浑浊变化的最小浓度为本草乳炎清散的MIC[12]。选用已经确定MIC的各组,从组内所有未发生浑浊变化的试管中各吸取100 μL培养液,加到相应的琼脂培养基中,用灭菌的三角形玻璃棒涂布均匀,置37℃恒温培养箱中恒温培养24 h,重复3次,观察并记录结果。结果判定:以琼脂平板内菌落数不超过5个的最低浓度为本草乳炎清散的MBC。
1.2.3 抗炎作用
1.2.3.1 二甲苯致小鼠耳廓肿胀试验 取成年健康小鼠50只,随机分为5组,每组10只,雌雄各半,试验前禁食24 h,不限制水,每天灌胃1次,连续7天。其中第1组为本草乳炎清散高剂量组,给药浓度为0.2 g/mL;第2组为本草乳炎清散中剂量组,给药浓度为0.1 g/mL;第3组为本草乳炎清散低剂量组,给药浓度为0.05 g/mL;第4组为阿司匹林对照组,给药浓度为0.001 g/mL;第5组为生理盐水对照组,每次给予等体积生理盐水[5],各组灌胃体积均为10 mL/kg。最后一次给药12 h后,在每只小鼠右耳滴涂20 μL二甲苯(正反两面涂敷,各10 μL)致炎[6],左耳作为对照,致炎30 min后处死小鼠,随即沿耳廓基线剪下双耳,用直径为9 mm的打孔器在左、右耳相对称位置取下耳片[7],称重并计算肿胀度及肿胀抑制率。计算公式:耳廓肿胀度=右耳片重量-左耳片重量;肿胀抑制率=(对照组平均肿胀度-药物组平均肿胀度)/对照组平均肿胀度×100%[8]。
1.2.3.2 小鼠棉球肉芽肿试验 实验动物分组及给药方案同1.2.3.1。肌肉注射陆眠宁Ⅱ将小鼠麻醉,无菌条件下在小鼠一侧腹股沟处皮下埋植高压灭菌过的棉球(约5 mg),术后24 h开始灌胃给药[9]。最后一次给药12 h后处死小鼠,取出棉球肉芽肿组织,于60℃干燥24 h至恒重[10],在分析天平上精确称量棉球肉芽肿的重量,计算肉芽肿重量以及增生抑制率[8]。计算公式:肉芽肿重量=棉球肉芽肿重量-原棉球重量;增生抑制率=(对照组肉芽肿平均重量-药物组肉芽肿平均重量)/对照组肉芽肿平均重量×100%。
1.2.3.3 醋酸致小鼠腹腔毛细血管通透性试验 实验动物分组及给药方案同1.7.1。最后一次给药12 h后,小鼠尾静脉注射1 g/L伊文思兰(Evans blue)生理盐水溶液,给药剂量为0.1 mL/10 g,然后腹腔注射6 mL/L冰醋酸溶液0.1 mL/10 g致炎[11]。20 min后处死小鼠,腹腔注射5 mL生理盐水,轻揉小鼠腹部数分钟,剖开腹腔,用一次性吸管吸取冲洗液,合并冲洗液于离心管中,3 000 r/min离心15 min,取上清液在波长590 nm处测定OD值,以OD值表示腹腔中伊文思兰(Evans blue)的含量,计算毛细血管通透性抑制率[12]。
计算公式:通透性抑制率=(对照组平均OD值-药物组平均OD值)/对照组平均OD值×100%。
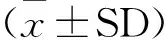
2 结果
2.1 体外抑菌作用
本草乳炎清散不同浓度水煎液对奶牛乳房炎3种主要致病菌:金黄色葡萄球菌、大肠埃希菌和无乳链球菌,均有抑制作用,且药物浓度越高,抑菌效果越好。本草乳炎清散低剂量组(0.25 g/mL)对金黄色葡萄球菌和无乳链球菌的抑菌圈直径均大于15 mm,对大肠埃希菌的抑菌圈直径为14.74,接近于15 mm,各致病菌对本草乳炎清散高度敏感,且本草乳炎清散的抑菌效果明显优于相同浓度的公英散(表1)。本草乳炎清散对金黄色葡萄球菌和无乳链球菌的MIC均为0.062 5 g/mL,MBC均为0.125 g/mL;对大肠埃希菌的MIC为0.125 g/mL,MBC为0.250 g/mL,均表现为良好的抑菌和杀菌作用(表2)。

表1 本草乳炎清散对3种主要致病菌的抑菌圈直径(mm)
2.2 抗炎作用
本草乳炎清散对二甲苯致小鼠耳廓肿胀的影响结果见表3;本草乳炎清散对小鼠棉球肉芽肿的影响结果见表4;本草乳炎清散对小鼠腹腔毛细血管通透性的影响结果见表5。由表3结果可知,本草乳炎清散对二甲苯所致小鼠耳廓肿胀有明显的抑制作用,高、中、低剂量组和阿司匹林组耳廓肿胀抑制率分别为39.74%、36.78%、28.84%和38.81%。与生理盐水对照组相比,本草乳炎清散高、中剂量组和阿司匹林组抑制小鼠耳廓肿胀存在极显著性差异(P<0.01);本草乳炎清散低剂量组存在显著性差异(P<0.05)。各药物组之间相比,本草乳炎清散高、中剂量组、阿司匹林组之间差异不显著;本草乳炎清散低剂量组与高、中剂量组存在显著性差异(P<0.05),与阿司匹林组存在极显著性差异(P<0.01)。

表2 本草乳炎清散对3种主要致病菌的MIC、MBC(g/mL)
由表4结果可知,本草乳炎清散对小鼠皮下棉球所致肉芽肿炎性增生有明显抑制作用,高、中、低剂量组和阿司匹林组小鼠肉芽肿增生抑制率分别为53.53%、51.69%、35.89%和55.37%。与生理盐水对照组相比,本草乳炎清散高、中、低剂量组和阿司匹林组抑制棉球肉芽肿增生均存在极显著性差异(P<0.01)。各药物组之间相比,本草乳炎清散高、中剂量组、阿司匹林组之间差异不显著;本草乳炎清散低剂量组与高、中剂量组存在显著性差异(P<0.05),与阿司匹林组存在极显著性差异(P<0.01)。
由表5结果可知,本草乳炎清散对醋酸致小鼠腹腔毛细血管通透性升高有明显抑制作用,高、中、低剂量组和阿司匹林组对小鼠腹腔毛细血管通透性升高抑制率分别为51.06%、46.81%、34.04%和53.19%。与生理盐水对照组相比,本草乳炎清散高、中剂量组和阿司匹林组抑制通透性升高存在极显著性差异(P<0.01);本草乳炎清散低剂量组存在显著性差异(P<0.05)。各药物组之间相比,本草乳炎清散高、中剂量组、阿司匹林组之间差异不显著;本草乳炎清散低剂量组与中剂量组存在显著性差异(P<0.05),与高剂量组、阿司匹林组存在极显著性差异(P<0.01)。

表3 本草乳炎清散对小鼠耳廓肿胀的影响
注:1.与对照组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);2.同列数据后标有不同小写字母表示差异显著(P<0.05)。
Note:1.Compared to the control group,“*” indicates significant difference between treatments (P<0.05﹚,“**” indicates extremely significant difference between treatments (P<0.01);2.The same column data marked with different lowercase letters indicate significant difference between treatments (P<0.05).

表4 本草乳炎清散对小鼠棉球肉芽肿的影响
注:1.与对照组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);2.同列数据后标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:1.Compared to the control group,“*” indicates significant difference between treatments (P<0.05﹚,“**” indicates extremely significant difference between treatments (P<0.01);2.The same column data marked with different lowercase letters indicate significant difference between treatments (P<0.05),marked with different capital letters indicate extremely significant difference between treatments (P<0.01).
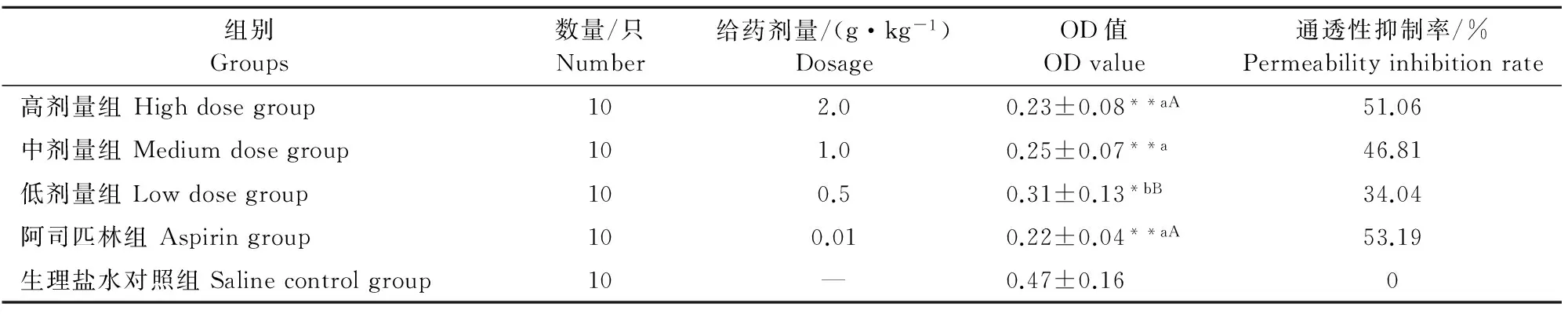
表5 本草乳炎清散对小鼠腹腔毛细血管通透性的影响
注:1.与对照组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);2.同列数据后标有不同小写字母表示差异显著(P<0.05),标有不同大写字母表示差异极显著(P<0.01)。
Note:1.Compared to the control group,“*” indicates significant difference between treatments (P<0.05﹚,“**” indicates extremely significant difference between treatments (P<0.01);2.The same column data marked with different lowercase letters indicate significant difference between treatments (P<0.05),marked with different capital letters indicate extremely significant difference between treatments (P<0.01).
3 讨论
本草乳炎清散抑菌试验以分离鉴定的金黄色葡萄球菌、大肠埃希菌、无乳链球菌3种奶牛乳房炎主要致病菌为代表,测定了本草乳炎清散对3中致病菌的MIC、MBC及体外抑菌活性。结果表明,本草乳炎清散对引起奶牛乳房炎的3种致病菌均有明显的抑制作用,且药物浓度越高,抑菌效果越好。本草乳炎清散对金黄色葡萄球菌、大肠埃希菌、无乳链球菌的MIC分别为0.0625、0.125、0.0625 g/mL;MBC分别为0.125、0.250、0.125 g/mL。本草乳炎清散(0.50 g/mL)对金黄色葡萄球菌、大肠埃希菌、无乳链球菌的抑菌圈直径分别为22.83、21.60、24.51 mm,均大于20 mm,为极敏感,且抑菌效果明显优于相同浓度的公英散。
本草乳炎清散抗炎试验通过二甲苯致小鼠耳廓肿胀模型、棉球致小鼠炎性肉芽肿增生模型和醋酸致小鼠腹腔毛细血管通透性升高模型,分别测定小鼠耳廓肿胀抑制率、肉芽肿增生抑制率和通透性抑制率,评价本草乳炎清散的抗炎效果。结果表明,本草乳炎清散对3种炎症均有明显抑制作用,且药物浓度越高,抗炎效果越好。本草乳炎清散高剂量组(2.0 g/kg)小鼠耳廓肿胀抑制率为39.74%,棉球肉芽肿增生抑制率为53.53%,腹腔毛细血管通透性升高抑制率为51.06%,与生理盐水对照组相比均存在极显著性差异(P<0.01),与阿司匹林组相比差异不显著,表明本草乳炎清散有显著的抗炎作用,且抗炎效果与阿司匹林相当。
近年来,随着抗生素类药物临床应用泛滥,药物残留问题越来越凸显,且多数病原菌对传统抗生素药物出现较强耐药性,严重影响了奶牛养殖业的健康发展,甚至危害到人类身体健康,因此寻找高效、低毒、低残留的新型药物成为当务之急。本草乳炎清散是一种纯中药复方制剂,不含药典中规定的有毒药材,且在动物体内残留极少,有望成为临床治疗奶牛乳房炎的优选药物。
[1] 王付景,郁 杰,葛竹兴,等."乳乃康"对健康奶牛乳腺组织的刺激性试验[J].江苏农业科学,2010(2):238-239.
[2] 胡松华,俞 斌.乳房炎治疗后牛奶中的抗生素残留[J].中国兽医杂志,1999(5):52-53.
[3] 洪伟鸣,郁 杰,左伟勇,等.乳乃康的急性毒性和抗炎活性研究[J].黑龙江畜牧兽医,2012(3):125-126.
[4] 李淑红,王京仁,成 钢,等.四种中草药对小鼠抗炎作用比较研究[J].湖北农业科学,2013,52(4):892-894.
[5] 陈雪芳,吴艳丽.六种菌悬液制备方法的探讨[J].大科技,2016(2).
[6] 赵金凤,胡功政,苑 丽,等.菌悬液浓度对体外药敏实验结果的影响[J].实验科学与技术,2012,10(4):33-35.
[7] 刘 健,王海雁,赵淑江.牛津杯法测定五倍子对大黄鱼病原弧菌的体外抑菌活力[J].海洋科学,2009,33(11):44-47.
[8] 刘冬梅,李 理,杨晓泉,等.用牛津杯法测定益生菌的抑菌活力[J].食品研究与开发,2006,27(3):110-111.
[9] 房春林,杨光友,杨海涵,等.杨树花提取物及其复方制剂的药理学试验[J].中国畜牧兽医文摘,2010(3):205-209.
[10] Georgantelis D,Ambrosiadis I,Katikou P,et al.Effect of rosemary extract,chitosan and α-tocopherol on microbiological parameters and lipid oxidation of fresh pork sausages stored at 4℃[J].Meat Sci,2007,76(1):172-181.
[11] 王俊丽,张要齐,孙雪峰,等.18种中药对猪大肠埃希菌的体外抑菌活性的测定方法比较[J].安徽农业科学,2012,40(26):12947-12948.
[12] 王建军,赵宝玉,张为民,等.茎直黄芪提取物的体外抑菌作用[J].西北农业学报,2007,16(2):108-112.
[13] 徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社,2002.
[14] 张 沂,于春令,王 强,等.复方苦芩软膏的抗炎镇痛作用研究[J].中国药学杂志,2012,47(21):1724-1726.
[15] 辛任升,刘 宇,梁剑平.苦豆子提取物的急性毒性及抗炎试验研究[J].黑龙江畜牧兽医,2015(12):111-112.
[16] 李正国,宋华荣,罗 燕,等.中药复方制剂的小鼠抗炎试验[J].中兽医医药杂志,2009,28(2):44-47.
[17] 李成应,李培锋,关 红,等.秦公散水煎剂的抗炎作用初步研究[J].中国兽医杂志,2008,44(4):28-29.
[18] 冯 升,杨康龙,佟 丽,等.复方中药制剂的抗炎及毒性作用检测[J].中国畜牧兽医,2011,38(9):235-237.
[19] 何慧琴,丁淑华.眼底Ⅰ号方对小鼠毛细血管通透性的影响[J].中医药通报,2002(2):51-52.
[20] 胡竟一,邱春燕,雷 玲,等.细辛的镇痛和抗炎作用[J].中药药理与临床,2011(2):67-69.
StudyonAntibacterialandAnti-inflammatoryEffectsofBencaoruyanqingPulvis
QIN Peng,YE Dong-yang,LI Lin-yu,CHEN Qiang,ZUO Ru-nan,MENG De-lan,TONG Yu,WANG Yi-ran,LIU Xiao-qiang, LI Yin-qian,YANG Ming-qi
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
To study the antibacterial and anti-inflammatory effects of Bencaoruyanqing Pulvis and provide reference and theoretical basis for clinical application,Oxford cup method and tube dilution method were used to determine inhibition zone,minimum inhibitory concentration(MIC) and minimum bactericidal concentration(MBC).Auricle swelling test,cotton-pellet granuloma test and peritoneal capillary permeability test in mice were used to observe the anti-inflammatory effect of Bencaoruyanqing Pulvis.Antibacterial test:the MIC of Bencaoruyanqing Pulvis againstStaphylococcusaureus,EscherichiacoliandStreptococcusdysgalactiaewere 0.0625,0.125,0.0625 g/mL,respectively;the MBC were 0.125,0.250,0.125 g/mL,respectively.Bencaoruyanqing Pulvis is extremely sensitive againstStaphylococcusaureus,EscherichiacoliandStreptococcusdysgalactiae,the diameters of the inhibition zone were 22.83,21.60,24.51 mm,respectively,all more than 20mm.Anti-inflammatory test:the inhibition rates of auricle swelling in high,medium and low dose groups of Bencaoruyanqing Pulvis were 39.74%,36.78% and 28.84%,respectively.Compared with the saline control group,there were extremely significant differences(P<0.01) in high and middle dose groups,there was a significant difference(P<0.05) in the low dose group.The inhibitory rates of granuloma hyperplasia were 53.53%,51.69% and 35.89% in high,medium and low dose groups of Bencaoruyanqing Pulvis,respectively.Compared with the saline control group,there were extremely significant differences(P<0.01) in high,middle and low dose groups.The inhibitory rates of capillaries permeability inhibition were 51.06%,46.81% and 34.04% in high,medium and low dose groups of Bencaoruyanqing Pulvis,respectively.Compared with the saline control group,there were extremely significant differences(P<0.01) in high and middle dose groups,there was a significant difference(P<0.05) in the low dose group.Bencaoruyanqing Pulvis has obvious antibacterial effect against 3 species of major pathogens of dairy cow mastitis,and anti-inflammatory effect and the inhibitory effects are positively correlated with dosages.
Cow mastitis;Bencaoruyanqing Pulvis;antibacterial effectinvitro;anti-inflammatory effect
2017-04-06
西北农林科技大学省级大学生创新创业训练计划项目(2201610712011)
秦 鹏(1991-),男,河北邯郸,硕士研究生,主要从事新兽药研发。*
S859.7
A
1007-5038(2017)11-0065-06
