用TG/FTIR/MS联用技术研究草酸钙分解过程中CO和 CO2的共逸出
2017-12-14
(北京大学分析测试中心北京,100871)
用TG/FTIR/MS联用技术研究草酸钙分解过程中CO和 CO2的共逸出
章斐
(北京大学分析测试中心北京,100871)
采用TG/FTIR/MS三联机在线检测CaC2O4分解过程中逸出气的红外和质谱信息,并改变试样量及气氛气体的氧浓度进行定性定量分析。发现在惰性气氛下CaC2O4的两个分解过程中均存在CO和CO2共逸出现象。其中与CO共逸出的CO2,由CO的歧化反应和氧化反应共同贡献;与CO2共逸出的CO,则是由歧化反应产物C与逸出气CO2发生碳气化反应而生成。系统内氧气浓度对CO歧化反应和碳气化反应有很大影响,当氧气体积浓度达到38 ×10-6时,已检测不到这两个反应的存在,此时质谱中O2(质荷比32)的离子流曲线出现负峰。
TG/FTIR/MS 草酸钙 共逸出 CO CO2歧化反应 碳气化反应
1 引言
一水草酸钙(CaC2O4·H2O)在程序温度下发生脱水和分解反应,在100℃至800℃温度范围内,依次脱除等摩尔的H2O、CO和CO2气体。这3个失重过程的温度区间互不重叠,且化学计量关系明确,因此在热分析领域广受青睐,是热分析研究和仪器性能评价的重要参考物质[1,2]。对于热重类仪器,通过分解过程的失重率与理论计算值的偏差,可以核查动态重量测试的准确性;对于热重与红外光谱、质谱等联用的仪器,通过对这三种具有代表性的逸出气的检测,可以评价检测器的响应时间和检测性能等[3-5],而且还经常作为联用类仪器进行定量分析的校准气源[6-10]。此外,CaC2O4·H2O的三个固相分解过程的分解机理各不相同,被认为是“理想的固相分解动力学模型”而得到广泛的研究和探讨[11]。
在以上的应用和研究中,普遍认为CaC2O4·H2O在氧化性气氛(air,O2)与惰性气氛(N2,He, Ar或真空)下分解的主要区别,在于分解逸出的CO气体在氧化性气氛下发生氧化反应并放出热量,使得本来应该是的吸热过程的CO逸出过程,最终表现为放热过程[12]。
CaC2O4·H2O具体分解过程可用方程式表达如下:
CaC2O4·H2O(s) = CaC2O4(s) + H2O (g)(反应1)
CaC2O4(s) = CaCO3(s) + CO (g)(反应2)
CaCO3(s) = CaO (s) + CO2(g) (反应3)
当气氛中存在O2气时,CO将发生氧化反应:CO(g) +0.5O2(g)= CO2(g)(反应4)
按理,无论在何种气氛气体下分解,最终的剩余物是一样的,均为CaO。但在实际测试中,很容易观察到氧化性气氛下得到的CaO呈白色,惰性气氛下得到的CaO却呈灰色,而这个现象在大部分的文献报道和相关书籍中均被忽略了。
热重分析只能检测物质在受热过程中的质量变化,同步的差热功能也只能检测试样在程序温度下的吸放热现象,均无法解释CaO变色的原因,需要结构分析类仪器进行辅助研究。1980年,D.Price等[13]用质谱法测定固相分解动力学参数时,采用原位加热的方法对CaC2O4施以程序升温,发现在逸出的CO气体中,出现质荷比(m/z)为44的离子流峰,认为在真空条件下,有部分CO逸出气发生歧化反应生成了CO2气体,即:
2CO(g)= C(s)+CO2(g)(反应5)
而歧化反应的另一个产物C则沉积在CaO表面,使其外观颜色呈灰色。
1990年,Jisheng Wang等[14]利用配置了程序控温分解装置的质谱仪(TPD-MS)对CaCO3和CaC2O4进行CO和CO2逸出气的定量标定,不仅确认了CO气体的歧化反应存在,还发现CaC2O4在真空下分解逸出CO2时,有额外的CO气体出现,并认为这部分CO是由歧化反应产生的C与分解逸出的CO2发生碳气化反应所生成:
C (s)+ CO2(g)= 2CO (g)(反应6)
近30年来发展起来的热重联用类仪器,为逸出气体的定性定量研究提供了便利,其中应用比较普遍的是热重分析仪与傅里叶变换变换光谱仪或质谱仪的联用(TG/FTIR、TG/MS)。红外光谱仪在鉴别官能团、同分异构体等方面具有优势,尤其对于H2O、CO和CO2这样具有偶极距的极性分子,都有特异吸收波数区域,很容易做出定性鉴别。质谱检测则可以通过离子碎片m/z识别分子的分子量和分子结构,比FTIR具有更高的灵敏度,而且可以检测没有红外吸收的气体分子(如O2、N2等)[15,16]。因此,利用TG/FTIR和TG/MS等联用类仪器,很容易发现在惰性气氛下的CaC2O4分解逸出气CO中共存着CO2气体,大部分文献报道都认为此CO2来源于逸出气CO部分发生歧化反应所产生[8,9,10,17,18],但也有报道[19]认为共逸出的CO2是CO 与系统中残存O2发生反应所致,因为在 TG/MS中观测到与CO逸出峰相对应的温度区间,MS的m/z32离子流曲线出现负峰。但对于CaC2O4分解逸出CO2时有CO气体共存现象,除了在真空系统下有发现报道外[14],在热重联用类仪器上未见报道。
TG/FTIR/MS三联机是最近几年发展起来的新型联用仪,以串联的模式将热重分解过程逸出的气体依次通过FTIR和MS进行在线检测。与TG/FTIR和TG/MS的分别测试相比,TG/FTIR/MS综合了FTIR和MS各自的检测优势,并在相同的检测环境下同时获得FTIR和MS的检测结果,避免不同仪器状况(如系统内不同的氧气含量)给测试结果带来的影响。我们利用此仪器研究CaC2O4在惰性气氛下的分解过程,发现它的二个分解过程中,均存在CO 和 CO2共逸出现象,其中与CO逸出气共存的CO2,不仅来自CO歧化反应,还来自CO与系统内残氧的氧化反应,而与CO2逸出气共存的CO,则是沉积C与CO2逸出气发生碳气化反应所产生。由此证明CaC2O4在惰性气氛下的二个分解过程均不是简单反应,存在逸出气体的二次反(secondry reaction)应,分别为CO的歧化反应和氧化反应,以及碳气化反应,而仪器系统内部氧气的浓度直接关系到CO歧化反应和碳气化反应能否发生和存在。
2 实验部分
2.1 样品与气氛
一水草酸钙,CaC2O4·H2O,纯度99.9985%,阿法埃莎(天津)化学有限公司生产;碳酸钙,CaCO3,AR. 纯度≥99.0%,广东西陇化工股份有限公司生产;
高纯氦气,纯度99.999%,北京氦普北分气体有限公司生产。
氧气体积浓度(V/V%)分别为115×10-6和962×10-6的标准氦气,北京市华元气体化工有限公司提供。
高纯氮气(纯度99.999%)和空气,北京市海科元昌实用气体有限责任公司生产。
2.2 测试仪器及主要参数
测试仪器为美国Perkin Elmer仪器公司的热重红外质谱三联机(TG/FITR/MS),配置TGA 8000 热重分析仪;FRONTIER傅里叶变换红外光谱仪;Clarus SQ8T四级杆质谱仪以及TL9000接口控制器,此TG/FITR/MS为串联模式,图1为仪器结构示意图(由Perkin Elmer仪器公司提供)。热重分解逸出的气体经传输线导入到红外气体池,在线记录下逸出气体的红外吸收信息,再部分导入到质谱检测器中,在线记录逸出气体不同m/z的离子碎片强度。
热重试验条件:测试温度30℃至900℃,升温速率为20℃/min(或10、30、50℃/min),天平吹扫气体(高纯氦气)流速为90 mL/min,样品吹扫气体(高纯氦气或含氧标准氦气)流速为45 mL/min,采用氧化铝坩埚,加样时将试样(预先经玛瑙研钵磨研成细粉)均匀地平铺在坩埚底部。
传输线参数:热重至红外和红外至质谱的传输线以及各接口的温度均为280℃,逸出气体抽取流速为70 mL/min(进入传输线的气体流速)。
红外检测条件:检测器分辨率8 cm-1,检测波长4000至450 cm-1,气体检测池温度280℃。在热重加样完毕并关闭炉子后稳定5分钟,使炉内空气置换干净后再采集红外背景图。
质谱检测条件:离子源温度230℃,离子源(EI)电子轰击能量为70eV,检测离子的m/z为10~100的总离子流(TIC)和m/z28、m/z44、m/z32等选择离子(SIM)。
待红外背景图采集结束后再开始热重升温程序,同时启动红外检测,半分钟后再开启质谱检测。

图1 TG/FTIR/MS三联机结构示意图
3 结果与讨论
3.1 纯CO2气体的MS测试结果分析
质谱检测器在检测CO和CO2共逸出气源时,面临的问题是如何区分CO分子离子CO+与CO2二级碎片离子CO+,因为二者的m/z均为28。实验采用文献[14]的方法,首先确定纯CO2气体的二级碎片离子CO+(m/z28)与分子离子CO2+(m/z44)的相对比例,并将此值作为判断标尺。这样,在CaC2O4测试中,如果测试结果中m/z28与m/z44的峰面积比值明显超过纯CO2气体的比值,可以认为有额外的来自CO气体的贡献。
考虑到TG/FTIR/MS是动态气源的连续检测,选择分析纯CaCO3作为纯CO2逸出气体的来源,以CaC2O4相同的进样方式和检测条件运行TG/FTIR/MS测试,并采用质谱SIM离子流曲线峰面积来计算m/z28和m/z44的比例关系,相应的峰面积标记为S28和S44。测试结果见表1。

表1 CaCO3分解逸出的CO2气体的质谱S28/S44检测结果
表1的数据表明在相同的测试条件下,加样量相近时CO2气体的碎片离子CO+和分子母离子面积之比基本相同,约为4.53%;不同样品量和升温速率下测得的S28/S44有一定偏差,但基本在相同的数量级范围。以上8次测试得到的S28/S44的平均值为4.55%,均方偏差为0.12%。因此,对于纯CO2气体的S28/S44之比可以基本确定为4.55±0.12%。
3.2 CaC2O4逸出气在高纯氦气气氛下的测试结果
本文主要探讨CaC2O4分解过程的逸出气体,但无水CaC2O4在室温下不稳定,容易吸潮。为了便于确定起始质量,实验选用室温下稳定的CaC2O4·H2O进行实验,在数据处理时忽略第一步的脱水过程,并将CaC2O4分解为CaCO3的过程称为a过程,CaCO3分解为CaO的过程称为b过程,相应的逸出气体分别表达为CO-a、CO2-a和CO-b、CO2-b,IR特征波数剖面图的吸收峰面积分别标记为ICO-a、ICO2-a,和ICO-b、ICO2-b,质谱选择离子的离子流峰面积分别标记为S28-a、S44-a和S28-b、S44-b。
在高纯氦气下,改变CaC2O4·H2O的起始质量,以20℃/min进行了7次系列实验,标记为M1~M7,对应试样量分别为0.995、3.098、5.085、7.574、10.290、12.818、15.373 mg。
图2为CaC2O4分解在480℃时(a过程)逸出气体的红外光谱图,M1至M7均观测到很强的CO红外特征吸收峰(2200-2050 cm-1)和CO2红外特征吸收峰(2400-2200 cm-1),而且随着试样量的增加,CO和CO2的红外吸收强度均增加。需要注意的是,CO2的红外消光系数远远大于CO,所以不能按照吸收峰强度直接比较二者的气体浓度。
图3为CaC2O4分解在680℃时(b过程)逸出气体的红外光谱图,CO2红外特征吸收峰非常强大,相比之下CO特征吸收峰非常弱,但从局部放大图中可以看到,除M1之外,M2至M7的红外光谱图中,均可观测到CO特征吸收双峰的存在。
通过红外特征波数剖面图也可以清晰地看到CaC2O4两个分解过程中CO和CO2共逸出现象。图4和图5分别为逸出气在2182 cm-1(CO红外特征吸收波长)和2360 cm-1(CO2红外特征吸收波长)的红外剖面图,与CaC2O4两个分解过程相对应的温度区间,均出现两个红外吸收分布峰。
因此,TG/FTIR的测试结果表明,CaC2O4在分解为CaCO3逸出CO的同时,有CO2共逸出,而CaCO3分解为CaO逸出CO2时,也存在着CO气体的共逸出。

图2 不同质量CaC2O4在480℃时逸出气体IR图

图3 不同质量CaC2O4在680℃时逸出气体IR图

图4 CaC2O4逸出气在2182 cm-1的IR剖面图

图5 CaC2O4逸出气在2360 cm-1的IR剖面图
不同温度下的逸出气体经过红外气体池后再导入到质谱检测器中,可以得到逸出气体的总离子流强度随时间(或热重温度)的变化分布图,称为TIC曲线,也可以得到选择离子的离子流强度随时间(或热重温度)的变化分布图,称为SIM离子流曲线。图5为M3的质谱测试结果,在TIC曲线和m/z44和m/z28的离子流曲线上,均出现两个离子流峰,温度区间与CaC2O4分解的a过程和b过程相对应。不同试样量的测试结果与此相类似。

图6 CaC2O4逸出气的质谱离子流曲线(M3)
m/z44离子流曲线的两个峰均为CO2分子离子的贡献。双峰的出现表明在CaC2O4分解的a过程和b过程中均有CO2逸出气体存在;m/z28离子流曲线的两个峰,则需要区分CO分子离子和CO2碎片离子CO+。通过积分各离子流曲线的峰面积,可以计算得到S28-a/ S44-a和S28-b/ S44-b的面积之比值,具体数据见表2。
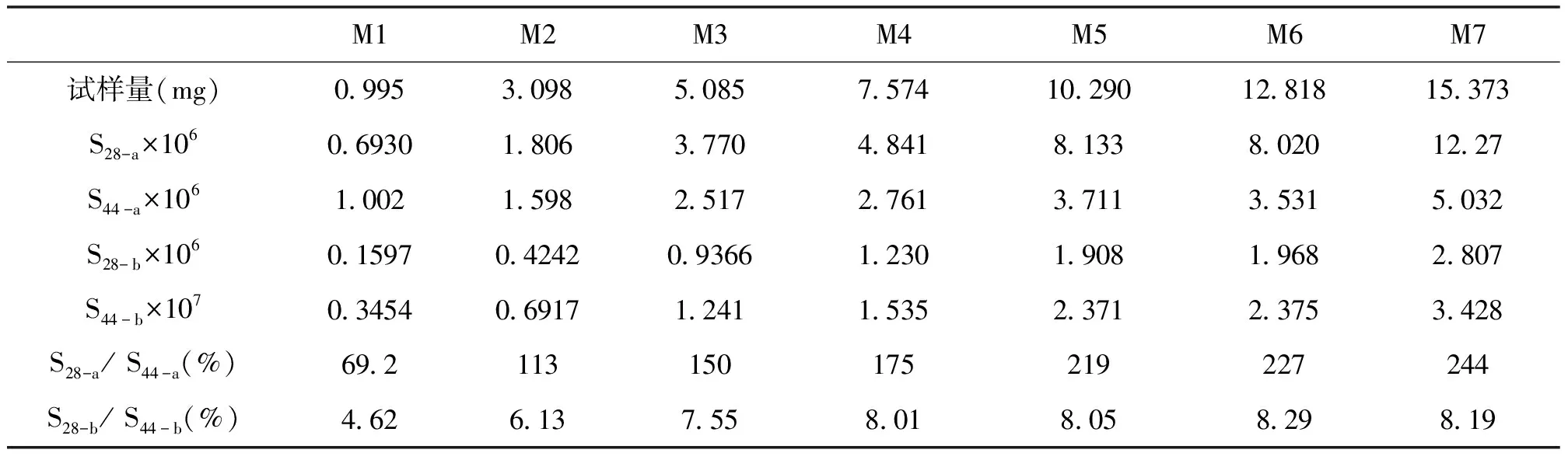
表2 不同试样量CaC2O4逸出气的质谱测试结果
表2中,S28-a/ S44-a的数据远远大于纯CO2的S28/ S44值(4.55%),说明有大量的CO气体的贡献;S28-b/ S44-b值除了M1外,其它试样量下的测试结果均大于4.55%,也可以判断m/z 28的第二个离子流峰,除了CO2二级碎片离子的贡献外,另有CO气体的贡献。
因此,从TG/MS的测试结果,也可以明确在CaC2O4分解为CaCO3逸出CO气体的同时,存在着CO2气体的共逸出,而在随后的CaCO3分解为CaO逸出CO2气体的同时,也存在着CO气体的共逸出。
与CO2-b共逸出的CO-b,源于C的气化反应(反应6),部分沉积C与逸出的CO2-b反应而生成CO[20,21,22,23]。碳气化反应为可逆的反应,所以在CaC2O4分解结束后,仍能观察到分解剩余物CaO上有沉积C的存在。证明了C的存在,也就证明了CO歧化反应的存在,说明CaC2O4分解逸出的CO-a,会部分发生歧化反应(反应5)。
3.3 CO歧化反应的特点及对TG分解过程的影响
按照文献报道[24-26],草酸盐类化合物分解逸出CO气体时,其分解产生的固相碱金属或碱土金属化合物作为催化剂,使CO在其表面发生歧化反应。因此,在CaC2O4分解中,分解产物CaCO3充当着CO歧化反应的催化剂,离开了催化剂表面的CO气体将不再发生歧化反应[27]。事实上,观察CaC2O4分解剩余物CaCO3和CaO,可以发现歧化反应的产物C只沉积在CaCO3和CaO固体上,试样坩埚和热重炉腔内没有任何附着。
图7为CaC2O4·H2O在高纯氮气(纯度99.999%)和空气下的热重曲线(TG曲线)和微商热重曲线(DTG曲线)。因为联用使用时TG炉内的气体有一部分被抽走,会影响TG的精确测试,所以选择在美国TA仪器公司的SDTQ600差热热重同步测定仪上进行TG测试,升温速率20℃/min,气氛气体流速100 mL/min。可以看到CaC2O4在不同气氛下分解逸出CO的过程,TG曲线和DTG曲线均存在一定的区别(表3)。

图7 CaC2O4·H2O在N2和air下的TG和DTG曲线
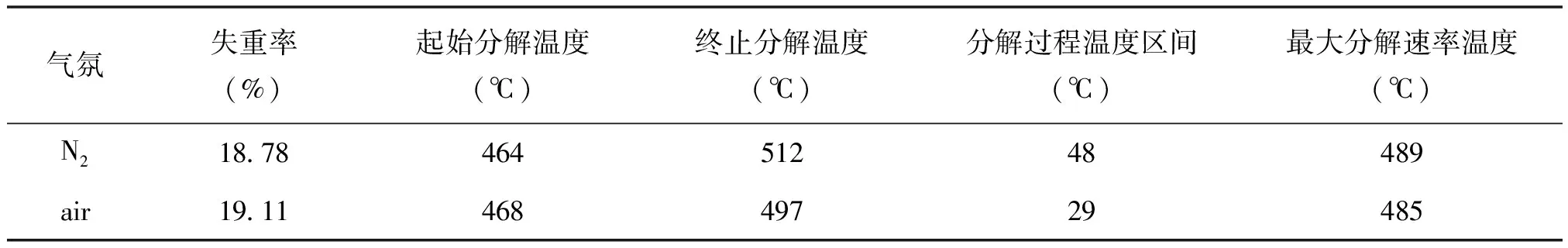
表3 CaC2O4·H2O在N2和air下分解逸出CO的TG和DTG测试结果
CaC2O4·H2O分解为CaCO3的理论失重率为19.16%。因为C的沉析增加了CaCO3的表观重量,因此在惰性气氛下此过程的失重率应该小于19.16%。在我们的测试中,高纯氮气下的失重率为18.78%,空气下的失重率为19.11%,前者比后者小0.33%。CaC2O4在空气气氛下分解出CO的失重率应该与理论值一致,而惰性气氛下的失重率与理论值之差,可视为C的沉析量。
从动力学角度分析,C的沉积会对分解过程形成阻碍,使得CaC2O4在惰性气氛下的分解速率略趋缓慢[28,29]。而空气气氛下,随着逸出的CO分子不断被氧化为CO2分子,有利于促进CaC2O4的分解,其分解速率将略微加快。DTG的测试结果可以反映出这两种气氛下分解过程的动力学差异,最大失重速率温度在高纯氮气下为489℃,空气下为485℃,失重发生的温度区间在高纯氮气下为48℃,空气下29℃,影响还是很明显的。
可见,CaC2O4逸出气CO在不同气氛下存在不同的二次反应。逸出气二次反应的存在对分解的动力学过程和热重测试结果都有一定的影响。
3.4 系统内氧气对CaC2O4逸出气测试结果的影响
如上所述,CaC2O4分解脱除CO的失重率,在高纯氮气下的测试值与理论值的差异,可视为沉积C的增加量。那么,沉积C与CO逸出气的重量之比可表达为0.38%∶19.16%,摩尔比则为(0.38%/12)∶(19.16%/28)=4.63%,此比值与CO的歧化反应发生程度相关。因为歧化反应产物C和CO2是等摩尔的,CaC2O4分解逸出的CO和CO2气体量也是等摩尔,所以C与CO逸出气的摩尔比可以转化为CO2-a和CO2-b的摩尔比,即CO2-a和CO2-b的摩尔比也应该是4.63%左右。
利用表2的原始数据可以计算得到质谱检测中两个CO2的m/z44离子流的峰面积之比S44-a/S44-b,利用红外测试中CO2官能团剖面图(图5)对两个CO2红外吸收峰进行积分,也可以得到峰面积之比ICO2-a/ICO2-b。不同试样量下的S44-a/S44-b和ICO2-a/ICO2-b的计算值见表4。

表4 CaC2O4逸出气中两个CO2峰面积比值的质谱和红外测试结果
从表4的数据可以看到,对于CO2-a/CO2-b的比例,在相同试样量时(即在同一测试中),质谱的S44-a/S44-b和红外的ICO2-a/ICO2-b大致相同,不同试样量下的测试结果不相同。但所有比值均远远超过CO歧化反应的实际发生程度(4.63%)。
另外,从表2的测试数据看,S28-b/S44-b随着试样量的增加呈增加趋势,表示随着试样量的增加,参与气化反应的C量是增加的,亦即CO歧化反应的反应程度也是随之增加的。但表4的数据则显示,随着试样量的增加,S44-a/S44-b和ICO2-a/ICO2-b均呈下降趋势,与S28-b/S44-b的变化趋势相矛盾。显然,在CO-a的逸出过程中,除了发生歧化反应外,还存在着CO的氧化反应(反应4),部分CO逸出气与系统内的残氧反应,增加了CO2-a的生成量。
对于热重仪器和热重联用类仪器,即使在惰性气氛下,系统内也不可避免有氧气残余[30]。因为在热重测试过程中需要导入较大流速的气氛气体,尽管使用的是高纯气体,如纯度为99.999%的高纯氦气,也意味着仍含有近10 ppm的杂质气体,包括氧气。对于检测器FTIR和MS来说,联用类仪器是一个连续进样的在线检测过程,吹扫气携带逸出气体的持续进入,使得在整个测试过程中系统内一直存在很低浓度的氧气。
如果测试条件相同,可以认为测试过程中系统内的残氧浓度是一定的,那么单位时间内CO被残氧消耗的量也基本一致。当试样量越小时,逸出的CO气被氧化成CO2的比例相对而言会更高,S44-a/S44-b和ICO2-a/ICO2-b的比值也就越大。而随着试样量的增加,CO发生氧化反应的比例相对减少,使得S44-a/S44-b和ICO2-a/ICO2-b的比值反而变小。
此外,在不同升温速率下检测CaC2O4分解逸出气(其它测试条件相同),和预期的一样,随着升温速率的增大,S28-b/S44-b、S44-a/S44-b和ICO2-a/ICO2-b的变化规律与试样量增加的规律相同(数据不在此列出),说明加大升温速率可以减少系统内残氧对CO的氧化影响。
但在以上测试中,能反映质谱系统内部氧气情况的m/z32离子流曲线,并没有出现文献[19]报道的负峰(见图5)。为了分析氧气浓度对CaC2O4分解逸出气的影响,分别用115 ×10-6和962 ×10-6的标准含氧氦气作为热重仪的样品吹扫气(45 mL/min),用高纯氦气作为热重仪的天平吹扫气(90 mL/min)进行测试,这样气氛气体中实际氧气的体积浓度(V/V%)分别为38 ×10-6和321×10-6。实验过程升温速率为20℃/min。
CaC2O4在高纯氦气和38 ×10-6、321 ×10-6含氧氦气气氛下分解时的m/z32离子流曲线见图8。从图8可以看到,在CO-a逸出气对应的温度区间,当氧气体积浓度为38 ×10-6时,m/z32离子流曲线出现很弱的负峰,而氧气体积浓度为321 ×10-6时,m/z32离子流曲线则出现明显的负峰,与之相比较,在高纯氦气下则没有出现负峰。
这3种气氛气体下的质谱测试结果见表5。在38 ×10-6和321 ×10-6含氧氦气气氛下,测得质谱S28-b/S44-b值分别为4.45%和4.35%,与纯CO2气体相当,意味着在CaC2O4分解的b过程中,质谱没有检测到额外的CO气体。
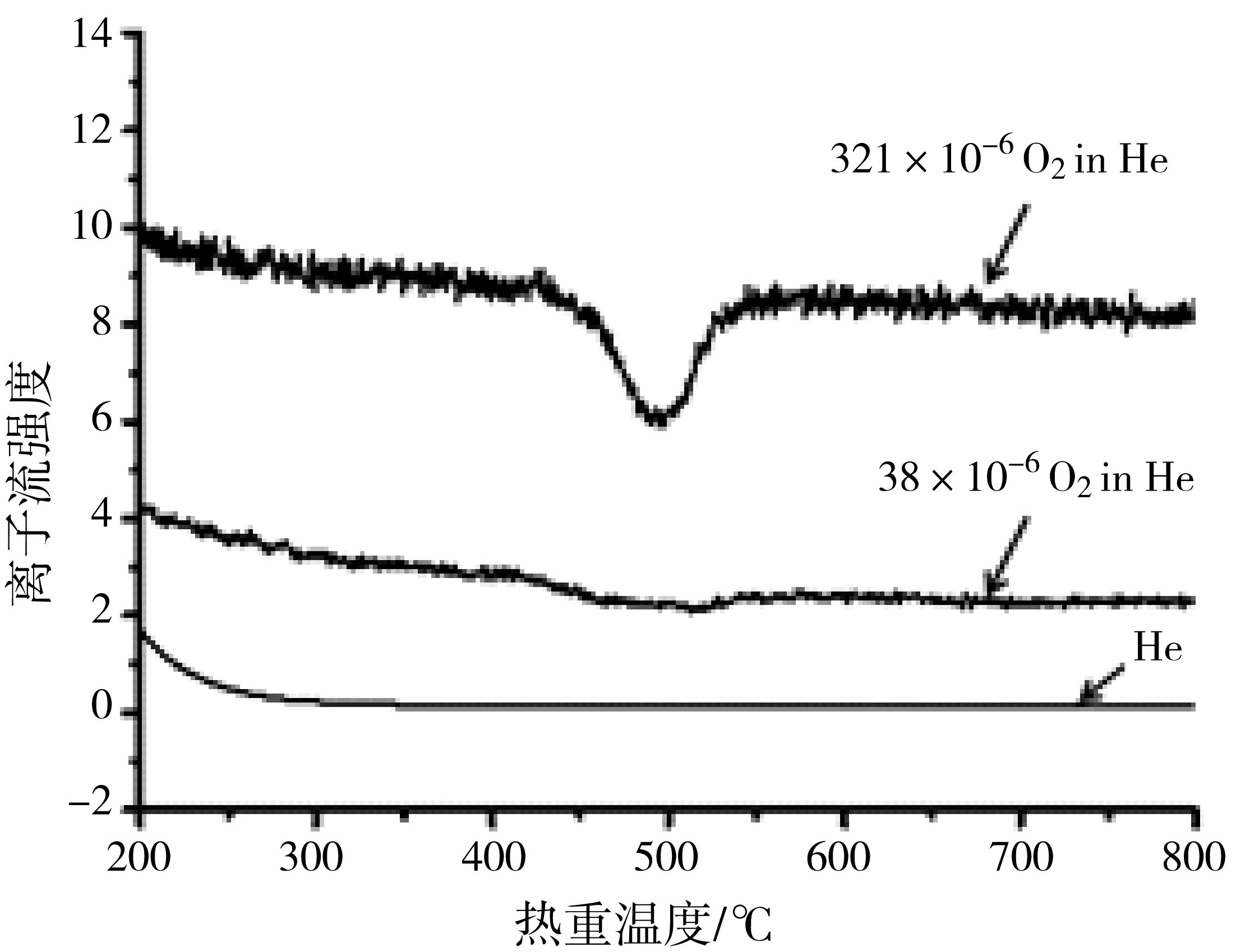
图8 CaC2O4逸出气在不同氧气浓度下的m/z 32离子流曲线
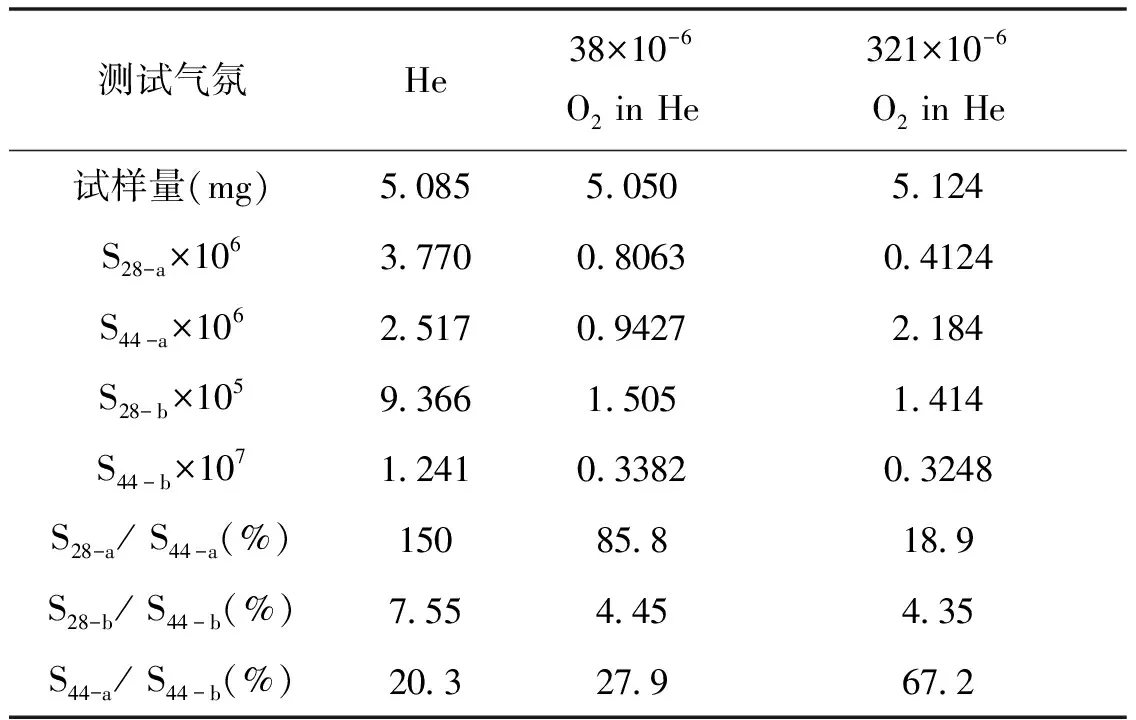
表5 CaC2O4逸出气在不同氧气浓度下的质谱测试结果
同样,在红外检测器中也没有检测到CO-b的存在。图9为3种不同氧气浓度气氛下CaC2O4在480℃时逸出气体的红外光谱图,随着氧气浓度的增加,CO红外特征吸收峰(2200-2050 cm-1)的吸收强度明显减弱,而CO2红外特征吸收峰(2400-2200 cm-1)的吸收强度则不断增强。图10为2182 cm-1(CO红外特征吸收波长)的红外剖面图,在与CaC2O4分解b过程相对应的温度区间,在高纯氦气下尚能观测到的高温段CO的红外吸收峰,在含氧气氛下没有出现。

图9 不同氧浓度下CaC2O4在480℃逸出气IR图
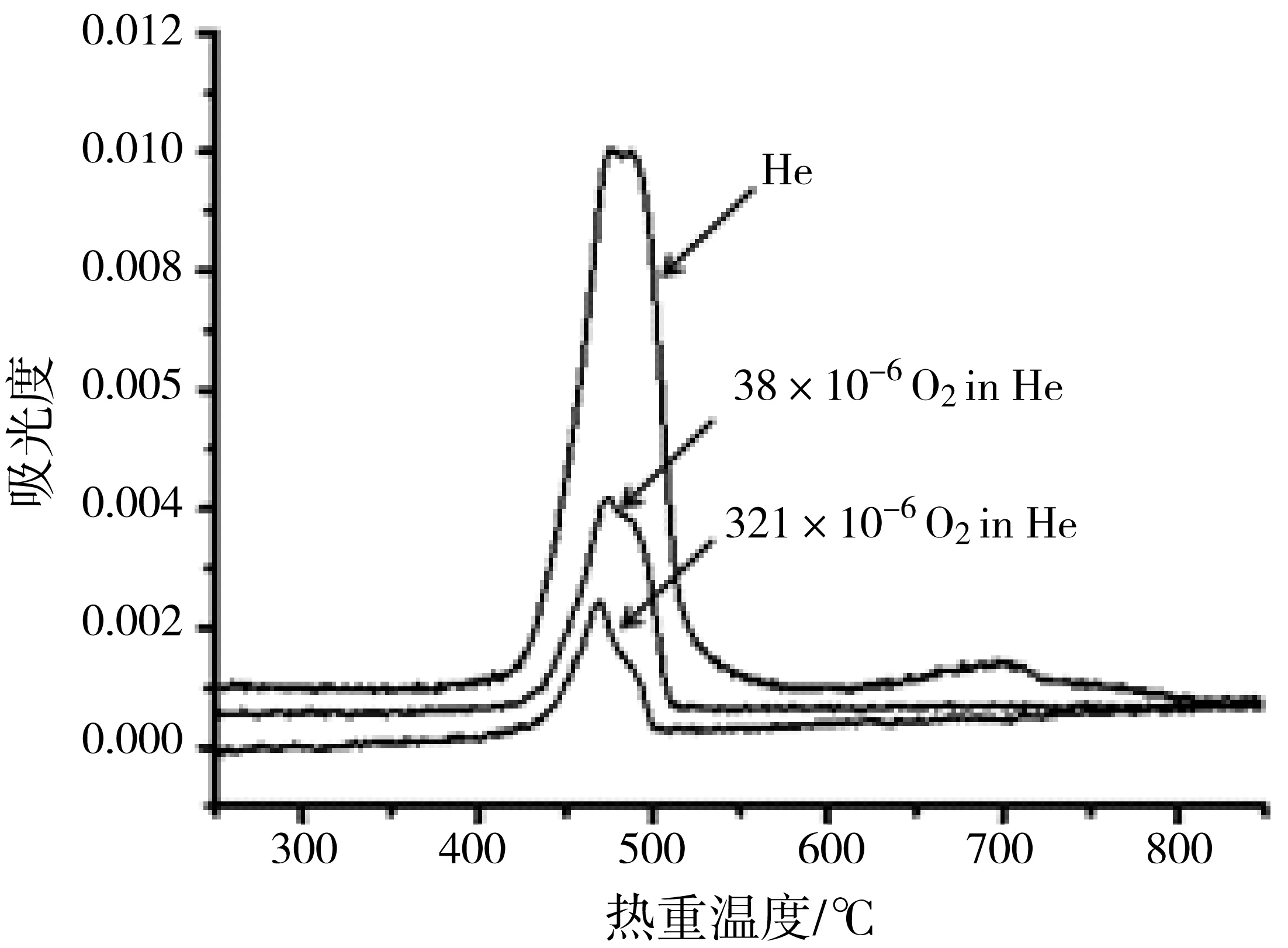
图10 不同氧浓度下CaC2O4逸出气在2182cm-1IR剖面图
由此可见,CO逸出气体的歧化反应受氧气的影响非常大,当测试系统内部有氧气存在时,CO将优先与氧气反应。在高纯氦气下,CO逸出气会部分发生歧化反应,同时也有部分发生氧化反应;在氧气体积浓度达到38×10-6时,红外和质谱均已检测不到CO歧化反应和C气化反应的发生迹象,此时的CO2-a主要由CO被氧气氧化所产生。所以,如果在质谱中观测到m/z32离子流曲线出现负峰,说明系统内的氧气浓度已超出正常惰性气氛的要求,应该考虑气氛气体的纯度是否合格或仪器是否存在漏气等问题。
4 结语
用TG/FTIR/MS三联机,可以在相同的测试条件下进行逸出气体的红外和质谱检测,获得可以互相佐证和互相补充的结构信息,并进行定性定量分析。以上对CaC2O4逸出气的研究结果表明,热重联用类仪器(TG/FTIR、TG/MS、TG/FTIR/MS等),其检测器检测到的不仅是失重过程中产生的逸出气,还包括逸出气自身发生二次反应所产生的衍生气体。因此,在对物质的结构和成分进行检测分析以及分解机理推测研究时,需要根据测试条件对检测结果进行谨慎分析,排除逸出气体二次反应可能导入的衍生气体,尤其要关注氧敏性气体(如CO、CH4、NO、H2等)与系统内残氧发生反应的可能性。
系统内的残氧浓度对惰性气氛下的测试结果会造成很大影响。我们认为,在CaC2O4分解逸出CO2的过程中能否检测到CO共逸出气的存在,可以作为测试系统内残氧浓度是否合理的一个评判标准。具体操作方法及效果将另文报道。
[1]Kutaish N, Aggarwal P, Dollimore D.Thermal analysis of calcium oxalate samples obtained by various preparativeroutes[J].ThermochimicaActa.1997,297:131-137.
[2] Blazejowski J, Zadykowicz B. Computational prediction of the pattern of thermal gravimetry data for the thermal decomposition of calcium oxalate monohydrate[J]. J Therm Anal Calorim. 2013,113:1497-1503.
[3]Statheropoulos M ,Kyriakou S,Tzamtzis N.Performance evaluation of a TGMS system[J].ThermochimicaActa.1998,322:167-173.
[4]ASTM E2105-00 Standard Practice for General Techniques of Thermogravimetric Analysis (TGA) Coupled With Infrared Analysis (TGA-IR)[S]. United States: ASTM Committee,2010.
[5] JC/T 2019-2010陶瓷材料的热分析-质谱同时联用测定方法[S].中华人民共和国工业和信息化部,2010.
[6] Maciejewski M, Baiker A.Quantitative calibration of mass spectrometric signals measured in coupledTG-MS system[J].ThermochimicaActa. 1997,295:95-105.
[7] Slager T L,Prozonic F M.Simple methods for calibrating IR inTGA/IRanalyses[J].ThermochimicaActa. 2005,426:93-99.
[8] Mittleman M.QuantitativeTGA/IR[J].Thermochimica Acta,1990,166:301-308.
[9] Binghui L I, Grozalez.Richard D. The measurement of small amounts of coke by a sensitiveTGA/FTIRtechnique[J].Catalysis Letters. 1998,54:5-8.
[10]张明烨,李玉新,魏飞,王垚. 热重-质谱联用测定积炭SAPO-34催化剂的焦炭量和焦炭H/C比[J].天然气化工(C1化学与化工),2014,39:5-9.
[11]Vlaev L,Nedelchev N,Gyurova K,Zagorcheva M.A comparative study of non-isohermal kinetics of decomposition of calcium oxalate monohydrate[J].J Anal Appl Pyrolysis,2008,81:253-262.
[12]章斐. 热分析仪器的气密性问题及检漏方法 [J].实验技术与管理,2012,29(1):36-39.
[13]Price D,Dollimore D,Fatemi N S,et.al. Mass spectrometric determination of kinetic parameters for solid state decomposition reactions.Part1.method;calcium oxalate decomplsition[J].Thermochimica Acta,1980,42:323-332.
[14] Wang Jisheng, Enaney BrianMc. Quantitative calibration of a TPD-MS system for CO and CO2using calcium carbonate and calcium oxalate[J].Thermochimica Acta,1991,190:143-153.
[15]陆昌伟,奚同庚. 热分析质谱法[M].上海:上海科学技术文献出版社,2002:176.
[16]陈玲红,陈祥,吴健,等. 基于热重-红外-质谱联用技术定量分析燃煤气体产物[J].浙江大学学报:工业版,2016,50(5):961-968.
[17]刘振海,山立子. 分析化学手册(第八分册)热分析[M].北京:化学工业出版社,2000:30-31.
[18] Cyril darribee,唐远旺. 逸出气体分析[M].上海:东华大学出版社,2010:39-41.
[20]Linares-Solano A , Hippo E D, Walker P L.Catalytic activity of calcium for lignite char gasification in various atmospheres [J].Fuel,1986,65(6):776-779.
[21]张松,汪琦,李金莲等.氧化物对碳气化反应的影响[J].材料导报,2013,(S1):115-116.
[22]张殿伟,郭培民,赵沛.低温下碳气化反应的动力学研究[J].钢铁,2007,42(6):13-16.
[23]李金莲,汪琦,李艳茹.碳气化反应的机理及热分析动力学研究[J].化学工程与装备,2009,(12):21-24.
[24]Bose S,Sahu K K,Bhatta D. Rare earth oxide-catalysed decomposition of calcium oxalate [J].Thermochimica Acta,1995,268:175-183.
[25] Deb Nidhuban.An investigation on the solid state pyrolyticdecompositionof bimetallic oxalate precursors of Ca,Sr and Ba with cobalt: A mechanistic approach[J].J Anal Appl Pyrolysis,2007,80:389-399.
[26] White Robert L,Ai Jiu.Variable-Temperature Diffuse Reflectance Infrared studies of calcium oxalate monohydrate[J].Applied Spectroscopy.1992,46(1):93-99.
[27] Kogler M, Köck E M, Klötzer B,et.al.High-Temperature Carbon Deposition on Oxide Surfaces by CO Disproportionation[J].J Phys Chem C, 2016, 120 (3):1795-1807.
[28]高松平,赵建涛,王志青,等. CO对褐煤快速热解行为的影响[J].燃料化学学报,2013,41(5):550-557.
[29]Linares-Solano A, Hippo E D, Walker P L.Catalytic activity of calcium for lignite char gasification in various atmospheres[J].Fuel, 1986,65(6):776-779.
[30] Wagner Matthias. 热分析应用基础[M].陆立明,译.上海:东华大学出版社,2011:112.
Studyonco-evolutionofCOandCO2duringdecompositionofcalciumoxalatebyTG/FTIR/MS.
ZhangFei
(AnalyticalInstrumentationCenter,PekingUniversity,Beijing100871,China)
The decomposition of CaC2O4was investigated by means of thermogravimetry/Fourier transform infrared spectrometry/mass spectrometry (TG/FTIR/MS). The evolved gas was studied qualitatively and quantitatively by changing the sample weight and the oxygen content of atmosphere. The co-evolution of CO and CO2was observed during both decomposition processes of CaC2O4under inert atmosphere. The CO2gas co-evolved with CO derives from the disproportion and oxidation of CO, while the CO gas co-evolved with CO2from the gasification of carbon, produced by the disproportion of CO, with CO2. Both disproportion and gasification are remarkably influenced by the content of the residue oxygen in the system. These two reactions cannot be detected when the concentration of oxygen is above 38×10-6and a negative peak on MS signal with m/z 32 appears.
TG/FTIR/MS;calcium oxalate;co-evolved gas;CO;CO2;disproportionation reaction;carbon gasification
10.3969/j.issn.1001-232x.2017.06.018
2017-06-12

章斐,女,1965年出生,硕士,高级工程师,研究方向:热分析仪器测试技术,E⁃mail:zhangfei@pku edu cn。
