快速溶剂萃取-在线固相萃取/高效液相色谱串联质谱法对复杂基体中壬基酚的测定
2017-12-14*
*
(1.广州市环境监测中心站,广州 510030;2.环境保护部华南环境科学研究所,广州 510655;3.深圳市深港产学研环保工程技术股份有限公司,深圳 518101)
快速溶剂萃取-在线固相萃取/高效液相色谱串联质谱法对复杂基体中壬基酚的测定
周志洪1刘清云2,3周树杰1赵涛2丘锦荣2*
(1.广州市环境监测中心站,广州 510030;2.环境保护部华南环境科学研究所,广州 510655;3.深圳市深港产学研环保工程技术股份有限公司,深圳 518101)
建立了测定复杂基体中壬基酚(Nonylphenol,NP)的快速溶剂萃取-在线固相萃取/高效液相色谱串联质谱分析方法。污泥、土壤及植物样品经冷冻干燥后,用正己烷、二氯甲烷、甲醇的混合溶剂(8∶1∶1, v/v/v)进行快速溶剂萃取;萃取液采用Spark在线固相萃取装置和配套在线固相萃取小柱进行在线富集和净化,以甲醇-0.1%氨水为流动相进行梯度洗脱,采用Agilent Poroshell 120 EC-C18高效液相色谱柱进行分离和分析。使用安捷伦6420三重四极杆串联质谱仪为质谱检测器,采用电喷雾电离源,以多反应监测(MRM)方式进行负离子模式监测,对复杂基体中NP进行定量分析。该方法NP 线性范围为0.25~75 ng,相关系数rgt; 0.999,检出限为0.05 ng;该方法污泥样品的回收率为67.8% ~82.6%,植物样的回收率为65.9%~96.5%;随机选取样品总数的十分之一进行平行样测定,相对偏差为0.1%~24.1%。该方法操作简单、灵敏,自动化程度高,可用于复杂基体中NP的快速测定。
壬基酚 复杂基体 快速溶剂萃取 在线固相萃取 高效液相色谱串联质谱
壬基酚(Nonylphenol,NP)是精细化工的重要原料和中间体,它与环氧乙烷缩合得到一种用途广泛的非离子表面活性剂壬基酚聚氧乙烯醚(NPnEOs),也是这种表面活性剂的主要降解产物。NP被认为是有代表性的环境内分泌干扰物(Endocrine Disrupting Chemicals,EDCs)和持久性有毒污染物(Persistent Toxic Substances, PTS);并且NP已经被列入到我国2015年新编订的危险化学品目录当中。NP在污泥中和土壤中浓度水平分别为大于10-1mg/kg(干重)[1-3]和102~103μg/kg[4-6],相比于水体和大气来说,浓度水平较高。同时,在植物中也检测到NP的存在[7-9]。
有许多方法被应用到复杂基体中NP的萃取及检测[10,11]。污泥样品、土壤样品(包括污泥混合土壤样品)、植物样品等复杂基体中NP主要的萃取方法有振荡萃取[7,8,12-14,20]、超声萃取[4,15-16]、快速溶剂萃取(ASE)[17-19]、微波萃取[20]。ASE是一种新的萃取方法,这种方法省时、节约溶剂、自动化程度高,也具有高的回收率,相比于索氏萃取、超声萃取来说,在后续的检测中会使得背景噪声降低,特别是对LC-MS方法来说,ASE能减少检测过程中的抑制效应[21]。复杂基体的样品萃取后要进行净化,以减少基体效应,因此部分研究[15,17]在GC-MS、 HPLC分析之前会采用离线固相萃取(SPE)的方法对目标化合物进行净化。近些年发展起来的在线固相萃取(on-line SPE)更是减少了样品制备时间、清洗洗脱等步骤且实现了自动化;On-lineSPE最大的优势就是降低了目标物在样品浓缩过程中因为挥发或者降解作用的损失,从而提高了分析的精密度[22]。
样品萃取净化后主要的分析手段为气质联用(GC-MS)[13,16,23,24]、高效液相色谱(HPLC)[7,8,14,25];用高效液相色谱-串联质谱(HPLC-MS/MS)来分析复杂基体中NP的文献较少[26-28],HPLC-MS/MS能更加有效的分析极性化合物、定性准确、并且不需要衍生化,为痕量有机物的检测提供了一种更具有选择性及更高的灵敏度的方法。
目前,SPE及on-line SPE 多应用在水相中痕量有机物的分析中[22,29,30],在对土壤或者复杂基体的分析中,运用固相萃取或在线固相萃取作为净化方法的研究较少。本方法采用以ASE为萃取方法、在线固相萃取结合液相色谱-串联质谱技术(On-line SPE LC-MS/MS)为分析方法对污泥、土壤及植物样品进行分析。该方法将为复杂基体(如污泥、含较多生物质的土壤样品、植物样品)中NP的分析测试提供一个准确且简单的新途径。
1 材料与方法
1.1 仪器、试剂和材料
1.1.1 仪器设备
冷冻干燥机(Christ,德国);臼式研磨仪(Retsch RM200,德国);高速万能粉碎机(天津市泰斯特仪器);ASE300 型快速溶剂萃取仪(美国 Dionex 公司);1290 超高效液相色谱仪(Agilent,美国);6420三重串联四极杆质谱仪(Agilent,美国);全自动在线固相萃取仪(Spark,荷兰); C18固相萃取小柱(7.5 μm粒径,Spark,荷兰);0.22 μm PTFE滤膜(Dikma,迪马公司)。
1.1.2 试剂材料
壬基酚各种不同支链的同分异构体混合物 0.25 g,纯度 100%,Dr Ehrenstorfer GmbH公司,标准样品英文名为Nonylphenol (technical);壬基酚内标,Nonylphenol -d8,25mg,Dr Ehrenstorfer GmbH公司;准确称取相应的标准物质,溶解于甲醇中,配制成1000 mg/L的单标储备液,单标储备液于-20℃下避光保存。正己烷;二氯甲烷;甲醇(HPLC 级,TEDIA);硅藻土为分析纯(使用前在马弗炉500℃烘5小时)。
1.2 样品的采集与制备
1.2.1 污泥样品采集
于2014年11月取自广州市某污水处理厂,污水处理厂脱水污泥样品采集至棕色样品瓶当中。样品经冷冻干燥后,用臼式研磨仪进行研磨,重新放进棕色样品瓶。棕色样品瓶放置阴凉处。
1.2.2 土壤样品采集
南方红壤,取自广州郊区。样品经冷冻干燥后,用臼式研磨仪进行研磨,重新放进棕色样品瓶。棕色样品瓶,置阴凉处。
1.2.3 植物样品采集
植物样品采集于植物去除城市污泥中有机污染物实验。实验采用非常规的盆栽实验。选用底直径71 cm,高60 cm的有机塑料容器(图1)以供盆栽。塑料容器底部设计有渗漏装置,侧底部有孔,连接有胶管,用于漏水。每个有机塑料实验装置盆底部平铺5 cm小石子,中层铺装20 cm远离城市区域的南方红壤,最上层装30 cm新鲜污泥,在污泥上种植玉米以及黑麦草。黑麦草(Lolium perenne L):种子购买于市场,新一代邦德、新品种宽叶型,四倍体一年生黑麦草。玉米(Zea mays var. yunshi-5):种子购买于云南农科院育种中心。
植物收获时,将植物分别用自来水和去离子水洗净,吸水纸吸干表面水,测定鲜重。玉米分茎叶和籽粒,玉米茎叶用剪刀剪碎混合。样品经冷冻干燥后,用高速万能粉碎机进行研磨,重新放进棕色样品瓶,置阴凉处。

图1 实验装置设计图
1.3 样品的预处理
1.3.1 称量
污泥、土壤样品准确称取约10 g,黑麦草样品及玉米茎叶样品准确称取约4 g,玉米籽粒样品准确称取约15 g于烧杯中,每个样品记录所称具体重量。
1.3.2 萃取
称量好的样品中加入适量烘过的硅藻土,搅拌均匀,使样品成松散的状态,加入壬基酚内标(NP-d8)25 μg使后续萃取液内标含量为500 ng/mL。如果是样品需要加标,则在此时一并加入适量的标准样品,制备成加标样品。样品放入快速溶剂萃取仪自带的33 mL不锈钢样品池中,拧紧上下池盖。用ASE 300 型快速溶剂萃取仪进行萃取。
快速溶剂萃取条件:溶剂为正己烷∶二氯甲烷∶甲醇(8∶1∶1, v/v/v);压力为1500 pa;温度为110 ℃;加热时间5 min;静态时间 6 min;冲洗体积:60%;吹扫时间:120 s;静态循环次数:3次。固体样品萃取之后会获得50 mL左右的萃取液。
萃取液转移到50 mL容量瓶中,样品不足50 mL用正己烷定容到50 mL,盖上盖子密封保存。萃取液如不进一步处理则置于冰箱中密封保存。更换溶剂:每个样品的萃取液取出5 mL转入试管中氮吹至近干后,加入5 mL甲醇进行更换溶剂。用玻璃注射器准确抽取1 mL,过0.22 μm PTFE滤膜,注入上机样品瓶。
1.4 On-line SPE和LC-MS / MS方法
1.4.1 On-line SPE条件
用3 mL甲醇活化固相萃取小柱,再分别用2 mL高纯水活化固相萃取小柱两次。吸取适量样品到样品环中,吸取的样品量在50 μL~200 μL之间,具体样品量视样品浓度大小而定。接着吸取2 mL水在样品环中与样品混合,混合后经过固相萃取小柱,在固相萃取柱中保留,用3 mL 20%甲醇水溶液清洗固相色谱柱,洗脱某些杂质到废液瓶中。六通阀切换后,由液相色谱流动相洗脱固相萃取小柱中的目标化合物进入液相色谱柱进行分离。
1.4.2 高效液相色谱条件
色谱柱采用Poroshell 120 EC-C18(3.0 mm ×100 mm × 2.7 μm,美国 Agilent 公司)。流动相为甲醇和含0.1%氨水的水溶液,流速0.4 mL/min;流动相梯度洗脱程序见表1。

表1 流动相梯度条件
1.4.3 三重串联四极杆LC-MS/MS条件
质谱检测器采用电喷雾离子化源(ESI) ,负离子方式检测;毛细管电压3500 V;雾化气,压力3.1×105Pa,温度300 ℃;干燥气10 L/min, 扫描方式为多重反应监测( MRM) ,具体参数见表2。
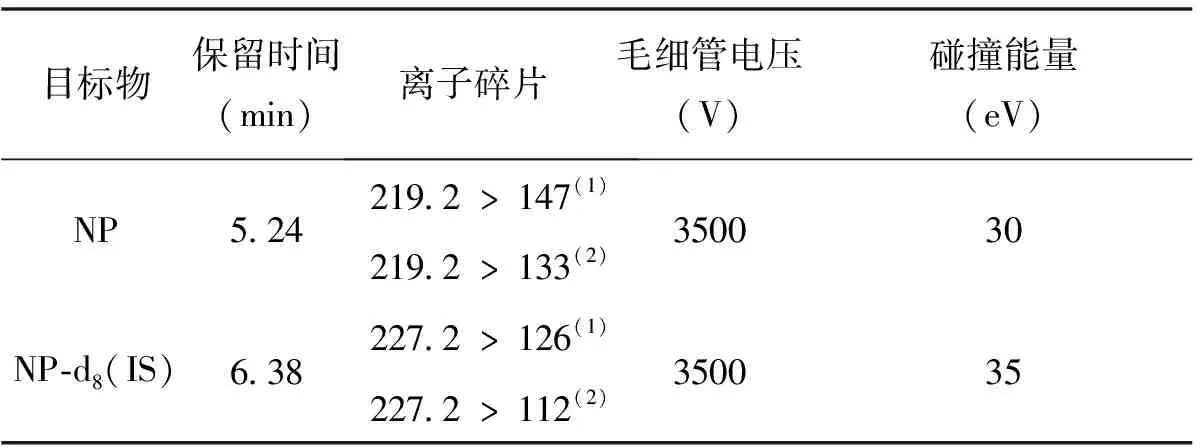
表2 壬基酚MS/MS参数
(1)定量离子;(2)定性离子;IS为内标
1.5 方法学确证
1.5.1 标准曲线
用壬基酚和壬基酚内标标准储备液以甲醇为溶剂配制标准溶液系列(1 mL),壬基酚的浓度分别为5、50、100、500、1000、1500 ng/mL,内标的浓度为500 ng/mL。
经On-line SPE LC-MS/MS测定,进样50 μL,记录色谱图,以NP的定量离子峰面积与内标NP-d8定量离子峰面积之比为纵坐标(y),NP进入液质分析的质量绝对量与内标NP-d8的质量绝对量之比为横坐标(x),绘制工作曲线。
1.5.2 方法回收率及精密度
选取10%的样品进行加标试验,分别是污泥样品10个、植物样品6个。由于污泥和植物的样品中NP的浓度大多相对较高,因此加标浓度确立为样品浓度的1~2倍左右,按萃取后50 ng/mL的添加量加入标准溶液按样品分析步骤进行测定NP含量,计算回收率。
1.5.3 定性和定量
样品中目标化合物色谱峰的保留时间须在相应标准色谱峰的保留时间5%的范围内,目标化合物的质谱定性离子必须出现,应同时包括1个母离子和1个子离子(表2)。待测目标化合物定性离子的选择离子色谱峰的信噪比应大于等于 3( S/N≥3) ,定量离子的选择离子色谱峰的信噪比应大于等于 10( S/N≥10) 。
样品浓度计算公式:
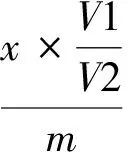
(1)
其中,c: 样品中的壬基酚的质量浓度,μg/kg;
x:从标准曲线上得到的壬基酚的质量绝对量,ng;
V1: 样品萃取液的体积,μL;
V2:样品进样体积,μL;
m:样品量,g。
1.5.4 质量控制
实验过程中必须做好严格的质量控制,避免使用塑料器皿,所有玻璃器皿经马弗炉 400 ℃ 烘烤4小时。每10个实际样品之间设定一个空白样品,用以评价背景污染。
2 结果与分析
2.1 On-line SPE LC-MS / MS条件优化
2.1.1 质谱条件的优化
质谱采用电喷雾离子化源(ESI)在负模式下对NP进行分析。雾化器压力为3.1×105Pa;干燥气流速和温度分别设为10 L/min和300 ℃;碰撞能、碎裂电压、母离子和子离子选择等其它质谱条件则采用Agilent 公司软件Optimizer 自动进行优化,最后用手动进行确认。具体参数见表2。
2.1.2 在线富集净化与色谱条件的优化
选择合适的在线固相萃取柱和设计合理的富集净化及洗脱条件是在线固相萃取方法的关键,实验证明C18填料可以很好的吸附酚类化合物,因此在本方法选择Spark 的HySphere C18HD (High Density)柱作为在线 SPE 柱,HySphere C18HD的填料表面为球形,平均直径为7.5 μm,此填料有很大的比表面积,能有效的吸附各种化合物,在解吸时又可以有尖锐的峰型。由于NP的保留较强,富集NP后使用20%的甲醇对小柱进行清洗,既可以把部分极性较强的盐类杂质清洗掉,又不影响NP的后续解吸。
2.1.3 流动相的选择
NP是酸性化合物,用负离子方式检测的,流动相对比使用了“乙腈-水”和“甲醇-水”,发现使用甲醇-水作为流动相,峰型更尖,响应更高。在水中添加氨水,能使NP更好的离子化,响应能更高,因此,最后选用甲醇-0.1%氨水作为流动相。
2. 2 方法的线性及最低定量限
标准曲线经线性拟合,得到的回归方程为y= 148.7x+2233.1,线性范围为0.25 ~75 ng相关系数大于0.999。根据3倍噪声计算,该实验方法测定NP 的检出限(LOD)为0.05ng ,以检出限(LOD)的4 倍计算的定量限(LOQ)为0.2 ng,方法具有较高的灵敏度。
2. 3 方法的回收率及精密度
根据1.5.2的方法得出以下结果,污泥样品的回收率为67.8% ~82.6%,植物样的回收率为65.9%~96.5%。选取10%的样品进行平行样测定,即样品平行测定两次,相对偏差为0.1%~24.1%。具体数据见表3、表4。

表3 方法回收率
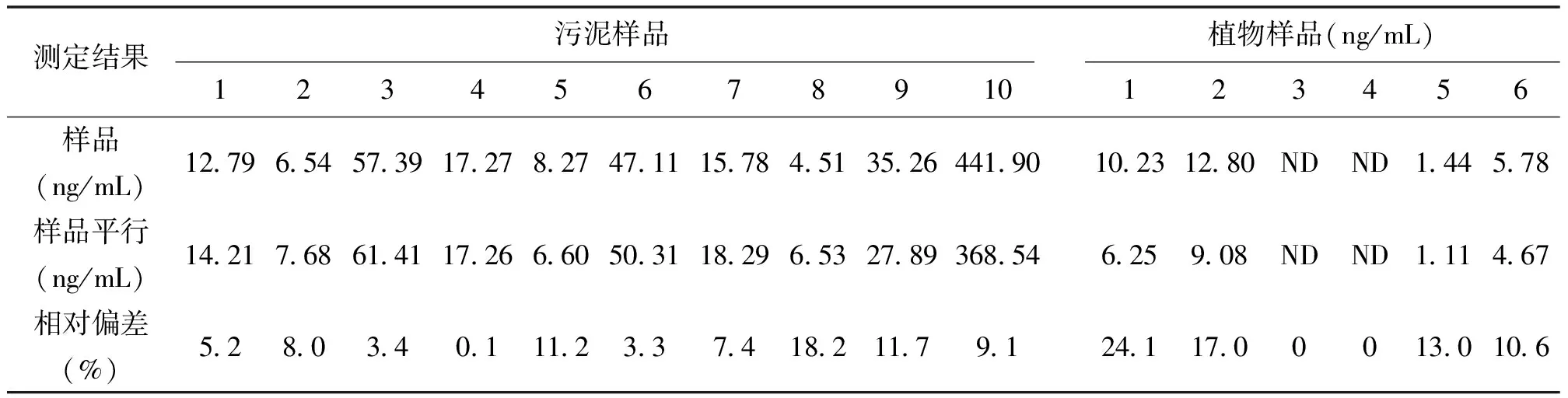
表4 方法精密度
注:加标量为50ng/mL ,ND表示未检出
2.4 实际样品
用该法分析了106个土壤样品和污泥样品,58个植物样品。土壤和污泥样品中NP的质量浓度范围为ND~65.17 mg/kg;植物样品中NP质量浓度为ND~3.41mg/kg。
图2为标准溶液和实际样品中目标化合物的LC-MS/MS色谱图。
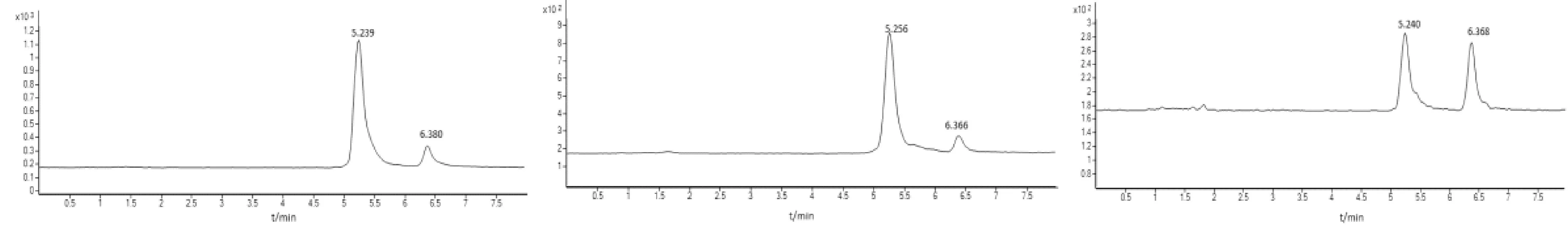
图2 标样,土壤样,植物样壬基酚MRM色谱图
3 结论
污泥、植物样品经冷冻干燥,经快速溶剂萃取,再用在线固相萃取结合液质质联用技术进行分析。检出限与定量限分别0.05ng和0.2 ng。污泥样的回收率为67.8% ~82.6%,植物样的回收率为65.9%~96.5%。相比于其他方法,该法有以下优点:
(1)采用快速溶剂萃取法进行萃取,萃取效率高。
(2)采用在线固相萃取-液质质联用技术,实现了样品的在线富集净化,简化了样品前处理过程,显著缩短分析时间,提高了分析效率。
(3)采用串联质谱的方式检测,选择性高、检出限低、方法的重现性和灵敏度高。
(4)自动化程度高,节约成本。该法的在线固相萃取小柱能重复使用并减少溶剂使用量等,节约了分析成本。
该方法为复杂基体样品中NP的分析测定提供了一个简单易行的途径,值得推广。
[1]Kvestak R, Ahel M. Occurrence of toxic metabolites from nonionic surfactants in the Krka river estuary [J]. Ecotoxicology and environmental safety, 1994, 28(1): 25-34.
[2]Giger W, Stephanou E, Schaffner C. Persistent organic chemicals in sewage effluents: I. Identifications of nonylphenols and nonylphenolethoxylates by glass capillary gas chromatography/mass spectrometry [J]. Chemosphere, 1981, 10(11): 1253-1263.
[3]马兴杰,邵兵,胡建英,等.壬基酚聚氧乙烯醚在污水处理过程中的迁移转化行为 [J].环境科学,2002,23 (05):80-83.
[4]Cai Q Y, Huang H J, Lü H X, et al. Occurrence of nonylphenol and nonylphenol monoethoxylate in soil and vegetables from vegetable farms in the Pearl River Delta, South China [J]. Archives of environmental contamination and toxicology, 2012, 63(1): 22-28.
[5]Chen F, Ying G G, Kong L X, et al. Distribution and accumulation of endocrine-disrupting chemicals and pharmaceuticals in wastewater irrigated soils in Hebei, China [J]. Environmental Pollution, 2011, 159(6): 1490-1498.
[6]王艳平,李正,杨正礼,等.黑龙江农田土壤壬基酚及其短链聚氧乙烯醚残留调查[J].土壤通报,2012,43(03):706-710.
[7]Sjstr M Å, Collins C, Smith S, et al. Degradation and plant uptake of nonylphenol (NP) and nonylphenol-12-ethoxylate (NP12EO) in four contrasting agricultural soils [J]. Environmental Pollution, 2008, 156(3): 1284-1289.
[8]Nowak K, Kouloumbos V, Schffer A, et al. Effect of sludge treatment on the bioaccumulation of nonylphenol in grass grown on sludge-amended soil [J]. Environmental Chemistry Letters, 2008, 6(1): 53-58.
[9]Dettenmaier E, Doucette W J. Mineralization and plant uptake of 14C-labeled nonylphenol, nonylphenol tetraethoxylate, and nonylphenol nonylethoxylate in biosolids/soil systems planted with crested wheatgrass [J]. Environmental Toxicology and Chemistry, 2007, 26(2): 193-200.
[10]Zoraida S F, Cristina M, José JS-R. Analytical Methodologies for the Determination ofEndocrine Disrupting Compounds in Biological andEnvironmental Samples[J]. BioMed Research International.2013,2013:1-25.
[11]Sara R M, Maria J L A, Dami`a B. Advantages and limitations of on-line solid phase extraction coupled to liquid chromatography-mass spectrometry technologies versus biosensors for monitoring of emerging contaminants in water[J]. Journal of chromatography A, 2007,1152(1): 97-115.
[12]Ying G G, Kookana R S. Sorption and degradation of estrogen-like-endocrine disrupting chemicals in soil [J]. Environmental Toxicology and Chemistry, 2005, 24(10): 2640-2645.
[13]Li J, Jiang L, Liu X, et al. Adsorption and aerobic biodegradation of four selected endocrine disrupting chemicals in soil-water system [J]. International Biodeterioration and Biodegradation, 2013, 76:3-7.
[14]Liu Q, Ji R, Hommes G, et al. Fate of a branched nonylphenol isomer in submerged paddy soils amended with nitrate [J]. Water Research, 2008, 42(19): 4802-4808.
[15]Chang B, Chiang B, Yuan S. Biodegradation of nonylphenol in soil [J]. Chemosphere, 2007, 66(10): 1857-1862.
[16]Shan J, Jiang B, Yu B, et al. Isomer-specific degradation of branched and linear 4-nonylphenol isomers in an oxic soil [J]. Environmental science and technology, 2011, 45(19): 8283-8289.
[17]Langdon K A, Warne M S J, Smernik R J, et al. Degradation of 4-nonylphenol, 4-t-octylphenol, bisphenol A and triclosan following biosolids addition to soil under laboratory conditions [J]. Chemosphere, 2011, 84(11): 1556-1562.
[18]Xia K, Jeong C Y. Photodegradation of the endocrine-disrupting chemical 4-nonylphenol in biosolids applied to soil [J]. Journal of environmental quality, 2004, 33(4): 1568-1574.
[19]Brown S, Devin-clarke D, Doubrava M, et al. Fate of 4-nonylphenol in a biosolids amended soil [J]. Chemosphere, 2009, 75(4): 549-554.
[20]Mortensen G K, Kure L K. Degradation of nonylphenol in spiked soils and in soils treated with organic waste products [J]. Environmental Toxicology and Chemistry, 2003, 22(4): 718-721.
[21]Lagan A, Bacaloni A, Deleva I, et al. Analytical methodologies for determining the occurrence of endocrine disrupting chemicals in sewage treatment plants and natural waters [J]. Analytica Chimica Acta, 2004, 501(1): 79-88.
[22] Rodriguez-mozaz S, Lopezdealda M J, Barcel D. Advantages and limitations of on-line solid phase extraction coupled to liquid chromatography-mass spectrometry technologies versus biosensors for monitoring of emerging contaminants in water [J]. Journal of Chromatography A, 2007, 1152(1): 97-115.
[23] Murillo-torres R, Dur n-alvarez J C, Prado-pano B, et al. Mobility of 4-nonylphenol and di (2-ethylhexyl) phthalate in three agricultural soils irrigated with untreated wastewater [J]. Water Science and Technology, 2012, 66(2): 292-298.
[24]Langdon K A, Warne M S J, Smernik R J, et al. Field dissipation of 4-nonylphenol, 4-t-octylphenol, triclosan and bisphenol A following land application of biosolids [J]. Chemosphere, 2012, 86(10): 1050-1058.
[25]Telscher M J, Schuller U, Schmidt B, et al. Occurrence of a nitro metabolite of a defined nonylphenol isomer in soil/sewage sludge mixtures [J]. Environmental science and technology, 2005, 39(20): 7896-7900.
[26]王艳平,杨正礼,李正,等.壬基酚在土壤中的降解和吸附特性 [J].农业环境科学学报,2011,30(08):1561-1566.
[27]Shan J, Wang Y, Wang L, et al. Effects of the geophagous earthworm Metaphire guillelmi on sorption, mineralization, and bound-residue formation of 4-nonylphenol in an agricultural soil [J]. Environmental Pollution, 2014, 189:202-207.
[28]吴唯,史江红,陈庆彩,等.沉积物中雌激素及壬基酚、辛基酚、双酚A的测定 [J].环境科学,2013,34 (02):724-731.
[29]郝瑞霞,梁鹏,赵曼,等.固相萃取-气相色谱-质谱-选择离子法检测污水中壬基酚[J]. 环境科学,2006,34(2):724-731.
[30]杨蕴嘉,牛宇敏,杨奕,等.在线固相萃取-液相色谱串联质谱法测定饮用水中的双酚A和壬基酚[J].卫生研究, 2013,42(01):127-132.
2017-05-09
周志洪,女,1975年出生,女,高级工程师,从事环境有机分析,E-mail:GZ_zhouzhihong@163.com。
*
丘锦荣,男,1978年出生,博士,教授级高级工程师,E-mail:qiujinrong@scies.org。
信息简讯
“跨境货品多参量无损检测仪的研制与应用”重大专项启动
2017年9月18日,钢研纳克检测技术有限公司在其永丰产业基地组织召开了由其牵头承担的国家重大科学仪器设备开发专项“跨境货品多参量无损检测仪的研制与应用”项目启动会。
随着“一带一路”国家战略推进及国际贸易快速发展,通关货品种类和数量激增,通关检测任务繁重,实验室送检分析速度已经不能满足进出口贸易的需求。同时,现有的快速检测仪器大部分存在着检测参数单一、检测灵敏度较低的问题,难以满足新形式下的需求。面对此需求,为了弥补现有口岸现场检测技术的不足、提升通关效率,钢研纳克检测技术有限公司牵头的项目组以“跨境货品多参量无损检测仪的研制与应用”申报了国家重大科学仪器设备开发专项2017年度项目,并获得了支持。
项目于2017年7月开始,2021年6月结束;总预算3990万元,其中中央财政专项经费1890万元;项目负责人为钢研纳克检测技术有限公司的副总经理陈吉文;项目分为“单波长全聚焦高灵敏度XRF检测模块研制”、“双波长瞬态差分高信噪比Raman检测模块研制”、“跨境货品多参数无损检测仪器工程化及产业化”等5个课题;项目参与单位还有中国检验检疫科学研究院、深圳出入境检验检疫局工业品检测技术中心、天津出入境检验检疫局化矿金属材料检测中心、中检国研(北京)科技有限公司、北京出入境检验检疫局检验检疫技术中心、山东出入境检验检疫局检验检疫技术中心、上海出入境检验检疫局工业品与原材料检测技术中心。(仪器信息网)
DeterminationofnonylphenolincomplexmatrixsamplesbyHPLC-MS/MSwithASEfollowedbySPE.
ZhouZhihong1,LiuQingyun2,3,ZhouShujie1,ZhaoTao2,QiuJinrong2*
(1.GuangzhouEnvironmentalMonitoringCenter,Guangzhou510030,China; 2.SouthChinaInstituteofEnvironmentalSciences,theMinistryofEnvironmentProtectionofPRC,Guangzhou510655,China; 3.IEREnvironmentalProtectionEngineeringTechniqueCo.,Ltd.,Shenzhen518101,China)
Samples of sediment, sludge and plants were extracted by ASE with a mixed solvent of dichloromethane, hexane and methanol (8:1:1, v/v/v). The extracts were on-line purified and enriched by SPE using Spark cartridges with methanol/water for elution, and then separated on an Agilent Poroshell 120 EC-C18column using methanol and water (containing 0.1% ammonia) as mobile phase for gradient elution. An Agilent 6420 triple quadrupole mass spectrometer was used for detection of NP on the negative ion multiple reactions monitoring (MRM) mode. The method showed desirable linearity in the concentration range of 0.25-75 ng, with correlation coefficients (r) no less than 0.999. The limit of detection (LOD) of the method was 0.05 ng. The method also exhibited favorable precision, with recoveries of 67.8%-82.6% for soils samples and 65.9%-96.5% for plants samples.10% of the total samples were selected to be measured in parallel, and the relative deviation was within 0.1%-24.1%. The proposed method is simple, sensitive, automated, and suitable for rapid determination of trace NP in complex samples.
nonylphenol; complex samples; accelerated solvent extraction;online SPE; HPLC-MS/MS
国家水体污染控制与治理科技重大专项( No.2014ZX07206001) 。
10.3969/j.issn.1001-232x.2017.06.005
