橄榄苦甙对卵巢辐射损伤的防治效果
2017-12-14陈桂莲黄惠娟田黎明
陈桂莲,黄惠娟,田黎明
橄榄苦甙对卵巢辐射损伤的防治效果
陈桂莲1,黄惠娟1,田黎明2
目的探讨橄榄苦甙减轻卵巢辐射损伤的效果及其机制。方法32只成熟雌性SD大鼠随机分为4组,正常对照组和辐射组予蒸馏水10 mL/(kg·d),橄榄苦甙组和辐射+橄榄苦甙组予橄榄苦甙100 mg/(kg·d),连续灌喂12周。12周后,辐射组和辐射+橄榄苦甙组大鼠动情期时,接受5 Gy的X线盆腔照射1次。辐射后7 d检测血清抗苗勒氏管激素(AMH)、IL-1、IL-6和TNF-α含量,计算卵巢组织各级卵泡数。结果与正常对照组比较,辐射组血清AMH浓度显著降低(Plt;0.05),血清IL-1、IL-6、TNF-α浓度升高(Plt;0.05);卵巢中卵泡数减少。与辐射组比较,辐射+橄榄苦甙组血清AMH升高,IL-1、IL-6、TNF-α浓度降低(Plt;0.05);卵泡总数增加。结论橄榄苦甙可通过抑制辐射诱导的炎症反应,减轻卵巢的辐射性损伤。
橄榄苦甙;电离辐射;卵巢储备功能;炎症因子
橄榄苦甙(oleuropein)是一种天然裂环烯醚萜苷类多酚化合物,为橄榄叶中的主要有效活性成分,具有多种药理活性,如降压[1]、抗氧化[2-3]、抗肿瘤[4-5]等。卵巢是女性生殖内分泌功能的主要器官,产生卵子并分泌激素。对年轻女性患者而言,放疗引起的卵巢功能损伤严重影响其生活质量。年轻宫颈癌患者术中保留卵巢,后期接受放疗的过程中,卵巢功能受到损伤,血清促性腺激素水平增高,血清雌激素、孕激素水平下降,出现围绝经期症状[6]。因此,如何减轻放射性卵巢损伤也成为研究的热点。本研究通过建立合适的辐射模型,首次探讨橄榄苦甙对卵巢辐射损伤的防治效果及潜在作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 清洁级雌性SD大鼠40只,6~7周龄,体重 (190±20)g,购于上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002],动物合格证编号:2015000521327,饲养于南京军区福州总医院比较医学科屏蔽环境[SYXK(闽)2013-0004],单笼饲养全价颗粒饲料喂养,环境温度(22±1)℃,光照12 h,自由摄食和饮水。适应3 d后,连续10 d每日晨8:00取阴道分泌物涂片,光镜下观察性周期,选用规律动情周期且周期为4~5 d的大鼠进入实验。
1.1.2主要试剂 橄榄苦甙(购于西安普莱特生物工程有限公司,橄榄苦苷90%HPLC),10%水合氯醛(购于南京军区福州总医院药学科制剂室,水合氯醛溶液,100 mL:10 g),大鼠卵泡刺激素(FSH)、大鼠黄体生成素(LH)、大鼠雌二醇(E2)、大鼠抗苗勒氏管激素(AMH)、大鼠肿瘤坏死因子-α(TNF-α)、大鼠白细胞介素-6(IL-6)、IL-1测定所用酶联免疫吸附法(ELISA)试剂盒均购自上海西唐生物公司。
1.1.3主要仪器 DENLEY DRAGON Wellscan MK 3酶标仪(THERMO);Wellwash 4 MK2洗板机(THERMO);TGL-168离心机(上海安亭科学仪器厂);XW-80A漩涡混合器(上海青浦沪西仪器厂);Olympus(BX41)光学显微镜(OLMPUS)。
1.2实验方法
1.2.1动物分组及给药 橄榄苦甙溶解于蒸馏水形成1 g/100 mL混悬液,经口灌胃给药,入选的32只大鼠,按随机数表法分4组,每组8只。①正常对照组;② 橄榄苦甙组;③辐射组;④辐射+橄榄苦甙组。各组大鼠连续灌喂12周,正常对照组和辐射组予蒸馏水10 mL/(kg·d);辐射组和辐射+橄榄苦甙组予橄榄苦甙100 mg/kg·d[相当于橄榄苦甙混悬液10 mL/(kg·d)]。
1.2.2辐射条件 大鼠于动情期时进行照射。将每只大鼠予10%水合氯醛按0.3 mL/100 g体重进行腹腔麻醉后,固定于自制模具中,采用瓦里安(Varian)直线加速器6 MVX射线进行盆腔一次性照射,照射剂量5 Gy,吸收剂量率100 cGy/min,照射野5×5 cm2,源皮距100 cm。
1.3 观察指标
1.3.1一般情况 测量大鼠体重,观察毛发及活动情况。比较大鼠照射前后及用药与否,体重的变化。
1.3.2大鼠卵巢湿重及器官系数分析 大鼠麻醉后称重,开腹分离卵巢组织,剔除周围组织,并用冰生理盐水冲净卵巢表面血污,滤纸吸干后称重。器官系数=(器官重量/体重)×100%。
1.3.3各组大鼠血清AMH、 IL-1、IL-6和TNF-α含量的检测 各组分别于照射后7 d(正常对照组和橄榄苦甙组也在同一天取材),用10%水合氯醛腹腔注射麻醉,腹部乙醇常规消毒,打开胸腔、腹腔,左心室采血3~5 mL,以3000 r/min离心10 min,离心半径13.5 cm,取上清液,-80 ℃保存,均采用ELISA法检测,操作步骤严格按试剂盒说明进行。采用450 nm吸光度,根据标准曲线确定所测指标的浓度。
1.3.4动情周期观察 照射后连续7 d,每日晨8:00取阴道脱落细胞涂片,光镜下观察进行动情周期判断[7]并记录。
1.3.5卵巢HE染色 分离右侧卵巢,用10%中性甲醛固定,依次行脱水,石蜡包埋,4 μm连续切片,隔20片取1片,随机选取3片,常规HE染色,光镜下计数整张切片各级卵泡数[8]。
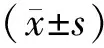
2 结 果
2.1一般情况 各组大鼠经过12周灌喂, 体重稳定增长,活动自如,毛发有光泽, 摄食饮水及排便正常,照射前对比各组未见明显差异。照射后7 d,对比照射前后及组间各组大鼠体重、摄食及饮水无明显变化。
2.2大鼠卵巢湿重及器官系数分析 照射后7 d,对比各组大鼠卵巢系数及脏器系数比值差异均无统计学意义(Pgt;0.05)。见图1。
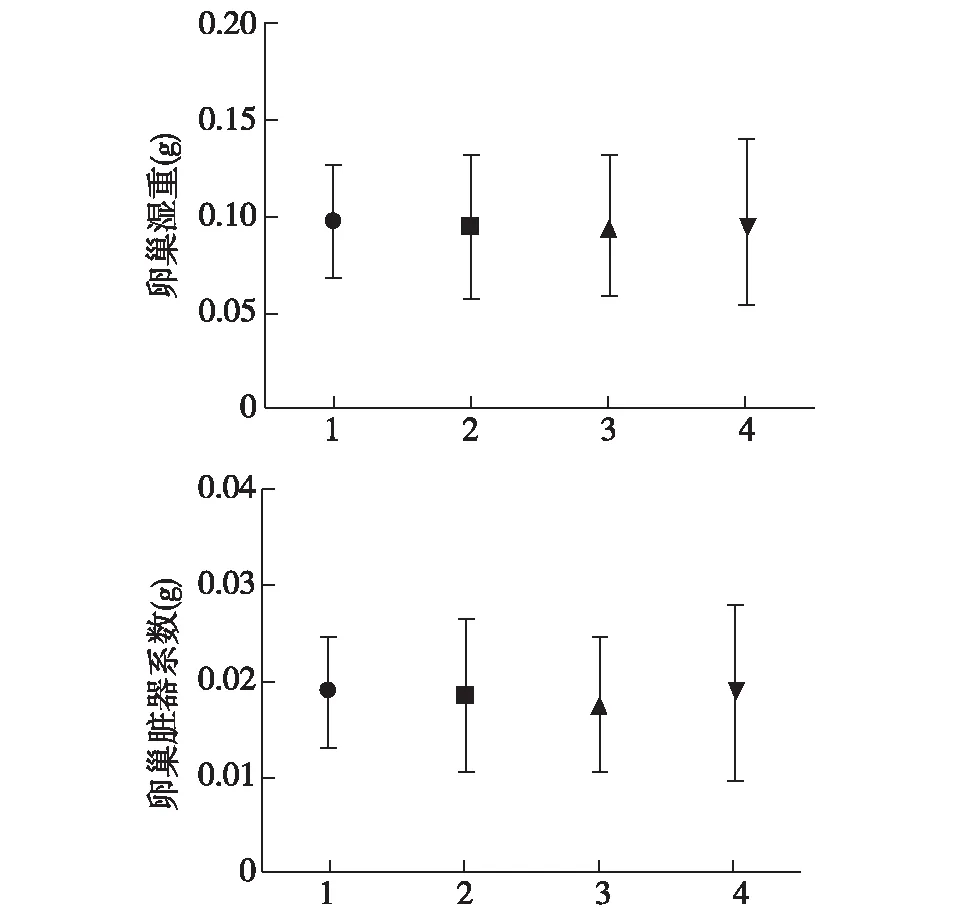
1:正常对照组;2:橄榄苦甙组;3:辐射组;4:辐射+橄榄苦甙组图1 各组大鼠卵巢湿重和脏器系数比较
2.3大鼠血清AMH浓度的测定 接受辐射的大鼠AMH分泌减少,而单纯给予橄榄苦甙大鼠AMH的分泌无影响。与正常对照组比较,橄榄苦甙组橄榄苦甙干预后,AMH差异无统计学意义(Pgt;0.05);辐射组照射后,AMH值显著减少(Plt;0.05);辐射+橄榄苦甙组接受橄榄苦甙干预后进行辐射,其AMH值较正常对照组下降但差异无统计学意义(Pgt;0.05),明显高于辐射组(Plt;0.05)。见图2。
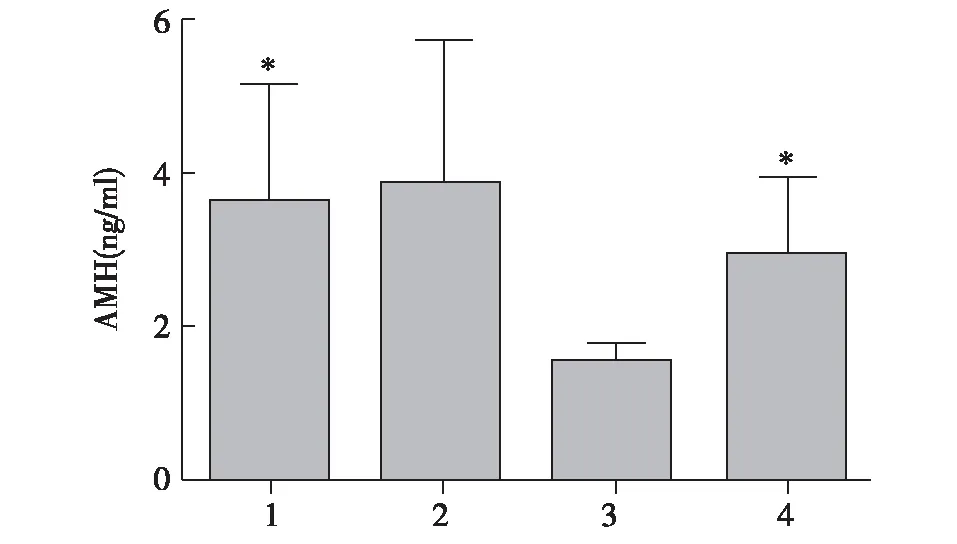
1:正常对照组;2:橄榄苦甙组;3:辐射组;4:辐射+橄榄苦甙组与辐射组比较,*Plt;0.05图2 各组大鼠血清AMH浓度比较
2.4大鼠血清IL-1、IL-6和TNF-α的测定 橄榄苦甙组IL-1、IL-6和TNF-α的浓度较正常对照组略有下降,其中TNF-α下降显著(Plt;0.05)。辐射组IL-1、IL-6和TNF-α的浓度均显著高于正常对照组和辐射+橄榄苦甙组(Plt;0.05)。辐射+橄榄苦甙组大鼠IL-1、IL-6和TNF-α的浓度与正常对照组比较差异无统计学意义(Pgt;0.05)。见表1。
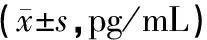
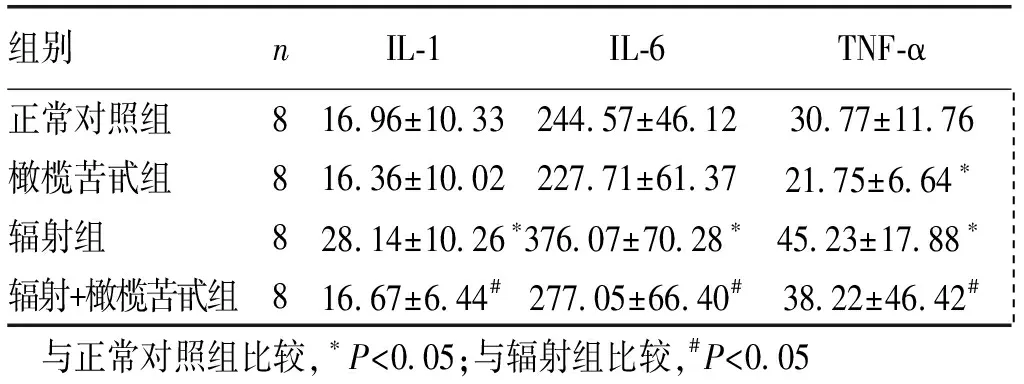
组别nIL⁃1IL⁃6TNF⁃α正常对照组816 96±10 33244 57±46 1230 77±11 76 橄榄苦甙组816 36±10 02227 71±61 3721 75±6 64∗ 辐射组828 14±10 26∗376 07±70 28∗45 23±17 88∗ 辐射+橄榄苦甙组816 67±6 44#277 05±66 40#38 22±46 42# 与正常对照组比较,∗Plt;0 05;与辐射组比较,#Plt;0 05
2.5大鼠动情周期变化 连续7 d阴道涂片,观察到正常对照组和橄榄苦甙组大鼠均可观察到下一次动情期改变;辐射组3/8大鼠出现动情周期延长,未见下一动情期;辐射+橄榄苦甙组大鼠均可出现下一动情期。
2.6大鼠卵巢组织光镜下改变及卵泡数变化 正常对照组卵巢结构清晰,卵巢中可见原始卵泡,各级发育中卵泡及成熟卵泡;辐射组卵巢结构混乱,皮质中原始卵泡和初级卵泡数量锐减,可见大量闭锁卵泡及多个大的陈旧样黄体组织;橄榄苦甙组卵巢结构清晰,各级卵泡数未见明显变化;辐射+橄榄苦甙组卵巢结构相对清晰,原始卵泡明显减少,可见少量闭锁卵泡及黄体样组织。见图3。
橄榄苦甙组大鼠卵泡总数及各级生长卵泡数较正常对照组正常大鼠差异无统计学意义(Pgt;0.05)。辐射组大鼠卵泡总数较正常对照组显著减少(Plt;0.05),各级卵泡中,原始卵泡、初级卵泡数减少明显 (Plt;0.05)。辐射+橄榄苦甙组大鼠,各组卵泡数较正常对照组减少,但差异无统计学意义(Pgt;0.05);辐射+橄榄苦甙组较辐射组卵泡总数多,以原始卵泡,初级卵泡数保留多(Plt;0.05)。见表2。

图3 各组大鼠卵巢组织HE染色(×40)
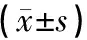
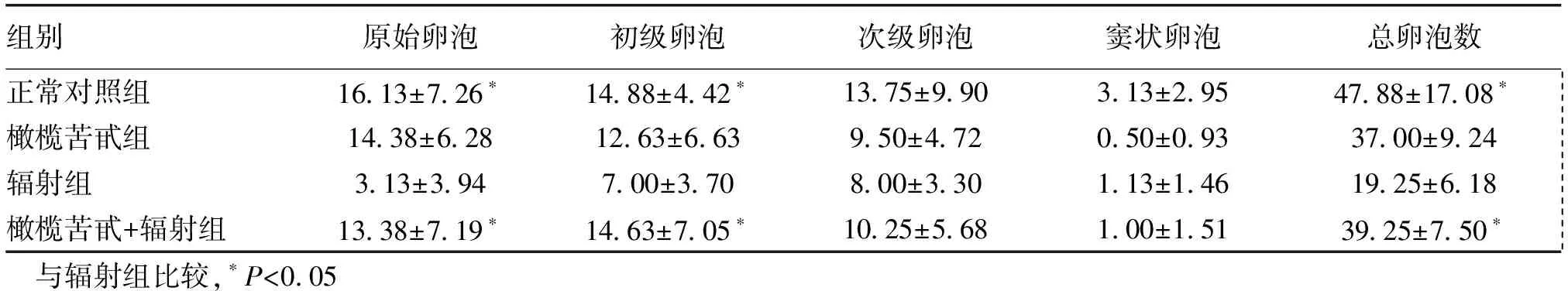
组别原始卵泡初级卵泡次级卵泡窦状卵泡总卵泡数正常对照组16 13±7 26∗14 88±4 42∗13 75±9 903 13±2 9547 88±17 08∗ 橄榄苦甙组14 38±6 2812 63±6 639 50±4 720 50±0 9337 00±9 24 辐射组3 13±3 947 00±3 708 00±3 301 13±1 4619 25±6 18 橄榄苦甙+辐射组13 38±7 19∗14 63±7 05∗10 25±5 681 00±1 5139 25±7 50∗ 与辐射组比较,∗Plt;0 05
3 讨 论
3.1卵巢储备功能评估方式 卵巢储备功能指的是卵巢内存留原始卵泡的数量和质量,反映了女性的生育潜能。近年来常用AMH评估卵巢储备功能[9]。研究认为,AMH能更好地用于预测绝经年龄,其与年龄相关的卵巢储备功能下降相关性最强。初级卵泡,次级卵泡及直径2~8 mm的早期窦卵泡中高表达AMH[10-11]。目前认为,AMH分泌在月经周期过程中相对稳定[12]。卵泡数目出生时已固定,不能再生,且仅0.1%的卵泡可发育成熟并排卵,绝大部分的卵泡闭锁消失。这也导致了卵巢功能易受损。始基卵泡作为卵巢功能的基本生殖单位。卵泡的耗竭及卵泡对垂体促性腺激素的无反应性可导致卵巢功能衰竭。由于原始卵泡并不分泌AMH,部分学者认为,AMH只能反映生长卵泡的数量,而无法反映处于休眠期的原始卵泡的数量[13]。卵巢组织中,各级卵泡的数量是反应卵巢储备功能的最直接的证据。本实验取大鼠卵巢制作组织切片,计数各级卵泡数,作为评估卵巢储备功能的手段之一。
3.2建立适宜辐射模型 现有卵巢辐射损伤模型各有不同。Pesty等[14]用不同剂量的射线(0.5、1、3、6 Gy)一次全身照射6周龄小鼠,各个剂量组均可发现原始卵泡和初级卵泡显著减少。Said等[3]用3.2 Gy的γ射线一次全身照射23 d龄未成熟SD大鼠,各级生长卵泡减少,闭锁卵泡增加。6~8周龄的Balb/c小鼠接受7.2 Gy的γ射线全身照射后,卵母细胞发育延迟,大多数处于减数分裂Ⅰ期,卵母细胞形态结构异常增加,且小鼠排卵率降低[15]。体外研究中,学者分离卵巢置于适宜的培养基培养,用0.2 Gy的射线照射,可观察到直径gt;500 μm的卵泡数较未照射组显著减少,且平均直径小;除此外卵母细胞裂解增多[16]。本实验中,接受盆腔5 Gy照射后,辐射组血清AMH明显降低(Plt;0.05);3/8大鼠动情周期延长;卵巢组织见总卵泡数减少,原始卵泡和初级卵泡为主,大量闭锁卵泡。成功建立卵巢辐射损伤模型。既往研究大多采用全身照射,辐射面积大,辐射损伤重,本实验采用盆腔照射,减少全身照射引起相邻器官及相关组织的影响,使辐射损伤更集中作用于卵巢,并采用多种直接和间接方法对卵巢储备功能进行评价。
3.3橄榄苦甙对抗炎症反应以减轻辐射性卵巢损伤 卵巢辐射损伤机制主要有氧化应激[3]和DNA损伤[16]。其他辐射模型证实电离辐射诱导血清IL-1、IL-6、IL-10、TNF-α等炎症因子发生变化,炎症反应参与放射性损伤[17-19]。 Das等[20]发现照射后小鼠体内除氧化应激反应,同时激活NF-kB通路,增加COX-2表达,提高炎症因子IL-6、TNF-α血清浓度,证实氧化应激反应和炎症反应均参与辐射损伤。橄榄苦甙可降低IL-1和IL-6的释放对抗炎症反应[21]。因此,我们猜想橄榄苦甙可通过调节IL-1、IL-6、TNF-α等炎症因子的释放,减轻卵巢辐射性损伤。IL-1、IL-6、TNF-α是介导急性期炎症反应最重要的细胞因子。IL-1、TNF-α主要由激活的巨噬细胞产生,可引起发热、食欲不振、嗜睡等症状。TNF-α还是炎症反应的启动因子,可损伤血管内皮细胞,增加血管通透性,刺激内皮细胞生成IL-1、内皮素等炎症介质,导致组织损伤;刺激单核巨噬细胞等合成分泌IL-1、6、8、TNF-α等形成“瀑布效应”加重组织损伤。本实验中,辐射组较对照组炎症因子IL-1、IL-6、TNF-α的释放显著增加,而橄榄苦甙的干预有效降低辐射+橄榄苦甙组血清IL-1、IL-6、TNF-α浓度,减轻辐射诱导的炎症反应。对比辐射组,辐射+橄榄苦甙组血清AMH浓度明显升高;阴道涂片未见动情周期异常;卵巢病理切片示,保留更多生长卵泡数,以原始卵泡和初级卵泡差异显著,可能为原始卵泡对辐射更为敏感[22]。因此,橄榄苦甙可在一定程度上减轻卵巢辐射损伤。结合炎症因子的改变及卵巢储备功能情况,我们有理由认为,橄榄苦甙通过抑制辐射诱导的炎症反应,减轻卵巢储备功能的损伤。
综上所述,橄榄苦甙可通过抑制炎症因子IL-1、IL-6、TNF-α的合成和释放,减轻辐射诱导的炎症反应,改善卵巢储备功能。
[1] Romero M, Toral M, Gómez-Guzmán M,etal. Antihypertensive effects of oleuropein-enriched olive leaf extract in spontaneously hypertensive rats[J]. Food funct, 2016, 7(1): 584-593.
[2] Ogun M, Ozcan A, Karaman M,etal.Oleuropein ameliorates arsenic induced oxidative stress in mice[J]. J Trace Elem Med Biol,2016,36:1-6.doi: 10.1016/j.jtemb.2016.03.006.
[3] Said RS, Badr AM, Nada AS,etal. Sodium selenite treatment restores long-lasting ovarian damage induced by irradiation in rats: impact on oxidative stress and apoptosis[J]. Repro toxicol, 2014,43 (1):85-93.
[4] Yan CM, Chai EQ, Cai HY,etal.Oleuropein induces apoptosis via activation of caspases and suppression of phosphatidylinositol 3-kinase/protein kinase B pathway in HepG2 human hepatoma cell line[J]. Mol Med Rep, 2015, 11(6): 4617-4624.
[5] Secme M, Eroglu C, Dodurga Y,etal.Investigation of anticancer mechanism of oleuropein via cell cycle and apoptotic pathways in SH-SY5Y neuroblastoma cells[J]. Gene, 2016, 585(1): 93-99.
[6] Sioulas VD, Jorge S, Chern JY,etal. Robotically assisted laparoscopic ovarian transposition in women with lower gastrointestinal cancer undergoing pelvic radiotherapy[J]. Ann Surg Oncol, 2016, 24(10):1-6.
[7] Cora MC, Kooistra L, Travlos G. Vaginal cytology of the laboratory rat and mouse review and criteria for the staging of the estrous cycle using stained vaginal smears.[J]. Toxicol Pathol, 2015,43(6):776-793.
[8] Erbas O,Akman L,Yavasoglu A,etal. Oxytocin improves follicular reserve in a cisplatin-induced gonadotoxicity model in rats[J]. Biomed Res Int,2014:703691. doi: 10.1155/2014/703691.
[9] Lunding SA, Aksglaede L, Anderson RA,etal. AMH as predictor of premature ovarian insufficiency: a longitudinal study of 120 turner syndrome patients[J].J Clin Endocrinol Metab, 2015, 100(7): E1030-E1038. doi: 10.1210/jc.2015-1621.
[10] Jeppesen JV, Anderson RA, Kelsey TW,etal. Which follicles make the most anti-Mullerian hormone in humans? Evidence for an abrupt decline in AMH production at the time of follicle selection[J]. Mol Hum Reprod, 2013, 19(8): 519-527.
[11] Broer SL, Mol B, Dolleman M,etal.The role of anti-Mullerian hormone assessment in assisted reproductive technology outcome[J]. Curr Opin Obstet Gynecol, 2010, 22(3): 193-201.
[12] Van Disseldorp J, Lambalk CB, Kwee J,etal. Comparison of inter- and intra-cycle variability of anti-Mullerian hormone and antral follicle counts[J]. Hum Reprod, 2010, 25(1): 221-227.
[13] Findlay JK, Hutt KJ, Hichey M,etal. What is the“ovarian reserve”?[J] Fertil Steril, 2015, 103(3): 628-630.
[14] Pesty A, Doussau M, Lahaye JB,etal.Whole-body or isolated ovary (60)Co irradiation: effects on in vivo and in vitro folliculogenesis and oocyte maturation[J]. Reprod Toxicol, 2010, 29(1): 93-98.
[15] Sapmaz-Metin M, Kanter M, Uzal C. The role of ionizing radiaton on ovulation rate and oocyte morphology in mouse[J]. Acta Biol Hung, 2014, 65(1): 27-37.
[16] Flegal M, Blimkie MS, Wyatt H,etal.Measuring DNA damage and repair in mouse splenocytes afterchronic in vivo exposure to very low doses of beta- and gamma-radiation[J]. J Vis Exp,2015,101:e52912. doi: 10.3791/52912.
[17] Lu J,Wang C,Cao X,etal.Effect of zhuyeshigao granule on tumor necrosis factor-alpha and interleukins serum protein levels in rats with radiation esophagitis[J]. J Tradit Chin Med, 2014,34(3):338-341.
[18] Chen H, Xiang H, Wu B,etal.Manganese superoxide dismutase gene modified mesenchymal stem cells attenuates acute radiation-induced lung injury[J]. Hum Gene Ther, 2016,106:1-24.
[19] Pourkhodadad S, Alirezaei M, Moghaddasi M,etal. Neuroprotective effects of oleuropein against cognitive dysfunction induced by colchicine in hippocampal CA1 area in rats[J]. J Neurol Sci,2016,66(5):397-405.
[20] Das U, Manna K, Sinha M,etal. Role of ferulic acid in the amelioration of ionizing radiation induced inflammation: a murine model[J]. PLoS One,2014,9(6):e97599. doi: 10.1371/journal.pone.0097599.eCollection 2014.
[21] Ryu SJ, Choi HS, Yoon KY,etal. Oleuropein suppresses LPS-induced inflammatory responses in RAW 264.7 cell and zebrafish[J]. J Agric Food Chem, 2015, 63(7): 2098-2105.
[22] Said RS, Nada AS, El-Demerdash E. Sodium selenite improves folliculogenesis in radiation-induced oarian failure: a mechanistic approach[J]. PLoS One,2012,7(12):e50928. doi: 10.1371/journal.pone.0050928.
2017-04-30;
2017-10-20)
(本文编辑:叶华珍; 英文编辑:王建东)
Experimentalstudyoftheeffectsofoleuropeinonirradiation-inducedovarianinjury
CHEN Gui-lian1, HUANG Hui-juan1, TIAN Li-ming2
(1.DepartmentofObestetricsandGynecology,ClinicalMedicalSchool,FuzhouGeneralHospitalofFujianMedicalUniversity/FuzhouGeneralHospitalofChinesePLA,Fuzhou350025,Fujian,China; 2.DepartmentofObstetricsandGynecology,EastHospitalAffiliatedtoXiamenUniversity,Fuzhou350025,Fujian,China)
ObjectiveTo study the effects of oleuropein on irradiation-induced ovarian injury.Methods32 femal SD rats were randomly assigned to 4 groups of 8 rats each: control group, oleuropein group, irradiation group and irradiation + oleuropein group. Rats in control group and irradiation group
distilled water 10 mL/(kg·d) intragastrically. Rats in oleuropein group and irradiation + oleuropein group received oleuropein 100 mg/(kg·d) intragastrically. 12 weeks later, rats in group irradiation group and irradiation + oleuropein group were exposed to pelvic irradiation at a dose of 5 Gy when they were in the estrus. After 7 days for radiation, the concentration of AMH, IL-1, IL-6 and TNF-α were detected and the number of growing follicles in ovarian tissue were counted.ResultsCompared with the control group, the serum AMH concentration in the radiation group was significantly decreased (Plt;0.05), and IL-1, IL-6 and TNF-α were increased (Plt;0.05) and the number of follicles in the ovaries was reduced. Compared with the radiation group, the serum AMH concentration were increased in the radiation + peridol group, and IL-1, IL-6 and TNF-α decreased (Plt;0.05). The total number of follicle was increased.ConclusionIt was concluded that oleuropein could inhibit the radiation-induced inflammatory response to reduce the radiation damage of the ovaries.
Oleuropein; Irradiation; Ovarian reserve; Cytokines
R711.4
A
1672-271X(2017)06-0576-05
10.3969/j.issn.1672-271X.2017.06.005
福建省科技计划项目(2014Y5008);全军医药卫生科研项目(14MS129)
1. 350025 福州,福建医科大学福总临床医学院(南京军区福州总医院)妇产科;2. 350025 福州,厦门大学附属东方医学院妇产科
陈桂莲,黄惠娟,田黎明.橄榄苦甙对卵巢辐射损伤的防治效果[J].东南国防医药,2017,19(6):576-580.
