“特色”试题分析研究
2017-12-14浙江应化德
浙江 应化德
“特色”试题分析研究

浙江省2009年实施新高考以来,出现了一类极具浙江特色的试题,如2010年第25题,可以说是一个标杆题,它的思想一直影响至今的选考,研究它非常有意义。该试题的情景体现化学学科的社会价值,汽车安全气囊工作原理知识,考查的内容体现化学的学科思想,利用定性定量相结合的物质推断与实验方案设计的思想、从不同角度分析问题的小综合思想,考查元素化合物知识的氧化还原反应方程式的规范书写及其他化学表示方法等。此题能力要求高、区分度好,考查学生的自主学习能力、信息运用能力、迁移对比能力、计量能力和化学语言表达能力等。当试题命题者命出好题时,出题的思想,出题的意图,就会传承下来,形成浙江特色,高考试题的改编及编写思路就有一条脉络可寻。那么教师、学生该怎么做呢?下面就该试题分析、解读,将解题方法、核心思维和应对策略作一阐述。
高考真题【2010年第25题】(14分)汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅含Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72 L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为__________,丙的电子式为__________。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为______________________________。
(3)单质乙与红棕色粉末发生反应的化学方程式为_______________,安全气囊中红棕色粉末的作用是__________。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是________。
A.KCl B.KNO3C.Na2S D.CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分:________(不考虑结晶水合物)。
1.试题解析
(1)根据题意,红棕色固体为Fe2O3,而甲是由Na与N组成的化合物,但不能想当然认为是Na3N,有定量数据必须定量分析:

甲的化学式为NaN3,而非Na3N。
(2)考查非氧化还原反应

(3)考查氧化还原反应

从氧化还原反应角度,Fe2O3只能把Na氧化为Na2O,因为Na2O2氧化性比Fe2O3强。
NaN3分解产生的钠,具有熔点低、易燃、易与水反应生成强碱极不安全因素,而铁熔点高,相对安全,避免分解产生的金属钠可能产生的危害。
(4)Fe2O3是作为Na的氧化剂,可以用CuO代替(对比模仿即可),还可以用KNO3代替,KNO3在酸性或高温下表现出氧化性(理解、迁移、创新),也是设置这小题的真正意义。
(5)考查探究化合物成分的实验方案设计,Na2O在空气中可能生成Na2CO3或NaHCO3或两者混合物,设计方案时首先要考虑选择定性判断还是定量分析,本小题显然定量比较合适,用“三步曲”回答:①可溶性盐的成分可能是Na2CO3、NaHCO3或Na2CO3与NaHCO3的混合物。②准确称取一定量的生成物,加热至恒重后,③如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3,或Na2CO3与NaHCO3的混合物。
2.试题解读
(1)背景与考点
2009年第一次新高考,命题人压力大,思想观点、内容、形式如何体现“新”呢?第一次新高考试题褒贬不一,但作者认为是很好的,像27题就是经典题。试题命制人,在不断探索、不断创新,像2010年第25题就是一道出题人很得意的试题,可以说是一个“杰作”。浙江省从2006年9月新课程的改革与实施,2009年6月第一次新高考到2016年6月结束共8次高考;从2014年9月,深化高校招生考试制度综合改革试点方案的实施,到2015年10月第一次的化学学考与选考至今共4次高考。这个试题的思想意图一直影响这12次的高考,如2017年4月的第27题无机物推导、28题的实验验证等分散到各题中,这就是浙江特色。
考查内容:无机化学式的推导、电子式的书写、氧化还原反应方程式和非氧化还原反应方程式的书写、物质的性质与用途、实验方案的设计等。
(2)考查能力
试题材料情景创新,考查学生提取信息和运用信息能力、化学计算能力、知识原理的运用能力、迁移能力、分析能力、实验设计能力、语言表达和规范用语能力。
对这类试题的解答,必须通过阅读、理解、分析、比较、演绎、推理、原理迁移等学科方法来解决问题。所以面对这样的试题,依靠“题海”来复习应考,显然是不行的,要有学科思想、要有针对性训练。
(3)渗透化学学科思想
①定性定量相结合的思想,试题要求考生经过定性判断、定量分析。Na、N组成的物质不一定就是Na3N,也可以是NaN3。

③小综合、小归纳的思想(从不同角度),CuO与Fe2O3物质组成类似,而KNO3是不同类型的物质,高温下也可作氧化剂与Na反应。
④理论联系实际的思想,情景来自生活,学有所用,安全气囊的设计,体现学科的社会价值。
⑤实验探究的思想(定量分析思想)
Na2O放在空气中可能生成的物质成分,从定量的角度探究分析。
(4)亮点、特色
元素化合物的考查,落在利用定性、定量相结合的方法推断化学式;体现小综合、小归纳的思想;突出氧化还原反应原理的运用;强化小实验操作的设计;显现化学学科的社会价值。
3.解题思维方式
要快速正确完美地解答这类试题,学生要适当了解该类试题的思想灵魂、出题目的,学生也要有一定理论水平,一定的思维程序。
(1)胆大心细的心态解决定性定量的问题

定量要心细,具体是指要根据数据仔细计算,不能想当然。例如:知道Na、N组成的化合物组成不一定是Na3N,可能是NaN3;知道组成元素是N、H,化合物不一定是NH3,也可能是N2H4、HN3、NH4N3、NH4H(其实不能稳定存在);化合物热分解产生CuO、CO2、H2O,该化合物不一定是Cu2(OH)2CO3,可能是xCu(OH)2、yCuCO3;化合物由Fe、C、O组成,该化合物不一定是FeCO3,也可能是Fe(CO)5、FeC2O4等。
关注一些特殊物质,如Cu2O、Fe3S4、Fe3I4、Al2O、SiO、CaCl、N2H4、CuS、Cu2S、CuOH、CuCl、CuI、CuCO3、Fe2Cl6、Fe(CO)5、FeC2O4、FeO(OH)、Na2FeO4、Fe(C5H5)2、K4[Fe(CN)6]、K3[Fe(CN)6]。
(2)充分认识试题的价值
大题中的选择题,从不同角度思考问题,认识出题的价值。例如:
2011年26题第3小题:为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是________。
A.Na2S2O3B.AlCl3
C.Na2CO3D.NaNO2

2013年27题第4小题:下列物质中也可能作为CO2捕获剂的是_____________。
A.NH4Cl B.Na2CO3
C.HOCH2CH2OH D.HOCH2CH2NH2

(3)复杂氧化还原反应方程式的书写方法,思维程序
①认识反应物性质(氧化性、还原性)
②判断氧化产物和还原产物(已知或需推断)
③电子得失总数相等
④根据化学环境添加物质(不要希望一步到位)
⑤验证
例如:写出用过量的NaClO溶液除去NO2的离子方程式




第五步:验证
(4)实验方案设计思路
主要考查反应产物的种类的判断与鉴别,如“Na2O在空气中可能生成的产物”,2017年4月选考“用化学方法验证FeSO4受热后固体的成分”等。解题思路如下:
①首先根据物质性质确定采用定性还是定量的角度验证成分,如Na2O在空气中可能生成的产物,若用定性方法很难回答。
②注意语言表达的规范性,且要用肯定的语言表达,如根据什么现象,确定是什么,而不是是否出现什么来描述。一般可以通过“三步曲”回答问题。
③不能出现科学性的错误。
④现象描述要准确,如未知液中加入K3[Fe(CN)6],没有明显现象,应该描述没有蓝色沉淀,因为赤血盐是有颜色的。
例如2017年4月高考题:回答如下:
①FeSO4加热后的固体可能是Fe2O3或Fe2O3和未分解的FeSO4;②取少量固体样品,加入稀硫酸溶解后分两份;③一份加入KSCN溶液,若出现血红色溶液即固体有Fe2O3,另一份滴加酸性KMnO4溶液,若褪色,即有未分解的FeSO4。
看似简单,很多考生也不能答满分,主要扣分点有:
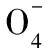

浙江省金华市外国语学校)
