工艺流程题及其解题基本策略
2017-12-14湖北王云峰
湖北 王云峰
工艺流程题及其解题基本策略

化学工艺流程题题目新颖、信息量大、涉及物质转化、化学反应原理、化学实验操作等知识,涉及面广,从而取代传统框图推断成为近几年高考的热门考题,可以说,化学工艺流程题是知识和能力的完美结合,符合新课标化学核心素养要求,特别是2017年新课标卷取消《化学与技术》选修模块,从而使得它在高考必做题中出现的几率大大增加。现对化学工艺流程题的结构特点和答题策略总结如下,希望对2018届备考有所帮助。
一、化工流程题的结构特点

【归纳】原料预处理
①酸浸:溶解、去氧化膜等,使得可溶性的离子进入溶液中,不溶物过滤去除。
②碱浸:去油污(酯)、溶解铝、二氧化硅、氧化铝等,使得可溶性的离子进入溶液中,不溶物过滤去除。
③水浸:与水反应或溶解,使原料变成离子进入溶液中。
④研磨(雾化、粉碎):增大反应接触面积,以加快化学反应速率或使反应更充分。
⑤灼烧(焙烧、煅烧):使物质高温分解或者氧化去除杂质、改变物质结构,使物质能溶解。如从海带中提取碘时的灼烧就是为了除去可燃性杂质。
⑥加入其他物质:如有机物醇、四氯化碳、无机盐等,其作用是反应、溶解。
浸取液(浸出液)——固体加水、酸、碱等溶解得到的离子的溶液。
浸取率(浸出率)——固体溶解后,离子在溶液中的含量的多少。注意与浸取速率(浸出速率)的差别。
【归纳】控制反应条件
①溶液的pH:提供酸碱性环境、抑制或促进离子水解等产生沉淀便于分离等。
调节pH的方法:调节pH所需的物质一般应满足两点:一是能与H+(或OH-)反应,使溶液pH增大(或减小);二是不引入新杂质。如:若要除去Cu2+中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。
②温度:升温——加快反应(溶解)速率;促进平衡向吸热反应方向移动;去除热稳定性差的物质或易升华的物质。
降温——防止物质分解,挥发;使平衡向放热反应方向移动;使高沸点的物质液化,使其与其他物质分离;降低溶解度,减少损失。
控温(水浴、沙浴、油浴)——受热均匀,便于控制温度。温度太高,速率太快;物质可能分解、挥发、水解;催化剂可能中毒;发生副反应等。温度太低,速率可能太慢;催化剂活性不高;物质转化率、产率不高等。
③氧化剂(还原剂)、电化学:生产目标(或过程)产物或去除某些离子。
④其他条件:浓度、压强、催化剂、隔绝空气等。
【归纳】分离提纯
①过滤:一贴二低三靠四洗。四洗:为什么要洗?用什么洗?怎么洗涤?是否洗干净?
为什么洗:去除晶体表面的杂质;把目标产物尽可能洗出来,提升产率。
用什么洗:蒸馏水、冷水、有机溶剂(醇、酮、醚)等;如用酒精洗硫酸亚铁铵晶体可降低晶体因溶解造成损失,可以除去表面的水,酒精易挥发,易干燥。
怎么洗涤:沿着玻璃棒向过滤器中加入蒸馏水(其他溶剂)至浸没沉淀,待其自然流下后,重复2~3次。
是否洗干净(离子检验):取最后一次洗涤液少许于试管中,滴加某试剂(其他操作),产生什么现象?则证明是否洗干净。
减压过滤(吸滤、抽滤):减压过滤装置由真空泵、布氏漏斗、吸滤瓶组成。
②结晶(重结晶):溶液中含单一溶质时,所得晶体不带结晶水,如氯化钠溶液结晶过程为蒸发结晶;所得晶体带有结晶水,如硫酸铜溶液得到CuSO4·5H2O的晶体过程为蒸发浓缩、冷却结晶、过滤。
溶液中含两种以上溶质时,要得到溶解度受温度影响小的溶质采用蒸发结晶、趁热过滤,如除去NaCl中少量的KCl;要得到溶解度受温度影响大的溶质采用蒸发浓缩、冷却结晶、过滤,如除去KCl中少量的NaCl。
晶体干燥:自然晾干、滤纸吸干、在干燥器中干燥、烘干(热稳定性较好)。
③萃取(分液):当向混合物中加入有机试剂(苯、四氯化碳等)后分离的,且题目信息有涉及溶解度不同时考虑萃取。常见液 - 液萃取(如用苯或CCl4萃取水中的溴),固 - 液萃取(如用酒精浸取黄豆中的豆油以提高油产量)。一般萃取分液后的混合溶液采取蒸馏的方式分离。海带中提取碘(灼烧、溶解、过滤、氧化、萃取、蒸馏)。
④蒸馏(分馏):题目信息有涉及沸点不同的物质时,考虑蒸馏,常见混合液体或液 - 固体系。
二、化工流程题答题思路
1.粗读题、得目的、标记有用信息、先问题后框图。
首先将题目从头到尾初读一遍,初步了解原料、目的和提供一些课本上没有但题目中必须要用到的新信息。养成良好做题习惯,阅读时随手标记目的及相关信息。先看问题,再看框图。
2.看箭头,析过程。
箭头打进的方向是反应物,打出的是生成物,有进又有出的是可循环利用的物质。
3.细分析,看措施,推用意,理关系。
①原料和产品:从某种原料出发,要得到最终产品,必须除去什么元素、引进什么元素?关注杂质离子的去向及产品的生成,有时需要逆向推倒。
②步骤与目的:加入某种试剂(什么反应),进行相应操作,其目的是什么?结合后面步骤进行思考。特别关注化合价变化和溶液酸碱性(两大主旋律)。
③信息和迁移:新信息一般是重要的暗示和突破口,所给的信息一定有用,但需要提炼、重组、分解和迁移,结合设问分析、判断,正确做答。
④感觉和结果:对于比较陌生的流程,不必纠结于某步骤不能看懂,要从宏观上把握整个流程,抓大放小,关注步骤的结果,跟着感觉走。
4.精准和规范:填写答案时要运用正确规范的化学用语,清晰、严密地组织、精准表述答案,按照题目要求写出答案。
三、规范答题思路
①增大原料浸出率的措施:搅拌、升高温度、延长浸出时间、增大气体的流速(浓度、压强),增大气液或固液接触面积。
②加热的目的:加快反应速率或促进平衡向某个方向移动。
③温度不高于××℃的原因:适当加快反应速率,但温度过高会造成(如浓硝酸)挥发、(如H2O2、NH4HCO3)分解、(如Na2SO3)氧化或促进(如AlCl3)水解等。
④从滤液中提取一般晶体(溶解度随温度升高而增大的晶体)的方法:蒸发浓缩(至有晶膜出现)、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗)、干燥。
⑤从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体的方法:蒸发浓缩、趁热过滤(如果温度下降,杂质也会以晶体的形式析出来)、洗涤、干燥。
⑥溶液配制、灼烧、蒸发、过滤用到的仪器要熟知。
⑦控制某反应的pH使某些金属离子以氢氧化物的形式沉淀。调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质;pH分离时的范围确定,范围过小易导致某离子沉淀不完全,范围过大易导致主要离子开始沉淀。
⑧减压蒸馏(减压蒸发)的原因:减小压强,使液体沸点降低,防止(如H2O2、浓硝酸、NH4HCO3)受热分解或挥发。
⑨检验溶液中离子是否沉淀完全的方法:将溶液静置一段时间后,向上层溶液中滴入沉淀剂,若无沉淀生成,则离子沉淀完全。
⑩洗涤沉淀:沿玻璃棒往过滤器中加蒸馏水至浸没沉淀,待水自然流下,重复操作2~3次。
四、真题再现
【2016高考新课标Ⅰ卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为________。
(2)写出“反应”步骤中生成ClO2的化学方程式:
。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)
【答案】(1)+3

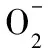
(4)2∶1 O2(5)1.57


湖北省远安县第一高级中学)
