枯草芽孢杆菌发酵蟹壳粉产蛋白酶的研究
2017-12-13刘杨柳魏东东刘燕郭润芳于宏伟孙纪录
刘杨柳,魏东东,刘燕,郭润芳,于宏伟,孙纪录
(河北农业大学食品科技学院,河北保定071001)
枯草芽孢杆菌发酵蟹壳粉产蛋白酶的研究
刘杨柳,魏东东,刘燕,郭润芳,于宏伟,孙纪录*
(河北农业大学食品科技学院,河北保定071001)
以蟹壳粉为培养基的主要成分,研究一株枯草芽孢杆菌UMN-26在其中产蛋白酶的最适培养条件,以期为使用微生物发酵法脱除蟹壳中的蛋白质打下基础。以发酵液中的蛋白酶酶活力作为指标,采用单因素试验和响应面法优化蟹壳粉培养基的发酵条件。试验结果表明,优化的培养基组成为:蟹壳粉浓度5.5%,蔗糖浓度11.81%,初始pH 7.27。最适培养条件为培养温度37℃,转速200 r/min,培养时间108 h。在此条件下,发酵液的蛋白酶酶活力达到1 465.86 U/mL,为优化前的7.86倍,蛋白质的脱除率为70.71%。
枯草芽孢杆菌;蛋白酶;蟹壳粉;响应面法;脱蛋白质率
蟹壳是蟹加工和消费过程中的副产物。每年全世界约产生数以百万吨的蟹壳。目前,大部分蟹壳通常作为废料被丢弃,导致环境污染及资源浪费。蟹壳的主要成分是矿物质(20%~50%)、蛋白质(20%~40%)、几丁质(15%~40%)[1]。其中,几丁质(chitin,又称甲壳素)及其衍生物在食品领域应用广泛,可作为絮凝剂、增稠剂、保鲜剂[2]、食品包装膜[3]及保健食品[4]等。获得蟹壳中的几丁质,至少需要经过脱蛋白质和脱矿物质两个关键步骤。一直以来,脱除蟹壳中的蛋白质常采用化学方法[5],即以10%的NaOH沸水浴1 h~2 h[6]。后来有所改进[7-8],如时杰将NaOH质量分数由10%降至2%以减少浓碱使用[9]。但是,这种化学方法始终存在两个弊端,一是会引起几丁质的解聚合作用,二是加剧环境污染。与之相比,生物技术工艺,如蛋白酶处理[10-12]及产蛋白酶微生物发酵[13],因其温和的工艺条件,近年来受到越来越多的关注。此外,生物学方法可得到天然分子量的几丁质,同时对环境友好。但是,目前,蛋白酶制剂相对较高的价格制约着酶法脱蛋白处理的应用,而采用产蛋白酶的微生物直接发酵蟹壳脱蛋白的报道也较少。
有鉴于此,本文使用响应面法,优化了一株枯草芽孢杆菌UMN-26在蟹壳粉培养基中发酵产蛋白酶的营养条件,旨在研发一种生产蛋白酶的廉价培养基。另一方面,发酵后的蟹壳粉已脱除部分或全部蛋白质,可为进一步提取较高品质的几丁质打下良好基础。
1 材料与方法
1.1 材料与试剂
蟹壳粉:新鲜蟹壳购于河北省黄骅市水产品加工市场,经清洗干燥粉碎,过120目筛后制得蟹壳粉,用于配制发酵培养基。
蔗糖、葡萄糖、乳糖、麦芽糖、酪蛋白、酪氨酸、碳酸钠、三氯乙酸(以上均为分析纯):国药集团药业股份有限公司;福林试剂(2 mol/L):Biotopped公司。
枯草芽孢杆菌(Bacillussubtilis)UMN-26:河北农业大学食品科技学院酶学实验室筛选并保存的菌种[14-15]。
斜面培养基:营养琼脂培养基,用于菌种短期保藏。
种子培养基:营养肉汤培养基,用于菌种活化。
蟹壳粉培养基:在300 mL三角瓶中加入一定量的蟹壳粉,补充或不补充碳源,加入蒸馏水60 mL配制成蟹壳粉培养基,调节初始pH 7.0。121℃灭菌15 min。用于发酵产酶。
1.2 仪器与设备
SP-756P型可见分光光度计:上海光谱仪器有限公司;PHS-3DW型pH计:合肥桥斯仪器设备有限公司;FA1004型电子天平:上海良平仪器仪表有限公司;HD-850型桌上式洁净工作台:苏州净化设备有限公司;SYQ-DSX-280A型不锈钢手提式压力蒸汽灭菌器:上海申安医疗器械厂;ZWY-2102C型双层恒温培养振荡器:上海智城分析仪器制造有限公司;GL-20G-Ⅱ型高速冷冻离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 发酵产酶条件
将枯草芽孢杆菌UMN-26从试管斜面接入营养肉汤培养基,200 r/min,37℃,12 h培养活化。然后以2%接种量接入60 mL蟹壳粉培养基(蟹壳粉浓度3%,初始pH至7.0),37℃,200 r/min,恒温振荡培养发酵5 d。发酵结束后,培养物12 000 r/min离心5 min,取上清液作为粗酶液,测定蛋白酶酶活力。
1.3.2 蛋白酶活力测定
依据福林法测定[16]。
取发酵液离心的上清液作为粗酶液,适当稀释后,取1.0 mL于10 mL具塞试管中(样品管2支,空白管1支),37℃水浴预热5min。然后样品管加入1.0 mL同样预热的1%酪蛋白溶液(0.1 mol/L,pH7.2的PBS配制),空白管则加2.0 mL的0.4 mol/L三氯乙酸,准确计时保温反应10 min后,样品管中迅速、准确地加入2.0mL三氯乙酸,空白管中则加1.0 mL酪蛋白溶液。取出试管静置10 min,再以9 000 r/min离心5 min。吸取上清液1.0 mL于试管中,依次加入5.0 mL的0.4 mol/L碳酸钠溶液,1.0 mL稀福林试剂,混匀,40℃水浴显色20 min。取出迅速冷却至室温。
蒸馏水代替上清液作试剂空白对照,调仪器零点。在波长680 nm下测定样品空白管和样品管的吸光度。样品管与样品空白管吸光度之差取平均值,通过线性回归方程计算酪氨酸浓度。
分别取不同浓度(0、20、40、60、80、100 μg/mL)的酪氨酸溶液1 mL,按照上述步骤测定吸光度,以酪氨酸浓度C为横坐标,吸光度A为纵坐标绘制标准曲线。本试验中的L-酪氨酸标准曲线如图1所示,线性回归方程为:A=0.009 8×C+0.012 4(R2=0.999 3)。
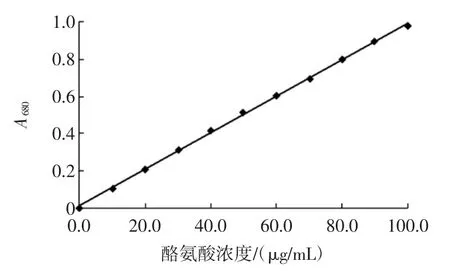
图1 L-酪氨酸标准曲线Fig.1 The standard curve of L-tyrosine
蛋白酶活力定义:在37℃,pH 7.2条件下,1 mL发酵液上清液在1 min内水解酪蛋白产生1 μg酪氨酸的蛋白酶量,定义为1个蛋白酶活力单位(U),单位为U/mL。
蛋白酶酶活力计算公式:从标准曲线计算出样品稀释液的酶活力,单位为U/mL。样品的酶活力按式(1)计算:
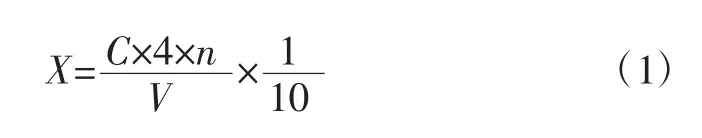
式中:X为样品酶活力,U/mL;C为由标准曲线得出的稀释液酶活力,U/mL;V为所取样品的体积,mL;4为反应试剂的总体积,mL;n为上清液的稀释倍数;10为反应时间10 min。
1.3.3 蟹壳粉蛋白质脱除率
采用凯氏定氮法[17]。
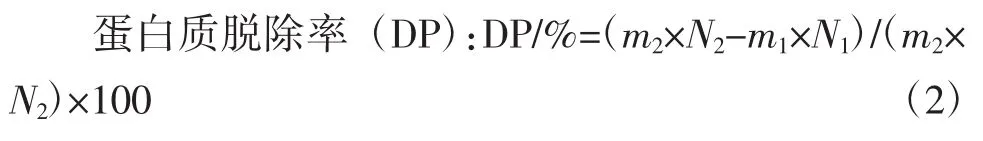
式中:m1为发酵后蟹壳回收质量,g;m2为发酵前蟹壳质量,g;N1为发酵后蟹壳含氮量,g;N2为发酵前蟹壳含氮量,g。
1.3.4 发酵产酶培养基单因素试验
1.3.4.1 蟹壳粉浓度对枯草芽孢杆菌产蛋白酶的影响
分别配制蟹壳粉浓度分别为1%、3%、5%、7%和9%的60 mL蟹壳粉培养基,调整初始pH 7.0,向其中接种2%活化菌液,于37℃、200 r/min条件下发酵5 d,研究蟹壳粉浓度对枯草芽孢杆菌产蛋白酶的影响。
1.3.4.2 碳源种类对枯草芽孢杆菌产蛋白酶的影响
于蟹壳粉浓度为5%的蟹壳粉培养基中,分别添加葡萄糖、蔗糖、麦芽糖和乳糖作为碳源补充(5%浓度),调整初始pH 7.0,向其中接种2%活化菌液,于37℃、200 r/min条件下发酵5 d,研究不同种类碳源对枯草芽孢杆菌产蛋白酶的影响。
1.3.4.3 补充蔗糖浓度对枯草芽孢杆菌产蛋白酶的影响
于蟹壳粉浓度为5%的蟹壳粉培养基中,分别补充浓度为 1%、3%、5%、7%、9%、11%和 13%的蔗糖,调整初始pH 7.0,向其中接种2%活化菌液,于37℃、200 r/min条件下发酵5 d,研究蔗糖浓度对枯草芽孢杆菌产蛋白酶的影响。
1.3.4.4 初始pH值对枯草芽孢杆菌产蛋白酶的影响
于蟹壳粉浓度为3%的蟹壳粉培养基(无其他碳源补充)中,调节初始 pH 值分别至 6.0、7.0、8.0,自然pH值(9.0)作为对照,向其中接种2%活化菌液,于37℃、200 r/min条件下发酵5 d,研究pH值对枯草芽孢杆菌产蛋白酶的影响。
1.3.5 发酵产酶培养基响应面法优化
根据响应面法(response surface methodology,RSM)中的 Box-Behnken Designs(BBD)原理设计和分析试验。在单因素试验基础上,确定试验自变量及较优水平,以蛋白酶酶活力为响应值设计、实施试验,得到二次方程模型,通过方差分析和模型预测,寻求最优的培养基条件。
1.3.6 培养条件的单因素试验
1.3.6.1 培养温度对枯草芽孢杆菌产蛋白酶的影响
在优化后的蟹壳粉培养基中以2%接种量接入枯草芽孢杆菌UMN-26,分别于32、37、42℃条件下,200 r/min振荡培养5 d。研究不同培养温度对枯草芽孢杆菌产蛋白酶的影响。
1.3.6.2 摇床转速对枯草芽孢杆菌产蛋白酶的影响
在优化后的蟹壳粉培养基中以2%接种量接入枯草芽孢杆菌UMN-26,分别设置转速为150、200、250 r/min,37℃振荡培养5 d。研究不同摇床转速对枯草芽孢杆菌产蛋白酶的影响。
1.3.6.3 培养时间对枯草芽孢杆菌产蛋白酶的影响
在优化后的蟹壳粉培养基中以2%接种量接入枯草芽孢杆菌UMN-26,于37℃,200 r/min条件下振荡培养 5 d。在培养期间,分别于 12、24、36、48、60、72、84、96、108、120 h 时取样,12 000 r/min 离心 5 min,取上清液测定蛋白酶活力。以发酵时间为横坐标,蛋白酶酶活力为纵坐标,绘制产蛋白酶曲线。
1.3.7 重复性
每个试验处理做两组平行,取平均值进行蛋白酶活力计算;每批试验做3次重复,以标准偏差估计试验误差。
2 结果与分析
2.1 发酵产酶培养基单因素试验
2.1.1 蟹壳粉浓度对枯草芽孢杆菌产蛋白酶的影响
蟹壳粉浓度对枯草芽孢杆菌产蛋白酶的影响见图2。
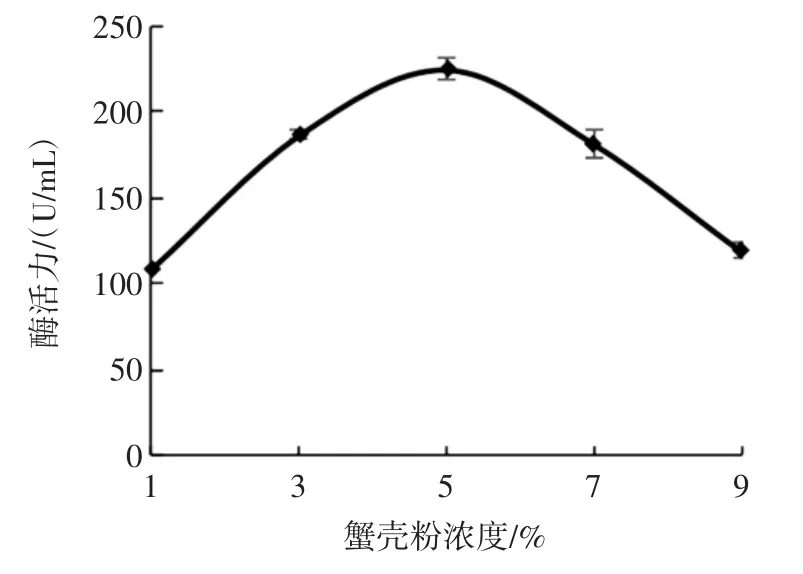
图2 蟹壳粉浓度对蛋白酶产生的影响Fig.2 The effect of crab shell powder concentration on proteinase production
由图2可知,在单纯的蟹壳粉培养基中,随着蟹壳粉浓度增高,UMN-26所产蛋白酶酶活力先增大后减小。当蟹壳粉浓度为5%时,发酵液的蛋白酶酶活力最高,为224.94 U/mL。这表明枯草芽孢杆菌UMN-26能利用蟹壳粉中的蛋白质、矿物质等营养成分生长产酶,并且不与蟹壳粉浓度始终呈正相关。原因可能是由于低浓度的蟹壳粉提供了枯草芽孢杆菌生长产酶的营养物质来源,且溶氧量适宜;但蟹壳粉浓度的增高,发酵液的溶氧量下降,菌体的生长繁殖受到抑制,甚至发生菌体自溶现象,最终导致产酶的下降[18]。
2.1.2 碳源种类对枯草芽孢杆菌产蛋白酶的影响
碳源种类对枯草芽孢杆菌产蛋白酶的影响见图3。
在图3中,补充各种受试碳源后的蟹壳粉培养基的产蛋白酶酶活力均高于纯蟹壳粉培养基中蛋白酶活力,表明蟹壳粉中天然的碳源种类(主要为几丁质)不适宜枯草芽孢杆菌生长产酶,需要补充新的碳源来促进UMN-26的生长产酶。图3还表明,补充蔗糖的蟹壳粉培养基中蛋白酶酶活力最高,达到848 U/mL。这与已报道的事实相符,即蔗糖是枯草芽孢杆菌的产酶最适碳源,原因可能是由于蔗糖对发酵液pH具有良好的缓冲作用[19]。

图3 碳源种类对蛋白酶产生的影响Fig.3 The effect of different carbon sources on proteinase production
2.1.3 蔗糖浓度对枯草芽孢杆菌产蛋白酶的影响
蔗糖浓度对枯草芽孢杆菌产蛋白酶的影响见图4。

图4 蔗糖浓度对蛋白酶产生的影响Fig.4 The effect of sucrose concentration on proteinase production
由图4可知,随着蟹壳粉培养基中补充的蔗糖浓度增高,UMN-26产蛋白酶酶活力开始时迅速增大,在蔗糖浓度达到7%以后,蛋白酶酶活力趋于稳定,蔗糖浓度增至13%后,蛋白酶活力反而呈降低趋势。其原因可能是一定浓度的蔗糖会促进UMN-26的生长和产酶,毕竟天然的蟹壳粉培养基中优良碳源较少,但是,蔗糖浓度达到一定程度时也会影响培养基的渗透压,高渗环境会抑制UMN-26的生命活动。
2.1.4 初始pH值对枯草芽孢杆菌产蛋白酶的影响
初始pH值对枯草芽孢杆菌产蛋白酶的影响见图5。
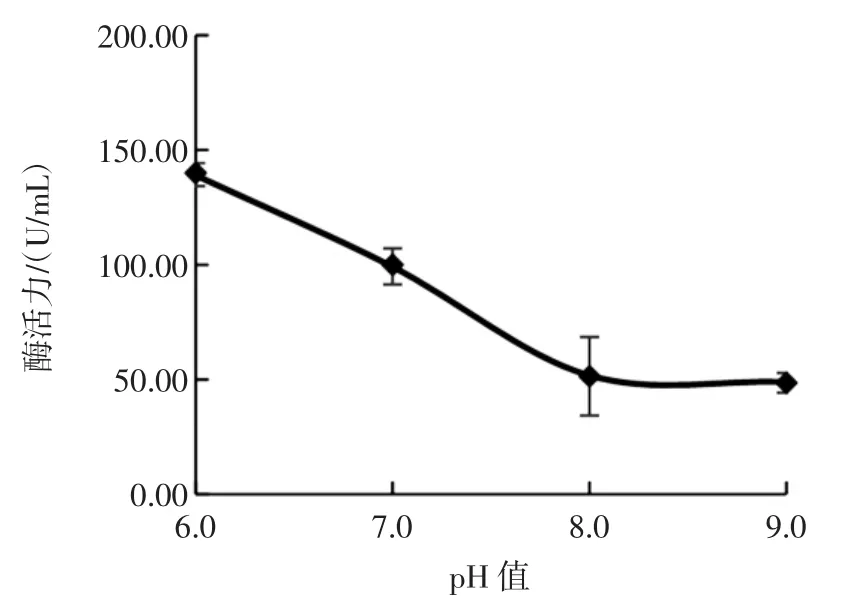
图5 初始pH值对蛋白酶产生的影响Fig.5 The effect of initial pH on proteinase production
培养基的pH值是影响微生物生长活动的一个重要理化指标。由图5可知,在蟹壳粉培养基的自然pH 9.0时,酶活力仅为48.62 U/mL,不适宜UMN-26的生长和产酶。随着初始pH值向酸性范围调整,蛋白酶酶活力随之增高。结合先前的研究[15],UMN-26所产蛋白酶,在pH 6~8的范围内酶活力最高,因此综合考虑,选择pH值7为较优水平。
2.2 发酵产酶培养基的响应面法优化
2.2.1 响应面试验设计结果
依据单因素试验结果,以蟹壳粉浓度A(%)、蔗糖浓度B(%)、初始pH值C为自变量,发酵液的蛋白酶酶活力Activity(U/mL)为响应值,应用Design-expert 7.1.6中的Box-Behnken原理设计试验,因素水平编码值见表1,响应面试验设计方案及结果如表2所示。

表1 因素水平编码表Table 1 Coded value of factor levels

表2 响应面法试验设计及结果Table 2 Project and results of the RSM experiment
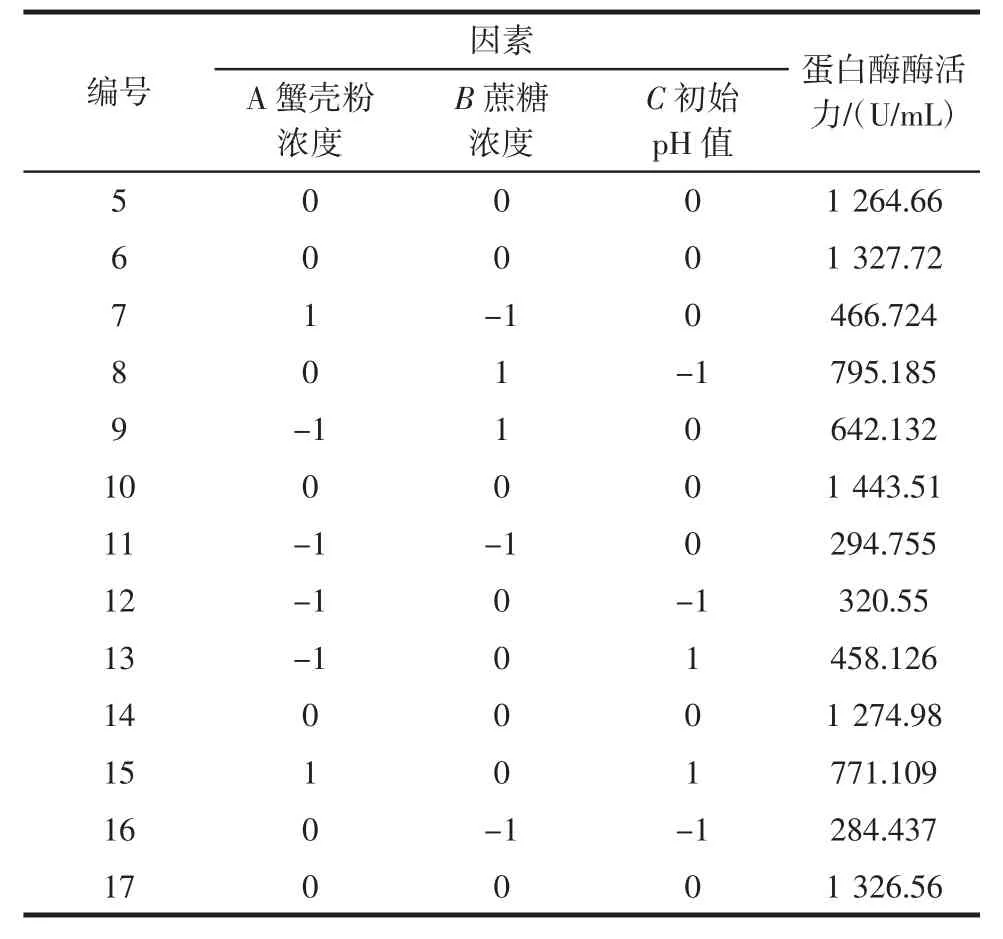
续表2 响应面法试验设计及结果Continue table 2 Project and results of the RSM experiment
由表2可知,试验共设计实施17个关键点,其中包括析因点12个,零点5个以估计试验误差。对以上17组试验数据进行二次多元回归拟合,建立Y为目标函数的多元二次回归方程(实际值),得到式(3)。
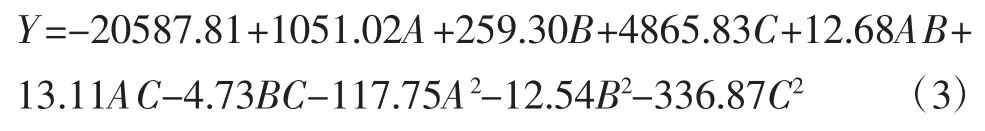
2.2.2 模型方差分析
利用BBD原理对多元二次回归方程模型式(3)进行方差分析,结果见表3。
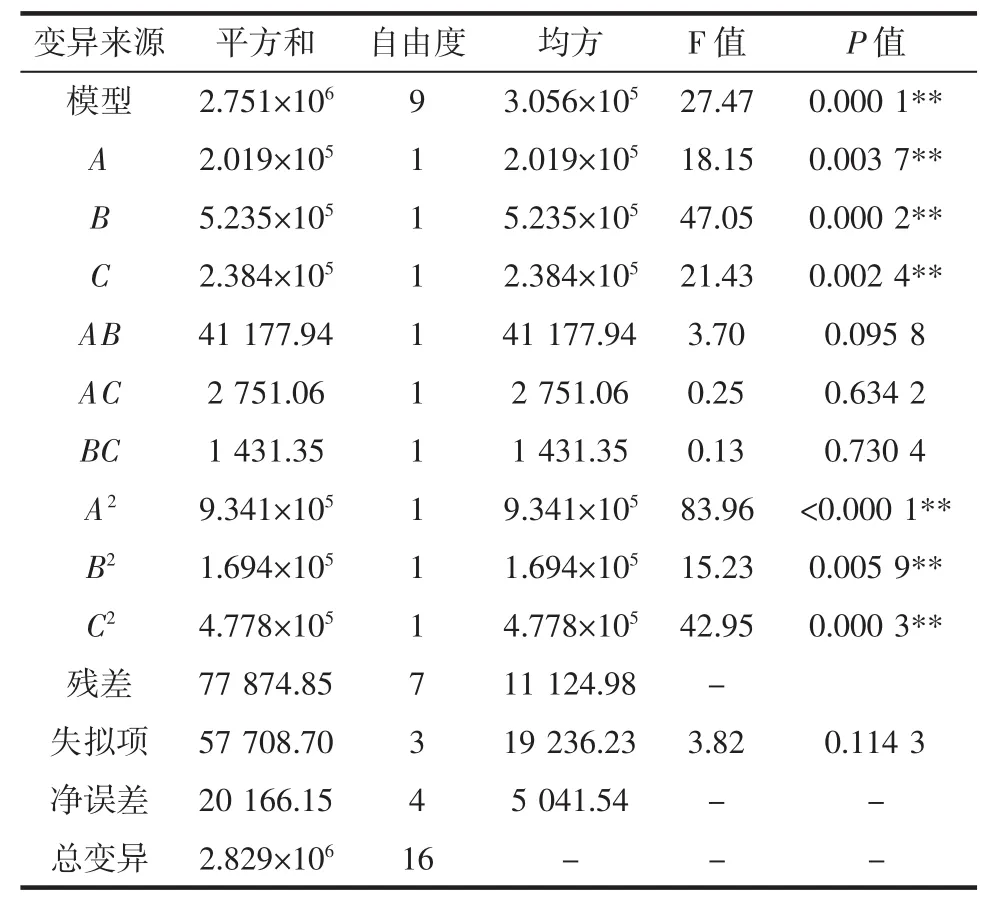
表3 响应面二次模型方差分析表Table 3 ANOVA for RS quadratic model
由表3方差分析可知,模型的F值为27.47(P=0.000 1<0.01)极显著,失拟项 F 值为 3.82(P=0.114 3>0.05)不显著。模型的预测决定系数R2=0.768 9,预测范围小,因此通过手动调节,去除交互项BC简化模型,以提高模型的拟合系数。简化后得到二次方程模型见式(4),其校正系数R2=0.943 9。表明简化后模型可用于最优值的预测。

简化后二次模型预测结果为蟹壳粉浓度为5.5%,蔗糖浓度11.81%,初始pH值为7.27,预测蛋白酶活力达到1 460.12 U/mL。根据实验室条件,该组合具备可操作性。因此在此条件下进行验证试验,测得蛋白酶酶活力为1 458.99 U/mL。
为直观表现各因素间的交互作用,简化模型中交互项AB和AC对响应值的交互影响以曲面图和等高线图来表示(见图6和图7)。
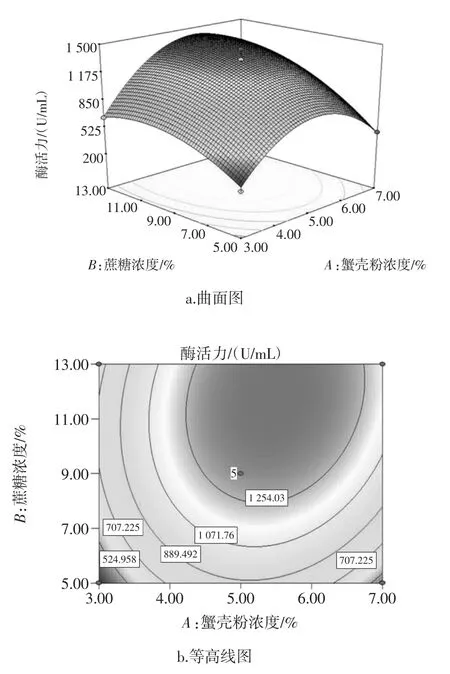
图6 交互项A和B对蛋白酶酶活力的影响Fig.6 The effect on proteinase activity of interaction term A and B
由图6a曲面图可以看出,随着蟹壳粉浓度增高,发酵液中的蛋白酶活力先增大后降低;随着蔗糖浓度增高,蛋白酶活力先增大后平缓下降,二者有一定的交互作用,但影响不显著;与等高线与边界线的交点越多表明主效应显著,由图6b等高线图可以看出,蟹壳粉浓度是主效应因子。
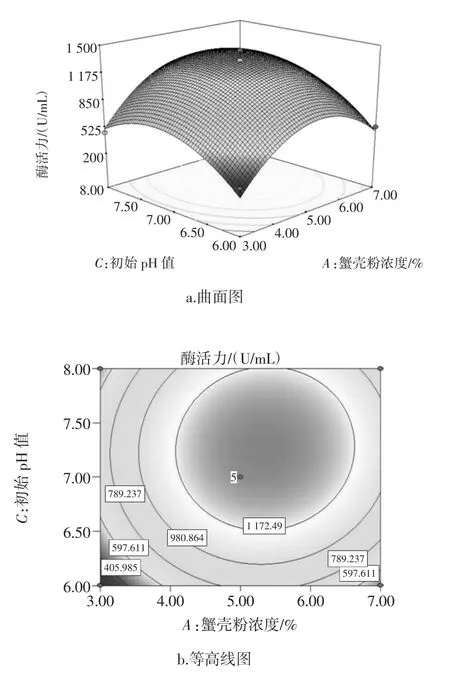
图7 交互项AC对蛋白酶酶活力的影响Fig.7 The effect on proteinase activity of interaction term A and C
由图7a曲面图可以看出,随着初始pH值增大,发酵液的蛋白酶活力先增大后降低;随着蔗糖浓度增大,蛋白酶活力先增大后降低,交互作用不显著;由图7b等高线图可知,蟹壳粉浓度对响应值蛋白酶活力比pH值的影响显著,是主效应因子。
2.3 发酵条件对枯草芽孢杆菌产蛋白酶的影响
2.3.1 温度对枯草芽孢杆菌产蛋白酶的影响
在优化后的培养基基础上,研究发酵条件对蛋白酶产生的影响,绘制温度与酶活力折线图8。
由图8可知,枯草芽孢杆菌UMN-26发酵蟹壳粉培养基,在37℃时蛋白酶酶活力最大。温度主要是影响菌体的生长:发酵温度低,枯草芽孢杆菌UMN-26的生长受到抑制,蛋白酶活力较低;温度越高,菌株衰老的速度也加快,酶活力降低[20]。
2.3.2 转速对枯草芽孢杆菌产蛋白酶的影响
在优化的蟹壳粉培养基基础上,研究不同转速对枯草芽孢杆菌UMN-26产蛋白酶的影响,得到图9。
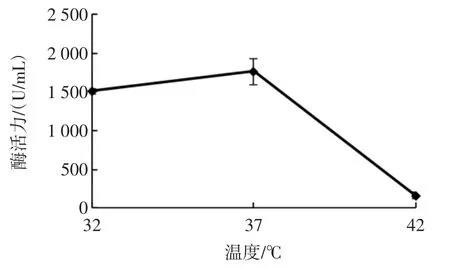
图8 发酵温度对蛋白酶产生的影响Fig.8 The effect of fermentation temperature on proteinase production
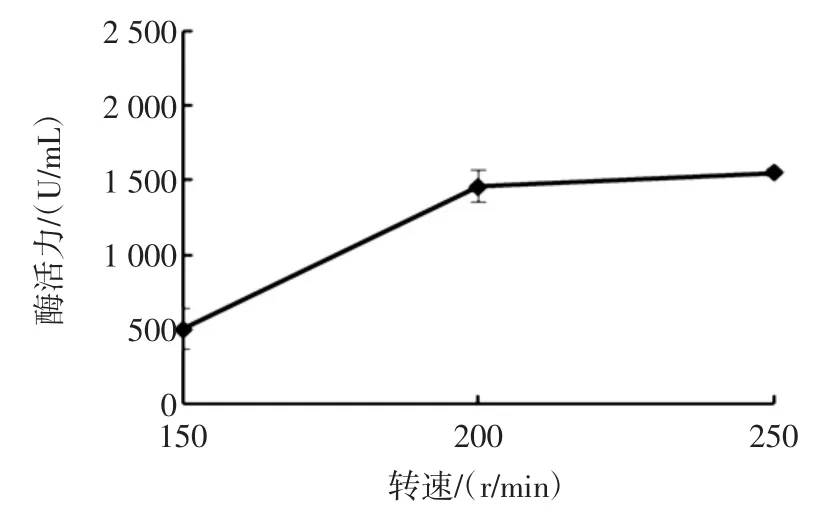
图9 转速对蛋白酶产生的影响Fig.9 The effect of rotational speed on proteinase production
摇床转速通过改变摇瓶的溶氧量而影响菌体生长和蛋白酶合成[21]。由图9可知,枯草芽孢杆菌UMN-26产蛋白酶酶活力在200 r/min后趋于稳定。枯草芽孢杆菌是好氧微生物,转速越高,溶氧量越高;但转速超过200 r/min,酶活力增加不大,原因可能是溶氧量已经满足菌体的需求量。因此确定转速为200 r/min。
2.3.3 枯草芽孢杆菌UMN-26产蛋白酶进程
对枯草芽孢杆菌在优化后的蟹壳粉培养基中的产蛋白酶情况进行分时段检测,每隔12 h测定蛋白酶活力,观测120 h,结果见图10。
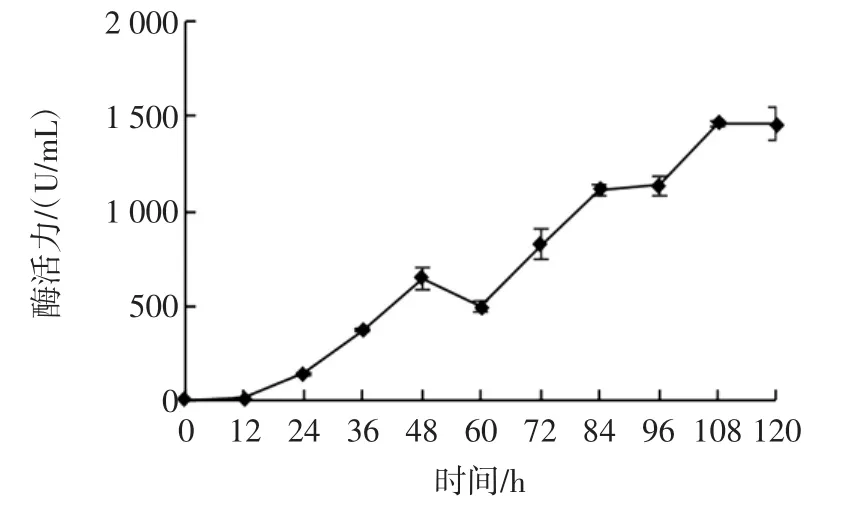
图10 优化后蟹壳粉培养基发酵产蛋白酶曲线Fig.10 The proteinase production curve of optimized crab shell powder medium
由图10可知,在优化后的蟹壳粉培养基中,蛋白酶活力随发酵时间延长而呈升高趋势,在108 h达到酶活力峰值1 465.86 U/mL,随后有所降低;发酵120 h后,蛋白酶酶活力为1 458.99 U/mL。表明优化后的蟹壳粉培养基为枯草芽孢杆菌UMN-26生长提供了适宜的营养条件,有利于产生蛋白酶。
2.4 蟹壳的蛋白质脱除效果
经过凯氏定氮法测定发酵前后蟹壳粉中的蛋白质含量,根据式(2)计算枯草芽孢杆菌发酵后蛋白质的脱除率DP为70.71%,表明枯草芽孢杆菌发酵蟹壳具有一定的蛋白质脱除效果。
3 结论与讨论
本文研制蟹壳粉培养基以培养枯草芽孢杆菌UMN-26产生蛋白酶,经响应面法优化后,得到蟹壳粉培养基的组成条件:蟹壳粉浓度5.5%,添加蔗糖浓度11.81%,初始pH 7.27。在此培养基中,优化发酵条件为:温度37℃,转速200 r/min,枯草芽孢杆菌在108 h产蛋白酶酶活力达到1 465.86 U/mL,是未优化的蟹壳粉培养基中酶活力(186.33 U/mL)的7.86倍。最终蛋白质脱除率为70.71%。这表明优化后的蟹壳粉培养基产蛋白酶活力大大提高,对蟹壳的蛋白质脱除有一定效果,优化方案有效。
蟹壳是蟹产品加工中的废弃物,蔗糖是来源充足且普遍的碳源之一,其成本相比牛肉膏、蛋白胨等原料成本低,因此本试验得到的将是一种价格低廉,绿色环保的产蛋白酶的蟹壳粉培养基。
此外,在以产蛋白酶的微生物发酵虾蟹壳脱除蛋白质的研究中,采用的菌种主要有粘质沙雷氏菌(Serratia marcescens)[22-23],铜绿假单胞菌(Pseudomonas Aeruginosa)[24-25],芽孢杆菌(Bacillus)[26-27],紫红曲霉菌(Monascus purpureus)[28]等,发酵周期 3 d~7 d,在发酵后蛋白酶活力较高的培养基中,虾蟹壳蛋白质的脱除效率能达到80%以上。Oh Y等研究了铜绿假单胞菌K-187高产蛋白酶的优化培养基,最高蛋白酶活力高达 21.2 U/mL,是优化前(2.2 U/mL)的 10倍[29]。LIU 等在不补充葡萄糖的虾头培养基中,接种10%枯草芽孢杆菌B.21886,于180 r/min,30℃培养96 h,发现24 h时达到产酶高峰(229.7±10.0)U/mL,而在补充2.5%的葡萄糖时,培养基产蛋白酶量达到700 U/mL,表明优化前后对蛋白酶产生量有较大影响[30]。而本文的研究结果也证实了这一点。更进一步,OLFA等研究用响应面法对短小芽孢杆菌A1发酵虾壳提取几丁质的进行条件了优化,发酵6 d后脱除了94%蛋白质[28]。由此可见,使用产蛋白酶的微生物发酵蟹壳粉来脱除其中的蛋白质,是一种富有潜力的绿色生物技术。使用本研究中的枯草芽孢杆菌UMN-26脱除蟹壳粉中的蛋白质,还需要进一步对发酵的环境条件进一步优化,以提高蛋白质的脱除率,并对发酵液中的蟹壳粉残渣进行详细的成分分析。
[1]Kurita K.Chitin and chitosan:functional biopolymers from marine crustaceans[J].Mar Biotechnol(NY),2006,8(3):203-226
[2]胡溪育.壳聚糖对水果保鲜作用的研究进展[J].黑龙江科学,2014(6):133-134
[3]欧丽娟.壳聚糖基活性包装膜的制备及其对牛肉的保鲜效果研究[D].上海:上海海洋大学,2015
[4]周锐丽,陈轶.甲壳素、壳聚糖的保健功能及应用展望[J].中国食物与营养,2013(11):65-69
[5]Toan N V,Ng C,Aye K N,et al.Production of high-quality chitin and chitosan from preconditioned shrimp shells[J].Journal of Chemical Technology&Biotechnology,2006,81(7):1113-1118
[6]刘培.南美白对虾虾头的微生物法综合利用技术[D].青岛:中国海洋大学,2014
[7]伍军,毛宏辉.从麻辣小龙虾虾壳中提取甲壳素的研究[J].粮油加工,2008(10):128-130
[8]王红.南美白对虾加工废弃物制备壳聚糖关键技术研究[D].保定:河北农业大学,2015
[9]时杰,刘平怀,刘洋洋,等.海南产虾蟹壳制取甲壳素的工艺研究[J].海南师范大学学报(自然科学版),2010(3):295-299
[10]Younes I,Hajji S,Frachet V,et al.Chitin extraction from shrimp shell using enzymatic treatment.Antitumor,antioxidant and antimicrobial activities of chitosan[J].Int J Biol Macromol,2014,69:489-498
[11]Younes I,Ghorbel-Bellaaj O,Nasri R,et al.Chitin and chitosan preparation from shrimp shells using optimized enzymatic deproteinization[J].Process Biochemistry,2012,47(12):2032-2039
[12]Younes I,Hajji S,Rinaudo M,et al.Optimization of proteins and minerals removal from shrimp shells to produce highly acetylated chitin[J].Int J Biol Macromol,2016,84:246-253
[13]Duan S,Li L,Zhuang Z,et al.Improved production of chitin from shrimp waste by fermentation with epiphytic lactic acid bacteria[J].Carbohydr Polym,2012,89(4):1283-1288
[14]刘东旺.芽孢杆菌N19中性蛋白酶发酵条件及其酶学性质研究[D].保定:河北农业大学,2008
[15]马宏颖.中性蛋白酶高产菌株的诱变选育及发酵条件研究[D].保定:河北农业大学,2008
[16]中华人民共和国国家质量监督检验检疫总局.GB/T 23527-2009蛋白酶制剂[S].北京:中国标准出版社,2009
[17]中华人民共和国卫生部.GB 5009.5-2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010
[18]王凤舞,段书娟,仝令君,等.产低温碱性蛋白酶菌株QD-1的鉴定及产酶条件和酶学性质[J].中国食品学报,2017(2):85-91
[19]Phadatare S U,Deshpande V V,Srinivasan M C.High activity alkaline protease from Conidiobolus coronatus(NCL 86.8.20):Enzyme production and compatibility with commercial detergents[J].Enzyme&Microbial Technology,1993,15(1):72-76
[20]曾诚,马毛毛,肖彦骏,等.解淀粉芽孢杆菌Z16的产酶条件优化及应用[J].食品工业科技,2016(3):196-200
[21]李洪康,李由然,李赢,等.枯草芽孢杆菌产中性蛋白酶发酵条件优化[J].食品与发酵工业,2016(5):102-107
[22]Zhang H,Fang J,Deng Y,et al.Optimized production of Serratia marcescens B742 mutants for preparing chitin from shrimp shells powders[J].InternationalJournalofBiologicalMacromolecules,2014,69:319-328
[23]Jo G H,Jung W J,Kuk J H,et al.Screening of protease-producing Serratia marcescens FS-3 and its application to deproteinization of crab shell waste for chitin extraction[J].Carbohydrate Polymers,2008,74(3):504-508
[24]Yen Y,Li P,Wang C,et al.An antifungal protease produced by Pseudomonas aeruginosa M-1001 with shrimp and crab shell powder as a carbon source[J].Enzyme and Microbial Technology,2006,39(2):311-317
[25]Ghorbel-Bellaaj O,Hmidet N,Jellouli K,et al.Shrimp waste fermentation with Pseudomonas aeruginosa A2:Optimization of chitin extraction conditions through Plackett-Burman and response surface methodology approaches[J].International Journal of Biological Macromolecules,2011,48(4):596-602
[26]Maruthiah T,Somanath B,Immanuel G,et al.Deproteinization potential and antioxidant property of haloalkalophilic organic solvent tolerant protease from marine Bacillus sp.APCMST-RS3 using marine shell wastes[J].Biotechnology Reports,2015,8:124-132
[27]Ghorbel-Bellaaj O,Younes I,Maalej H,et al.Chitin extraction from shrimp shell waste using Bacillus bacteria[J].International Journal of Biological Macromolecules,2012,51(5):1196-1201
[28]Ghorbel-Bellaaj O,Hajji S,Younes I,et al.Optimization of chitin extraction from shrimp waste with Bacillus pumilus A1 using response surface methodology[J].International Journal of Biological Macromolecules,2013,61:243-250
[29]Oh Y,Shih I,Tzeng Y,et al.Protease produced by Pseudomonas aeruginosa K-187 and its application in the deproteinization of shrimp and crab shell wastes[J].Enzyme and Microbial Technology,2000,27(1/2):3-10
[30]Liu P,Liu S,Guo N,et al.Cofermentation of Bacillus licheniformis and Gluconobacter oxydans for chitin extraction from shrimp waste[J].Biochemical Engineering Journal,2014,91:10-15
Research on Fermentation of Crab Powder for Proteinase Production by Bacillus subtilis
LIU Yang-liu,WEI Dong-dong,LIU Yan,GUO Run-fang,YU Hong-wei,SUN Ji-lu*
(College of Food Science and Technology,Hebei Agricultural University,Baoding 071001,Hebei,China)
The optimal cultural conditions for protease production by Bacillus subtilis UMN-26 with the crab shell powder as the main composition of culture medium was studied,which may lay the foundation for deproteinization of crab cells with microbiological fermentation method.Single factor tests and response surface methodology were adopted to optimize the fermentation conditions of the crab shell powder culture medium,with the proteinase activity of the fermentation supernatant as an index.The results showed that the optimized conditions were:crab shell powder concentration was 5.5%,sucrose concentration was 11.81%and initial pH 7.27.And optimized fermentation conditions were:cultural temperature was 37℃,rotational speed was 200 r/min and time was 108 h.The protease enzyme activity of fermentation supernatant reached 1 465.86 U/mL,7.86 times than the former,and the rate of deproteinization was 70.71%.
Bacillussubtilis;proteinase;crabpowder;responsesurfacemethodology;deproteinizationefficiency
10.3969/j.issn.1005-6521.2017.24.035
河北省科学技术厅项目(15273204D)
刘杨柳(1992—),女(汉),硕士研究生,研究方向:食品工程。
*通信作者:孙纪录(1972—),男,教授,博士。
2017-05-11
