实时荧光PCR法在鱼翅鉴别中的应用
2017-12-13方军林晨张志军王李平熊娟陈敏儿
方军,林晨,张志军,王李平,熊娟,陈敏儿
(中国广州分析测试中心,广东省化学危害应急检测技术重点实验室,广东广州510070)
实时荧光PCR法在鱼翅鉴别中的应用
方军,林晨,张志军,王李平,熊娟,陈敏儿
(中国广州分析测试中心,广东省化学危害应急检测技术重点实验室,广东广州510070)
为有效鉴别市售鱼翅的真伪,针对鱼翅中鲨鱼源性成分的线粒体基因组的部分序列,利用实时荧光聚合酶链式反应(Polymerase Chain Reaction,PCR)技术,通过特异性引物和探针的设计建立起一种有效的真伪鉴别方法。该方法中对样品脱氧核糖核酸(Deoxyribonucleic acid,DNA)的提取方法、DNA检测的浓度灵敏度、质量灵敏度以及方法的特异性进行研究。结果表明鱼翅样品用试剂盒进行提取效果良好,其检测的DNA浓度灵敏度可达1×10-5ng/μL,质量灵敏度可达0.01%。利用该方法对市场上的购买的47份鱼翅类样品和18份非鱼翅样品进行了检测,43样品检测出鲨鱼成分,包括4份仿鱼翅在内的22份未检出鲨鱼成分。
鱼翅;实时荧光PCR;灵敏度;特异性;鉴别
鱼翅,又称鲛鲨翅、鲨鱼翅,是一种由软骨鱼系鲨鱼或犁头鳐经加工而制作的产品,主要以鳍中的软骨(又称翅筋)供食,主要包括背鳍、胸鳍、尾鳍、腹鳍等。鱼翅制作工艺复杂,包括去沙、漂白、脱皮和去骨等多种工序。由于原料数量有限[1],且鱼翅富含胶原蛋白[2],价格昂贵,尤其是在东南亚市场,属高端消费品。随着人们生活水平的不断提高,对鱼翅的消费需求量越来越大。由于我国相关法规的不完善,许多不法分子趁虚而入,选用明胶、海藻酸钠为主要原料,研制出仿真鱼翅,其在外观和口感上和真鱼翅类似,很难辨认。近年来,市场上出现大量的仿真鱼翅[3],扰乱市场秩序,极大的损害消费者的权益。
为辨别鱼翅的真伪,保障消费者的权益,研究人员已开发出多种鉴别鱼翅真伪的方法[4-11],如郭云霞等[5]建立利用感官技术和普通PCR技术鉴别真伪的方法,林婉玲等[6]用热胀冷缩的方法鉴别真伪,冼燕萍等[7]用扫描电镜鉴别真伪,韩婉清等[8]发展红外光谱鉴别鱼翅真伪的技术。PCR作为检测遗传信息载体DNA的一种新方法,具有操作简单、特异性好、灵敏度高的特性,广泛用于物种鉴定和生物体的真伪鉴别[9-24],国内也有大量文献报道利用PCR技术鉴别鲨鱼源性成分的方法[12-15],如覃芳芳等[12]、郭云霞等[13]使用普通PCR技术鉴别鲨鱼源性成分,建立相应的行业标准。实时荧光PCR技术作为一种在常规PCR基础上发展起来的新的技术,实时荧光PCR技术全程采用的是闭管式检测,不需PCR后处理,克服普通PCR假阳性问题和交叉污染,灵敏度高,特异性强,无需电泳,简单快速[10],郭云霞等[14]建立SYBR Green荧光PCR技术鉴别鲨鱼源性成分的方法。王德莲等[16]利用实时荧光PCR技术成功地鉴别了鱼翅制品中的鲨鱼源性成分。但是荧光染色PCR法由于产生的非特异性产物较多,容易导致高背景和假阳性,使其应用受到了一定程度的限制。
细胞中的线粒体基因特异性较强,具有潜在靶基因的优势[11,17]。本研究根据鲨鱼纲在细胞色素氧化酶序列,设计出特异性引物和探针,建立了实时荧光PCR技术鉴别鱼翅真伪的新方法,试验结果优于文献[15]的报道。
1 材料与方法
1.1 材料与试剂
市售47份鱼翅样品,包括29份鱼翅干制品(明翅)、8份未加工的干鱼翅(生翅),4份泡发鱼翅,2份冻干鱼翅(明翅),4份仿鱼翅类样品:广州市海味干果行业商会;鳕鱼、石斑鱼、鱿鱼、秋刀鱼、带鱼、金鲳鱼、黄鱼、平菇、花生、海带、玉米、冬瓜、土豆、红薯、黄豆、鸡、鸭、罗非鱼:市售。DNA提取试剂盒:广州迪澳生物科技有限公司;鱼翅引物(COI-F、COI-R):生工生物工程(上海)有限公司;TaqMan探针:Invitrogen公司;PCR预混合溶液(PCR-mix):天根生化科技有限公司。
1.2 仪器与设备
7500荧光定量PCR仪:美国Applied Biosystems公司;PICO17高速台式离心机:美国Thermo Fisher Scientific公司。
选取细胞色素氧化酶COI基因为鱼翅的特异基因,利用Vector NTI软件对查到的各序列进行比对,比对结果表明COI基因具有一定的保守性,并通过软件Primer Express 3.0.1设计特异引物及探针。引物和探针序列如表1所示。

表1 鱼翅引物及探针Table 1 Primers and probes for shark fins
1.3 方法
1.3.1 样品制备
鱼翅干制品、未加工的干鱼翅和冻干鱼翅用锉刀磨碎成粉状后备用,泡发鱼翅烘干后用粉碎机制成粉状后备用,罗非鱼肉样品烘干后研磨成粉末。取粉末状鱼翅样品按一定质量分数比添加到粉末状的罗非鱼样品中,混合均匀,用于质量灵敏度的测定。
1.3.2 DNA提取
分别称取约0.01 g样品,利用迪澳公司的动物组织的基因组提取试剂盒或者植物组织的基因组提取试剂盒进行样品DNA的提取,作为DNA扩增的模板。
1.3.3 PCR扩增
经试验确定的实时荧光PCR反应体为:12.5 μL的 PCR-Mix,引物 COI-F/R 各 1 μL,Probe 0.5 μL,无菌水 5 μL,5 μL DNA。
2 结果与分析
2.1 DNA提取方案的确定
称取不同质量的鱼翅样品,利用迪澳公司的动物组织的基因组提取试剂盒进行样品DNA的提取,使用核酸定量分析仪测定其质量,检测结果显示,DNA浓度为358 ng/μL,OD260/OD280比值为1.8。表明本试验所用DNA试剂盒能够提取到足够量的DNA,满足后续检测的要求。以提取的DNA作为阳性模板,ddH2O作为阴性对照,以COI-F/R作为引物,加入相应的探针,进行PCR扩增。参照ABI7500荧光PCR仪使用说明书,设置反应程序为:Holding Stage为95℃5 min,1个循环;Cycling Stage为95℃ 20 s,60℃ 1 min,40个循环,并收集荧光信号,结果图1所示。
从图 1可以看出,0.01、0.02、0.005 g鱼翅样品的扩增曲线的Ct值分别在27、28、29,均为有效扩增。0.01 g样品量时扩增效果最好,因此取0.01 g样品作为本试验的取样量。
2.2 浓度灵敏度试验
将鱼翅 DNA 分别稀释至 1、10-1、10-2、10-3、10-4、10-5ng/μL几个梯度,每个稀释度分别取5 μL进行PCR实验,以ddH2O代替DNA模板作为阴性对照,以COI-F/R作为引物,加入相应的探针,进行PCR扩增,并收集荧光信号,以确定该检测方法对鱼翅检测的浓度灵敏度,结果如图2所示。
从图2中可以看出,将鱼翅DNA稀释至不同浓度梯度进行扩增后,出峰时间和浓度梯度呈明显梯度变化,1×10-5ng/μL的鱼翅在Ct值为35时出现阳性扩增,其DNA检测的浓度灵敏度可达1×10-5ng/μL。与王德莲[15]相比,检测DNA灵敏度更高,是其1000倍左右。
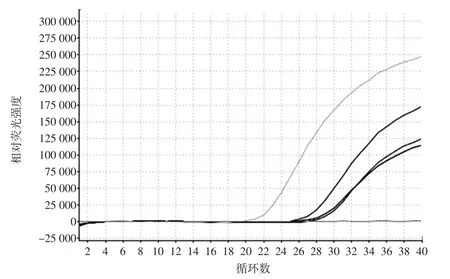
图1 不同提取方案得到的扩增曲线Fig.1 Amplification curves from different extraction method
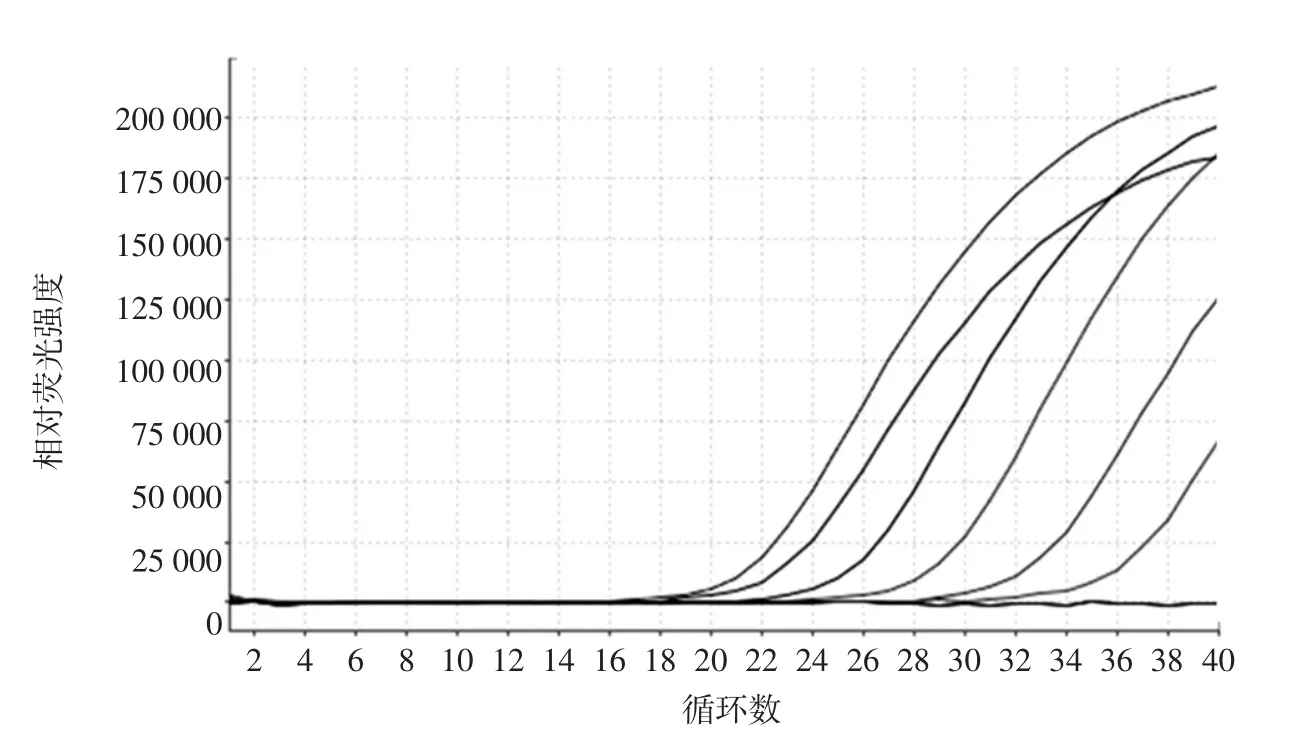
图2 DNA浓度灵敏度试验Fig.2 Sensitivity of different DNA concentration
2.3 质量灵敏度试验
将粉碎后的鱼翅样品与粉碎后的罗非鱼肉样品混合,使其质量分数分别为0.01、0.1、1、10%的几个梯度,加入相应的探针,进行PCR扩增,并收集荧光信号,以确定该检测方法对鱼翅检测的灵敏度,结果如图3所示。
从图3中可以看出,将鱼翅DNA稀释至不同的质量分数,COI-F/R作为引物进行PCR扩增,出峰时间和质量分数呈明显梯度变化,含0.01%(m/m)鱼翅的混合样品在Ct值为33时出现有效扩增,因此该方法能检测出样本中0.01%的鲨鱼源性成分。与王德莲[15]相比,检测的质量灵敏度也大幅度提高,是其10倍左右。
2.4 特异性试验
分别选取1个明翅、1个生翅、1个泡发鱼翅、1个冻干鱼翅、1个仿鱼翅以及18个非鱼翅样品,进行PCR扩增,结果如图4。
从图4可以看出,COI-F/R引物只在鲨鱼源性样品(包含明翅、生翅、冻干鱼翅、泡发鱼翅)中有扩增,在仿翅样品中未发生扩增,与文献[3]的报道的仿鱼翅主要为明胶、海藻酸钠,不含鲨鱼成分的调查结果相吻合。在其余18个非鱼翅样品(包括合鳕鱼、石斑鱼、鱿鱼、秋刀鱼、带鱼、金鲳鱼、黄鱼、平菇、花生、海带、玉米、冬瓜、土豆、红薯、黄豆、鸡、鸭和罗非鱼)中也未发生扩增,说明该检测方法的特异性良好,可用于鲨鱼源性样品的检测。
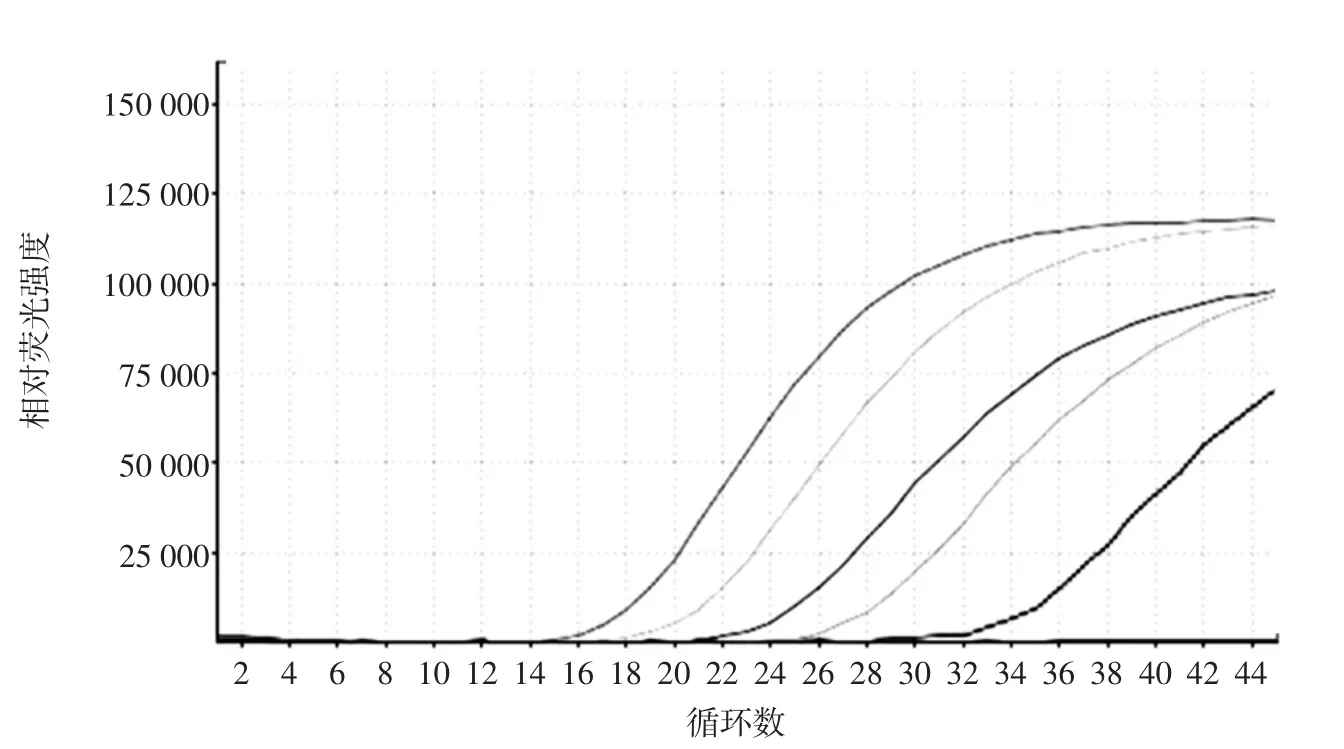
图3 质量灵敏度Fig.3 Sensitivity of different weight concentration

图4 鲨鱼源性成分检测的特异性试验Fig.4 Specific detection of shark-origin components
2.5 实际样品检测
利用本试验建立的方法对采集到的市售47份各种鱼翅样品进行检测,包括仿鱼翅、明翅、生翅、泡发鱼翅和冻干鱼翅,结果如图5所示。
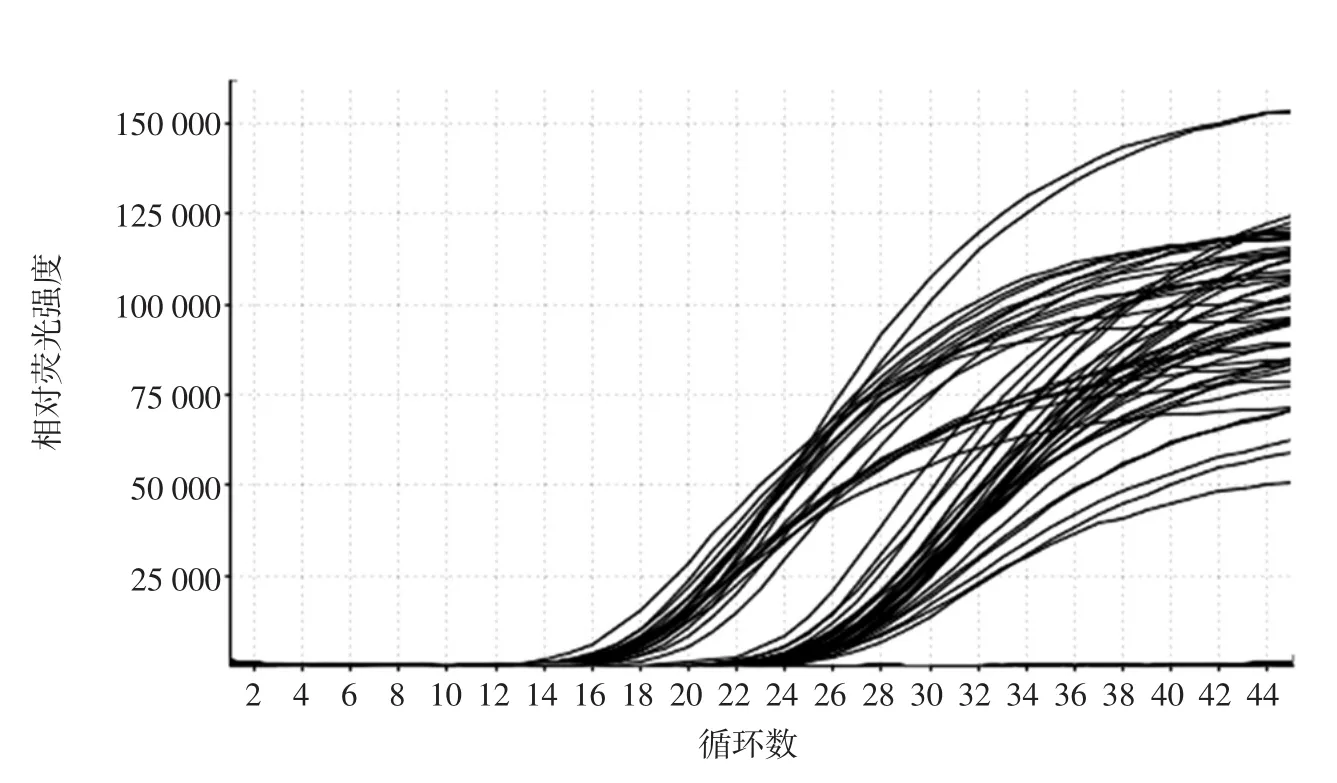
图5 实际样品检测的DNA扩增谱图Fig.5 Amplification curves of shark fins
从图5可以看出,COI-F/R引物在4份仿鱼翅样品中未出现扩增,在其余43个鱼翅样品中均出现有效扩增,说明该43个样品中含有鲨鱼源性成分,上述43份鱼翅均为销售方声称的真鱼翅样品,说明目前广州海味市场销售的鱼翅中均含有鲨鱼成分。
3 结论
本研究通过设计特征的引物和探针,建立实时荧光PCR法鉴别鱼翅真伪的方法。通过相关试验表明,该方法DNA浓度灵敏度可达1×10-5ng/μL,质量灵敏度可达0.01%,检出限可达0.1%。与王德莲等[15]采用的实时荧光PCR方法相比,浓度灵敏度提高3个数量级,质量灵敏度提高1个数量级,且具有较高的物种特异性。通过对市场上销售的鱼翅样本及非鱼翅类的动植物样本进行检测,43份真鱼翅样本中均检出鲨鱼源性成分,而22份非鲨鱼源性鱼翅样本中均未检出鲨鱼源性成分,显示出该方法具有良好的特异性和通用性,为鉴别市售鱼翅的真伪提供了一种可靠的技术手段。
[1]肖乐,郝向举.鱼翅消费的是与非[J].中国水产,2013(7):21-25
[2]徐凤香,高昕,李昭勇,等.鱼翅营养成分提取与定性分析[J].食品工业科技,2007,28(1):225-227
[3]张莉.“假鱼翅”后有“真问题”[J].中国食品,2013(5):17-19
[4]LUO Dong-hui,HAO Dong,XIAN Yan-ping.Stable Isotope Ratios Combined with Fourier Transform Infrared Spectroscopy and Scanning Electron Microscope Analysis to Identify the Dried Shark Fins[J].Food Anal.Methods,2016(9):2400-2405
[5]郭云霞,冒海琳,张舒亚,等.鱼翅的分类及鉴别方法[J].食品工业,2011(6):96-99
[6]林婉玲,杨少玲,杨贤庆,等.天然鱼翅与仿生鱼翅快速鉴别方法的建立[J].现代食品科技,2015,31(10):287-294
[7]冼燕萍,董浩,罗海英,等.扫描电镜法快速鉴别鱼翅干制品品质[J].食品科技,2015,40(2):343-347
[8]韩婉清,罗海英,冼燕萍,等.鱼翅干制品品质的ATR-FTIR鉴别研究[J].光谱学与光谱分析,2015,35(2):379-383
[9]DANILLO P,OTTO BF G,ADRIANE P W,et al.Discrimination of shark species by simple PCR of 5S rDNA repeats[J].Genetics and Molecular Biology,2008,31(1):361-365
[10]FAJARDO V,GONZA I,ROJAS L,et.al.A review of current PCR-based methodologies for the authentication of meats from game animal species[J].Trends Food Sci Technol,2010,21(8):408-421
[11]郭凤柳,熊蕊,刘晓慧,等.应用PCR技术检测掺假肉类[J].食品安全质量检测学报,2014,5(2):541-545
[12]覃芳芳,王德莲,冼燕萍,等.鱼翅类食品中鲨鱼成分PCR鉴定方法研究[J].现代食品科技,2014,30(4):274-278
[13]郭云霞,包建强,张舒亚,等.食品中鲨鱼源性成分真实性PCR鉴别研究[J].食品工业科技,2011,32(10):421-424
[14]郭云霞,张舒亚,谌鸿超,等.SYBR Green实时荧光PCR检测食品中鲨鱼源性成分真实性方法的建立[J].食品与生物技术学报,2012,31(12):1300-1306
[15]王德莲,刘冬虹,许丽珠,等.鱼翅制品中鲨鱼源性成分的实时荧光PCR检测方法[J].现代食品科技,2015,31(4):289-293
[16]王敏,刘荭,黄海,赵晓萌,等.DNA条形码技术在深圳鱼肉制品鉴定中的应用[J].食品科学,2015,36(20):247-251
[17]王庆华.现代分析技术在鉴别伪劣食品中的应用[J].食品研究与开发,2002,23(2):67-68
[18]FABBRICE T.Molecular identification methods of fish species:reassessment and possible applications[J].Rev Fish Biol.Fisheries,2009(19):265-293
[19]RASUMSSEN R,MORRISSEY M.DNA-Based Methods for the I-dentification of Commercial Fish and Seafood Species[J].Compr Rev Food Sci Food Saf,2008(7):280-295
[20]ASENSIO L.PCR-based methods for fish and fishery products authentication[J].Trends Food Sci Technol,2007,18(11):558-566
[21]Wen Jing,ZENG Ling,Sun Yu-lin,et al.authentication and traceability of fish maw products from the market using DNA sequencing[J].Food Control,2015(55):185-189
[22]李向丽,刘垚,谭贵良,等.基于LAMP法快速检测羊肉及其制品中的猪、鸭和羊源性成分[J].中国食品卫生杂志,2015,27(3):247-252
[23]冼钰茵,易敏英,高东微,等.环介导等温扩增技术快速检测肉及肉制品中的牛源性成分[J].食品工业科技,2016,37(7):278-282
[24]陈颖,王晶,吴亚君,等.动物明胶中3种DNA提取方法的比较研究[J].食品与发酵工业,2006,32(4):42-45
Identification of Shark Fins with Real-Time PCR Method
FANG Jun,LIN Chen,ZHANG Zhi-jun,WANG Li-ping,XIONG Juan,CHEN Min-er
(China National Analytical Center,Guangzhou,Guangdong Provincial Key Laboratory of Emergency Test for Dangerous Chemicals,Guangzhou 510070,Guangdong,China)
A novel effective method for identification of shark fins available in market was established by Real time Polymerase Chain Reaction(PCR)technique.Specific primers and probes were designed from a portion mitochondria genome of shark fin.Extraction method of Deoxyribonucleic acid(DNA),sensitivity of DNA concentration,sensitivity of DNA weight and specificity were investigated.It was indicated that enough concentration of DNA for detection would be obtained by kit extraction method.DNA concentration sensitivity of 1×10-5ng/μL and DNA weight sensitivity of 0.01%were abtained.47 shark fin products and 18 non-shark fin products available in market were determined with the above PCR method.DNA of shark was be found in 43 products while DNA of shark was not be found in other 22 products including 4 man-made shark fin products.
shark fin;real-time PCR;sensitivity;specificity;identification
10.3969/j.issn.1005-6521.2017.24.026
广东省省级科技计划项目(2013B020501005、2015B090906023)
方军(1975—),男(汉),高级实验师,硕士,研究方向:食品检测与质量控制。
2017-04-02
