吕梁黑山羊的体细胞克隆
2017-12-13吴苏君罗惠娣毛杨毅贺东昌周胜花李春艳郭慧慧薛丽娜党文庆
李 希,王 曦,吴苏君,罗惠娣,毛杨毅,贺东昌,周胜花,李春艳,张 丽,郭慧慧,薛丽娜,党文庆
吕梁黑山羊的体细胞克隆
李 希,王 曦,吴苏君,罗惠娣,毛杨毅,贺东昌,周胜花,李春艳,张 丽,郭慧慧,薛丽娜,党文庆
(山西省农业科学院畜牧兽医研究所,山西太原030032)
研究旨在尝试利用体细胞克隆技术进行地方优良品种吕梁黑山羊的克隆保种。剪取吕梁黑山羊耳缘组织,通过组织块培养法获得了吕梁黑山羊皮肤成纤维细胞,使用第6代的皮肤成纤维细胞作为供体细胞进行核移植,将重构胚胎通过手术移植到受体辽宁白绒山羊母羊体内,结果成功获得了2只体细胞克隆黑山羊,生长发育状况良好,且与供体黑山羊一致,表明体细胞克隆技术是可行的。这是山西省首例吕梁黑山羊克隆个体,它的成功为优良地方品种改良、保种等研究提供了有效可行的方法,为下一步进行吕梁黑山羊的转基因育种研究奠定了技术基础。
吕梁黑山羊;克隆;保种;核移植
吕梁黑山羊是山西省地方优良品种之一,主要产于山西西部黄土高原山区一带,具有遗传性稳定、适应性好、抗病力强、耐粗饲、易抓膘、肉质鲜嫩等特点,是山西省乃至全国珍贵的畜种资源,有很高的经济生物种用价值。但由于近年来对地方品种重视不够,无序化杂交,使得其经济实用价值受到严重影响,品种资源保护也受到严重威胁。调查研究发现,吕梁黑山羊的数量不仅以惊人的速度锐减,而且已处于濒危或灭绝的边缘,如何更高效地保护吕梁黑山羊这一地方优良品种已经刻不容缓[1]。
传统的保种方法是建立活畜保种场,但是,活畜保种方法不仅成本费用高,而且能够保存的品种以及个体数量有限。体细胞克隆技术的成功为珍稀濒危物种保种提供了另一条有效途径。体细胞克隆技术是将供体细胞通过显微操作的方法注射到去核的卵母细胞中构建重组胚,经胚胎移植给受体产生存活后代的方法。由于体细胞的保存方法成熟且效率高,结合克隆技术,能够实现动物在短时间内重现。克隆技术在动物种质资源保护中具有独特的优势,是动物活体保种的最有力辅助手段[2-3]。
本试验拟通过对吕梁黑山羊耳成纤维细胞培养及其克隆研究,探讨保种的可行性,旨在为今后山西省濒危动物保护和畜禽品种改良研究提供有效可行的方法。
1 材料和方法
1.1 试验材料
吕梁黑山羊的耳缘组织采自山西省农业科学院畜牧兽医研究所克隆基地试验羊场;受体羊为健康无病,特别是无生殖系统疾病、且有良好繁殖记录的经产辽宁白绒山羊。
DMEM和TCM-199购自Gibco公司;胎牛血清FBS购自Hyclone公司;FSH,PG购自宁波市三生药业有限公司;CIDR购自新西兰Inter Ag公司;维生素ADE注射液购自陕西西乡长江动物药品公司;胰蛋白酶,NaHCO3,HEPES,DPBS,二甲基亚砜(DMSO),Hoechst33342,离子霉素,6-DMAP等均购自Sigma公司,青、链霉素为国产。细胞培养皿及胚胎培养4孔板购自NUNC公司。
1.2 试验方法
1.2.1 吕梁黑山羊耳缘成纤维细胞系的建立 用镊子夹住双面刀片除净黑山羊耳毛,依次用碘酒、75%酒精消毒干净,拿采样钳剪取靠近耳尖的皮肤组织块(1 cm2),在有青霉素和链霉素的DPBS中洗3遍,放入含有青霉素和链霉素的DMEM中,封口膜封口,4 h内带回实验室。在超净工作台中将组织块彻底除净毛发,放入75%的酒精中浸泡30 s,用DPBS漂洗3遍,在有培养液的培养皿中用消毒的眼科剪剔除掉结缔组织,并把耳组织剪成约1 mm2的小块,接种到60 mm培养皿的底部,使组织块均匀分布且有一定间距,倒置培养于37℃,5%CO2,饱和湿度的培养箱中6~8 h,待组织块贴壁后,沿皿壁加入含有15%FBS的DMEM培养液4 mL,使培养液慢慢浸没组织块,培养5~7 d观察组织块周围有无细胞爬出,待细胞生长至80%汇合时,进行传代培养或冷冻保存。
1.2.2 成纤维细胞的纯化 依据上皮样细胞和成纤维细胞对胰蛋白酶的敏感性不同(成纤维细胞对胰蛋白酶敏感,脱壁快,而上皮样细胞则不敏感,脱壁慢;其次,接种以后成纤维细胞也比上皮样细胞贴壁快,大多数细胞能在0.5~1.0 h内贴壁,而上皮细胞短时间内不能贴壁)经过2~3次传代分离即可获得纯化的成纤维细胞。
1.2.3 成熟卵母细胞的采集
1.2.3.1 供体母羊的处理 采用同期发情与超数排卵相结合的方法,在发情周期的任意一天将阴道栓CIDR放入供体母羊阴道,放入CIDR第1天记为0 d,同时肌肉注射维生素ADE 5 mL,于第14天开始采用递减法注射超数排卵药物FSH,连续3 d,每天7:00和19:00分别等量注射一次(表1),并在最后一次注射FSH的同时肌肉注射氯前列烯醇PG 1 mL(0.1 mg),同时撤栓;撤栓24 h后利用公羊试情。超排供体一般在最后一次注射FSH后24~48 h内发情。

表1 FSH的注射量 mL
1.2.3.2 卵母细胞的采集 手术前空腹24 h,将供体羊四肢固定并呈前低后高仰卧于手术保定架上,臀部肌注0.5 mL鹿眠新麻醉,剪毛并刮净毛茬,常规消毒处理,盖上手术创巾,在乳房下2~4 cm处沿腹中线打开腹腔,找到卵巢,观察记录卵巢上的卵泡数及黄体发育情况,然后在宫管结合部的子宫侧插入冲卵套管针,注入37℃冲卵液,将卵母细胞从输卵管伞部冲出,收集于离心管中。然后换另一侧子宫角和输卵管,方法同前。收集的离心管立即带回实验室在体视显微镜下检查卵子情况,挑选出形态完整、胞质均匀并排出第一极体的卵母细胞作为体细胞核移植的受体细胞。
1.2.4 体细胞核移植 将供体细胞和成熟的卵母细胞同时转移到显微操作液滴中,操作液为添加20 mmol/LHepes的TCM199+10%FBS。然后在倒置显微镜(Olympus)下用固定针吸住卵母细胞,去核针去核,选择大小合适光滑的单个成纤维细胞,注入到去核卵母细胞的卵周隙。操作30~40个卵后,将重构卵转移到TCM199培养液中,在38.5℃,5%CO2,饱和湿度培养箱中恢复0.5~1.0 h,然后检测重构卵完整性并进行激活操作。
1.2.5 重组胚的融合激活 将恢复好的完整的重构胚胎分批转移到融合液中平衡3~5 min,然后每批5个放入电极宽度为1mm的已经铺满融合液的电融合槽(BTX ECM2001电融合仪)中,用自制拨卵针调节,使供体细胞与卵母细胞相接触的界面与电极平行,然后由ECM2001细胞融合仪施加2个直流脉冲,2.0 kV/cm,25μs,间隔 1 s。电击之后将经过电融合的重构胚转入TCM199中培养0.5 h后,显微镜下观察其融合情况。融合好的胚胎转移到含5μmol/L离子霉素的TCM199培养液中激活5 min,然后转移到含2 mmol/L 6-二甲基氨基嘌呤(6-DMAP)的TCM199培养液中,在38.5℃,5%CO2及饱和湿度的培养箱中培养4 h。最后转入TCM199培养液中培养。
1.2.6 胚胎移植和妊娠检测 重构胚完成融合激活后,立即进行胚胎移植。挑选形态和发育较好的重构胚,采用外科手术法移入同步发情的受体辽宁绒山羊母羊输卵管中。同前,母羊在手术前24 h内禁食禁水,手术前刮毛,并保定于手术架上。同样在腹中线距乳房约4 cm处开口,接着将子宫角和输卵管拉出,观察记录卵巢上的黄体发育情况。挑选黄体较多的一侧进行移植,用带有1 mL注射器的移植针从输卵管伞部进针,细心地将含有重构胚胎的液体缓缓注入,然后慢慢拔出移植针。每只受体移植12枚左右胚胎。胚胎移植后45~60 d可进行超声波妊娠检测,对怀孕的母羊调整饲养管理,直至克隆羊出生。
2 结果与分析
2.1 吕梁黑山羊耳缘皮肤成纤维细胞系的建立
通过组织块贴壁培养法成功制备出了吕梁黑山羊的耳缘皮肤成纤维细胞。组织块经过5~6 d的培养即可观察到细胞从组织块边缘向外迁出,10 d左右能清楚看到沿组织块周围生长出来的成纤维细胞。从形态来看,细胞主要呈梭形、长条状、多角形或不规则形,且细胞之间有较大间隙,排列疏松,当细胞长到铺满皿底时,呈放射状或漩涡状分布。一般细胞生长到70%~80%汇合时,就立即将其进行消化传代或液氮冻存。吕梁黑山羊的原代及传代成纤维细胞如图1所示。

2.2 克隆胚胎的构建
本研究首先采集卵母细胞292枚,通过体外成熟164枚,构建体细胞核移植胚胎68枚,融合率为41.46%。在此基础上,利用相同方法对295枚体内成熟卵母细胞进行去核,得到295枚去核卵母细胞。经核移植与电融合操作获得重组胚146枚,融合率为49.49%。卵母细胞及克隆胚胎生产情况列于表2。体内成熟的卵细胞如图2所示,核移植的注核过程如图3所示。
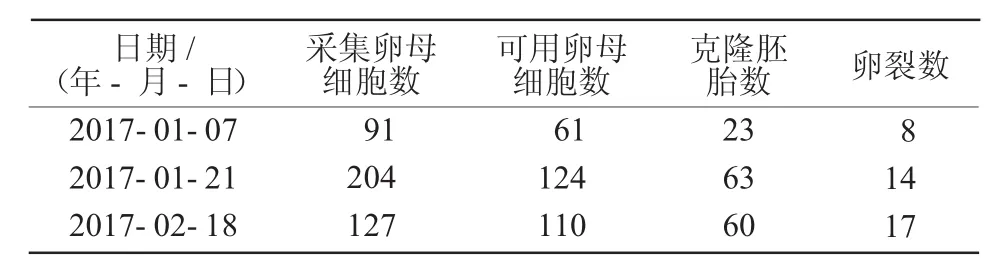
表2 克隆胚胎生产与发育


2.3 克隆胚胎的移植
挑选身体状况与同期发情良好的受体母羊12只,通过手术移植的方法,将重构胚胎移植到12只母羊体内,移植情况列于表3。
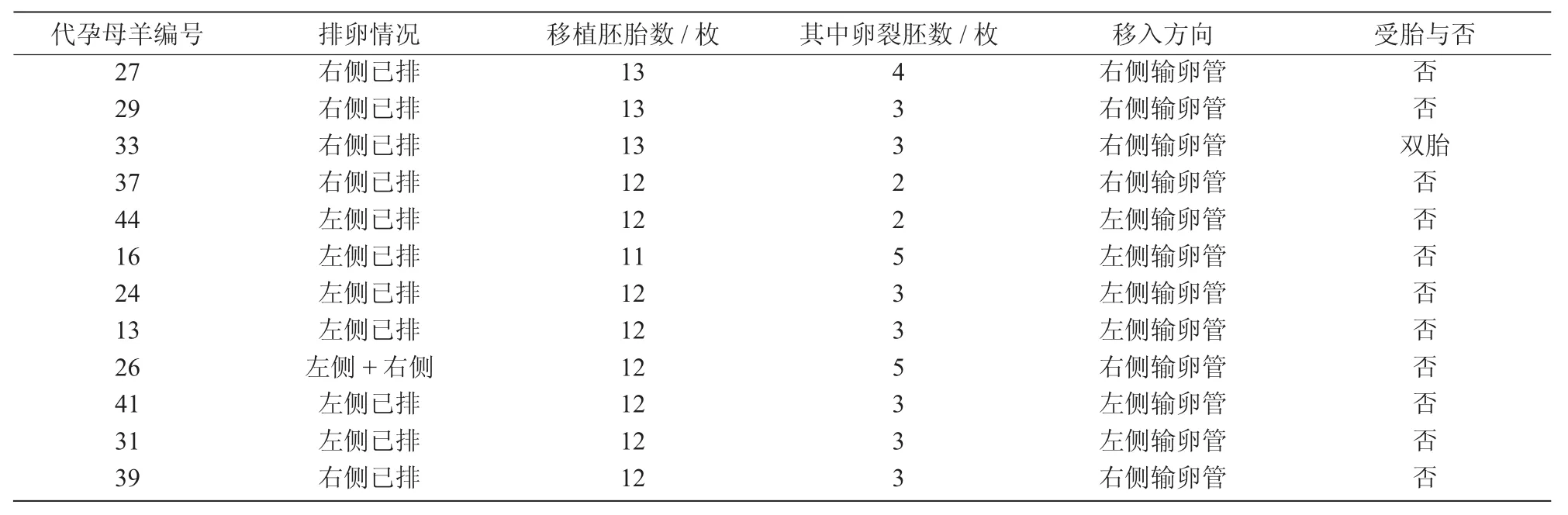
表3 吕梁黑山羊克隆胚胎移植情况
移植后60 d对这些受体进行B超检查,确认妊娠1只,共移植母羊12只,受胎1只,受胎率为8.33%(1/12)。于2017年6月24日足月产下2只健康胎儿,出生体质量分别为2.7,3.7 kg;其克隆羊都是雌性,毛色为黑色,与代孕母羊的毛色不同(图4)。

目前,2只克隆羊生长发育状况良好。从本研究克隆的情况来看,吕梁黑山羊的克隆可能还存在一定问题,虽然我们成功获得了吕梁黑山羊克隆个体,但胚胎移植的受胎率较低,生产出的克隆羊数也少,说明我们的技术还存在不完善的地方,还有待改进。
3 讨论
体细胞克隆技术已经成为畜禽遗传资源保护的一种有效方法。克隆技术是指将供体细胞转移到去核的第2次减数分裂中期卵母细胞中,经过融合、激活、体外培养、胚胎移植等一系列手段生产出与供体细胞遗传信息完全一致的新个体的一项技术[4-6]。通过建立动物体细胞系、结合体细胞克隆技术,是保护物种最为理想的方法之一,比常规活体保种的方法更为经济、有效[7]。另外,通过核移植和基因导入技术还可以为家畜育种开辟新途径[8]。本研究成功生产出2只吕梁黑山羊体细胞克隆羊,获得了山西省首例吕梁黑山羊克隆个体,说明通过体细胞克隆技术来实现吕梁黑山羊保种是可行的,同时可为下一步进行畜禽品种保护和改良育种研究奠定技术基础。
电融合是生产克隆动物的关键步骤,直接影响着重组胚的后续发育[9]。电融合是一个复杂的生理物理学变化过程,其原理是在紧密接触的卵母细胞膜与供体细胞膜上利用电场电击形成微孔,借助Ca2+离子在胞质内的流动而融为一体[10]。当体细胞被注入去核卵母细胞卵周隙后,必须经过细胞融合,才能最终成为一个完整的细胞继续发育。在克隆技术中,融合率越高,后续可用胚胎数就越多,克隆效率也越高。本研究融合率只有49.49%,这一结果反映了体细胞核移植技术尚有不完善之处。可能与核移植和重构胚融合间隔时间的延长有直接关系,还有待进一步验证。据STON等[11-13]报道,融合与激活步骤的间隔时间的延长不仅会影响早期克隆胚胎的卵裂率和囊胚率,而且对妊娠率也有较显著的影响[14]。此外,供体细胞的形态大小也影响体细胞核移植的融合率[15-16]。因此,筛选生长状态好的供体细胞是提高胚胎融合率的关键。
由于克隆胚胎生成的复杂性,移植时必须保证受体动物生殖周期与克隆胚发育阶段同步[17],否则会对胚胎造成不利的影响,直接影响受胎率。因此,使胚胎保持在相对同步的环境是移植成功的关键,但在实际操作中很难做到完全同步。用发育程度较低的重构胚移植到受体动物体内环境,能得到较好的妊娠率[18],本试验中所移植的吕梁黑山羊胚胎为构建后1~2细胞期的胚胎;受体是试情后36 h左右的绒山羊,在胚胎移植时所选受体母羊均已经发生排卵且卵巢大小正常。共移植受体12只,受胎率为8.33%(1/12),未出现流产、畸形、死胎等问题,说明体内成熟的卵母细胞质量远远优于体外成熟的卵母细胞。移植胚胎的数目以及发育状况对受体母羊的妊娠率也有显著影响[19]。此外,克隆胚胎的质量、胚胎移植的操作技术、受体母羊的激素水平、营养状况及生理状况等因素都会影响妊娠率[20]。
以往克隆技术的研究大多通过改变供体细胞的类型、改善培养体系和融合激活条件等来提高克隆效率[21-22],本研究结果显示,克隆胚胎移植后受体的妊娠率和后代存活率也会影响克隆效率的高低。因此,应该进一步探索如何提高克隆羊的受胎率、存活率及受体移植同步性等问题。
[1]梁茂文,毛杨毅,韩一超,等.吕梁黑山羊特色产业发展思考[J].山西农业科学,2017,45(8):1369-1371.
[2]张德福,戴建军,吴彩凤,等.应用生物技术保存地方猪种种质资源研究[J].生物技术通报,2008(S1):117-120.
[3]张德福,吴彩凤,戴建军,等.梅山猪耳成纤维细胞体外培养及其克隆[J].中国兽医学报,2014,34(7):1188-1204.
[4]李瑞哲,孙永刚,马志杰,等.牛体细胞核移植中的异常重编程及提高核移植效率的措施[J].家畜生态学报,2016,37(1):1-4.
[5]刘海军,郑梓,王儒,等.山羊体外成熟卵母细胞去核时间及方法对去核效率的影响[J].华北农学报,2011,26(2):90-93.
[6] STEINBORN R,SCHINOGL P,WELLSD N,et al.Coexistence of Bos taurus and B.indicus mitochondrial DNAs in nuclear transfer-derived somatic cattleclones[J].Genetics,2002,162:823-829.
[7] MCCREATH K J,HOWCROFT J,CAMPBELL K H S,et al.Production of gene-targeted sheep by nuclear transfer fromcultured somatic cells[J].Nature,2000,405:1066-1069.
[8]朱化彬,程金华,孙秀柱.鲁西黄牛体细胞克隆保种技术的研究[J].畜牧兽医学报,2006,37(12):1287-1292.
[9]KATOY.Eight calvescloned fromsomatic cellsof asingleaboult[J].Science,1998,282:1095.
[10]郭延华,王立民,唐红,等.绵羊体细胞核移植融合效率影响因素的研究[J].新疆农业科学,2014,51(1):136-142.
[11]STON K I A,LI G,HICKSB A,et al.Effect of the time inter-val between fusion and activation on nuclear state and development in vitro and in vivo of bovine somatic cell nuclear transfer embryos[J].Reproduction,2006,131(1):45-51.
[12] LIU J,LI L L,DU S,et al.Effects of interval between fusion and activation cytochalasin B treatment and number of transferred embryos on cloning efficiency in goats[J].Theriogenology,2011,76(6):1076-1083.
[13]KIMS,PARK SW,HOSSEINMS,et al.Production of cloned dogs by decreasingtheinterval between fusion and activation duringsomatic cell nuclear transfer[J].Molecular Reproduction and Development,2009,76(5):483-489.
[14]MIYOSHIK,RZUCIDLOSJ.Improvementsin cloningefficiencies may be possible by increasing uniformity in recipient oocytes and donor cells[J].Biol Reprod,2003,68:1079-1086.
[15]ROBLJM,STICESL.Prospectsfor thecommercial cloningof animalsby nuclear transplantation[J].Theriogenology,1989,31(1):75-84.
[16]刘海军,刘灵,刘玉堂,等.受体卵母细胞来源和供体细胞类型对山羊体细胞核移植融合率的影响 [J].华北农学报,2008,23(1):41-44.
[17]屈雷,雷安民,闫海龙.陕北白绒山羊种公羊的体细胞克隆[J].西北农林科技大学学报(自然科学版),2012,40(9):29-34.
[18] BERG D K,LI C,ASHER G,et al.Red deer cloned from antler stem cells and their differentiated progeny[J].Biol Reprod,2007,77(3):384-394.
[19]沈爱民.克隆动物食品的未来 [M].北京:中国科学技术出版社,2015.
[20]覃广胜,陈明棠,杨春艳,等.影响水牛体细胞克隆胚胎移植的因素[J].中国兽医学报,2011,31(4):594-597.
[21]WILMUTI,BEAUJCANN,DESOUSA PA,et al.Somatic cell nuclear transfer[J].Nature,2002,419(10):583-587.
[22]WILMUTI,SCHNIEKEA E.Viableoff spring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
Somatic Cell Cloning of Lüliang Black Goats
LIXi,WANGXi,WUSujun,LUOHuidi,MAOYangyi,HEDongchang,ZHOUShenghua,LIChunyan,ZHANGLi,GUOHuihui,XUELina,DANGWenqing
(Instituteof Animal Husbandry and Veterinary,Shanxi Academy of Agricultural Sciences,Taiyuan 030032,China)
The objective of this study was to clone Lüliang black goat using the SCNT (somatic cell nuclear transfer)technology and to protect local variety.A piece of ear tissue was collected from Lüliang black goat and cultured to get skin fibroblast cells.The reconstructed embryos were produced by nuclear transfer usingthe G6 generation of Lüliang black goat ear firbroblast cellsas donors and Liaoning whitecashmere goat ooctyes as receptors,and we successfully cloned two lüliang black lambs on June 24,2017 which were consistent with the donor.The result indicated that Lüliang black goat was successfully cloned by SCNT technology.This study obtains the first cloned offspring of Lüliang black goat,which will provide a effective feasible method for breeding,and lay a foundation for next step that producetransgenetic goatsby somatic nuclear transfer.
Lüliangblack goat;clone;breed conservation;somatic cell nuclear transfer
S827
A
1002-2481(2017)12-2001-05
10.3969/j.issn.1002-2481.2017.12.25
2017-08-17
山西省农业科学院科技自主创新能力提升工程项目(2017ZZCX-02)
李 希(1982-),女,山西交城人,助理研究员,硕士,主要从事动物细胞胚胎工程及克隆研究工作。
