替诺福韦与替比夫定阻断乙型肝炎病毒母婴传播效果比较
2017-12-12周佩钟晓祝廖慧华何建军陈春晖
周佩,钟晓祝,廖慧华,何建军,陈春晖
(南方医科大学珠江医院,广州510282)
替诺福韦与替比夫定阻断乙型肝炎病毒母婴传播效果比较
周佩,钟晓祝,廖慧华,何建军,陈春晖
(南方医科大学珠江医院,广州510282)
目的比较替诺福韦(TDF)和替比夫定(LdT)阻断乙型肝炎病毒(HBV)母婴传播的效果和安全性。方法选取42例HBeAg阳性、HBV DNA>106IU/mL的孕妇,将其分为TDF组17例和LdT组25例,自妊娠中晚期服药至分娩。检测各组治疗前和分娩前HBV DNA、ALT水平,观察药物不良反应、婴儿生长发育情况以及母婴传播阻断效果。结果两组婴儿7月龄检测HBsAg均为阴性,乙肝母婴传播阻断率均为100%。除LdT组1例婴儿出现先天腭裂,其余婴儿生长发育指标均正常。TDF组和LdT组孕妇治疗后HBV DNA水平均较治疗前降低(P均<0.05),经等效性检验,两组治疗后HBV DNA水平具有等效性(P<0.05)。产前ALT水平较基线水平下降(P均<0.05),两组ALT复常率比较差异无统计学意义(P>0.05)。两组孕妇均未出现不良反应。结论TDF和LdT均能降低乙肝孕妇产前HBV DNA水平,阻断乙肝母婴传播效果良好,且较为安全。
乙型肝炎病毒;妊娠;替诺福韦;替比夫定;母婴传播
我国属于乙型肝炎病毒(HBV)感染高流行地区,母婴传播是HBV重要的传播方式。若未采取任何预防措施,HBeAg阳性、高病毒载量的孕妇所生新生儿HBV感染率高达80%~90%[1]。即使通过乙肝疫苗和乙肝免疫球蛋白联合预防,也仍有8%~15%预防接种无效,发生乙肝母婴传播[2~4]。研究显示,高病毒载量的孕妇服用核苷(酸)类似物能够降低母体HBV DNA载量,显著降低母婴传播发生率[5~7]。目前用于治疗乙肝的核苷(酸)类似物很多,但仅有替诺福韦(TDF)和替比夫定(LdT)属于妊娠B级药物,可用于乙肝孕妇的治疗[8,9]。由于TDF在我国上市时间短,在中国乙肝孕妇中的研究数据尚不多,关于TDF和LdT抗病毒疗效是否有差异也少有报道。本研究对乙肝孕妇应用TDF和LdT治疗进行回顾性分析,为阻断HBV母婴传播提供更准确和可靠的临床依据。
1 资料与方法
1.1 临床资料 选取2015年7月~2016年7月在本院随访分娩的慢性乙肝病毒感染孕妇42例,均符合《慢性乙型肝炎防治指南》[10]中的诊断标准。根据患者选用的抗病毒药物分成TDF组和LdT组,TDF组17例,年龄(29.8±4.5)岁,初始用药孕周(26.2±3.8)周,药物暴露时间(10.7±4.5)周;LdT组25例,年龄(28.9±4.3)岁,初始用药孕周(25.9±4.0)周,药物暴露时间(10.1±4.1)周。纳入标准:①HBeAg阳性,HBV DNA>1×106IU/mL;②治疗前无乙肝抗病毒治疗史;③自愿接受抗病毒治疗;④按时随访,完成相关检查项目。排除标准:①合并其他病毒感染,如HAV、HCV、HIV感染;②合并其他肝病,如自身免疫性肝病、酒精性肝病等;③合并心血管、泌尿系等其他系统慢性疾病。两组年龄、初始用药孕周、药物暴露时间具有可比性。本研究通过医院伦理委员会审查,入选孕妇均签署知情同意书。
1.2 治疗方法 TDF组给予TDF(葛兰素史克)300 mg/次口服,LdT组给予LdT(诺华制药有限公司)600 mg/次口服,1次/d,均从妊娠中晚期开始服药至分娩。婴儿出生24 h内注射乙肝免疫球蛋白100 IU,并于出生24 h内、1月龄及7月龄时分别接种乙肝疫苗10 μg。
1.3 观察指标及检测方法 ①血清HBV DNA检测:于治疗前、治疗后(分娩前)抽取孕妇外周血4 mL,取血清用Light Cycler扩增仪Taqman荧光PCR检测HBV DNA,试剂盒购自瑞士罗氏制药公司,检测下限为500 IU/mL。②血清ALT检测:于治疗前、治疗后(分娩前)抽取孕妇外周血4 mL,取血清用Aeroset生化分析仪(中山标佳生物有限公司)、速率法检测ALT水平,正常值参考范围4~40 U/L。③母婴传播阻断效果:婴儿在7月龄时抽取外周血4 mL,取血清用酶联免疫吸附法检测乙肝标志物,HBsAg阴性为阻断成功。④婴儿生长发育情况:观察婴儿出生时Apgar评分、体质量、身长、出生缺陷等。⑤不良反应:观察孕期服用抗病毒药物的不良反应,如胃肠道反应、肌酸激酶升高、肾功能损害等。
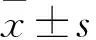
2 结果
2.1 两组治疗前后血清HBV DNA水平比较 治疗前两组血清HBV DNA水平比较差异无统计学意义(P>0.05),治疗后两组产前HBV DNA均较治疗前降低(P均<0.05),组间比较差异无统计学意义(P>0.05)。进一步行等价检验,两组治疗后HBV DNA水平具有等效性(P<0.05)。见表1。
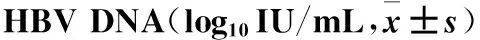
表1 两组治疗前后
2.2 两组治疗前后血清ALT水平比较 治疗前TDF组ALT水平中位数为20(11.0~83.0)U/L,LdT组为35(12.0~76.0)U/L,两组治疗前ALT比较差异无统计学意义(P>0.05);治疗后TDF组ALT水平中位数为16(10.5~21.0)U/L,LdT组为18(10.0~24.5)U/L,两组产前ALT较治疗前均下降(P均<0.05)。TDF组治疗前6例ALT异常,治疗后0例异常,ALT复常率为100%;LdT组治疗前10例ALT异常,治疗后1例异常,ALT复常率为90%,两组ALT复常率比较差异无统计学意义(P>0.05)。
2.3 两组母婴传播阻断效果 两组婴儿7月龄时检测乙肝标志物,HBsAg均为阴性,HBsAb均为阳性,母婴传播阻断率为100%。
2.4 两组婴儿生长发育情况 分娩后所有婴儿Apgar评分均为9分。TDF组婴儿体质量(3 182.94±473.97)g,身长(50.14±1.79)cm,未观察到先天缺陷;LdT组婴儿体质量(3 041.20±491.79)g,身长(49.00±2.78)cm,1例婴儿出现先天腭裂;两组婴儿各生长发育指标比较差异均无统计学意义(P均>0.05)。
2.5 两组不良反应情况 治疗期间,TDF组和LdT组孕妇无任何不适,耐受情况较好,无孕妇因不良反应终止用药。未观察到与用药相关的实验室指标异常情况。
3 讨论
母婴传播是我国HBV慢性感染的主要传播模式,采用乙肝疫苗和乙肝免疫球蛋白联合预防可显著降低新生儿乙肝感染率。但目前高乙肝病毒载量孕妇所生婴儿仍有8%~15%预防接种无效,发生乙肝母婴传播。流行病学研究证实,HBV DNA载量高于1×106IU/mL是母婴传播的独立危险因素[10,11]。既往有研究报道,当HBV DNA>1×108IU/mL时,母婴传播率为43.0%,HBV DNA<1×106IU/mL时,母婴传播率下降30.0%,而当HBV DNA<104IU/mL时,传播风险将低至6.0%以下[12]。因此,降低HBV DNA水平是阻断乙肝母婴传播的关键措施之一。亚太肝病学会(APASL)[13]、欧洲肝病学会(EASL)[14]推荐,HBV DNA>1×106IU/mL的高病毒载量乙肝孕妇,在妊娠中晚期可应用核苷(酸)类似物阻断HBV母婴传播。TDF和LdT属于核苷(酸)类似物,通过抑制病毒复制过程中聚合酶和转录酶的活性发挥抗病毒作用,临床前研究尚未观察到对胚胎和胎儿发育造成不良影响,因此可用于乙肝孕妇。目前TDF和LdT已被美国食品药品管理局(FDA)列为妊娠B级药物,被证实能够降低母体HBV DNA水平,妊娠期使用是安全的[8,9]。
既往文献报道,HBV DNA治疗前后水平及变化在抗HBV中有很好的预测价值[15];妊娠期抗病毒药物暴露时间较长的孕妇,分娩时病毒载量更低[16]。本研究结果显示,两组孕妇产前HBV DNA水平均较治疗前下降,两组治疗后HBV DNA水平具有等效性,提示对于HBeAg阳性、HBV DNA>1×106IU/mL的乙肝孕妇,于妊娠中晚期开始应用TDF和LdT至分娩均能有效抑制HBV复制,两药疗效具有等效性。但本研究病例数尚少,还有待继续积累样本进一步观察。
本研究中,TDF组和LdT组婴儿完成乙肝疫苗全程接种后,于7月龄时检测乙肝标志物,婴儿HBsAg均为阴性,母婴传播阻断率为100%。说明高病毒载量乙肝孕妇经过TDF和LdT抗病毒治疗后,乙肝母婴传播的发生率进一步下降。
本研究中,部分孕妇妊娠中后期ALT轻度升高,考虑与妊娠期体内激素水平波动有关,后期多可自行恢复。服药期间所有孕妇未出现药物不良反应,婴儿出生后的生长发育指标无异常。LdT组1例婴儿出现先天腭裂,但该孕妇在妊娠中晚期服药,此时胎儿的器官发育已经完成,且既往研究提示LdT无致突变性和无致畸性[2],不会对胚胎和胎儿的生长发育造成不良后果,故不能肯定该婴儿先天缺陷与药物相关。以上结果表明,孕期服用TDF和LdT抗病毒治疗是较安全的。
综上所述,TDF和LdT都能降低HBeAg阳性、HBV DNA>1×106IU/mL的乙肝孕妇产前HBV DNA水平,阻断乙肝母婴传播效果良好,且较为安全,孕妇可根据自身的病情及经济能力个体化选择药物。
[1] Centers for Disease Control and Prevention(CDC).Assessing completeness of perinatal hepatitis B virus infection reporting through comparison of immunization program and surveillance data-United State[J]. Morb Mortal Wkiy Rep, 2011,60(13):410-413.
[2] Zou H, Chen Y, Duan Z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers[J]. J Viral Hepat, 2012,19(2):1365-2893.
[3] Han GR, Cao MK, Zhao W, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection[J]. J Hepatol, 2011,55(6):1215-1221.
[4] Wu Q, Huang H, Sun X, et al. Telbevudine prevents vertical transmission of hepatitis B virus from women with high viral lords: a prospective long-term study[J]. Clin Gastroenterol Hepatol, 2015,13(6):1170-1176.
[5] Zhang H, Pan CQ, Pang Q, et al. Telbivudine or lamivudine use in late pregnancy safely reduces perinatal transmission of hepatitis B virus in real-life practice[J]. Hepatology, 2014,60(2):468-476.
[6] Jourdain G, Ngo-Giang-Huong N, Cressey TR, et al. Prevention of mother-to-child transmission of hepatitis B virus: a phase Ⅲ, placebo-controlled, double-blind, randomized clinical trial to assess the efficacy and safety of a short course of tenofovir disoproxil fumarate in women with hepatitis B virus e-antigen[J]. BMC Infect Dis, 2016,16:393.
[7] Pan CQ, Han GR, Jiang HX, et al. Telbivudine prevents vertical transmission from HBeAg-positive women with chronic hepatitis B[J]. Clin Gastroenterol Hepatol, 2012,10:520-526.
[8] But DY, Yuen MF, Fung J, et al. Safety evaluation of telbivudine[J]. Expert Opin Drug Saf, 2010,9(5):821-829.
[9] A Working Group of the Office of AIDS Research Advisory Council (OARAC). Recommendations for useofantiretroviraldrugsinpregnantHIV-1-infected womenformaternal healthandinterventionstoreduceperinatal HIV-1 transmission in the United States[EB/OL].2015.
[10] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015更新版)[J].中华肝脏病杂志,2015,23(12):888-905.
[11] Liu CP, Zeng YL, Zhou M, et al. Factors associated with mother-to-child transmission of hepatitis B virus despite immunoprophylaxis[J]. Intern Med, 2015,54(7):711-716.
[12] Zhang RL, Luo Y, Xie JX, et al. A correlation analysis between the rate of vertical transmission of HBV and HBsAg-positive father to infant and the rate of neonatal cord blood HBV-DNA[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2010,31(2):159-162.
[13] Liao YF,Kao JH,Piratvisuth T,et al. Asian-Pacific consensus statement on the management of chronichepatitis B: a 2012 update[J]. Hepatol Int, 2012,6(3):531-561.
[14] European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection[J]. J Hepatol, 2015,57(1):167-185.
[15] Lee S, Park JY, Kim do Y, et al. Prediction of virologic response to tenofovir mono-rescue therapy for multidrug resistant chronic hepatitis B[J]. J Med Virol, 2016,88(6):1027-1034.
[16] Yi W, Pan CQ, Liu M, et al. Clinical outcomes of tenofovirdisoproxil fumarate(TDF) treatment versus no treatment for pregnant women with active chronic hepatitis B(CHB) and elevated alanine aminotransaminase(ALT)[J]. Hepatology, 2014,60(S1):1088-1128.
10.3969/j.issn.1002-266X.2017.42.030
R512.6
B
1002-266X(2017)42-0091-03
中国肝炎防治基金会资助项目(TG1509XBK)。
钟晓祝(E-mail: 569418126@qq.com)
2017-04-28)
