非小细胞肺癌组织中Ezrin、Snail蛋白表达及意义
2017-12-12李米红廖子君张彦兵李旭徐瑞李丽娜胡雪玲郭亚焕
李米红,廖子君,张彦兵,李旭,徐瑞,李丽娜,胡雪玲,郭亚焕
(1陕西师范大学学府医院,西安710062;2陕西省肿瘤医院)
·临床研究·
非小细胞肺癌组织中Ezrin、Snail蛋白表达及意义
李米红1,廖子君2,张彦兵2,李旭2,徐瑞2,李丽娜2,胡雪玲2,郭亚焕2
(1陕西师范大学学府医院,西安710062;2陕西省肿瘤医院)
目的探讨Ezrin和Snail蛋白在非小细胞肺癌(NSCLC)组织中的表达和临床意义。方法选择80例NSCLC患者,取手术切除的肿瘤组织和癌旁正常肺组织,应用免疫组化法检测Ezrin和Snail蛋白表达水平,分析Ezrin和Snail蛋白表达与临床病理参数的关系,并分析两者的相关性。结果肺癌和正常肺组织中Ezrin蛋白的高表达率分别为47.5%和17.5%,Snail蛋白的高表达率分别为51.3%和12.5%,肺癌组织中Ezrin和Snail蛋白的高表达率均高于正常组织(P均<0.01)。Ezrin、Snail蛋白表达与TNM分期、淋巴结转移相关(P均<0.01)。Ezrin与Snail蛋白表达呈正相关(γ=0.327,P=0.003)。结论Ezrin和Snail蛋白表达增高可能在NSCLC的发生、发展过程中发挥重要作用,联合检测Ezrin和Snail蛋白表达可以作为判断病情的生物学指标。
非小细胞肺癌;Ezrin蛋白;Snail蛋白;上皮间质转化;淋巴结转移
肺癌中约80%的患者为非小细胞肺癌(NSCLC)[1]。由于早期症状不容易被发现,大多数肺癌患者在就诊时已处于中晚期,预后极差。肿瘤转移是导致肺癌患者死亡的主要原因。Ezrin蛋白是一种膜细胞骨架连接蛋白,可与细胞表面受体或黏附分子相互作用,调节肿瘤细胞的黏附性,调控肿瘤的侵袭和转移[2,3]。Snail蛋白是锌指转录因子超家族的之一,能够调控上皮间质转化(EMT),而EMT在肿瘤浸润和转移过程中发挥重要作用[4,5]。本研究通过检测NSCLC组织中Ezrin和Snail蛋白的表达情况,探讨二者在NSCLC发生发展中的作用。
1 资料与方法
1.1 临床资料 收集2013年1月~2015年1月陕西省肿瘤医院收治的NSCLC患者80例,男57例、女23例,年龄39~73岁、中位年龄60岁。取手术切除(不可手术患者通过支气管镜检或CT引导下经皮肺穿刺获取肿瘤组织标本)的肿瘤组织,病理检查显示分化程度高分化19例、中分化32例、低分化29例,病理类型鳞癌38例、腺癌42例,TNM分期Ⅰ~Ⅱ期42例、Ⅲ~Ⅳ期38例,合并淋巴结转移35例、无淋巴结转移45例。另取癌旁正常肺组织标本40例。本研究经医院伦理委员会审批通过,获得患者及家属知情同意。
1.2 Ezrin和Snail蛋白检测方法 采用免疫组化法。取石蜡组织切片,60 ℃烘箱内烘烤60 min,加入二甲苯溶液脱蜡,不同梯度乙醇脱水,3%过氧化氢去离子水封闭,室温下孵育15 min。高压热修复切片,滴加山羊血清,37 ℃孵育40 min。滴加一抗(抗人Ezrin或Snail抗体),4 ℃冰箱中孵育过夜;滴加二抗,37 ℃孵育30 min。DAB显色,苏木素复染,显微镜下观察。取已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。由2位病理科医生观察染色情况,并采用盲法独立阅片。Ezrin和Snail均定位于细胞质,以胞质中出现棕黄色均匀染色定义为阳性表达。先在200倍镜下选取5个视野,计数阳性染色的细胞数,对阳性细胞数占细胞总数的百分比进行评分,0%为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;然后对染色强度进行评分,无染色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。阳性细胞百分比评分和染色强度评分的乘积0~3为低表达,≥4为高表达[6]。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料采用χ2检验和Fisher确切概率法进行分析,相关性分析行Spearman检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺癌和正常肺组织中Ezrin蛋白表达比较 肺癌和正常肺组织中Ezrin蛋白的高表达率分别为47.5%(38/80)、17.5%(7/40),Snail蛋白的高表达率分别为51.3%(41/80)和12.5%(5/40),肺癌组织中Ezrin和Snail蛋白的高表达率均高于正常肺组织(P均<0.01)。
2.2 Ezrin、Snail蛋白表达与肺癌患者临床病理特征的关系 Ezrin、Snail蛋白表达与TNM分期和淋巴结转移有关(P均<0.01),而与年龄、性别、肿瘤直径、分化程度、病理分型无关(P均>0.05)。见表1。
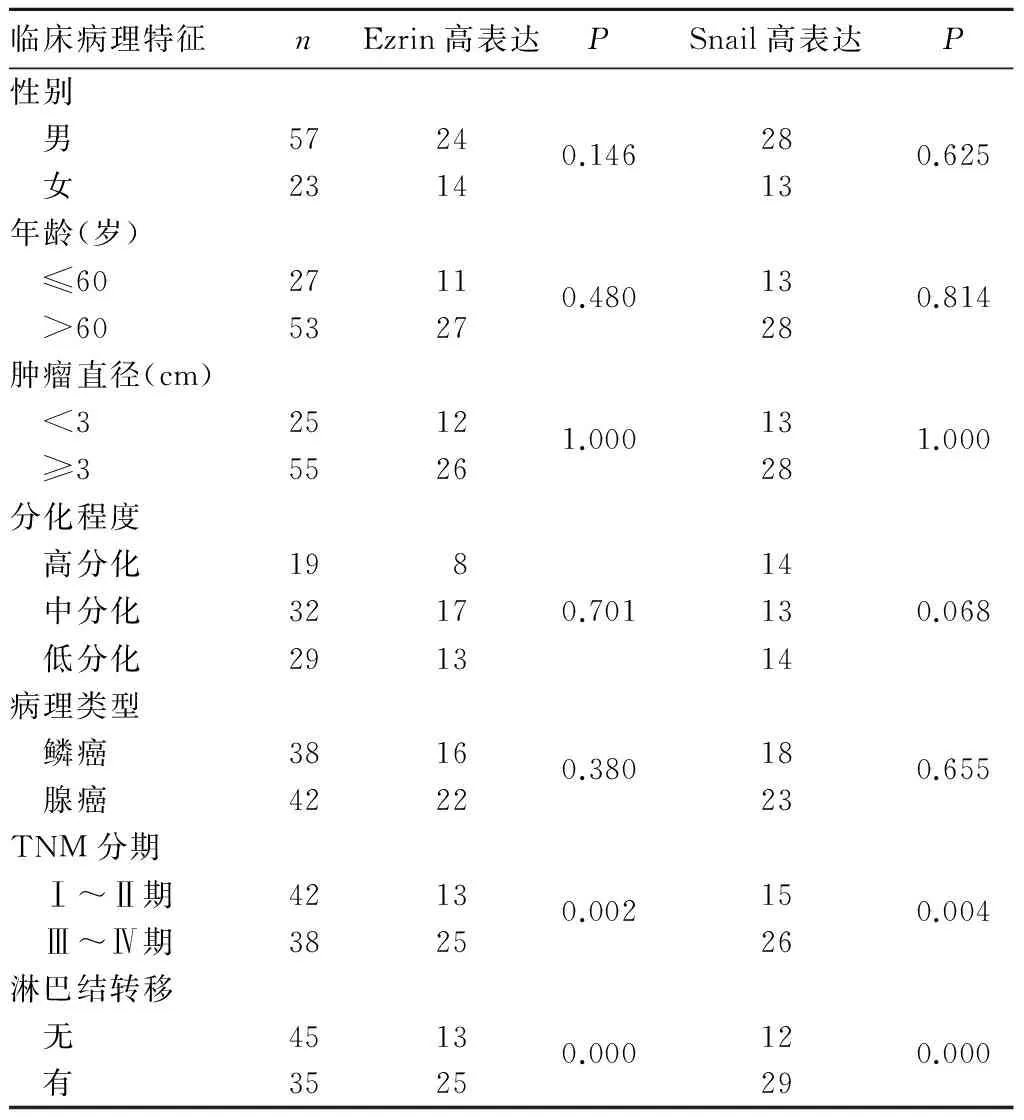
表1 Ezrin、Snail蛋白表达与肺癌患者临床病理特征的关系(例)
2.3 Erin和Snail蛋白在肺癌组织中表达的相关性 肺癌组织中,Erin和Snail蛋白表达呈正相关(r=0.327,P<0.01)。
3 讨论
EMT是细胞从上皮向间皮表型转化的过程,其特征是上皮标志物如细胞表面黏附分子的丢失和间皮标志物的过表达,在肿瘤细胞侵袭、迁移中发挥重要作用[7]。Ezrin蛋白为膜细胞骨架连接蛋白,通过与表面受体或黏附分子相互作用,调节肿瘤细胞的黏附性,从而调控肿瘤的侵袭和转移。其中的机制主要包括以下两方面:①Ezrin蛋白可通过激活Rac-1蛋白,将E-钙黏蛋白从细胞膜位置募集到细胞质,细胞膜E-钙黏蛋白的缺失破坏了细胞间的连接,导致肿瘤细胞的脱落。②高表达的Ezrin蛋白可阻止细胞质的E-钙黏蛋白向细胞膜转运,导致E-钙黏蛋白在细胞膜表面分布减少,间接减少肿瘤细胞之间的连接,从而使肿瘤细胞易脱离肿瘤原发灶而发生转移。Ezrin蛋白也通过参与细胞间和细胞内部的信号转导调控转移过程[3,8,9]。陈清勇等[6]报道,肺癌组织中Ezrin蛋白表达高于癌旁正常组织;与低转移性肺癌细胞系比较,高转移性肺癌细胞系中Ezrin mRNA和蛋白表达明显增高;Ezrin蛋白表达与淋巴结转移有关。除了在肺癌中的研究以外,在其他类型的肿瘤组织中也有类似的发现。Ezrin目前被发现与乳腺癌的增殖、凋亡、侵袭、转移以及血管生成的过程有关[10]。Ezrin高表达与骨肉瘤分化程度低以及预后差有明显的相关性[11]。本研究结果显示,Ezrin蛋白在肺癌组织中的表达高于正常肺组织,Ezrin高表达与TNM分期和淋巴结转移有关。提示Ezrin蛋白对肺癌的发展具有促进作用。
研究显示,Snail蛋白通过调控EMT在肿瘤浸润和转移过程中发挥重要作用。Snail作为EMT相关转录因子之一,调控E-钙黏蛋白的表达水平,同时也是EMT发生的一个关键因子[12],而E-钙黏蛋白表达的缺失是EMT的关键步骤。在发生EMT的过程中,Snail蛋白与E-钙黏蛋白的启动子区结合,使其表达下调,导致细胞之间的黏附力下降,侵袭和转移能力增强。本研究发现,与正常肺组织比较,Snail蛋白在肺癌组织表达显著增高,Snail表达增高与较晚的TNM分期和淋巴结转移有显著的相关性。目前研究发现Snail在肺癌、乳腺癌、食管鳞癌等多种肿瘤中表达上调[13,14],并与肿瘤的组织学类型、病理分级、侵袭转移、预后等有关。Ezrin与细胞表面分子相互作用,共同调节恶性肿瘤转移的各个环节。我们进一步分析了Ezrin蛋白和Snail蛋白表达的相关性,发现肺癌Ezrin蛋白和Snail蛋白表达具有显著的正相关性。综合上述研究结果,我们认为,Ezrin和Snail蛋白表达增高可能在NSCLC的淋巴结转移过程中发挥重要作用。Ezrin蛋白和Snail蛋白可能成为肺癌的分子标志物,其高表达提示患者淋巴结转移的可能性较大,同时也可以成为NSCLC治疗的生物靶点。Snail蛋白通过下调E-钙黏蛋白的表达,促进EMT发生。Ezrin蛋白通过激活Rac-1蛋白,下调细胞膜E-钙黏蛋白表达。推测Ezrin可能也参与了EMT的发生,这种作用可能与Snail蛋白相关。
综上所述,Snail蛋白和Ezrin蛋白在NSCLC组织中表达增高,二者表达呈正相关,提示Snail蛋白和Ezrin蛋白可能在肺癌的淋巴结转移中发挥相似的促癌作用,二者联合检测可能成为判断肺癌淋巴结转移的生物学指标。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Ekta A, Anathbandhu C, Premila DL, et al. Akt inhibitor MK-2206 promotes anti-tumor activity and cell death by modulation of AIF and Ezrin in colorectal cancer[J]. BMC Cancer, 2014,14:145.
[3] Hoskin V, Szeto A, Ghaffari A, et al. Ezrin regulates focal adhesion and invadopodia dynamics by altering calpain activity to promote breast cancer cell invasion[J]. Mol Biol Cell, 2015,26(19):3464-3479.
[4] Kaufhold S, Bonavida B. Central role of Snail1 in the regulation of EMT and resistance in cancer: a target for therapeutic intervention[J]. J Exp Clin Cancer Res, 2014,33(1):62.
[5] Wang ZS, Shen Y, Li X, et al. Significance and prognostic value of Gli-1 and Snail/E-cadherin expression in progressive gastric cancer[J]. Tumour Biol, 2014,35(2):1357-1363.
[6] 陈清勇,严杰,胡慧珍,等.埃兹蛋白的表达与非小细胞肺癌转移和预后的关系[J].中华肿瘤杂志,2012,34(6):436-440.
[7] 石永利,吴鸿雁,樊祥山,等.上皮-间叶转变相关蛋白在非小细胞肺癌中的表达及其预后意义[J].中国癌症杂志,2011,21(5):342-347.
[8] Pujuguet P, Del Maestro L, Gautreau A, et al. Ezrin regulates E-cadherin-dependent adherens junction assembly through Rac1 activation[J]. Mol Biol Cell, 2003,14(5):2181-2191.
[9] Harrison GM, Davies G, Martin TA, et al. Distribution and expression of CD44 isoforms and Ezrin during prostate cancer-endothelium interaction[J]. Int J Oncol, 2002,21(5):935-940.
[10] Long ZY, Wang TH. Advances of the role of Ezrin in migration and invasion of breast cancer cells[J]. Sheng Li Ke Xue Jin Zhan, 2016,47(1):21-26.
[11] Zhao DH, Zhu J, Wang WB, et al. Correlations of Ezrin expression with pathological characteristics and prognosis of osteosarcoma: a meta-analysis[J]. Scientific World J, 2014,2014:837543.
[12] Doble BW, Woodgett JR. Role of glycogen synthase kinase-3 in cell fate and epithelial-mesenchymal transitions[J]. Cells Tissues Organs, 2007,185(1-3):73-84.
[13] Im KS, Kim JH, Kim NH, et al. Possible role of Snail expression as a prognostic factor in canine mammary neoplasia[J]. J Comp Pathol, 2012,147(2-3):121-128.
[14] Argast GM, Krueger JS, Thomson S, et al. Inducible expression of TGFβ, Snail and Zeb1 recapitulates EMT in vitro and in vivo in a NSCLC model[J]. Clin Exp Metastasis, 2011,28(7):593-614.
10.3969/j.issn.1002-266X.2017.42.015
R734.2
B
1002-266X(2017)42-0049-03
陕西省自然科学基金项目(2013JM402)。
郭亚焕(E-mail: 277962686@qq.com)
2017-06-04)
