IL-37对人原代髓样树突状细胞炎症相关因子表达的影响
2017-12-12吴万通崔兆娜
吴万通,崔兆娜
(1天津市东丽区东丽医院,天津300300;2天津市河西区陈塘庄街社区卫生服务中心)
IL-37对人原代髓样树突状细胞炎症相关因子表达的影响
吴万通1,崔兆娜2
(1天津市东丽区东丽医院,天津300300;2天津市河西区陈塘庄街社区卫生服务中心)
目的观察白细胞介素37(IL-37)对人原代髓样树突状细胞(mDC)表达炎症相关因子TNF-α、IL-6、IL-12的影响。方法使用淋巴细胞分离液将全血细胞分离后提取单个核细胞,流式细胞分选方法分离纯化CD11c+CD123lowHLA-DR+的mDC。将分选后的mDC分为3组:未处理组加入完全培养基;对照组加入完全培养基培养后,再加入100 ng/mL LPS;IL-37预处理组分别加入0.125、0.25、0.5、1 μg/mL IL-37后,再加入100 ng/mL LPS。采用实时荧光定量PCR方法检测mDC中TNF-α、IL-6、IL-12 mRNA表达,ELISA法检测细胞上清液中TNF-α、IL-6、IL-12水平。结果与未处理组比较,对照组TNF-α、IL-6、IL-12 mRNA表达均升高(P均<0.01)。与对照组相比,IL-37预处理组加入0.25、0.5、1 μg/mL IL-37预处理后,TNF-α、IL-6 mRNA表达降低;加入0.5、1 μg/mL IL-37预处理后,IL-12 mRNA表达降低(P均<0.01)。与未处理组比较,对照组细胞上清液中TNF-α、IL-6、IL-12水平升高。各浓度IL-37预处理组与对照组相比,TNF-α水平均降低(P均<0.05);加入0.25 μg/mL IL-37预处理后,细胞上清液中IL-6、IL-12水平降低(P均<0.05)。结论IL-37能够降低人原代mDC表达和分泌炎症相关因子。
白细胞介素37;髓样树突状细胞;流式细胞术;肿瘤坏死因子α;白细胞介素6;白细胞介素12
髓样树突状细胞(mDC)是一群专职的抗原提呈细胞,它能够捕获、加工并通过其表面受体提呈抗原给T细胞。mDC是适应性免疫反应和固有免疫反应的桥梁[1]。白细胞介素37(IL-37)在人类体内大多数类型的细胞中均有表达,包括单核细胞、树突状细胞、内皮细胞和上皮细胞,并能够调节炎症反应。体外研究[2]表明,表达在巨噬细胞和上皮细胞的IL-37能抑制促炎性细胞因子IL-1α、IL-1β、TNF-α和巨噬细胞炎性蛋白2(MIP-2)的产生。体内研究[3]表明,小鼠体内IL-37表达能够保护机体,抵抗化学诱导型结肠炎和代谢综合征。此外,IL-37转基因小鼠在内毒素休克中能够降低肺、肾、肝损伤[2]。尽管IL-37在多种疾病的发生发展中发挥重要功能,但其对人原代mDC的免疫学作用尚不清楚。2015年12月~2016年11月,我们观察了IL-37对人原代mDC炎症相关因子TNF-α、IL-6、IL-12表达的影响,为探讨其在疾病发病中的作用提供理论依据。
1 材料与方法
1.1 材料 脂多糖购自Sigma公司;淋巴细胞分离液购自天津灏阳生物制品公司;IL-37购自R&D公司;RPMI-1640培养基购自美国HyClone公司;恒温培养箱和cDNA逆转录试剂盒购自美国Thermo公司,荧光标记的抗人抗体(Lin-FITC、CD123-PE、HLA-DR-PerCP、CD11c-APC)购自BD公司。BD FACSAriaⅢ流式细胞分选仪购自BD公司;人IL-6、IL-12、TNF-α、GAPDH cDNA扩增引物由上海生物工程有限公司负责合成,人IL-6、IL-12、TNF-α ELISA试剂盒购自深圳欣博胜生物有限公司。
1.2 单个核细胞的提取 采集体检正常产妇枸橼酸钠抗凝脐血约100 mL,与等量PBS充分混匀。在50 mL离心管中加入淋巴细胞分离液20 mL,用移液管吸取30 mL已稀释的全血,沿离心管管壁缓慢加入,保持两液面界面清晰。离心,吸取中上层单个核细胞,放入离心管中,加入2倍体积PBS,洗涤去除血小板及残留的淋巴细胞分离液。将细胞稀释成1×107/mL,待后续实验。
1.3 流式细胞术分选CD11c+CD123lowHLA-DR+的mDC 取单个核细胞,离心后加入200 μL 1% PBS,重悬后依次加入荧光标记抗体Lin-FITC、CD123-PE、HLA-DR-PerCP、CD11c-APC,混匀细胞后冰浴避光反应30~40 min。PBS洗涤,去除多余的游离抗体。离心重悬后上机分选。在配置的15 mL分选接收管内加入3 mL 1% PBS及青霉素-链霉素溶液,收集目的细胞。离心,去上清后重悬。使用流式分选仪软件分析细胞表型。基于外周血单个核细胞的自身特点,通过FSC-A/SSC-A散点图结果排除待测样本中的死细胞和碎片即为总PBMC。基于Lin/CD123散点图,在总PBMC中圈出Lin-CD123low的细胞。进一步基于CD11c/HLA-DR散点图,在Lin-CD123low细胞中,找到CD11c、HLA-DR双阳性细胞,圈出CD11c+/HLA-DR+细胞即为mDC(Lin-CD123lowHLA-DR+CD11c+),使用流式细胞分选仪进行分选,收集mDC。
1.4 mDC体外刺激培养 将分选后的mDC按1×106/孔接种于12孔板中,分为3组:未处理组加入完全培养基培养48 h;对照组加入完全培养基培养24 h后,加入100 ng/mL LPS继续培养24 h;IL-37预处理组分别加入0.125、0.25、0.5、1 μg/mL IL-37处理24 h后,再加入100 ng/mL LPS培养24 h。5% CO2条件下37 ℃培养,收集mDC及培养基上清。
1.5 mDC中TNF-α、IL-6、IL-12 mRNA表达检测 采用实时荧光定量PCR(qRT-PCR)方法。收集3组细胞,采用TRIzol总RNA提取试剂盒提取细胞总RNA。紫外分光光度计检测其纯度,按逆转录试剂盒进行操作,将总RNA逆转录为cDNA。ABI7500仪器上进行Real time PCR反应。引物序列:GAPDH上游引物为5′-CATGAGAAGTATGACAACAGCCT-3′,下游引物为5′-AGTCCTTCCACGATACCAAAGT-3′; TNF-α上游引物为5′-CTCTTCTGCCTGCTGCACTTTG-3′,下游引物为5′-ATGGGCTACAGGCTTGTCACTC-3′;IL-6上游引物为5′-GCCCATGCTACATTTGCCGAAG-3′,下游引物为5′-CAGGAGCCCAGCTATGAACTC-3′;IL-12上游引物为5′-GACATTCTGCGTTCAGGTCCAG-3′,下游引物为5′-CATTTTTGCGGCAGATGACCGTG-3′。PCR体系为20 μL:Transgen 2×SYBR Green RT-PCR Master MIX 10 μL;Primers 2 μL;cDNA 1 μL;DEPC水7 μL。按以下条件进行Real time PCR扩增:95 ℃ 10 min;94 ℃ 15 s,60 ℃ 1 min,循环40次。仪器记录荧光值,扩增结束后绘制溶解曲线。目的基因的表达量采用2-ΔΔCt方法计算。
1.6 细胞上清液中TNF-α、IL-6、IL-12水平检测 采用ELISA法。收集3组细胞的上清液,采用ELISA法测定细胞上清液中TNF-α、IL-6、IL-12水平,依据ELISA试剂盒说明书进行操作。
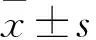
2 结果
2.1 各组mDC中TNF-α、IL-6、IL-12 mRNA表达比较 与未处理组相比,对照组TNF-α、IL-6、IL-12 mRNA表达均升高(P均<0.01)。与对照组相比,IL-37预处理组加入0.125 μg/mL IL-37预处理后,TNF-α、IL-6、IL-12 mRNA表达水平差异均无统计学意义(P均>0.05);当加入0.25、0.5、1 μg/mL IL-37预处理后,TNF-α、IL-6 mRNA表达降低(P均<0.01);当加入0.5、1 μg/mL IL-37预处理后,IL-12 mRNA表达降低(P均<0.01)。见表1。

表1 各组mDC中TNF-α、IL-6、IL-12 mRNA表达比较
注:与对照组比较,*P<0.01。
2.2 各组细胞上清液中TNF-α、IL-6、IL-12水平比较 与未处理组比较,对照组细胞上清液中TNF-α、IL-6、IL-12水平升高。各浓度IL-37预处理组与对照组相比,TNF-α水平均降低(P均<0.05);加入0.125 μg/mL IL-37预处理后,细胞上清液中IL-6、IL-12水平无明显变化(P均>0.05);加入0.25、0.5、1 μg/mL IL-37预处理后,细胞上清液中IL-6、IL-12水平降低(P均<0.05)。见表2。

表2 各组细胞上清液中TNF-α、IL-6、IL-12表达比较
注:与对照组比较,*P<0.05。
3 讨论
IL-37的抗炎作用已在多种不同种类的细胞中得到证明[2,4,5]。外源性IL-37通过与IL-18受体的α链结合,发挥抑制炎症的作用[6]。此外,细胞内IL-37可转运到细胞核,以下调促炎性细胞因子的表达[7]。IL-37能在体外和体内广泛抑制固有免疫反应。重组IL-37已被证明能减少肝细胞损伤引起的缺血和再灌注损伤[8]。此外,重组IL-37能保护小鼠抵抗急性肺损伤和降低气管内滴注烟曲霉菌后的中性粒细胞浸润[9]。转染IL-37的间充质干细胞已被证明能通过增加髓源性抑制和调节性T细胞并降低CD4+细胞数量来保护小鼠抵抗结肠炎[10]。
虽然大量研究均显示IL-37可能会降低炎症因子的表达,但多数研究均局限于通过IL-37转染细胞实现,而外源性IL-37作用的相关报道所研究的树突状细胞主要是通过IL-4和GM-CSF体外诱导小鼠骨髓细胞或人的外周血单个核细胞来实现的。外源性应用IL-37对人类原代mDC的相关实验仍未见报道。mDC在许多临床疾病中发挥关键作用,尤其是参与疾病的免疫学反应。我们首先通过流式细胞术原理分离脐带血中mDC(Lin-CD123lowHLA-DR+CD11c+细胞),分离比例与相关报道一致。核因子-κB(NF-κB)是介导细胞炎症反应的主要转录因子,包括趋化因子和细胞因子的表达[11]。LPS能激活细胞表面上的Toll样受体4(TLR4),进而与细胞内的适配器作用激活NF-κB[12]。NF-κB然后可以转位到细胞核内,调节促炎因子基因的表达,包括TNF-α和IL-6[13]。许多研究表明,抑制NF-κB能降低炎症细胞因子的产生,从而保护小鼠免受致命内毒素血症。我们最近的研究表明,IL-37能抑制小鼠树突状细胞磷酸化NF-κB的表达。本研究结果显示,IL-37能抑制人mDC炎症因子TNF-α、IL-6、IL-12的表达。由于mDC在免疫性疾病及炎症性疾病的发生发展中起关键作用,而IL-37抑制mDC炎症因子的产生能导致免疫反应受到抑制,因此推测,IL-37可能通过抑制人类原代mDC的NF-κB相关信号通路,从而抑制炎症因子的表达。我们的前期研究表明,IL-37能够通过NF-κB的相关通路作用于小鼠树突状细胞,从而进一步影响T细胞功能[14]。本研究结果显示,LPS能升高mDC中炎症因子TNF-α、IL-6、IL-12的表达,而经IL-37处理的mDC表达TNF-α、IL-6、IL-12的水平明显降低。表明IL-37可能通过降低NF-κB的激活抑制炎症因子表达。已有研究[6]表明,IL-37抗炎活性的产生需要IL-18Rα受体和TIR-8(SIGIRR)。本研究结果表明,IL-37能够明显降低由LPS刺激导致的IL-6和TNF-α的产生。而且本研究中IL-37在较低浓度时可以降低炎症因子的表达,而高浓度时炎症因子的抑制效应并没有明显增加。我们推测这可能与mDC表面存在的相应受体数量有关,也有可能是因为在低浓度时IL-37结合IL-18Rα并募集IL-1R8,而高浓度的IL-37/IL-18Rα复合物可能会募集IL-18Rβ,从而激活了相应的IL-18信号通路。
综上所述,IL-37能够降低人原代mDC相关炎症因子的表达。这为进一步研究IL-37和人原代mDC的生物学功能提供了新的途径,为更好地研究IL-37在疾病中的作用机制奠定了良好的实验基础。
[1] Rodriguez PC, Ochoa AC, Al-Khami AA. Arginine metabolism in myeloid cells shapes innate and adaptive immunity[J]. Front Immunol, 2017,8:93.
[2] Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamental inhibitor of innate immunity[J]. Nat Immunol, 2010,11(11):1014-1022.
[3] McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37 expression protects mice from colitis[J]. Proc Nati Acad Sci U S A, 2011,108(40):16711-16716.
[4] Bufler P, Azam T, Gamboni-Robertson F, et al. A complex of the IL-1 homologue IL-1f7b and IL-18-binding protein reduces il-18 activity[J]. Proc Nati Acad Sci U S A, 2002,99(21):13723-13728.
[5] Cavalli G, Koenders M, Kalabokis V, et al. Treating experimental arthritis with the innate immune inhibitor interleukin-37 reduces joint and systemic inflammation[J]. Rheumatology, 2016,55(12):2220-2229.
[6] Li S, Neff CP, Barber K, et al. Extracellular forms of IL-37 inhibit innate inflammation in vitro and in vivo but require the IL-1 family decoy receptor IL-1R8[J]. Proc Nati Acad Sci U S A, 2015,112(8):2497-2502.
[7] Sharma S, Kulk N, Nold MF, et al. The IL-1 family member 7b translocates to the nucleus and down-regulates proinflammatory cytokines[J]. J Immunol, 2008,180(8):5477-5482.
[8] Sakai N, Van Sweringen HL, Belizaire RM, et al. Interleukin-37 reduces liver inflammatory injury via effects on hepatocytes and non-parenchymal cells[J]. J Gastroenterol Hepatol, 2012,27(10):1609-1616.
[9] Moretti S, Bozza S, Oikonomou V, et al. IL-37 inhibits inflammasome activation and disease severity in murine aspergillosis[J]. PLoS pathog, 2014,10(11):e1004462.
[10] Wang WQ, Dong K, Zhou L, et al. IL-37b gene transfer enhances the therapeutic efficacy of mesenchumal stromal cells in dss-induced colitis mice[J]. Acta pharmacol Sin, 2015,36(11):1377-1387.
[11] Bonizzi G, Karin M. The two NF-kappaB activation pathways and their role in innate and adaptive immunity[J]. Trends Immunol, 2004,25(6):280-288.
[12] Boyd JH, Mathur S, Wang Y, et al. Toll-like receptor stimulation in cardiomyoctes decreases contractility and initiates an NF-kappaB dependent inflammatory response[J]. Cardiovasc Res, 2006,72(3):384-393.
[13] Ghosh S, Dass JF. Study of pathway cross-talk interactions with NB-kappaB leading to its activation via ubiquitination or phosphorylation: a brief review[J]. Gene, 2016,584(1):97-109.
[14] Wu W, Wang W, Wang Y, et al. IL-37b suppresses T cell priming by modulating dendritic cell maturation and cytokine production via dampening ERK/NF-kappaB/s6k signalings[J]. Acta Biochim Biophys Sin, 2015,47(8):597-603.
10.3969/j.issn.1002-266X.2017.42.011
R742
A
1002-266X(2017)42-0040-03
天津市东丽区科技发展计划(2015DL10002)。
2017-05-26)
