片段化热带森林优势植物叶虫食及其影响因素研究
2017-12-11胡鸿雁李志鹏林小兵杨效东
胡鸿雁 ,郑 征 ,王 瑾 ,李志鹏 ,林小兵 ,杨效东
(1. 中国科学院大学,北京 100049;2. 中国科学院 西双版纳热带植物园 热带森林生态学重点实验室,云南 勐仑 666303)
片段化热带森林优势植物叶虫食及其影响因素研究
胡鸿雁1,2,郑 征2,王 瑾1,2,李志鹏1,2,林小兵1,2,杨效东2
(1. 中国科学院大学,北京 100049;2. 中国科学院 西双版纳热带植物园 热带森林生态学重点实验室,云南 勐仑 666303)
植食性昆虫取食叶片(叶虫食)不仅影响植物种群结构、群落组成和生态系统的功能,还影响食物网内物种的相互关系。但是有关叶虫食在人为干扰的片段化森林中的情况还研究甚少。本研究以西双版纳纳板河保护区两种森林类型(雨林和常绿阔叶林)各4个片段森林作为研究对象,通过树冠的叶片采样分析了每种片段森林共有优势树种的虫食率和虫食频度,并调查了各片段森林的面积和树种多样性。结果表明:(1) 雨林片段和常绿阔叶林片段的优势树种平均虫食率分别为7.6%和6.7%,雨林片段的优势树种平均虫食频度(77.0%)显著高于常绿阔叶林片段的(67.5%)(P<0.05);(2) 雨林片段的树种多样性显著高于常绿阔叶林片段的(P<0.05);(3) 两种片段森林的优势树种叶虫食与片段面积和树种多样性之间均没有显著相关关系。因此,影响片段森林中优势树种叶虫食的因素与片段面积和树种多样性没有直接关系,可能与植食性昆虫和捕食者的散布有关,有待于进一步的研究。
森林片段化;叶虫食;片段面积;树种多样性;纳板河
在森林生态系统中,植物叶虫食是重要的生态过程,植食性昆虫消耗约10%的植物叶片[1]。昆虫对叶片的取食不仅是热带植物叶片受损的主要方式[2],也是热带生态系统养分循环(碳、氮)的主要驱动因素[3]。叶虫食被认为是对生态过程产生重要和持久(温和)调控作用的因素[4],叶虫食在降低植物适合度,影响植物竞争和群落动态的同时[5-6],也促使植物在不同取食压力下进化出多种适应性策略,塑造了丰富多样的生态适应类型和错综复杂的营养关系[7-8],并调整植物地上部和地下部的养分和生物量分配,推动了森林生态系统的物质循环和能量流动[9-10]。
群落水平上叶虫食的差异通常受控于群落树种和环境因素。叶片的营养含量在物种间存在差异,同一植株叶片的营养含量因叶片高度的不同也存在差异[11]。不同树种的防御特征及其相对多度在群落水平上对叶虫食具有决定性作用。而环境梯度的改变将通过植食性昆虫群落的变化对植物叶虫食产生综合性影响,相关的研究探讨了包括海拔生境梯度对叶虫食的影响[3,12]。然而,因人类活动带来的土地利用变化格局对森林生态过程的影响还知之甚少,尤其是单一农业景观背景下,森林片段化与叶虫食格局的关系正成为生态学必需面临和亟待解决的重要科学问题[13-14]。
人类活动加剧了热带森林的压力,连续森林逐渐转变为被非森林环境包围的具有各种形状、大小不一的隔离片段[15]。片段森林的面积大小被认为是影响叶虫食水平的重要因素之一[16],通常来说较大的生境面积具有较高的生境异质性和更多的食物资源。森林片段化引起的局域环境变化(面积下降,边缘增加,群落结构改变等)[17],可能改变植食性昆虫的群落结构和叶虫食的强度和格局[13,18]。一方面表现为片段化森林因面积减少导致植食性昆虫的捕食者数量下降[19],从而使得植食性昆虫种群数量(如幼虫)迅速增加并加大了对植物的摄食强度和压力[20],导致叶虫食损失升高。另一方面则表现为森林片段被隔离后,植食性昆虫数量下降[21]、边缘效应对植食性昆虫产生不利影响[22]、适口性好的植物数量下降[23]和植物资源质量变差[24]等方面,导致植食性昆虫对植物的取食压力减小,叶虫食损失下降。如Faveri等(2008)研究发现亚马逊森林片段内群落水平叶虫食损失随片段面积的减小而下降[21]。
但也有少数研究显示森林片段化对叶虫食水平没有影响[25-26],而森林的质量如树种多样性、植被复杂度、先锋树种的多度等对其有影响[27-28]。但是关于片段化森林面积大小与叶虫食压力水平的相互关系至今仍存有很大争议[21,28]。
地处热带北缘的西双版纳地区是印-缅生物多样性热点区域,也是国际上确认的重要生物多样性保护中心[29]。自上世纪中期,大面积的热带森林被橡胶园替代[30]。森林大面积减少的同时加剧了森林片段化,残余森林片段被大片的人工种植林及次生植被隔离[31],成为面积大小不一的残余斑块[32],不仅改变了当地的气候环境[17],也使动植物多样性和群落组成发生了巨大变化[33-34],影响了整个生态系统的结构和功能。虽然对该区域热带(季节)雨林的叶虫食研究已有报道[35-36],但对片段化森林的叶虫食还缺乏研究。本研究以西双版纳纳板河流域自然保护区两种森林类型(常绿阔叶林和雨林)的片段化森林为研究对象,开展优势树种叶虫食的调查,了解森林类型对优势树种叶虫食的影响;分析片段森林优势树种叶虫食与森林属性(片段面积)及质量(树种多样性)的关系,探讨影响优势树种叶虫食的主要因素。研究结果不仅能够提高对森林片段化与叶虫食关系的认识,而且可以为森林片段化地区生物多样性保护和维持以及片段森林的保护和管理提供科学依据。
1 研究地点和研究方法
1.1 研究地点自然概况
研究地点位于西双版纳纳板河流域国家级自 然 保 护 区(22°04′~ 22°17′ N,100°32′~100°44′ E),保护区位于西双版纳傣族自治州境内,地跨景洪市嘎洒镇和勐海县勐宋乡、勐往乡。总面积2.66×105hm2,其中核心区3 900 hm2、缓冲区 5 808 hm2、实验区 16 892 hm2。保护区地势西北高东南低,最高海拔2 304 m,最低海拔539 m,年降雨量为1 100~1 600 mm,年平均气温18℃~22℃,热量丰富,雨量充沛。土壤类型主要有砖红壤、赤红壤、红壤、黄壤。气候类型属北热带南亚热带半湿润气候,5月至10月为雨季,11月至次年4月为旱季。本研究工作在保护区的缓冲区和实验区的片段森林中实施。
1.2 样地信息
通过实地调查,结合卫星地图选取研究样地。对卫星地图进行分析确定研究样地的面积。在纳板河保护区热带常绿阔叶林和热带雨林中分别选定4个片段(共8个片段)作为研究样地,样地基本信息见表1。
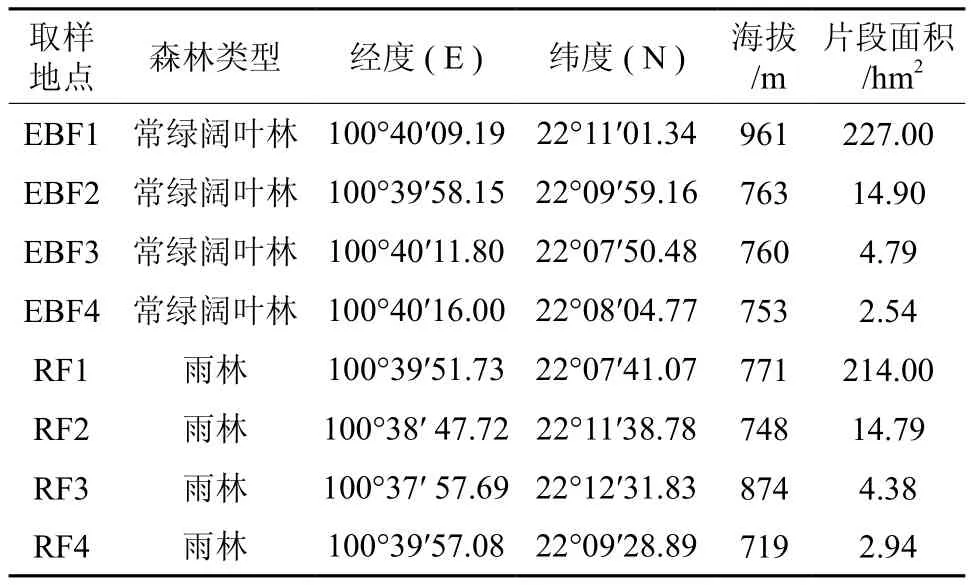
表1 西双版纳纳板河保护区森林样地概况†Table 1 Sampling sites information of Nabanhe reserve in Xishuangbanna
1.3 树种多样性调查
2014年4月上旬,对4个常绿阔叶林片段和4个雨林片段进行了植被调查。在每个片段内设置3个20 m×20 m的样方,样方之间的距离大于100 m,8个片段共24个样方。对每个样方内所有胸径(DBH)>5 cm的乔木树种进行每木调查[28],挂牌,记录编号,测量其胸径、树高等生长情况。
统计样方内DBH>5 cm的乔木树种数量及其个体数和树木总数,采用香农多样性指数(Shannon’s diversity index)公式计算树种多样性(H′):

其中:S:总的物种数;Pi:第i种的个体数占总物种数的比例。
1.4 叶虫食调查取样
于2014年4月下旬旱季末期时,在所选的4个常绿阔叶林片段和4个雨林片段中,分别选取每种林型各片段的共有优势树种作为调查对象。常绿阔叶林片段的调查树种为滇银柴Aporosa yunnanensis,短刺栲Castanopsis echinocarpa,黄牛木Cratoxylum cochinchinense,湄公栲Castanopsis mekongensis。热带雨林片段的调查树种为:大叶红光树Knema furfuracea,假海桐Pittosporopsis kerrii,绒毛番龙眼Pometia pinnata,白颜树Gironniera subaequalis。
在研究样地内,对选定的调查树种每种随机选取5~7株个体,数量不够的则全部作为样木调查。在每株样木树冠中部外侧不同方向选取3-5枝典型枝条,用高枝剪剪下,将全部叶片取下后用标本夹压平。
1.5 虫食率和虫食频度的测定
对以上压平后的叶片样品进行拍照,用Image J软件进行虫食叶面积和叶片总面积的分析,并统计每个植株个体的虫食叶片数和叶片总数,分别计算叶片虫食率和虫食频度。
叶片虫食率用叶面积损失率(即虫食叶面积占叶片总面积的百分比)表示,即虫食率(%)=100×虫食叶面积/叶片总面积。 (2)
叶片虫食频度用虫食叶片数占叶片总数的百分比表示,即虫食频度(%)=100×虫食叶片数/叶片总数。 (3)
1.6 数据处理
数据处理和分析采用Microsoft Excel 2013和SPSS 20.0软件。
采用单因素方差分析法(One-way ANOVA)分别检验不同森林类型片段内优势树种间虫食率及虫食频度的差异。采用独立方差T检验(Independent t-test)来检验两种森林类型片段间优势树种平均虫食率、虫食频度的差异以及两种森林类型片段间树种多样性的差异。用Pearson相关系数分析优势树种虫食率和虫食频度与片段面积及树种多样性的关系。
2 结果与分析
2.1 片段森林的优势树种叶虫食
2.1.1 常绿阔叶林片段优势树种的叶虫食
常绿阔叶林片段共计调查4个共有优势树种78株4170片叶,其中滇银柴15株464片叶,短刺栲25株2338片叶,黄牛木16株703片叶,湄公栲19株665片叶。
常绿阔叶林片段内,4个树种的平均虫食率为6.7%,湄公栲的虫食率最大(10.6%),滇银柴的虫食率最小(3.3%),黄牛木与滇银柴和短刺栲之间的虫食率均无显著差异(p>0.05),其他树种间差异达显著水平(p<0.05)(表2);4个树种的平均虫食频度为67.5%,湄公栲的虫食频度最大(83.5%),短刺栲的虫食频度最小(58.7%),湄公栲的虫食频度显著大于其他三个树种的虫食频度(p<0.05),而滇银柴、短刺栲和黄牛木三个树种间的虫食频度无显著差异(p>0.05)(表2)。
2.1.2 雨林片段优势树种的叶虫食
雨林片段共计调查4个共有优势树种67株2238片叶,其中大叶红光树17株285片叶,假海桐18株752片叶,绒毛番龙眼19株697片叶,白颜树13株504片叶。

表2 纳板河保护区常绿阔叶林片段共有优势树种的虫食率和虫食频度†Table 2 Herbivory and herbivory frequency of shared dominant tree species of evergreen broadleaved forest fragments in Nabanhe reserve
雨林片段内,4个树种的平均虫食率为7.6%,大叶红光树的虫食率最大(13.8%),白颜树的虫食率最小(4.7%),大叶红光树的虫食率显著大于其他三个树种的虫食率(p<0.05),而假海桐、绒毛番龙眼和白颜树三个树种间虫食率无显著差异(p>0.05)(表3);4个树种的平均虫食频度为77.0%,其中大叶红光树的虫食频度最大(89.4%),白颜树的虫食频度最小(69.6%),除大叶红光树的虫食频度显著大于假海桐和白颜树的虫食频度(p<0.05)外,其他树种间的虫食频度差异不显著(p>0.05)(表3)。

表3 纳板河保护区热带雨林片段共有优势树种的虫食率和虫食频度†Table 3 Herbivory and herbivory frequency of shared dominant tree species of rain forest fragments in Nabanhe reserve
2.2 两种片段森林间优势树种叶虫食及树种多样性的比较
2.2.1 常绿阔叶林片段和雨林片段优势树种叶虫食的比较
分析常绿阔叶林片段和雨林片段优势树种叶虫食的结果显示,常绿阔叶林片段和雨林片段的优势树种平均虫食率分别为6.7%和7.6%,差异不显著(P>0.05)(图1a),而常绿阔叶林片段优势树种的平均虫食频度(67.5%)显著小于雨林片段优势树种的平均虫食频度(77.0%)(P<0.05)(图1b)。

图1 两种片段森林间优势树种平均虫食率和虫食频度的比较Fig.1 Comparison of mean herbivory and herbivory frequency of dominant tree species between different fragments of two forest types
2.2.2 常绿阔叶林片段和雨林片段树种多样性的比较
本实验所调查的4个常绿阔叶林片段和4个雨林片段的树种数、多度和树种多样性的结果如表4所示。
独立样方T检验结果显示,常绿阔叶林片段的树种多样性显著小于雨林片段的树种多样性(P<0.05),表明相较于常绿阔叶林片段,雨林片段具有更高的物种丰富度(图2)。
2.3 两种片段森林的优势树种叶虫食与片段面积及树种多样性的关系
2.3.1 优势树种叶虫食与片段面积的关系
两种片段森林的优势树种虫食率和虫食频度与片段面积的相关分析结果显示,不仅常绿阔叶林片段的优势树种虫食率和虫食频度与片段面积之间没有显著相关系(R2=0.013,P>0.05;R2=0.057,P>0.05),而且雨林片段的优势树种虫食率和虫食频度与片段面积也没有显著相关 关 系(R2=0.055,P> 0.05;R2=0.128,P>0.05)(表5)。

表4 纳板河保护区4个常绿阔叶林片段和4个雨林片段的树种多样性†Table 4 Tree diversity of 4 evergreen broad-leaved forest fragments and 4 rain forest fragments in Nabanhe reserve (Shannon’s diversity index)

图2 两种片段森林间树种多样性的比较Fig.2 Comparison of tree diversity between different fragments of two forest types
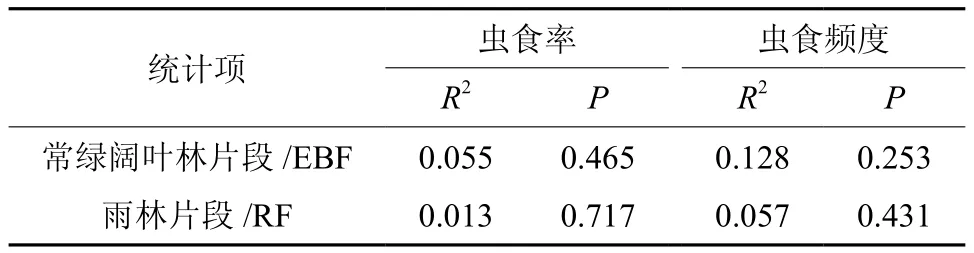
表5 两种片段森林的优势树种虫食率和虫食频度与片段面积的相关性†Table 5 Pearson correlation between herbivory, herbivory frequency of dominant tree species and fragment area of two forest type fragments
2.3.2 优势树种叶虫食与树种多样性的关系
两种片段森林的优势树种虫食率和虫食频度与树种多样性之间的相关分析结果显示,常绿阔叶林片段的优势树种虫食率和虫食频度与树种多样性没有显著相关系(R2=0.000 8,P>0.05;R2=0.040,P>0.05),同时雨林片段的优势树种虫食率和虫食频度与树种多样性也没有显著相关关系(R2=0.161,P>0.05;R2=0.256,P>0.05)(表6)。

表6 两种片段森林的优势树种虫食率和虫食频度与树种多样性的相关性†Table 6 Pearson correlation between herbivory, herbivory frequency of dominant tree species and tree diversity of two forest type fragments
3 讨论与结论
本实验结果显示,森林类型对优势树种的虫食频度有显著影响,雨林片段的优势树种虫食频度显著大于常绿阔叶林片段的;雨林片段的优势树种虫食率大于常绿阔叶林片段的,虽然结果无差异,但也表现出一定趋势。西双版纳地区常绿阔叶林分布在海拔较高的山脊,而热带季节雨林主要分布在海拔900 m 以下的潮湿沟谷、山坡下部及低丘台地[31]。海拔梯度的改变将通过植食性昆虫群落变化对植物叶虫食强度产生综合性影响,一般来说,叶虫食损失随海拔的升高而下降[37-38],因此雨林片段的叶虫食损失高于常绿阔叶林片段。森林片段化能够显著降低植物多样性、改变植物种类组成[33],尤其是木质树种组成发生改变和多样性下降[27],本研究发现雨林片段的树种多样性显著大于常绿阔叶林片段,常绿阔叶林片段树种多样性较低,植物资源相对于热带雨林片段更加短缺,植食性昆虫对植物叶片取食的数量有限,因此会增加对每个叶片的取食量,导致虫食率的升高,这可能是造成两种片段森林间优势树种虫食率没有显著差异而优势树种虫食频度有显著差异的原因。
森林片段化能使植食性昆虫的生长环境和群落结构发生变化,在导致变化的众多因素中,片段面积被认为是十分重要的因素[16]。Ruiz-Guerra等在墨西哥热带雨林片段内的实验表明,不管在群落水平还是共有种水平,片段面积与叶虫食损失有显著正相关关系,连续林的叶虫食水平要显著高于片段森林内的叶虫食损失[18]。森林片段化导致小面积森林片段叶虫食损失降低这一结论也见于其他研究[21,22,24]。但是现在越来越多的研究发现,片段森林群落水平叶虫食损失的变化与片段面积没有相关性[28,39],本实验研究结果也证实片段森林的优势树种叶虫食损失与片段面积没有显著相关关系。
森林片段化能够降低植物多样性并改变植物种类组成[33]。Schuldt等在中国东南地区亚热带森林所做的研究发现,树种多样性升高可以促进植食性昆虫的取食,导致叶虫食损失升高[40]。而有的研究却发现,树种多样性下降会导致叶虫食损失升高[41],然而Botzat 等对南非南部森林片段所做的叶虫食调查发现,植物在群落水平上的叶虫食损失与树种多样性没有关系[28]。本实验研究结果也发现,不管是常绿阔叶林片段还是雨林片段,优势树种虫食率和虫食频度与树种多样性均没有显著相关关系。相似的研究结果也见于Souza 等的研究[39]。
综上,热带地区片段化雨林的优势树种叶虫食水平要高于片段化常绿阔叶林,片段化雨林的树种多样性显著高于片段化常绿阔叶林,影响片段森林中优势树种叶虫食的因素与片段面积和树种多样性没有直接关系。
本论文研究纳板河保护区片段森林优势植物的叶虫食及其影响因素,调查样地周围均是橡胶林,相对于周围是耕地的片段森林而言,橡胶林的存在可以为捕食者以及植食性昆虫的迁徙和生存提供暂时的栖息地。林龄小于20 a的橡胶林(低龄林)具有开放式的林冠,郁闭度较低,而林龄在20~40 a(高龄林)的橡胶林具有较密闭的林冠层,郁闭度相对较高[42]。现阶段,大多数的橡胶林都是低龄林,为森林中昆虫穿越于相邻自然林提供暂时栖息地。随着橡胶林龄的增长,栖息地的生存环境质量会下降,这对所有的昆虫物种都是不利的,尤其对专性昆虫和稀有种的影响更大[43]。由森林片段化导致的植食性昆虫和捕食者数量的变化都会对植物叶虫食产生影响,在本研究中没有进行植食性昆虫和捕食者的调查,因此无法对其下行控制叶虫食的情况作出解释,在将来的研究中应该开展相应的调查。
[1] Hairston N G, Smith F E, Slobodkin L B. Community structure,population control, and competition[J]. American naturalist,1960, 94(879): 421-425.
[2]Garcia-Guzman G, Dirzo R. Patterns of leaf-pathogen infection in the understory of a Mexican rain forest: incidence,spatiotemporal variation, and mechanisms of infection[J].American Journal of Botany, 2001, 88(4): 634–645.
[3]Metcalfe D B, Asner G P, Martin R E,et al. Herbivory makes major contributions to ecosystem carbon and nutrient cycling in tropical forests[J]. Ecology Letters, 2013, 17(3): 324-332.
[4]Maron J L, Crone E. Herbivory: effects on plant abundance,distribution and population growth[J]. Proceedings of The Royal Society B-Biological Sciences, 2006, 273(1601): 2575-2584.
[5]Avila-Sakar G. Leist L L, Stephenson A G. Effects of the spatial pattern of leaf damage on growth and reproduction: nodes and branches[J]. Journal of Ecology, 2003, 91(5): 867-879.
[6]Steets J A, Ashman T L. Herbivory alters the expression of a mixed-mating system[J]. American Journal of Botany, 2004,91(7): 1046-1051.
[7]蔡志全, 曹坤芳. 热带森林植物幼叶抗虫食防卫方式研究的现状及进展[J]. 广西植物, 2002, 22(5): 474-480.
[8]Kursar T A, Coley P D. Convergence in defense syndromes of young leaves in tropical rainforest[J]. Biochemical Systematics and Ecology, 2003, 31(8): 929-949.
[9]Coley P D. Intraspecific variation in herbivory on two tropical tree species[J]. Ecology, 1983, 64(3): 426-433.
[10] Ribeiro S P, Basset Y. Gall-forming and free-feeding herbivory along vertical gradients in a lowland tropical rainforest: the importance of leaf sclerophylly[J]. Ecography, 2007, 30(5): 663-672.
[11] 许宽宽, 卢 建, 刘仁林, 等. 九连山常绿阔叶林叶片化学元素的空间分布[J]. 中南林业科技大学学报, 2016,36(8):77-87.
[12] Pellissier L, Fiedler K, Ndribe C, et al. Shifts in species richness,herbivore specialization, and plant resistance along elevation gradients[J]. Ecology and evolution, 2012, 2(8): 1818-1825.
[13] Wirth R, Meyer S T , Leal I R,et al.Plant herbivore interactions at the forest edge[J]. Progress in Botany, 2008, 69: 423-448.
[14] Santos B A, Benitez-Malvido J. Insect herbivory and leaf disease in natural and human disturbed habitats: lessons from Early-Successional Heliconia Herbs[J]. Biotropica, 2012, 44(1): 53-62.
[15] Turner I M. Species loss in fragments of tropical rain forest: a review of the evidence[J]. Journal of Applied Ecology, 1996,33(2): 200-209.
[16] Ewers R M, Didham R K. Confounding factors in the detection of species responses to habitat fragmentation[J]. Biological Reviews, 2006, 81(1): 117-142.
[17] Camargo J L C, Kapos V. Complex edge effects on soil-moisture and microclimate in central Amazonian forest[J]. Journal of Tropical Ecology, 1995, 11(2): 205–221.
[18] Ruiz-Guerra B, Guevara R, Mariano N A. Insect herbivory declines with forest fragmentation and covaries with plant regeneration mode: evidence from a Mexican tropical rain forest[J]. Oikos, 2010, 119(2): 317-325.
[19] de Almeida W R, Wirth R, Leal I R. Edge-mediated reduction of phorid parasitism on leaf-cutting ants in a Brazilian Atlantic forest[J]. Entomologia Experimentalis et Applicata, 2008, 129(3):251-257.
[20] Elzinga, J A, Turin H, van Damme, J M M. Plant population size and isolation affect herbivory of Silene latifolia by the specialist herbivore Hadean bicruris and parasitism of the herbivore by parasitoids[J]. Oecologia, 2005, 144(3): 416-426.
[21] Faveri S B, Vasconcelos H L, Dirzo R. Effects of Amazonian forest fragmentation on the interaction between plants, insect herbivores, and their natural enemies[J]. Journal of Tropical Ecology, 2008, 24(1): 57-64.
[22] Valladares G, Salvo A, Cagnolo L. Habitat fragmentation effects on trophic processes of insect-plant food webs[J]. Conservation Biology, 2006, 20(1): 212-217.
[23] Arnold A E, Asquith N M. Herbivory in a fragmented tropical forest: patterns from islands at Lago Gatun, Panama[J].Biodiversity and conservation, 2002, 11(9): 1663-1680.
[24] Simonetti J A, Grez A A, Celis-Diez J L, Bustamante RO.Herbivory and seedling performance in a fragmented temperate forest of Chile[J]. Acat Oecologica–International Journal of Ecology, 2007, 32(3): 312-318.
[25] Benitez-Malvido J, Garcia-Guzman G, Kossmann-Ferraz ID.Leaf-fungal incidence and herbivory on tree seedlings in tropical rainforest fragments: an experimental study[J]. Biological Conservation, 1999, 91(2-3): 143-150.
[26] Benitez-Malvido J, Lemus-Albor A. The seedling community of tropical rain forest edges and its interaction with herbivores and pathogens[J]. Biotropica, 2005, 37(2): 301-313.
[27] Laurance W F, Nascimento H E M, Laurance S G,et al.Rain forest fragmentation and the proliferation of successional trees[J].Ecology, 2006, 87(2): 469-482.
[28] Botzat A, Fischer L, Farwig N. Forest-fragment quality rather than matrix habitat shapes herbivory on tree recruits in South Africa[J]. Journal of Tropical Ecology, 2013, 29(2): 111-122.
[29] Myers N, Mittermeier R A, Mittermeier C G,et al.Biodiversity hotspots for conservation priorities[J]. Nature, 2000, 403(6772):853-858.
[30] Li H M, Aide T M, Ma Y X,et al.Demand for rubber is causing the loss of high diversity rain forest in SW China[J]. Biodiversity and Conservation, 2007, 16(6): 1731-1745.
[31] 朱 华, 王 洪. 西双版纳热带季节雨林的研究[J]. 广西植物,1998, 18(4): 371-384.
[32] Zipperer W C. Deforestation patterns and their effects on forest patches[J]. Landscape Ecology, 1993, 8(3): 177-184.
[33] Benitez-Malvido J, Martinez-Ramos M. Impact of forest fragmentation on understory plant species richness in Amazonia[J]. Conservation Biology, 2003, 17(2): 389–400.
[34] Mann C C. Addicted to rubber[J]. Science, 2009, 325(5940):564-566.
[35] 郑 征, 刘伦辉, 和爱军, 等. 西双版纳湿性季节雨林凋落物和叶虫食量研究[J]. 植物学报, 1990, 32(7): 555 -557.
[36] 郑 征, 陈旭东, 毛红卫, 等. 西双版纳热带季节雨林林窗内幼树叶生长与虫食动态[J]. 植物生态学报,2001,25(6):676-686.
[37] Galen C. Limits to the distribution of alpine tundra plantsherbivores and the alpine skypilot, polemonium viscosum[J].Oikos, 1990, 59(3): 355-358.
[38] Miller E, Louda S, Rose K, Eckberg J. Impacts of insect herbivory on cactus population dynamics: Experimental demography across an environmental gradient[J]. Ecological Monographs, 2009, 79: 155-172.
[39] Souza D G, Santos B A, Wirth R,et al. Community-level patterns of insct herbivory in a fragmented Atlantic forest landscape[J].Environmental Entomology, 2013, 42(3): 430-437.
[40] Schuldt A, Baruffol M, Böhnke M,et al.Tree diversity promotes insect herbivory in subtropical forests of south-east China[J].Journal of Ecology, 2010, 98: 917-926.
[41] Jactel H, Brockerhoff E G. Tree diversity reduces herbivory by forest insects[J]. Ecology Letters, 2007, 10(9): 835-848.
[42] Meng LZ, Martin K, Liu J X,et al.Contrasting responses of hoverflies and wild bees to habitat structure and land use change in a tropical landscape (southern Yunnan, SW China) [J]. Insect Science, 2012a, 19(6): 666–676.
[43] Meng L Z, Martin K, Weigel A,et al.Impact of rubber plantation on carabid beetle communities and species distribution in a changing tropical landscape (southern Yunnan, China)[J]. Journal of Insect Conservation, 2012b, 16(3): 423-432.
[本文编校:吴 彬]
Study on insect herbivory of dominant plants and its influencing factors in tropical forest fragments
HU Hongyan1,2, ZHENG Zheng2, WANG jin2, LI Zhipeng1,2, LIN Xiaobing1,2, YANG Xiaodong2
(1. University of Chinese Academy of Sciences, Beijing 100049; 2. Key Laboratory of Tropical Forest Ecology, Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Menglun 666303, Yunnan, China )
Insect herbivory largely affects plant population structure, community organization, and ecosystem functioning, and it also affects the relationship among species within the food web, but little is known on how insect herbivory is altered in human-modified landscapes. Four rain forest fragments and four evergreen broad-leaved forest fragments were sampled from Nabanhe national reserve,Xishuangbanna. Leaves of shared dominant tree species of each forest type of fragments were collected from canopy to analyze insect herbivory ( including herbivory and herbivory frequency ), meanwhile tree diversity and fragment area were also measured. The results were as follows: (1) Mean herbivory of dominant tree species of rain forest fragments and evergreen broad-leaved forest fragments were 7.6% and 6.7% respectively, mean herbivory frequency (77.0%) of dominant tree species of rain forest fragments was significant higher than that of evergreen broad-leaved forest fragments (67.5%) (P<0.05). (2) The tree diversity of rain forest fragments was significant higher than that of evergreen broad-leaved forest fragments (P<0.05). (3) Insect herbivory of dominant tree species both in rain forest fragments and evergreen broad-leaved forest fragments had no correlation with tree diversity and fragment area. Therefore, Tree diversity and fragment area have no effect on insect herbivory of dominant tree species in forest fragments directly. Future studies should evaluate whether dispersal ability of predators and herbivores can cause change of insect herbivory in forest fragments.
forest fragmentation; leaf herbivory; fragment area; tree diversity; Nabanhe
S763.30 文献标志码:A 文章编号:1673-923X(2017)10-0098-07
10.14067/j.cnki.1673-923x.2017.10.016
http: //qks.csuft.edu.cn
2016-05-16
国家自然科学基金项目(Y2GJ201B01)
胡鸿雁,硕士研究生
杨效东,研究员;E-mail:yangxd@xtbg.ac.cn
胡鸿雁,郑 征,王 瑾,等. 片段化热带森林优势植物叶虫食及其影响因素研究[J].中南林业科技大学学报,2017,37(10): 98-104.
