福氏拟菱形藻(Pseudo-nitzschia fukuyoi)
——中国产毒拟菱形藻的新记录*
2017-12-09黄春秀董焕嫦吴海燕谭志军
黄春秀 董焕嫦 吴海燕 谭志军 李 扬①
(1.华南师范大学生命科学学院 广州市亚热带生物多样性与环境生物监测重点实验室 广州 510631;2.华南师范大学生命科学学院 广东省水产健康安全养殖重点实验室 广州 510631;3.中国水产科学研究院黄海水产研究所 农业部水产品质量安全检测与评价重点实验室 青岛 266071)
福氏拟菱形藻(Pseudo-nitzschia fukuyoi)
——中国产毒拟菱形藻的新记录*
黄春秀1,2董焕嫦1,2吴海燕3谭志军3李 扬1,2①
(1.华南师范大学生命科学学院 广州市亚热带生物多样性与环境生物监测重点实验室 广州 510631;2.华南师范大学生命科学学院 广东省水产健康安全养殖重点实验室 广州 510631;3.中国水产科学研究院黄海水产研究所 农业部水产品质量安全检测与评价重点实验室 青岛 266071)
为了提高对我国海域拟菱形藻属(Pseudo-nitzschia)物种多样性的认识,并明确其是否能够产生多莫酸(domoic acid,DA)。本文从中国沿海分离和建立了拟菱形藻的单克隆培养株系,结合光学显微镜下的群体特征、透射电镜下的超微形态学特征、基于核糖体转录间隔区(internal transcribed spacer,ITS)的分子系统学数据,以及基于ITS2转录RNA的二级结构分析,鉴定到我国拟菱形藻属的1个新记录种:福氏拟菱形藻(P.fukuyoiLim,Teng,Leaw &Lim)。本文对其形态学特征进行描述,与相似物种进行了对比分析;对其 ITS2-RNA序列进行了分析;利用高效液相色谱-串联质谱联用法(liquid chromatography tandem mass spectrometry,LC-MS/MS)对培养藻株的产毒特征进行了分析,多个株系中均检测到DA,单细胞产毒水平为0.02—0.23pg,这是我国报道的第二种产毒拟菱形藻。利用卤虫(Artemia salina)和褶皱臂尾轮虫(Brachionus plicatilis)对福氏拟菱形藻的产毒水平进行了诱导,发现浮游动物能够提高福氏拟菱形藻的DA含量,增强幅度在4.7—28.5倍之间。本文提高了对我国拟菱形藻属物种多样性的认识,明确了福氏拟菱形藻的产毒特征和水平,为后续深入研究提供了基础数据。
福氏拟菱形藻;物种多样性;形态学特征;核糖体转录间隔区;ITS2-RNA 二级结构;多莫酸
拟菱形藻(Pseudo-nitzschiaPeragallo)广泛分布于全球近岸水域,是记忆缺失性贝毒(amnesic shellfish poisoning,ASP)——多莫酸(domoic acid,DA)的重要生物来源(Lelonget al,2012;Traineret al,2012)。自1987年引发首次ASP中毒事件之后(Bateset al,1989),拟菱形藻和DA备受关注。DA能够沿着食物链在各级海洋生物体内累积,并最终危害鸟类、海狮、鲸鱼、人类等高等动物(Lelonget al,2012;Traineret al,2012)。截至目前,全球已记录了 49种拟菱形藻,其中有26种能够产生DA(Tenget al,2016;Liet al,2017;Moestrupet al,2017)。
以往研究发现拟菱形藻在我国沿海广泛分布(吕颂辉等,1992;钱宏林等,2000;陈菊芳等,2002;李扬等,2010;Lüet al,2012),并常常在春季和夏季达到较高细胞丰度,甚至引发藻华(陈菊芳等,2005;Lüet al,2012)。另外,全球已报道的能够产生DA的26个拟菱形藻物种之中(Tenget al,2016;Liet al,2017;Moestrupet al,2017),有16种在我国沿海有分布(李扬等,2010;Lüet al,2012;徐国双等,2015;Liet al,2017)。我国学者曾对中国海域多个拟菱形藻物种,如尖刺拟菱形藻(P.pungens)(Liet al,2005)、尖细拟菱形藻(P.cuspidata)和多纹拟菱形藻(P.multistriata)(邢小丽等,2007)、银河拟菱形藻(P.galaxiae)和微孔拟菱形藻(P.micropora)(徐国双等,2015)、并基拟菱形藻(P.decipiens)(黄春秀等,2017)等开展产毒能力研究,均未检测到DA。但是,Li等(2017)在广东沿海分离鉴定了一个新种:伪装拟菱形藻(P.simulans),并在其培养株系中检测到 DA,单细胞产毒水平是 1.05—1.54×10-3pg,这是关于我国产毒拟菱形藻的唯一报道。但这并不意味着我国海域中产毒拟菱形藻物种多样性低,因为近年在我国沿海多个区域的海产品中均检出DA,如大连、湛江、北海和舟山海域(宋琍琍等,2008;吉薇等,2011;王恒,2011),这表明中国海域DA分布广泛,且作为海域DA重要产生者——可产毒的拟菱形藻在我国近海分布也可能较为广泛,物种多样性也较高。但目前相关认识还非常少,因此本文基于建立的单克隆培养株系,对中国沿海拟菱形藻开展了种源信息和产毒特征的分析,增加对我国海域拟菱形藻属物种多样性和产毒能力的认识。
1 材料和方法
1.1 单克隆藻株的建立
本实验室于2016年 8月在广东大亚湾海域,利用浮游植物网(孔径 10µm)进行水平拖网,并尽快带回实验室。利用毛细管复洗法在倒置显微镜(Mshot MI-12,广州明美科技有限公司,中国)下分离目标藻细胞,经过多次水洗和转移,以确保目标藻的纯化。最后转移至预先滴有L1培养基的48孔细胞培养板中(Guillardet al,1993;Lundholmet al,2006),放置在光照强度约 50—80µmol photons/(m2·s)、光周期 12h﹕12h、温度20±2°C的条件下培养。待其存活并繁殖达到约 100个藻细胞之后,转移到盛有 L1培养基的100mL锥形瓶中培养,以MC(Marine collection)序列进行编号。
1.2 卤虫和轮虫的培养及诱导
将市场中购买的卤虫(Artemia salina)卵置于浓度200mg/L的福尔马林溶液中浸泡30min消毒,再用灭菌人工海水冲洗至无气味,投入经过灭菌处理的 L1培养基中,培养温度等条件与拟菱形藻培养条件一样。约10d后,将10—20个成体的卤虫用毛细管复洗法转移到盛有 L1培养基(已加入约 100个藻细胞)的锥形瓶中。同样,将市场上购买回来的褶皱臂尾轮虫(Brachionus plicatilis)活体,用毛细管复洗法分离10—20个转移到培养基中。然后放置在光照强度约50—80µmol photons/(m2·s)、光周期 12h﹕12h、温度20±2°C 的条件下培养。
1.3 形态学观察
光学显微镜(light microscopy,LM)观察:取处于对数生长期的藻液 0.1mL,滴在载玻片上,盖上玻片后,利用正置光学显微镜(Olympus BX53,日本)进行微分干涉(differential interference contrast,DIC)的观察,并使用Olympus DP27数码相机拍照,在Olympus CellSens软件上获取图像信息。主要观察群体特征、细胞色素体形态等。
透射电子显微镜(transmission electron microscopy,TEM)观察:取对数生长期的藻液 2mL,加入等量浓硫酸(>95%)以去除有机质,然后用蒸馏水多次水洗至中性(徐国双等,2015)。用微量进样器吸取5—10µL酸化后的水样,滴加在喷镀碳膜的铜网(100目)上,自然晾干后,即可在透射电镜(日立JEM-1010,日本)下观察和拍照。主要观察壳面超微结构,如点条纹、肋突、孔纹等。
1.4 分子系统学分析
离心法收集处于对数生长期的藻细胞,进行总DNA的提取(Lundholmet al,2002)。利用引物ITS1和ITS4进行核糖体转录间隔区(ITS)的扩增和测序(Limet al,2013)。PCR产物送至上海立菲生物科技有限公司进行纯化和测序。从NCBI下载拟菱形藻种类的ITS nrDNA序列,使用BioEdit软件进行序列的比对和矩阵(Limet al,2013)。基于MrModeltest 2.3软件的计算,选择最适模型和参数为GTR+I+G,用MrBayes 3.2软件(Ronquistet al,2012)构建贝叶斯推理树(Bayesian inference,BI),用RAxML-HPC2软件(Milleret al,2010)构建最大似然树(maximum likelihood,ML)。以奇异棍形藻(Bacillaria paxillifer)、新月细柱藻(Cylindrotheca closterium)和船斑菱形藻(Nitzschia navis-varingica)为群外对照(Tenget al,2014)。
1.5 ITS2二级结构的预测及CBCs分析
从GenBank下载福氏拟菱形藻的ITS nrDNA序列,参考序列标注,将其ITS2片段截下。使用Mfold软件(Percopoet al,2016)在线预测其ITS2的二级结构,所得二级结构含4个环和一个拟菱形藻属环。以福氏拟菱形藻的二级结构为同源模板,使用 ITS2 Database软件(Percopoet al,2016)在线预测本文的5个福氏拟菱形藻单克隆株系,与其亲缘关系最接近的伪柔弱拟菱形藻(P.pseudodelicatissima)和尖细拟菱形藻的RNA二级结构。最后使用VARNA软件(Limet al,2013)观察并下载二级结构。同时使用 4SALE v.1.7软件(Limet al,2013)中自带的补偿碱基变化(compensatory base changes,CBCs)功能观察CBC差异,分析生殖隔离情况。
1.6 LC-MS/MS法检测藻毒素
取处于生长稳定期中后期的藻液 300—600mL,藻细胞浓度约5×105cell/mL,经0.2µm醋酸纤维滤膜过滤,压力不高于0.5Pa,收集藻细胞立刻置于-20°C冰箱中保存;另外取5mL混匀的藻细胞加2mL鲁格试剂于-4°C保存,用于单细胞产毒量的计算。将已收集的藻细胞加4mL甲醇水(甲醇﹕水=1﹕1)充分混匀,用超声波细胞粉碎机冰浴破碎5min,经0.22µm滤膜过滤,滤液于-20°C下保存备用。本实验样品皆寄往中国水产科学研究院黄海水产研究所上机检测。
采用Prominence UFLC超快速液相色谱(Shimadzu公司)和5500 QTRAP四极杆-线性离子阱复合质谱检测系统(SCIEX公司)对预处理的样品进行DA检测,参见Wu等(2014)方法进行分析。DA标准品购自德国Sigma公司。
2 结果
2.1 形态学描述
福氏拟菱形藻(Pseudo-nitzschia fukuyoiLim,Teng,Leaw &Lim)(图1a—g)细胞具有两个黄褐色的色素体,对称分布在横轴两侧,可形成链状群体,细胞间重叠部为壳面全长的1/4—1/5(图1a,b)。细胞壳面呈线形至披针形(图1a,b),壳面两端相似,呈箭头状(图1c,d),环面观时两壳端形状稍微呈S型(图1b)。壳面长49—55µm,宽2.1—2.5µm。管壳缝强烈偏心,具有中央较大船骨点(图1e)。壳套高1—2个孔纹,中部高2个孔纹(图1e),接近两端高1个孔纹(图1d)。肋突分布在壳缘,排列不规则(图1e),密度为16—21个/10µm。点条纹由一排孔纹组成(图 1e,f),密度为34—39条/10µm。孔纹形状为圆形或方形,孔纹内部的筛板膜分成1—5个分区,以2—3个分区为主,每个分区为不规则的六边形,可见少部分分区在孔纹中央(图1f),孔纹密度为4—6个/1µm。可观察到三条环带,壳环带宽2个孔纹,高3—4个孔纹,点条纹密度44—46个/10µm(图1h),孔纹内部有裂缝,分成不规则的六边形,接近两端出现壳环带高 2个孔纹(图1g);第二条环带点条纹由一排孔纹组成(图 1g),孔纹内部都是由六边形的筛孔构成(图1g)。第三条环带只有一排纵向排列的孔纹。
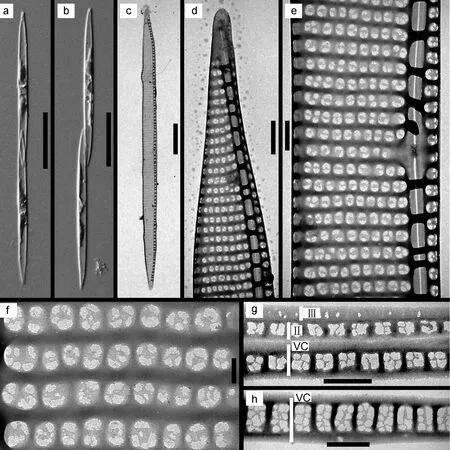
图1 福氏拟菱形藻的显微照片Fig.1 Microscope images of Pseudo-nitzschia fukuyoi
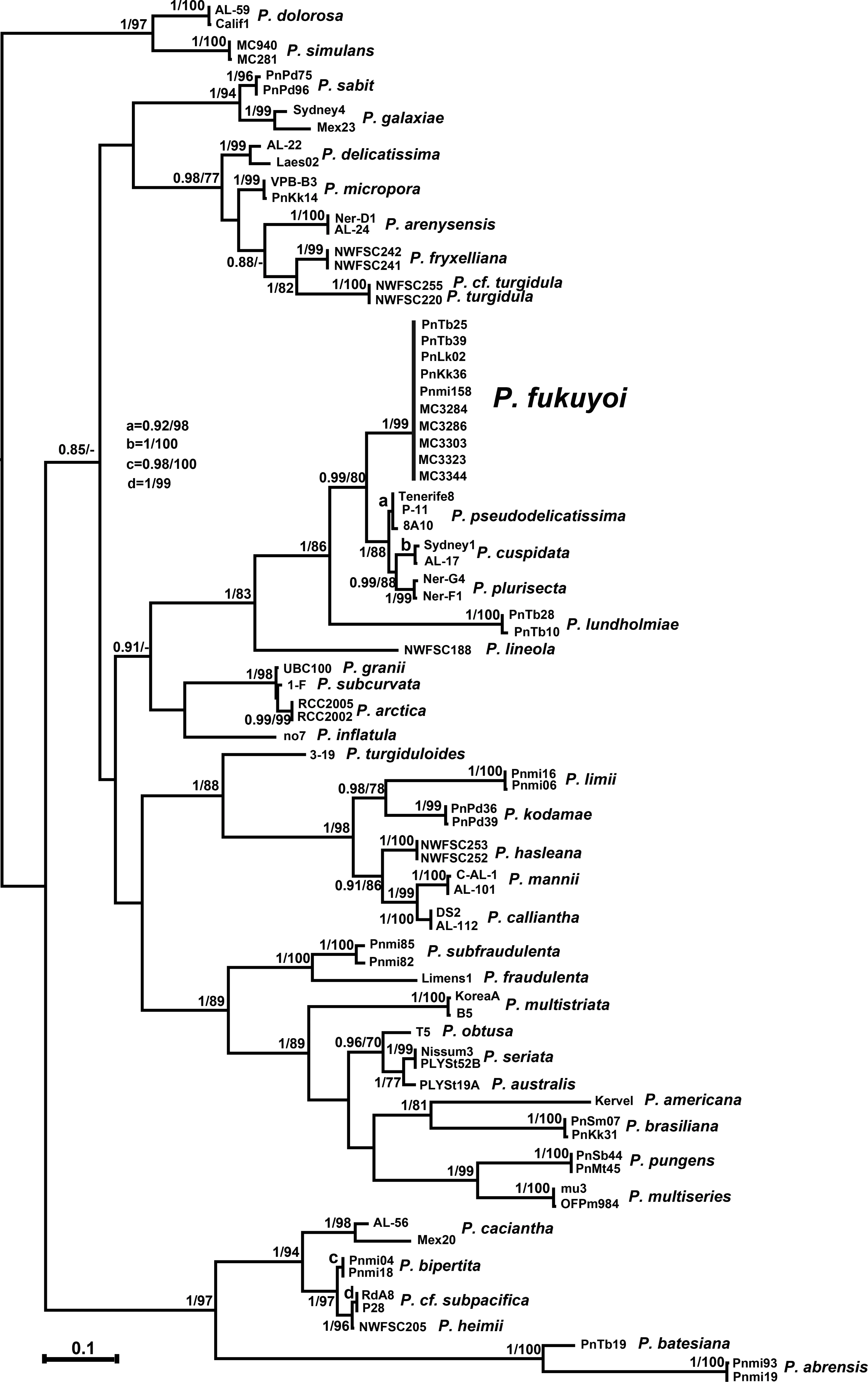
图2 基于核糖体转录间隔区ITS1-5.8S-ITS2的最大似然树Fig.2 Maximum likelihood tree inferred from ITS1-5.8S-ITS2 rDNA
本种营海水浮游生活,此前有产生 DA的报道,单细胞产毒量为3.85—4.54pg(Daoet al,2015),本文亦检测到 DA的存在,单细胞产毒水平为0.02—0.23pg。本种采自广东大亚湾(8月),也曾报道被发现于马来西亚和越南(Limet al,2013;Daoet al,2015;Tenget al,2016)。
2.2 基于ITS序列分析的分子系统学分析
对ITS1-5.8S-ITS2序列的972个碱基进行了比对分析,建立的最大似然树和贝叶斯推理树具有相同的结构,合并形成图2。MC3284、MC3286、MC3303和MC3323的基因完全相同,与MC3344有1个碱基的差异。前 4个株系与马来西亚株系 PnKk36、Pnmi158的基因完全相同,与马来西亚株系PnTb25、PnTb39有 1个碱基差异,但是与马来西亚株系PnLk02遗传差异较大,有6个碱基差异。由于越南株系Pn5、Pn6的ITS序列尚未上传到NCBI,因此暂未作比对。本文建立的5个株系与已报道的5株马来西亚福氏拟菱形藻聚在同一个分支上,且具有较高的置信值(BPP=1,ML=99),这表明分子分类的结果也支持形态鉴定的结论。
2.3 ITS2二级结构分析
福氏拟菱形藻的ITS2二级结构模型具有四个单环和一个拟环IIa(图3),与已报道的福氏拟菱形藻的ITS2二级结构基本一致(Limet al,2013)。福氏拟菱形藻ITS2-RNA的标志性区间位于helix III和helix IV,33-bp信号区域:5'-CCATTTGGCAAGCCTGGATGGT TTCTAAGTCTA-3'。本文 4个福氏拟菱形藻株系(MC3284、MC3286、MC3303、MC3323)与之前报道的马来西亚株系 PnKk36、Pnmi158具有完全一致的ITS2二级结构,与MC3344和马来西亚株系PnTb25、PnLk02只有 1个单核苷酸多态性(single nucleotide polymorphism,SNP)的差异,没有 CBC 和hemi-CBC(HCBC)的差异,这表明ITS2二级结构的结论亦支持形态学与分子分类的鉴定结果。将本文的福氏拟菱形藻与系统发育树上亲缘关系最近的伪柔弱拟菱形藻(8A10,P-11)和尖细拟菱形藻(AL-17,Sydney1)相比较,发现与前者有1个CBC和4个SNPs的差异,与后者有1个CBC,1个HCBC和6个SNPs的差异。
2.4 DA产毒特征
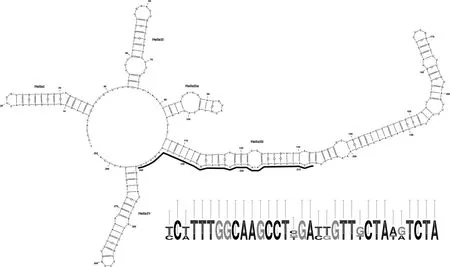
图3 福氏拟菱形藻ITS2二级结构图Fig.3 The secondary structure of ITS2-RNA in Pseudo-nitzschia fukuyoi strain MC3286
以 DA 标准品浓度(μg/mL)为横坐标,峰面积为纵坐标,建立LC-MS/MS检测DA的标准曲线,DA浓度为50—500μg/L时,其峰面积与质量浓度有良好的线性关系(R2=0.99934),回归方程为y=164.64875x-3947.22457。本方法的检测下限为50ng/mL。DA的出峰保留时间为0.77min。对常规培养和浮游动物诱导的福氏拟菱形藻进行 LC-MS/MS检测,结果在预定的保留时间内都出现样品峰,检出量见表1。这也是我国报道的能够产生DA的第二个拟菱形藻物种。
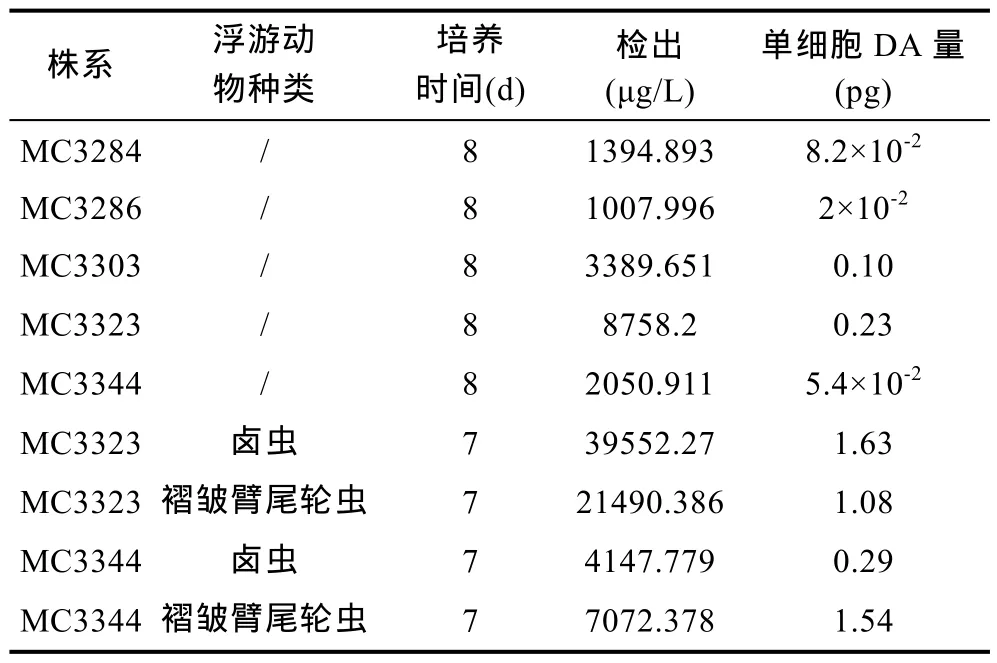
表1 DA的检出结果Tab.1 The results of DA content detected in this study
另外,本文对 2株福氏拟菱形藻(MC3323,MC3344)进行了浮游动物混培诱导实验。结果显示(表1):MC3323株系在卤虫的诱导下,DA水平增加了7倍,在褶皱臂尾轮虫诱导后增加了 4.7倍;而株系MC3344在卤虫的作用下产DA量只增加了5.4倍,但是在褶皱臂尾轮虫的诱导下增加量高达 28.5倍。因此,卤虫和褶皱臂尾轮虫都能提高福氏拟菱形藻的DA产毒水平。
3 讨论
3.1 福氏拟菱形藻与相似种的比较研究
福氏拟菱形藻的形态特征是壳面呈线形至披针形,具有中央船骨点,点条纹由单排孔纹组成,属于伪柔弱拟菱形藻复合群(P.pseudodelicatissimacomplex)(Limet al,2013)。在最初的研究中,对于伪柔弱拟菱形藻的认知较为笼统,将所有点条纹由单排孔纹组成的物种都归为伪柔弱拟菱形藻。但是随着研究的深入,发现该种形态多样,产毒特征也不稳定,或许存在(拟)隐形种。Lundholm等(2003)对点条纹由单排孔纹组成的拟菱形藻进行了二次研究,提出了伪柔弱拟菱形藻复合群的概念,认为伪柔弱拟菱形藻复合群物种的主要形态特征有:(1)壳面呈线形或披针形;(2)点条纹由单排孔纹组成;(3)具有中央较大船骨点;(4)具有相似的壳套和壳环带结构(Lundholmet al,2003;李扬等,2010)。然而该复合群物种间的形态学差异需要在电子显微镜下才能区分出来,关键区别特征是孔纹内部的小孔数量和排列方式(Lundholmet al,2003;Limet al,2013;Tenget al,2016)。截止目前,伪柔弱拟菱形藻复合群中的物种已经丰富到23个种(Liet al,2017)。
本研究的福氏拟菱形藻(2.1—2.5µm;16—21µm;34—39µm)在宽度、肋突和点条纹上与以往报道的越南株系(1.53—2.28µm;16—21µm;33—37µm)更为接近(Daoet al,2015),而在孔纹密度(4—6个)和壳环带上的点条纹密度(44—46µm)则与已报道的马来西亚株系(4—7 个;39—47µm)更为接近(Limet al,2013)。无论是在形态学还是遗传学上,福氏拟菱形藻的最相似种类都是尖细拟菱形藻和伪柔弱拟菱形藻(Limet al,2013)。但是本文福氏拟菱形藻的宽度(2.1—2.5µm)明显高于尖细拟菱形藻(1.4—2.0µm)和伪柔弱拟菱形藻(0.9—1.6µm),而在肋突密度、点条纹密度和环带上的点条纹密度上,本实验株系(16—21µm;34—39µm;44—46µm)明显低于尖细拟菱形藻(19—25µm;35—44µm;47—53µm)和伪柔弱拟菱形藻(20—25µm;36—43µm;48—55µm)(Lundholmet al,2003)。三者最明显的区别在于,孔纹内的筛板膜分区有所差异,前者孔纹被硅质桥分成1—5部分,以2—3个分区为主,而且出现部分分区位于孔纹中央,而后两者孔纹内部主要分成2部分,为上下不规则的2部分(Lundholmet al,2003;Limet al,2013)。总之,拟菱形藻属不同物种之间的形态学差异非常细微,以超微形态学特征对其进行鉴定仍存在着不少困难,所以本文结合形态学与分子系统学对福氏拟菱形藻进行了物种识别。
3.2 拟菱形藻属DA产毒特征分析
福氏拟菱形藻首次报道于马来西亚(Limet al,2013),当时作为拟菱形藻属的新物种进行报道,并未对其产毒特征进行检测。之后报道于越南海域,并检测到高浓度 DA,产毒量为3.85—4.54pg/cell(Daoet al,2015)。本文从大亚湾水域分离并建立了5个福氏拟菱形藻培养株系,利用 LC-MS/MS技术对其产毒特征进行检测,均能检测到 DA,单细胞产毒量为0.02—0.23pg,低于越南株系的产毒水平。以往研究也已证实,拟菱形藻产毒是一个比较复杂的情况,不同海域同种拟菱形藻产DA特征也存在差异,如采自新西兰一些水域的尖刺拟菱形藻可产 DA(徐国双等,2015),而采自中国沿海的尖刺拟菱形藻却没有检测到DA(Liet al,2005)。同样,采自马来西亚一些水域的柯氏拟菱形藻(P.kodamae)可产生DA,但采自东马来西亚一些海域的柯氏拟菱形藻却没有检测到DA(Tenget al,2016)。这表明拟菱形藻是否产毒不是一个稳定特征。而且有研究认为,产毒拟菱形藻的生理特征与生长的环境因子如生长周期、硅、氮、磷、光照与光周期、细菌的共生等都会影响其产DA的量(Lelonget al,2012)。
3.3 浮游动物对拟菱形藻产毒特征和水平的影响
目前已经认识到有较多因素能够影响拟菱形藻的DA产毒特征和水平,以往研究多集中在拟菱形藻的培养因子上,如物理参数(温度、盐度、光照和pH)、营养参数(Si、P、N、Fe、Cu)和生物参数(细菌、病毒和真菌)(Lelonget al,2012)。然而近年来有学者从捕食关系的角度,分析了浮游动物对于拟菱形藻产毒的影响。如有学者将产毒的成列拟菱形藻(P.seriata)与不产毒的格式拟菱形藻(P.granii)分别与桡足类Calanus copepodites放在一起,发现成列拟菱形藻产毒水平有所上升,而在桡足类的诱导下格式拟菱形藻也能够产生DA(Tammilehtoet al,2015)。研究认为,桡足类与拟菱形藻属于食物链中的捕食关系,拟菱形藻增加 DA水平,可以降低捕食者的摄食率(Tammilehtoet al,2015)。本文进行的浮游动物诱导实验中,也验证了上述观点。在浮游动物诱导实验中,无论是加入卤虫,还是褶皱臂尾轮虫,均能够增加福氏拟菱形藻的产毒水平,最高可增加28.5倍。本文的诱导实验说明,浮游动物能够显著刺激有毒拟菱形藻的产毒水平,而浮游动物的缺失,也可导致有毒拟菱形藻的产毒能力大大降低,这或许可以解释为什么我国拟菱形藻在实验室培养条件下极少检测到DA,而在自然海域如浮游植物样品中却有高含量 DA(Liet al,2017)。
4 结论
(1)本研究结合形态学与分子生物学技术,鉴定到我国拟菱形藻属的 1个新记录种:福氏拟菱形藻,增加了我国拟菱形藻属的物种多样性。
(2)本文建立的5个福氏拟菱形藻株系中均能检测到 DA,单细胞产毒量为0.02—0.23pg,这是我国报道的第二个能够产生DA的拟菱形藻物种。
(3)利用卤虫和褶皱臂尾轮虫对福氏拟菱形藻的产毒特征与水平进行了诱导,发现浮游动物能够促使拟菱形藻的DA水平,增加幅度在4—28倍之间。
王 恒,2011.舟山海域贝类海产品中软骨藻酸含量调查.中国卫生检验杂志,21(12):2986—2988
邢小丽,杨军霞,康燕玉等,2007.大亚湾水域两种拟菱形藻的形态学鉴定及毒素分析.台湾海峡,26(4):576—582
吉 薇,郑洁莹,曾雪萍等,2011.南海海域软骨藻酸(DA)贝类毒素的HPLC方法检测.现代食品科技,27(1):120—122,116
吕颂辉,齐雨藻,1992.南海大鹏湾的主要赤潮生物.暨南大学学报(自然科学),13(3):130—133
李 扬,何利娜,马艳艳等,2010.伪柔弱拟菱形藻复合群的形态分类学研究.水生生物学报,34(2):302—311
宋琍琍,张海琪,侯镜德等,2008.液相色谱-串联质谱法测定贝类毒素软骨藻酸的残留.水产学报,32(6):950—956
陈菊芳,齐雨藻,徐 宁等,2005.大亚湾拟菱形藻水华及其在生物群落中的生态地位.海洋学报,27(1):114—119
陈菊芳,徐 宁,王朝晖等,2002.大亚湾拟菱形藻(Pseudo-nitzschiaspp.)种群的季节变化与环境因子的关系.环境科学学报,22(6):743—748
钱宏林,梁 松,齐雨藻,2000.广东沿海赤潮的特点及成因研究.生态科学,19(3):8—16
徐国双,李 扬,2015.我国沿海拟菱形藻属的 2新记录种及其产毒特征分析.热带亚热带植物学报,23(6):614—624
黄春秀,徐国双,李 扬,2017.大亚湾水域并基拟菱形藻的种类鉴定和产毒特征分析.水生生物学报,已录用
Bates S S,Bird C J,de Freitas A S W,et al,1989.Pennate diatomNitzschia pungensas the primary source of domoic acid,a toxin in shellfish from eastern Prince Edward Island,Canada.Canadian Journal of Fisheries and Aquatic Sciences,46(7):1203—1215
Dao H V,Phan V B,Teng S T,et al,2015.Pseudo-nitzschia fukuyoi(Bacillariophyceae),a domoic acid-producing species from Nha Phu Bay,Khanh Hoa Province,Vietnam.Fisheries Science,81(3):533—539
Guillard R R L,Hargraves P E,1993.Stichochrysis immobilisis a diatom,not a chrysophyte.Phycologia,32:234—236
Lelong A,Hégaret H,Soudant P,et al,2012.Pseudo-nitzschia(Bacillariophyceae)species,domoic acid and amnesic shellfish poisoning:revisiting previous paradigms.Phycologia,51(2):168—216
Li A F,Yu R C,Wang Y F,et al,2005.Morphological and toxicity characteristics ofPseudo-nitzschia pungensstrain PP0201-01 isolated from the East China Sea.Chinese Journal of Oceanology and Limnology,23(4):418—426
Li Y,Huang C X,Xu G X,et al,2017.Pseudo-nitzschia simulanssp.nov.(Bacillariophyceae),the first domoic acid producer from Chinese waters.Harmful Algae,2017,67:119-130.
Lim H C,Teng S T,Leaw C P,et al,2013.Three novel species in thePseudo-nitzschia pseudodelicatissimacomplex:P.batesianasp.nov.,P.lundholmiaesp.nov.,andP.fukuyoisp.nov.(Bacillariophyceae)from the Strait of Malacca,Malaysia.Journal of Phycology,49(5):902—916
Lü S H,Li Y,Lundholm N,et al,2012.Diversity,taxonomy and biogeographical distribution of the genusPseudo-nitzschia(Bacillariophyceae)in Guangdong coastal waters,South China Sea.Nova Hedwigia,95(1—2):123—152
Lundholm N,Daugbjerg N,Moestrup Ø,2002.Phylogeny of the Bacillariaceae with emphasis on the genusPseudo-nitzschia(Bacillariophyceae)based on partial LSU rDNA.European Journal of Phycology,37(1):115—134
Lundholm N,Moestrup Ø,Hasle G R,et al,2003.A study of thePseudo-nitzschia pseudodelicatissima⁄cuspidatacomplex(Bacillariophyceae):what isP.pseudodelicatissima? Journal of Phycology,39(4):797—813
Lundholm N,Moestrup Ø,Kotaki Y,et al,2006.Inter- and intraspecific variation of thePseudo-nitzschia delicatissimacomplex (Bacillariophyceae)illustrated by rRNA probes,morphological data and phylogenetic analyses.Journal of Phycology,42(2):464—481
Miller M A,Pfeiffer W,Schwartz T,2010.Creating the CIPRES science gateway for inference of large phylogenetic trees.In:Proceedings of Gateway Computing Environments Workshop (GCE).New Orleans,LA:IEEE,2010:1—8,doi:10.1109/gce.2010.5676129
Moestrup Ø,Akselmann R,Fraga S,et al,2017.IOC-UNESCO taxonomic reference list of harmful micro algae.(2017-07-24).http://www.marinespecies.org/hab
Percopo I,Ruggiero M V,Balzano S,et al,2016.Pseudo-nitzschia arcticasp.nov.,a new cold-water crypticPseudo-nitzschiaspecies within theP.pseudodelicatissimacomplex.Journal of Phycology,52(2):184—199
Ronquist F,Teslenko M,van der Mark P,et al,2012.MrBayes 3.2:efficient Bayesian phylogenetic inference and model choice across a large model space.Systematic Biology,61(3):539—542
Tammilehto A,Nielsen T G,Krock B,et al,2015.Induction of domoic acid production in the toxic diatomPseudo-nitzschia seriataby calanoid copepods.Aquatic Toxicology,159:52—61
Teng S T,Lim H C,Lim P T,et al,2014.Pseudo-nitzschia kodamaesp.nov.(Bacillariophyceae),a toxigenic species from the Strait of Malacca,Malaysia.Harmful Algae,34:17—28
Teng S T,Tan S N,Lim H C,et al,2016.High diversity ofPseudo-nitzschiaalong the northern coast of Sarawak(Malaysian Borneo),with descriptions ofP.bipertitasp.nov.andP.limiisp.nov.(Bacillariophyceae).Journal of Phycology,52(6):973—989,doi:10.1111/jpy.12448
Trainer V L,Bates S S,Lundholm N,et al,2012.Pseudo-nitzschiaphysiological ecology,phylogeny,toxicity,monitoring and impacts on ecosystem health.Harmful Algae,14:271—300
Wu H Y,Guo M M,Tan Z J,et al,2014.Liquid chromatography quadrupole linear ion trap mass spectrometry for multiclass screening and identification of lipophilic marine biotoxins in bivalve mollusks.Journal of Chromatography A,1358:172—180
PSEUDO-NITZSCHIA FUKUYOI—A NEW RECORD OF TOXICPSEUDO-NITZSCHIATAXA FROM CHINA
HUANG Chun-Xiu1,2, DONG Huan-Chang1,2, WU Hai-Yan3, TAN Zhi-Jun3, LI Yang1,2
(1.Guangzhou Key Laboratory of Subtropical Biodiversity and Biomonitoring,College of Life Science,South China Normal University,Guangzhou510631,China;2.Guangdong Provincial key Laboratory of Healthy and Safe Aquaculture,College of Life Science,South China Normal University,Guangzhou510631,China;3.Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality,Ministry of Agriculture,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao266071,China)
To clarify the species diversity of the genusPseudo-nitzschiain China and declare their domoic acid (DA)production,a set of monoclonal strains were isolated and established from Chinese coastal waters in this study.Based on the morphology under light microscope (LM)and transmission electron microscopy (TEM),and molecular analysis inferred from internal transcribed spacer (ITS)region of ribosomal rRNA encoding gene,and comparison of ITS2-RNA secondary structure,a new recordPseudo-nitzschiaspecies for China was identified:P.fukuyoiLim,Teng,Leaw &Lim.Its morphological features was described in detail and compared with similar species,and the unique molecular feature for the secondary structure of ITS2-RNA was analyzed.Using liquid chromatography tandem mass spectrometry (LC-MS/MS)injection,DA could be detected from all five establishedP.fukuyoistrains,with concentrations around 0.02-0.23 pg cell-1.In addition,Artemia salinaandBrachionus plicatiliswere used to mix-culture withP.fukuyoistrains,to evaluate the impact on the ability of DA-production.The result show that the existence of zooplankton could increase DA-production level ofP.fukuyoifor 4.7–28.5 times.The discovery enriches the diversity of the genusPseudo-nitzschiain China,and report a new toxicPseudo-nitzschiaspecies,P.fukuyoi,which can provide basic data for further studies.
Pseudo-nitzschia fukuyoi;diversity;morphology;internal transcribed spacer;ITS2-RNA secondary structure;domoic acid
Q949.2
10.11693/hyhz20170200032
* 国家自然科学基金项目,31570205号,31370235号;广州市科技计划项目,201607010370号。黄春秀,硕士研究生,E-mail:3127166788@qq.com
① 通讯作者:李 扬,研究员,硕士生导师,E-mail:liyang@scnu.edu.cn
2017-02-18,收修改稿日期:2017-06-01
