靶向沉默786-O细胞Survivin基因表达降低肾癌侵袭能力的研究
2017-12-09徐芝立张丽红张翼梁长春马志强
徐芝立 张丽红 张翼 梁长春 马志强
·论著·
靶向沉默786-O细胞Survivin基因表达降低肾癌侵袭能力的研究
徐芝立 张丽红 张翼 梁长春 马志强
目的探讨Survivin基因影响肾癌侵袭能力的机制。方法利用RNA干扰转染技术靶向沉默肾癌786-O细胞Survivin基因表达,通过RT-PCR及Western blot技术检测Survivin mRNA及蛋白表达水平变化,并检测MMP-2蛋白表达情况。结果成功制备转染Survivin siRNA质粒的低Survivin 表达的786-O/low-Survivin细胞系,细胞表达绿色荧光,转染效率超过90%。RT-PCR电泳条带灰度值显示,Survivin siRNA/786-O组的Survivin mRNA表达水平(0.233±0.044)明显低于Control siRNA/786-O组(0.628±0.093)以及Non-siRNA/786-O组(0.657±0.079)(Plt;0.01)。Control siRNA/786-O组和Non-siRNA/786-O组的Survivin mRNA表达水平差异无统计学意义(Pgt;0.05)。Survivin siRNA转染786-O细胞后,抑制了Survivin基因的转录活性。Western Blot实验显示:Survivin siRNA/786-O组的Survivin蛋白表达水平(2.424±0.303)明显低于Control siRNA/786-O组(15.483±0.343)以及Non-siRNA/786-O组(15.513±0.407)(Plt;0.01)。Survivin siRNA/786-O组MMP-2蛋白表达水平(0.484±0.111)明显低于Control siRNA/786-O组(10.861±1.347)以及Non-siRNA/786-O组(10.947±1.744)(Plt;0.01)。Control siRNA/786-O组和Non-siRNA/786-O组的Survivin蛋白及MMP-2蛋白表达水平均差异无统计学意义(Pgt;0.05)。Survivin siRNA转染786-O细胞后,显著下调了Survivin蛋白水平,并下调了MMP-2蛋白表达水平。结论靶向沉默Survivin基因能显著下调肾癌786-O的SurvivinmRNA和蛋白分子表达,并干扰了MMP-2蛋白的表达,揭示出Survivin基因参与调控肾癌侵袭转移的潜在调控机制。
Survivin基因;MMP-2基因;RNA干扰;肾癌
肾癌是泌尿生殖系统常见肿瘤,占肾脏恶性肿瘤的80%~90%,占成人恶性肿瘤的3%,发病率逐年提高,大约60%的新发病例被偶然发现,其中约25%的患者被确诊已经出现肿瘤转移[1]。根治性肾切除或肾部分切除手术仍然是治愈局限性肾癌的主要治疗方法,而转移性肾癌患者可选的治疗手段及效果较为有限。近些年来,尽管肿瘤分级、临床分期和血管受侵情况可以有效预测肾癌的恶性行为与临床转归,但相同临床分期的肿瘤患者预后经常大不相同,因此,寻找有效预测预后转归的肿瘤标记物分子对于肾癌患者的临床治疗和预后判断有重要的指导意义。随着分子生物学的快速发展,针对肿瘤基因的分子研究和靶向治疗逐渐应用于临床,为转移性肾癌患者的治疗带来新希望。基础研究发现,凋亡抑制蛋白IAP家族的Survivin基因在肿瘤细胞凋亡、肿瘤新生血管生成以及肿瘤侵袭转移等恶性进展过程中发挥了重要作用[2]。临床研究发现,甲状腺癌、膀胱癌、小细胞肺癌、尤文氏肉瘤等多种恶性肿瘤的发生、发展、不良预后与Survivin基因密切相关[3-6]。Xiong等[7]通过meta分析发现肾癌患者肿瘤组织中Survivin基因表达增高,与总生存时间及肿瘤特异性生存时间下降有关,提示Survivin参与了肿瘤恶性进展过程。学者Wang等[8]报道Survivin分子在前列腺癌组织中高表达,且外周血循环肿瘤细胞的Survivin mRNA水平与前列腺癌远转移率明显相关,更进一步揭示出Survivin基因表达可能通过促进肿瘤细胞的侵袭转移行为而参与了肿瘤进展机制。已有国内学者通过RNA干扰技术靶向沉默Survivin基因表达,可以引起基质金属蛋白酶的表达下调,从而抑制食管癌Eca-109细胞的侵袭与迁移能力[9],在食管癌模型上验证了上述构想的可能性。本实验尝试利用质粒载体携带小干扰RNA(siRNA)转染肾癌786-O细胞,靶向沉默Survivin基因的表达,检测其mRNA和蛋白分子表达水平的变化,同时检测基质金属蛋白酶家族MMP-2蛋白的表达,探讨Survivin基因影响肾癌细胞侵袭能力的分子机制,国内鲜有相关文献报道。
1 材料与方法
1.1 材料 人肾癌786-O细胞株由河北省肿瘤研究所冻存惠赠。以HuSH pGFP-V-RS为载体构建发夹结构Survivin沉默质粒,简称Survivin siRNA,空载体质粒中没有Survivin shRNA基因序列的嵌入,又称Control siRNA,购自ORIGENE公司。美国Invitrogen公司设计合成cDNA引物,Survivin上游引物序列5′-CACCGCATCTCTACATTCAA-3′,下游引物序列:5′-CACTTTCTTCGCAGTTTCCT-3′,扩增产物片段为345 bp;内参GAPDH上游引物序列:5′-TGCCAGATGAGGTTGAGCTG-3′,下游引物序列5′-GTAGAGGCAGGGATGATGTTC-3′,扩增产物片段为287bp。Survivin抗体、MMP-2分子抗体均购自美国Abcam公司。RPMI1640培养基、胰蛋白酶、胎牛血清购自美国Gibco公司。第一链cDNA反转录合成试剂盒购自Thermo公司。
1.2 试验方法
1.2.1 细胞培养与转染:人肾癌细胞株786-O接种于含10%胎牛血清的RPMI1640混合培养基中,置于37℃、5%CO2细胞培养箱,当细胞生长至80%~90%融合时进行传代,收集对数生长期的肾癌786-O细胞,分3组准备:Survivin siRNA/786-O组(干扰组)、Control siRNA/786-O组(对照组)和Non-siRNA/786-O组(空白组),按照Lipofectamine 2000转染试剂盒的要求分别转染前2组786-O细胞进行后续实验。
1.2.2 RT-PCR技术检测786-O细胞中Survivin基因的沉默情况:分别取转染后48 h对数生长期的各组细胞裂解后,按照TriQuick总RNA提取试剂(TriQuick Reagent)操作说明书提取总RNA,并进行总RNA浓度、纯度及完整性的检测。①两步法进行RT-PCR反应,第一步:用Thermo公司的第一链cDNA反转录合成试剂盒进行从RNA到DNA的制备。细胞总RNA于42℃ 65 min;70℃ 5 min合成cDNA。第二步:将反应产物cDNA稀释5倍直接用于PCR扩增,反应条件:Survivin:95℃ 5 min;95℃ 1 min,58℃ 1 min,72℃ 90 s,30个循环。72℃ 5 min,4℃终止。GAPDH:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,35个循环。72℃ 5 min,4℃终止。②分别取DNA ladder I和各目的基因的PCR扩增产物5 μl于1.5%的琼脂糖凝胶加样孔中,恒压110 V电泳35 min,用紫外凝胶成像系统进行扫描,采用Gel-Pro Analyzer 3.1分析软件检测条带灰度值,mRNA表达相对值=目的片段灰度值/GAPDH灰度值。
1.2.3 Western Blot实验检测786-O细胞中Survivin基因的沉默情况:取转染后48 h对数生长期的Survivin siRNA/786-O组、Control siRNA/786-O组和Non-siRNA/786-O组的各组细胞裂解,分别提取细胞总蛋白,进行定量。取60 μg蛋白样品及4 μl蛋白marker,分别加入SDA-PAGE凝胶的上样孔中,4℃、恒压90 V缓冲液中电泳分离蛋白分子,转膜,滴加不同比例稀释的一抗,4℃孵育过夜,滴加二抗,孵育,洗涤,最后用Odyssey双色红外荧光扫描系统进行分析。
1.2.4 参照1.2.3 实验步骤,Western Blot实验检测786-O细胞中Survivin基因沉默后MMP-2蛋白的表达水平。
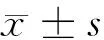
2 结果
2.1 成功转染质粒的786-O细胞 成功制备转染Survivin siRNA质粒的低Survivin 表达的786-O/low-Survivin细胞系,细胞表达绿色荧光,转染效率超过90%。见图1。
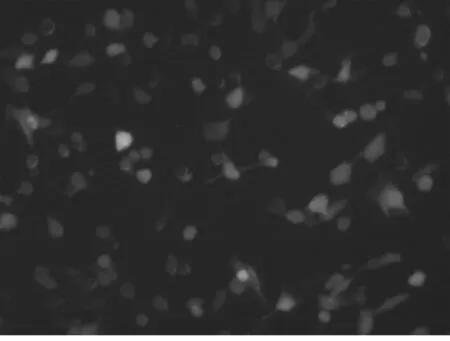
图1 成功转染质粒的786-O细胞
2.2 RT-PCR实验检测RNA干扰肾癌786-O细胞系后Survivin mRNA表达水平 电泳条带灰度值显示,Survivin siRNA/786-O组的Survivin mRNA表达水平(0.233±0.044)明显低于Control siRNA/786-O组(0.628±0.093)以及Non-siRNA/786-O组(0.657±0.079),差异有统计学意义(Plt;0.01)。Control siRNA/786-O组和Non-siRNA/786-O组的Survivin mRNA表达水平差异无统计学意义(Pgt;0.05)。Survivin siRNA转染786-O细胞后,抑制了Survivin基因的转录活性。见表1,图2。
2.3 Western Blot实验检测RNA干扰肾癌786-O细胞系Survivin基因表达后Survivin 蛋白及MMP-2蛋白表达的变化 Survivin siRNA/786-O组Survivin蛋白表达水平(2.424±0.303)明显低于Control siRNA/786-O组(15.483±0.343)及Non-siRNA/786-O组(15.513±0.407)(Plt;0.01)。Survivin siRNA/786-O组MMP-2蛋白表达水平(0.484±0.111)明显低于Control siRNA/786-O组(10.861±1.347)及Non-siRNA/786-O组(10.947±1.744)(Plt;0.01)。Control siRNA/786-O组和Non-siRNA/786-O组Survivin蛋白及MMP-2蛋白表达水平均差异无统计学意义(Pgt;0.05)。Survivin siRNA转染786-O细胞后,显著下调了Survivin蛋白水平,并下调了MMP-2蛋白表达水平。见表1。
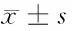

组别SurvivinmRNASurvivinproteinMMP-2protein干扰组0.233±0.0442.424±0.3030.484±0.111对照组0.628±0.093*15.483±0.343*10.861±1.347*空白组0.657±0.079*15.513±0.407*10.947±1.744*
注:与干扰组比较,*Plt;0.01
3 讨论
肾癌是严重危害人类健康的恶性肿瘤之一,发病率逐年提高。由于肾癌多属天然耐药肿瘤,放化疗均不敏感,尚没有针对中晚期肾癌的特异性有效疗法。随着分子生物学的进步,研究发现许多癌基因的激活参与了肾癌发生发展过程。
Survivin基因位于人类染色体17q25,片段长14.7 kb,编码142个氨基酸组成的蛋白,分子质量约16.5 kDa,含有杆状病毒IAP(inhibition of apoptosis proteins)序列,是1997年由Ambrosini等利用效应细胞蛋白酶受体-1(effector cell protease receptor-1,EPR-1) cDNA在人类基因组库的杂交筛选中分离出来的[10]。Survivin基因在肿瘤细胞周期调控、细胞自噬以及瘤内血管形成等多方面扮演癌基因的角色,其异常高表达与肿瘤的预后密切相关[11]。研究发现,Survivin基因不同程度表达在于人的睾丸、胸腺、血管内皮细胞及胚胎组织中,除此之外,在人的正常分化成熟的组织中检测不到Survivin的表达,但在绝大多数人类肿瘤细胞中都高表达,参与调控细胞重要的生理病理过程,具有抑制肿瘤细胞凋亡、促进肿瘤细胞增殖侵袭和肿瘤间质血管形成、降低癌细胞对放疗和化疗的敏感性等作用,与肝癌、肾癌等众多恶性肿瘤患者的不良预后生存密切相关[12]。Kim等[13]对局部晚期的直肠癌患者进行术前放化疗的标本进行检测发现,Survivin高表达患者在放化疗后出现明显的肿瘤分期降级。Tarik等[14]则报道,胆囊癌组织Survivin表达量增加与肿瘤组织淋巴管浸润及患者生存时间降低关系密切,提示Survivin基因表达增强了肿瘤细胞的侵袭能力而促进了肿瘤进展。肿瘤的迅速生长、包膜浸润、血管侵袭、转移及耐药产生等是影响肿瘤预后的重要因素,Survivin能参与其中多个过程而显著降低肿瘤的治疗效果和缩短总生存时间,是恶性细胞转化的标志[11]。
RNA干扰(RNA interference,RNAi)是通过小干扰RNA(small interference RNA,siRNA)造成靶基因mRNA特异性降解,从而使基因转录后沉默的现象[15]。与传统的反义寡核苷酸(ASODNs)、反义肽核酸(ASPNAs)技术相较,新的基因阻断方法RNA干扰技术以其高效性和序列特异性的优点,成为极富应用潜力的抗肿瘤基因治疗新方式。我们通过携带siRNA的质粒转染肾癌786-O细胞,检测到Survivin mRNA及蛋白表达水平明显下降,成功靶向沉默了Survivin基因,证实了siRNA基因序列的有效性,构建了低Survivin 表达的786-O/low-Survivin细胞系,在此基础上,对肿瘤侵袭能力密切相关的基质金属蛋白酶家族分子MMP-2蛋白表达水平进行检测。
基质金属蛋白酶(matrix metalloproteinase,MMPs)是一组含Ca2+、Zn2+的能降解细胞外间质的蛋白酶,几乎能降解细胞外基质中的各种蛋白成分,在肿瘤侵袭转移中起主要作用[16]。目前已经分离鉴定出26个成员,其中MMP-2属于MMPs家族中重要成员,可以形成Ⅳ型胶原酶降解肿瘤细胞外间质和基底膜的Ⅳ型胶原蛋白,帮助肿瘤细胞浸润周围组织,从而导致肿瘤侵犯局部组织并转移至远处器官[17]。国内学者贾海燕等[18]报道,MMP-2在肾透明细胞癌中呈过度表达,MMP-2的高表达与肾透明细胞癌肿瘤的分级、临床分期及侵袭转移有关。李昌等[19]发现,MMP-2的表达与肝外胆管癌发生、发展和浸润转移相关,认为MMP-2可能在肝外胆管癌的浸润转移中发挥重要作用。我们对低Survivin 表达的786-O/low-Survivin细胞系进行检测发现,MMP-2蛋白表达明显降低,而Control siRNA/786-O组以及Non-siRNA/786-O组的MMP-2蛋白表达水平无明显差异,这显示靶向沉默Survivin基因干扰了MMP-2基因的蛋白分子表达,也提示Survivin基因可能通过调控MMP-2基因表达参与了肿瘤细胞的侵袭转移过程。
研究发现,在新生血管内皮及血管腔分支形成中,Survivin基因呈现高表达状态,可以促进血管内皮的持续增殖以形成瘤内血管系统[20]。肿瘤组织中Survivin基因的高表达增强了β-catenin、T细胞因子及血管内皮生长因子(vascular endothelial growth factor,VEGF)的转录活性与表达水平;提示Survivin基因促进肿瘤基质血管形成的能力是肿瘤侵袭转移的必需因素[21]。而MMP-2作为基质金属蛋白酶家族(MMPs)中最重要的成员,通过降解细胞外基质,帮助肿瘤细胞顺利穿越细胞外基质和基底膜,侵袭转移到周围组织与远器官,为肿瘤间质血管的形成、扩展起到协同促进作用[22]。这种肿瘤进展中的病生理机制将Survivin基因与MMP-2基因表达紧密联系到一起,我们的实验通过靶向沉默Survivin基因表达可以降低MMP-2分子的表达量,也一定程度上验证了Survivin基因与MMP-2基因在肿瘤的侵袭和转移中的相互作用机制。
由于Survivin基因在人体正常组织和肿瘤组织中表达水平的明显差异,使其成为基因靶向治疗的理想靶分子,因此,针对Survivin基因基础与临床研究逐渐成为肿瘤防治领域的热点课题。Seo等[23]发现,膀胱癌细胞高表达Survivin基因,利用嵌合型病毒携带Survivin启动子基因与肿瘤细胞基因融合后,可以在细胞及肿瘤组织模型上展现高效杀伤能力。Xia等[24]在人类肝癌细胞中,利用YM155作为Survivin的抑制剂,降低Survivin基因转录水平,损伤DNA,可以抑制细胞增殖与促进肿瘤凋亡。有学者则将肝癌PLC/PRF/5细胞的Survivin基因敲除,建立Survivin基因沉默表达的PLC-k3细胞系,发现铂类化疗药物极大增强了对癌细胞的杀伤能力[25]。还有学者利用热休克蛋白SP90的抑制剂NVP-AUY922下调乳头状甲状腺癌的Survivin表达而诱导肿瘤细胞出现凋亡[26]。在结肠癌中,Wang等[27]利用RNA干扰技术沉默Survivin启动子激活因子c-Myc的表达,封闭Survivin基因,使结肠癌细胞系增加了对放疗的敏感性。针对Survivin基因的靶向治疗可以增强放化疗效果,提高患者生存率。这些研究表明,下调Survivin基因表达能有效抑制肿瘤的发生、恶性发展,Survivin作为肿瘤抗原基因具有应用于肿瘤基因治疗的巨大潜力。
目前,在针对Survivin分子的免疫治疗实践中,Survivin蛋白作为肿瘤相关抗原,可以在动物体内利用其免疫原性诱导产生抗Survivin的免疫应答。国外学者已经尝试在临床Ⅰ/Ⅱ实验中应用Survivin多肽分子和多肽疫苗进行机体接种,在难治性黑色素瘤患者中观察到抗Survivin的T细胞数量增加,降低肿瘤复发率,延长患者生存时间[28]。这些研究结果显示,Survivin分子作为肿瘤相关抗原,在肿瘤基因治疗中应用潜力巨大。另外,由于Survivin基因表达具有显著的细胞周期依赖性,因此在其高峰表达的G2/M细胞周期阶段进行干扰阻滞,可诱导细胞凋亡并降低肿瘤的侵袭迁移能力。
综上所述,我们的实验利用RNA干扰技术成功靶向沉默了肾癌786-O细胞Survivin基因的表达,并检测到MMP-2蛋白表达出现下调,在一定程度上揭示了Survivin基因影响肾癌肿瘤侵袭转移的分子机制,表明Survivin基因作为肿瘤免疫治疗靶基因具有潜在的应用价值。由于MMP-2分子不仅促进癌细胞的侵袭、转移,还在启动癌细胞恶性增殖、抑制肿瘤调亡以及促进癌组织基质血管形成等肿瘤进展中的多个环节中发挥重要作用[29],所以Survivin基因如何通过调控MMP-2分子表达进而影响肿瘤转移,其具体分子机制尚需进一步研究。进一步研究如何利用Survivin基因表达的肿瘤特异性来调控癌基因与抑癌基因的表达水平,对肿瘤细胞和肿瘤微环境进行高选择性杀伤,还需要更多的临床与基础研究数据。
1 Koike H,Nitta M,Sekine Y,et al.YM155 reverses rapamycin resistance in renal cancer by decreasing survivin.J Cancer Res Clin Oncol,2014,140:1705-1713.
2 梁宗英,侯继申,董晓利,等.大蒜素干预下大鼠血清对食管癌EC109细胞凋亡及Survivin表达的影响.河北医药,2015,37:3528-3530.
3 Yazdani N,Sayahpour FA,Haghpanah V,et al.Survivin gene polymorphism association with papillary thyroid carcinoma.Pathol Res Pract,2012,208:100-103.
4 Srivastava AK,Singh PK,Srivastava K,et al.Diagnostic role of survivin in urinary bladder cancer.Asian Pac J Cancer Prev,2013,14:81-85.
5 Chen P,Zhu J,Liu DY,et al.Over-expression of survivin and VEGF in small-cell lung cancer may predict the poorer prognosis.Med Oncol,2014,31:775.
6 Shelake S,Sankpal UT,Bowman WP,et al.Targeting specificity protein 1 transcription factor and survivin using tolfenamic acid for inhibiting Ewing sarcoma cell growth.Invest New Drug,2017,35:158-165.
7 Xiong CH,Liu HP,Chen,ZX,et al.Prognostic role of survivin in renal cell carcinoma:A system review and meta-analysis.Eur J Intern Med,2016,33:102-107.
8 Wang HS,Yang MS,Xu J,et al.Survivin mRNA-circulating tumor cells are associated with prostate cancer metastasis.Tumor Biol,2016,37:723-727.
9 牛朝霞,张秀芝,陈洁,等.Survivin基因沉默抑制食管癌Eca-109细胞的侵袭与迁移.安徽医科大学学报,2016,51:185-188.
10 Ambrosini G,Adida C,Altieri DC.A novel antiapoptosisgene,survivin,expressed in cancerand lymphoma.Nat Med,1997,3:917-921.
11 殷海森,赵新颖,苏长青.以Survivin为靶标的肿瘤治疗策略.第二军医大学学报,2016,37:342-348.
12 Su CQ.Survivin in survival of hepatocellular carcinoma.Cancer Lett,2017,379:184-190.
13 Kim K,Chie EK,Wu HG,et al.High survivin expression as a predictor of poor response to preoperative chemoradiotherapy in locally advanced rectal cancer.Int J Colorectal Dis,2011,26:1019-1023.
14 Tarik S,Asuman A,Tulu K,et al.The prognostic significance of survivin expression in gallbladder carcinoma.APMIS,2016,124:633-638.
15 Guo S,Kemphues KJ.Par-l,a gene required for establishing polarity in C.elegans embryos,encodes aputative Ser/Thr kinase that is asymmetrically distributed.Cell,1995,81:611-620.
16 Liu J,Ping W,Zu Y,et al.Correlations of lysyloxidase with-MMP2/MMP9 expression and its prognostic value in non-small cell lung cancer.Int J Clin Exp Pathlo,2014,7:6040-6047.
17 Jacob A,Jing J,Lee J,et al.Rab40b regulates trafficking of MMP2 and MMP9 during invadopodia formation and invasion of breast cancer cells.J Cell Sci,2013,126:4647-4658.
18 贾海燕,李丕宝.肾透明细胞癌组织中COX-2、MMP-2的表达变化及意义.山东医药,2015,55:36-37.
19 李昌,杨岩,蓝诺,等.肝外胆管癌组织MMP-2表达及其临床意义.中华肿瘤防治杂志,2017,24:689-691.
20 郭建霞,张小云,赵春林,等.Wnt/β-catenin信号通路相关因子与结肠癌患者预后的相关性研究.河北医药,2016,38:371-373.
21 Fernandez JG,Rodriguez DA,Valenzuela M,et al.Survivin expression promotes VEGF-induced tumor angiogenesis via PI3K/Akt enhanced β-catenin/TCF-Lef dependent transcription.Mol Cancer,2014,13:209.
22 Costa AM,Pinto F,Martinho O,et al.Silencing of the tumor suppressor gene WNK2 is associated with upregulation of MMP2 and JNK in gliomas.Oncotarget,2015,6:1422-1434.
23 Seo HK,Seo JB,Nam JK,et al.Development of replication-competent adenovirus for bladder cancer by controlling adenovirus E1a and E4 gene expression with the survivin promoter.Oncotarget,2014,5:5615-5623.
24 Xia H,Chen J,Shi M,et al.The over-expression of survivin enhances the chemotherapeutic efficacy of YM155 in human hepatocellular carcinoma.Oncotarget,2015,6:5990-6000.
25 Or YY,Chow AK,Ng L,et al.Survivin depletion inhibits tumor growth and enhances chemosensitivity in hepatocellular carcinoma.Mol med Rep,2014,10:2025-2030.
26 Liu J,Sun W,Dong W,et al.HSP90 inhibitor NVP-AUY922 induces cell apoptosis by disruption of the survivin in papillary thyroid carcinoma cells.Biochem Biophys Res Commun,2017,487:313-319.
27 Wang R,Chen DQ,Huang JY,et al.Acquisition of radioresistance in docetaxel-resistant human lung adenocarcinoma cells is linked with dysregulation of miR-451/c-Myc-survivin/rad-51 signaling.Oncotarget,2014,5:6113-6129.
28 Altieri DC.Targeting survivin in cancer.Cancer Lett,2013,332:225-228.
29 Fisher JF,Mobashery S.Mechanism-based profiling of MMPs.Methods Mol Biol,2010,622:471-487.
MechanismoftargetedsilencingSurvivingeneexpressioninhumanrenalcarcinomacellline-786-Ocellstoreduceinvasionabilityofrenalcarcinomainvitro
XUZhili,ZHANGLihong,ZHANGYi,etal.
DepartmentUrinarySurgery,TheThirdHospitalofShijiazhuangCity,Shijiazhuang050011,China
ObjectiveTo investigate the mechanism of targeted silencing Survivin gene expression in human renal carcinoma cell line-786-O cells to reduce invasion ability of renal carcinoma.MethodsThe RNA inteference transfection technique was used to silence Survivin gene expression in human renal carcinoma 786-O cells.The expression levels of Survivin mRNA and protein as well as MMP-2 protein were detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western Blot,respectively.ResultsThe 786-O/low-Survivin was established successfully.As compared with control siRNA/786-O and non-siRNA/786-O,and the Survivin siRNA/786-O showed obvious reduction of expression levels of Survivin mRNA and protein (Plt;0.01).Moreover the expression levels of MMP-2 protein were also down-regulated significantly in Survivin siRNA/786-O (Plt;0.01). However there were no significant differences in the expression levels of Survivin mRNA between siRNA/786-O control group and non-siRNA/786-O group (Pgt;0.05). After Survivin siRNA was transfected into 786-O cells,which inhibited the transcription activity of Survivin gene. Western Blot assay showed that the expression levels of Survivin protein (2.424±0.303) in Survivin siRNA/786-O group were significantly lower than those (15.483±0.343) in siRNA/786-O control group as well as those (15.513±0.407) in non-siRNA/786-O group (Plt;0.01). Moreover the expression levels (0.484±0.111) of MMP-2 protein in Survivin siRNA/786-O group were significantly lower than those (10.861±1.347) in siRNA/786-O control group as well as those (10.947±1.744) in non-siRNA/786-O group (Plt;0.01). However there were no significant differences in the expression levels of Survivin protein and MMP-2 protein between siRNA/786-O control group and non-siRNA/786-O group (Pgt;0.05). After Survivin siRNA was transfected into 786-O cells,which obviously down-regulated the expression levels of Survivin protein and MMP-2 protein.ConclusionThe targeted silencing of Survivin gene can obviously down-regulate the expression levels of Survivin mRNA and protein in human renal carcinoma cell line-786-O cells,and can interfere the expression of MMP-2 protein,which suggests that Survivin gene may participate in the regulation mechanism of invasion and metastasis of renal cancer.
Survivin gene; MMP-2 gene; RNA interference; renal cancer
10.3969/j.issn.1002-7386.2017.23.001
项目来源:石家庄市科学技术研究与发展指导计划项目(编号:131462333)
050011 河北省石家庄市第三医院泌尿外科
R 737.11
A
1002-7386(2017)23-3525-05
2017-07-18)
