CDC6在颅咽管瘤中表达及靶向CDC6 RNAi抑制肿瘤细胞增殖的研究
2017-12-09王淑为张剑宁刘爽赵虎林
王淑为 张剑宁 刘爽 赵虎林
(海军总医院神经外科,北京 100048)
·小儿神经外科疾病的诊断与治疗·
CDC6在颅咽管瘤中表达及靶向CDC6 RNAi抑制肿瘤细胞增殖的研究
王淑为 张剑宁 刘爽 赵虎林*
(海军总医院神经外科,北京 100048)
目的研究真核细胞中细胞分裂周期蛋6(CDC6)与颅咽管瘤(CP)的相关性,探讨其对CP细胞的生物学作用。方法免疫组化法检测CP标本中CDC6的表达情况,并合成CDC6小的干涉核糖核酸 (siRNA)片段,转染CP细胞。用四甲基偶氮唑盐(MTT)法检测干扰CDC6表达后CP细胞生长水平,绘制细胞生长曲线。同时应用流式细胞仪(FCM)检测细胞周期。结果免疫组化结果显示在正常脑组织与CP组织中CDC6表达存在明显差异,而生长曲线显示下调CDC6的表达之后,CP细胞增殖变慢,曲线变缓,与未转染的细胞相比细胞生长被明显抑制。流式细胞仪分析细胞周期发现细胞的脱氧核糖核酸合成后期(G2)明显缩短,提前进入合成(M)期。结论CDC6在CP细胞中表达量较正常细胞高,而且参与了CP细胞的增殖调控。
CDC6; CP; 细胞增殖; 细胞周期
颅咽管瘤(craniopharyngioma, CP)是一种生长缓慢的先天性表皮源性肿瘤,常位于鞍区。是颅内最常见的肿瘤之一,在儿童鞍区肿瘤中,CP约占60%以上。其临床表现出侵袭性生长的生物学行为,治疗效果不佳,并发症多,容易复发,严重影响了患者的生存质量和存活时间[1]。在过去的150多年来,众多学者对CP进行了广泛的研究,但主要集中在治疗方面,而基础研究极少,使人们对CP分子水平和生物学特点方面知之甚少。本课题将研究细胞分裂周期蛋白6 (cell division cycle 6, CDC6)在颅咽管瘤中的表达及临床意义以及靶向下调CDC6的表达对CP细胞增殖作用的影响,从而为CP提供新的临床治疗方法以及阐述其基因水平发病机制奠定基础。
材料与方法
一、病历资料
本研究所使用标本来自中国人民解放军海军总医院神经外科选择者的肿瘤组织。其中有20例正常脑组织石蜡标本,20例CP组织石蜡标本(10例釉质上皮型和10例鳞状乳头型),以及5例新鲜CP手术切除组织切块。所有纳入标本的患者临床病理资料均完整,首选治疗均为手术治疗,术前无放、化疗史。所有标本均经两位病理专家复核确认,取材、使用均经本院伦理委员会讨论同意,并签署患者知情同意书。设立实验组和对照组,后采用免疫组织化学亲和素-生物素-过氧化物酶复合物(avidin-biotin-peroxidase complex, ABC)法进行染色。
二、主要试剂
常规培养液为添加10%胎牛血清(fetal bovine serum, FBS)(Hyclone, 美国)的改良Eagle基本培养基(Dulbecco's modified Eagle Medium, DMEM)(Gibco, 美国)。含有乙二胺四乙酸(ethylenediamine tetraacetic acid, EDTA)的胰酶及淋巴细胞分离液购自泰格美公司,细胞周期检测试剂盒均购自美国Gibco公司,CDC6单克隆抗体(mouse anti-CDC6 molyclonal antibody)购自Santa-Cruze公司,小干扰核糖核酸片段(small interfering RNA, siRNA)。
三、方法
1.免疫组化染色:石蜡切片常规脱蜡、脱水、按免疫组化ABC法试剂盒说明书进行操作。染色的切片随机选取5个视野,计数100个细胞,按照阳性细胞数占总细胞数的百分比评分:阳性细胞数<25%为0分,25%~50%为1分,50%~75%为2分,>75%为3分;再按染色强度评分:0分为无色,1分为淡黄色,2分为黄色,3分为棕黄色。两项得分相乘,综合结果进行评分,两项相乘≥4者记为阳性。采用χ2检验、Fisher's确切概率法及Spearman相关分析,α=0.05(双侧),比较实验组和对照组CDC6的表达差异,以及不同病理类型间CDC6的表达不同,得出结论。
2.CP细胞培养:新鲜CP手术切除组织切块来源于海军总医院神经外科住院患者共5例,术后病理证实均为牙釉质上皮型。在新鲜肿瘤组织边缘,无囊变、坏死、钙化及电凝的部位无菌取材后,将组织置于含有2 mL 0.25% EDTA-胰酶的30 mm培养皿中,用剪刀将组织剪碎,37 ℃消化20 min。用3 mL添加10% FBS的DMEM培养液终止消化。无菌滤网过滤细胞,1000 r/min离心5 min。弃上清,DMEM洗3次,用含10% FBS的DMEM培养液混悬沉淀,以1×103个细胞/3 mL接种于六孔板,每两天换液一次,倒置显微镜下观察细胞生长。选取生长情况最佳的细胞作为后续研究所用细胞。
3.靶向CDC6 RNAi体外抑制CP细胞的增殖研究:①有效干扰片段筛选:设计合成三条CDC6 siRNA(上海吉玛),代号分别为304、793、1146。CP细胞在10 cm培养皿中培养至 80%~90%融合时,倾去培养液,用 2 mL无血清DMEM 液洗涤细胞两次。加入1 mL EDTA-胰酶溶液混匀后,37 ℃放置1 min。小心吸去胰酶溶液,在加入2 mL含10% FBS的DMEM 培养液,吹打使细胞形成单细胞悬液。血球计数板计数,按1×105细胞/孔的浓度接种 6孔板,混匀后37 ℃ 5% CO2培养24 h。1OD siRNA干粉用120 μL焦碳酸二乙酯(diethy pyrocarbonate, DEPC)水溶解,终浓度约为20 μM。在1.5 mL离心管(Eppendorf, EP)中加入250 μL DMEM,再加入10 μL siRNA,取另一1.5 mL EP管,加入250 μL DMEM,加入5 μL lipofectamin 2000,混匀,室温放置5 min后将两管混合,室温放置20 min。吸去6孔板中的培养液,每孔加入 500 μL无血清的 DMEM 培养液。将转染混合物逐滴加入 6 孔板中,混匀后,在培养箱中温育6 h。吸弃转染液,加入2 mL含10% FBS的D/F12培养液,于37 ℃、5% CO2继续培养至24 h、48 h,分别收样,进行实时定量聚合酶链式反应(real-time PCR)及免疫印迹法(Western Blot)法检测,筛选有效干扰片段并确定最佳干扰时间。②MTT法检测CP细胞增殖活力:将生长状态良好的转染CDC6 siRNA的CP细胞和对照组未转染CP细胞用无血清DMEM培养基稀释成1×104/mL,分别接种于24孔板(1 mL/孔),每组设6个平行孔,同时设空白对照(仅添加培养基)。置37 ℃,5% CO2培养箱内过夜。分别培养0、24、48和72 h,向各组孔内加入100 μL MTT溶液,继续培养4 h,向各孔中加入甲瓒裂解液1 mL,继续置CO2培养箱中孵育至甲瓒全部溶解,于微量振荡器上轻轻震荡混匀15 min,吸出裂解液,酶标仪上490 nm测定各孔吸光度值(optical density, OD),取各孔吸光度的平均值,以时间为横轴,OD值为纵轴绘制增殖曲线。③流式细胞仪(flow cytometer, FCM)分析:CP细胞转染 24、48 h后用常规胰酶消化,洗2次,制成单细胞悬液,并调整细胞数量至1×106/mL。加入 1 mL预冷磷酸缓冲盐溶液(phosphate buffer saline, PBS)重悬细胞,1000 r/min离心5 min,吸净上清。加入500 μL PBS,轻轻重悬细胞,使细胞分离为单个,逐滴加入预冷的100%乙醇(-20 ℃)1.5 mL,使其终浓度为75%,4 ℃,放置过夜固定。取出固定的样品,1000 r/min×5 min,弃上清。加入1 mL预冷PBS重悬细胞,1000 r/min×5 min,离心收细胞。重复1次,以除去乙醇,用300目滤网过滤,样品浓度调至1×105/mL。加入150 μL RNA酶(250 g/mL)重悬细胞,37 ℃消化30 min。加入100 L碘化丙啶(propidium iodide, PI)工作液,4 ℃避光染色30 min。转至流式检测管,上机检测,PI用488 nm 氩离子激光器激发,由630带通滤光片接收,通过散点图收集细胞,采用设门技术排除粘连细胞和在碎片,分析PI荧光直方图上细胞各周期的百分率。
四、统计学分析
将所得结果使用SPSS 16.0统计学软件进行分析。定量资料进行单通道ANOVA单因素方差分析,方差不齐者采用秩和检验,样本间的两两比较应用t检验,P<0.05被认为差异有统计学意义。
结 果
一、免疫组化染色
CDC6主要表达于细胞浆及细胞核中,从免疫组化结果(图1)可以看出,CP细胞中比CDC6表达量较正常细胞明显增高,差异具有统计学意义(P<0.05)。
二、CP细胞的培养
原代CP细胞呈小团状生长,有细胞击落形成,散在分布。聚集的细胞大小不一,多为多边形,密度低时可见单个长梭形细胞。细胞透亮,遮光性好,呈“铺路石”样排列,初次接种细胞增殖较慢,团状细胞可重叠生长,前2 d细胞生长较慢,第3~5天汇合率可达80%~90%[2]。
三、靶向CDC6 RNAi 体外抑制CP细胞的增殖研究
1.有效感染片段选择:实验设计的三条感染片段包装病毒感染细胞后,real-time PCR结果显示,编号为1146的片段在转染CP细胞24 h后,CDC6表达量在三条片段中最低(图2)Western Blot也显示同样的结果(图3)。因此最终选定编号为1146的片段作为感染片段,且转染后24 h为细胞周期检测最佳时间。
2.MTT检测细胞增殖能力:MTT检测发现转染了CDC6 siRNA片段的细胞增殖能力明显低于正常细胞(图4),在转染后24 h达到最低。且差异具有统计学意义(P<0.05)。
3.细胞周期检测:流式细胞仪检测细胞周期发现转染CDC6感染片段的细胞G1期明显变长,而G2期明显缩短(P<0.05),这与CDC6调节有丝分裂的功能有关(图5)。

图1 免疫组化ABC法检测标本中CDC6表达(×200)
Fig 1 Expression of CDC6 detected by ABC staining (×200)
A:The immunohistochemical staining of craniopharyngioma cells showed the expression of CDC6 in craniopharyngioma cells was apparently higher than the normal cells; B:The immunohistochemical staining of the expression of CDC6 in normal cells.
图2 Real-time PCR筛选有效干扰片段
Fig 2 Screening effective interfering fragments by real-time PCR
A:Relative gene expression of CDC6 using real-time PCR at 24 h after transfection. The data showed 1146 was the most effective interfering fragments; B:Relative gene expression of CDC6 using real-time PCR at 48 h after transfection. The data showed 24 h was the optimum time.

图3 Western Blot筛选有效干扰片段
Fig 3 Screening effective interfering fragments by Western Blot
A:CDC6 protein expression using Western Blot at 24 h after transfection. The data showed 1146 was the most effective interfering fragments; B:CDC6 protein expression using Western Blot at 48 h after transfection. The data showed 24 h was the optimum time.
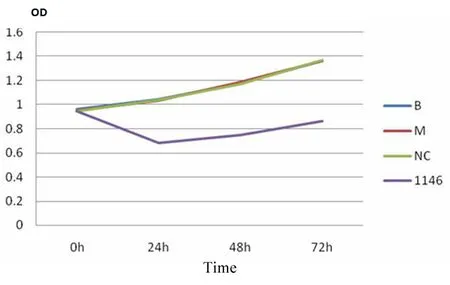
图4 细胞增殖能力检测
Fig 4 The cell growth of CP cells and CDC6 siRNA CP cells for 72 h
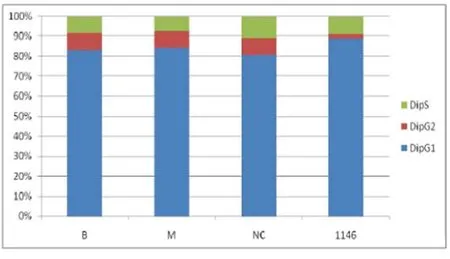
图5 流式细胞仪检测细胞周期变化
Fig 5 Cell cycle detection by flow cytometry
讨 论
细胞异常增殖是肿瘤发展的核心过程,细胞的增殖与细胞周期密切相关,而细胞周期又受DNA复制起始蛋白的调控,真核细胞中CDC6是起始细胞DNA复制的必需蛋白,其主要功能是参与组装完成“复制前复合体(pre-replication complexes, pre-RC)”[3]。近期的研究发现,CDC6在调控细胞有丝分裂方面也具有重要作用[4]。CDC6介导基因组异常情况下苏氨酸蛋白激酶通路信号的活化[5],从而阻止有丝分裂的提前进入。CDC6还可抑制有丝分裂期细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1, CDK1)的活性[6-7],促进有丝分裂滑脱[8]。因此,CDC6必然与细胞的恶性增殖及恶性转化密切相关,抑制CDC6将会产生有效的抗肿瘤作用。近年来已有CDC6在非小细胞性肺癌、甲状腺癌、前列腺癌等肿瘤细胞中高表达的报道。
颅咽管瘤是上皮源性肿瘤,组织学上分为釉质上皮型、鳞状乳突型。CP虽然生长缓慢,但因位置特殊往往难于根治,反复复发后引起视神经级垂体等结构的进行性损害[9]。我们在临床中见证应用CDC6抑制剂对CP患者进行治疗并取得良好的肿瘤控制,由此推测CDC6在CP的发生、发展的过程中起着重要作用。
我们首先研究了石蜡切片中正常脑组织及CP组织CDC6表达情况的差异,免疫组化染色结果显示CP细胞中的CDC6表达量明显高于正常脑组织细胞,这和其他实体肿瘤中的情况一致[10-12]。为了进一步探讨CDC6对CP细胞的生物学活性的影响,我们设计合成了CDC6 siRNA,筛选到有效片段之后,将其转染CP细胞,然后对其生长情况进行了分析,结果显示,下调CDC6的表达后,CP细胞的增殖能力明显降低。并且G2期显著缩短,提示细胞提前进入有丝分裂期(M期)。因此,我们认为,CDC6不仅阻碍了CP细胞的增殖,而且对其细胞周期也有重要的影响。
以上的研究结果提示,CDC6可能在CP的发生发展中起着重要作用。因此我们认为,深入研究CDC6在CP生物学特性中的作用,对于揭示CDC6的作用机制及其对CP的治疗有重要的理论指导和临床意义,有望为CP提供新的治疗靶点。
1CHANG C V, ARAUJO R V, CIRQUEIRA C S, et al. Differential expression of stem cell markers in human adamantinomatous craniopharyngioma and pituitary adenoma [J]. Neuroendocrinology, 2017, 104(2):183-193.
2常洪波, 高铭, 王淑为, 等. 13例颅咽管瘤细胞体外培养及鉴定 [J]. 中华神经外科疾病研究杂志, 2015, 14(2):150-154.
3CHEN S, CHEN X, XIE G, et al. CDC6 contributes to cisplatin-resistance by activation of ATR-Chk1 pathway in bladder cancer cells [J]. Oncotarget, 2016, 7(26):40362-40376.
4HE Y, YAN D, ZHENG D, et al. Cell division cycle 6 promotes mitotic slippage and contributes to drug resistance in paclitaxel-treated cancer cells [J]. PLoS One, 2016,11(9):2633-2647.
5MARTINEZ-BARBERA J P, ANDONIADOU C L. Concise Review:paracrine role of stem cells in pituitary tumors:a focus on adamantinomatous craniopharyngioma [J]. Stem Cells, 2016, 34(2):268-276.
6LIU Y, WANG C H, ZHANG S C, et al. TREM-1 expression in craniopharyngioma and Rathke's cleft cyst:its possible implication for controversial pathology [J]. Oncotarget, 2016, 7(31):50564-50573.
7THIMSEN V, HÖLSKEN A, BUCHFELDER M, et al. EpCAM (CD326) is differentially expressed in craniopharyngioma subtypes and Rathke's cleft cysts [J]. Nature, 2016, 6:29731.
8HOSSAIN M, STILLMAN B. Opposing roles for DNA replication initiator proteins ORC1 and CDC6 in control of Cyclin E gene transcription [J]. Elife, 2016, 5:e12785.
9COOK J G, PARK C H, BURKE T W, et al. Analysis of CDC6 function in the assembly of mammalian prereplication complexes [J]. Proc Natl Acad Sci USA, 2002, 99(3):1347-1352.
10PIATTI S, LENGAUER C, NASMYTH K, et al. CDC6 is an unstable protein whose de novo synthesis in G1 is important for the onset of S phase and for preventing a "reductional" anaphase in the budding yeast Saccharomyces cerevisiae [J]. EMBO J, 1995, 14(15):3788-3799.
11LAU E, ZHU C, ABRAHAM R T, et al. The functional role of CDC6 in S-G2/M in mammalian cells [J]. EMBO Rep, 2006, 7(4):425-430.
12CLAY-FARRACE L, PELIZON C, SANTAMARIA D, et al. Human replication protein CDC6 prevents mitosis through a checkpoint mechanism that implicates Chk1 [J]. EMBO J, 2003, 22(3):704-712.
EffectsofCDC6onproliferationofcraniopharyngiomacellsinvitro
WANGShuwei,ZHANGJianning,LIUShuang,ZHAOHulin
DepartmentofNeurosurgery,NavyGeneralHospitalofPLA,Beijing100048, China
ObjectiveThe effect of CDC6 on proliferation of craniopharyngiom (CP) cells in vitro was explored.MethodsImmunohistochemical method was used to detect the expression of CDC6 in the specimens of craniopharyngioma, and CDC6 siRNA interference fragments were synthesized. MTT method was used to detect the growth of the tumor cells after interference, and the cell growth curve was drawn and the cell growth inhibition rate was calculated. The cell cycle was detected by flow cytometry.ResultsThe results of immunohistochemistry showed that the expression of CDC6 was significantly different between normal brain tissue and craniopharyngeal tumor tissue, and the growth curve showed that after down-regulation of CDC6 expression, craniopharyngioma tumor cell growth was slow, which indicated the cell growth was significantly inhibited compared with non-transfected cells. Cell cycle was detected by flow cytometry.ConclusionThe expression of CDC6 is higher in craniopharyngioma cells, and is involved in the regulation of proliferation of craniopharyngioma cells.
CDC6; Craniopharyngioma cells; Proliferation; Cell cycle
1671-2897(2017)16-389-04
R 739.41
A
王淑为,主管技师,硕士,E-mail:wangshuwei618@163.com
*通讯作者: 赵虎林,副主任医师,博士,E-mail:zhaohulin_90@sohu.com
2017-01-04;
2017-04-05)
