EDTA络合电位滴定法测定硫酸镍中镍的研究
2017-12-07陈潮炎
张 侠,陈潮炎
(1.徐州北矿金属循环利用研究院,江苏 徐州 221002;2.北矿检测技术有限公司,北京 102628)
EDTA络合电位滴定法测定硫酸镍中镍的研究
张 侠1,2,陈潮炎2
(1.徐州北矿金属循环利用研究院,江苏 徐州 221002;2.北矿检测技术有限公司,北京 102628)
本文采用铜离子选择电极为指示电极,Ag/AgCl电极为参比电极,Cu-EDTA溶液为指示剂,以EDTA为滴定剂,并优化了自动电位滴定仪参数,确定了最佳试验条件,运用自动电位滴定法直接测定硫酸镍中的主体元素镍。方法较EDTA滴定法更简单方便,自动化程度高,无需再用氯化锌标准溶液进行返滴定,最大程度地降低了判断终点所造成的误差,结果准确。
硫酸镍;EDTA电位滴定法;镍
1 试验部分
1.1 仪器与试剂
瑞士万通公司生产的888型自动滴定仪,20 mL交换单元,铜离子选择电极,Ag/AgCl参比电极。
镍标准溶液:称取1.000 0g金属镍(99.999%)于250 mL烧杯中,加20 mL盐酸(1+1),加热至完全溶解,冷却,移入1 000 mL容量瓶中,以水定容。此溶液含镍1.000 g/L。
氨水-氯化铵缓冲溶液:称取54 g氯化铵溶于200 mL水中,加350 mL氨水,移入1 000 mL容量瓶中,以水定容,该缓冲溶液pH为10。
Cu-EDTA溶液:(1)称取1.588 7 g高纯阴极铜于150 mL烧杯中,加30 mL盐酸(2+3),加热至完全溶解,蒸至小体积,加20 mL水煮沸,冷却,加水至200 mL,加氨水调至pH9;(2)称取9.306 g乙二胺四乙酸二钠,加150 mL水溶解;(3)将上述两份溶液移入同一个500 mL容量瓶中,以水定容,Cu与EDTA等量络合,其Cu-EDTA络合物浓度为0.05 mol/L。
EDTA标准溶液的配制:称取13.06 g乙二胺四乙酸二钠,加水溶解,移入1 000 mL容量瓶中,以水定容,此溶液c(EDTA)≈0.035 mol/L。转入仪器专用滴定瓶中,按试验方法用镍标准溶液进行标定。
1.2 试验
移取适量含镍溶液于250 mL烧杯中,加水至100 mL左右,用氨水(1+1)调至pH10(用pH试纸测试),加10 mLpH10的氨水-氯化铵缓冲溶液,加磁子于烧杯中,放在滴定台上搅拌均匀。加入1 mLCu-EDTA溶液作指示溶液,以铜离子选择电极为指示电极,Ag/AgCl电极为参比电极,EDTA标准溶液为滴定剂,888型自动滴定仪自动记录电位变化,至电位发生突跃,仪器记录下电位突跃(即滴定终点)时滴定剂所耗体积,向仪器中输入试样量及计算公式,计算试样中镍的含量。
2 结果与讨论
2.1 电极工作原理
本试验采用铜离子选择电极为指示电极,EDTA为滴定剂,加入1mL Cu-EDTA络合物,以指示电位变化,其原理为在未达到终点时,Cu-EDTA中的Cu2+被Ni2+取代而对铜离子电极响应,产生相应电位,达到等当点时,Cu2+与最后加入的EDTA络合,Cu2+浓度发生突跃变化,相应的电位也发生突跃变化,从而指示终点[1]。除指示电极外,选择银-氯化银电极作参比电极,此电极稳定性和重现性均较好,其内充液为3 mol/LKCl溶液。
2.2 滴定pH的选择
笔者分别探讨了以氨水-氯化铵(pH10)与醋酸-醋酸钠(pH5.5~6.0为介质,以铜离子选择电极为指示电极,以EDTA标准溶液直接滴定10.00 mg镍。试验表明:(1)以醋酸-醋酸钠为缓冲介质,电位没有突跃,仪器无法指示终点;(2)采用氨水-氯化铵为缓冲介质,EDTA标准溶液直接滴定,电位突跃明显,镍回收率在98%以上。所以,选择pH10的氨水-氯化铵缓冲溶液为滴定介质,其用量为20 mL。
2.3 Cu-EDTA溶液用量
笔者试验了作为指示剂用的0.05 mol/LCu-EDTA溶液的用量对滴定10.00 mg镍终点及电位突跃的影响,其结果如表1、表2所示。结果表明,Cu-EDTA溶液的加入量由1至6 mL,其电位突跃大小没有变化,而滴定同样量的镍,其EDTA消耗量变化不大,略呈递增的趋势。Cu-EDTA溶液在滴定前加入或在预加滴定剂时即滴定刚开始时加入,对滴定没有影响。为节约试剂用量,选择1 mLCu-EDTA溶液为指示溶液。

表1 Cu-EDTA溶液用量对滴定的影响
2.4 EDTA标准溶液的同步标定
取5.00 mg、10.00 mg、20.00 mg、30.00 mg镍,按试验方法分别滴定,其结果如图1所示,通过线性回归得到EDTA标准溶液对镍的滴定系数FNi为2.056 mg/mL,曲线线性方程式为Y=0.007 38+0.485 89X,线性相关系数为0.999 9;按镍标准溶液滴定系数计算EDTA标准溶液浓度分别为0.035 10 mol/L和0.035 04 mol/L,与用锌标准溶液标定的结果0.035 01 mol/L一致。

图1 镍工作曲线
以10.00 mg镍标准溶液绘制滴定曲线,如图2所示。在pH10的氨性缓冲溶液中,以铜离子选择电极为指示电极,Ag/AgCl电极为参比电极,Cu-EDTA溶液为指示剂,EDTA标准溶液分别直接滴定镍其电位突跃明显。

图2 10.00 mg镍U-V滴定曲线
2.5 共存离子的影响
2.5.1 铁的干扰
向10.00 mg镍标准溶液中加入不同量的铁(Ⅲ),按试验方法测定镍的含量,计算回收率,其结果如表2所示。

表2 铁干扰试验
结果显示,当测定溶液中铁含量低于20 mg时,镍测定结果相对误差小于5%,随着铁含量的增加,镍回收率逐渐下降。大量的铁在pH10条件下形成氢氧化铁沉淀,这是铁吸附少量Ni2+造成的,当溶液中铁含量小于10 mg,对Ni2+的吸附较小,不影响测定结果,可不需掩蔽铁而直接滴定。与使用指示剂的普通滴定法相比,能在浑浊或有沉淀的溶液中直接进行滴定也是电位滴定法的优势所在。当铁含量大于10 mg时,氢氧化铁沉淀对Ni2+的吸附已造成镍回收率明显偏低,需要寻找合适的掩蔽剂。
2.5.2 锰的干扰
向10.00 mg镍标准溶液中加入不同量的锰(Ⅱ),按试验方法测定镍的回收率,其结果如表3所示。试验结果表明,随着锰(Ⅱ)加入量的增加,镍的回收率降低,锰(Ⅱ)在10 mg以下,对钴的测定无影响;锰(Ⅱ)在10 mg以上,应预先分离。

表3 锰(Ⅱ)干扰试验
2.5.3 掩蔽剂的选择
酒石酸与柠檬酸钠是氨性溶液中铁的良好掩蔽剂,滴定法中一般采用酒石酸与柠檬酸钠掩蔽铁、铝、铜、铅、锰、锌等杂质离子。因此,配制浓度均为300 g/L的酒石酸钠与柠檬酸钠,以铁为例,比较它们在10.00 mg镍溶液中对铁掩蔽的效果,其结果如表4所示。

表4 铁掩蔽试验
由结果可知,柠檬酸钠掩蔽铁的效果比酒石酸钠好,掩蔽铁时应先加入柠檬酸钠,然后再调成氨性,掩蔽速度快。
2.6 样品分析
2.6.1 硫酸镍
称取0.200 0 g样品于150 mL烧杯中,加10 mL盐酸(1+1),溶解蒸至小体积,稍冷,加20 mL水,煮沸,冷却后加水至100 mL。然后,按试验方法进行多次测定,其中一份试样加入10.00 mg镍进行加标回收试验,其结果如表5所示。
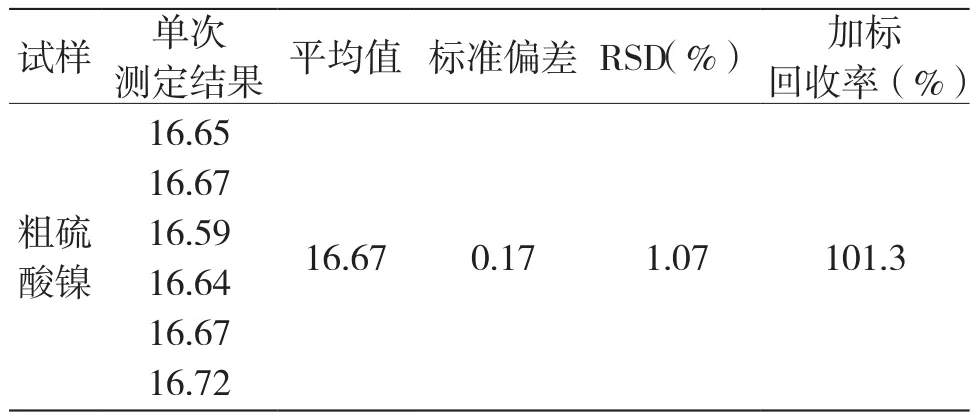
表5 试验结果(n=6)
2.6.2 空白试验
取三份空白溶液,加入10 mLpH10的氨水-氯化铵缓冲溶液,1 mLCu-EDTA溶液,按试验方法,改加液步长为0.005 mL,其EDTA标准溶液滴定体积分别为0.010 mL、0.008 mL、 0.011 mL,试剂空白远远小于试样分析时所选择的加液步长0.050 mL,在测定过程中可忽略不计。但加入10 mLCu-EDTA溶液时,其空白消耗有0.055 mL,这验证了表1中随着Cu-EDTA溶液用量的加入,滴定10.00 mg镍所消耗的EDTA标准溶液体积略有增加的原因。
2.6.3 精制硫酸镍
称取2.000 g左右样品于150 mL烧杯中,加10 mL盐酸、50 mL水,煮沸溶解盐类,冷却后转移至200 mL容量瓶,加水定容,分取10 mL上述溶液至150 mL烧杯,按试验方法进行测定,其结果如表6所示。该方法与丁二酮肟重量法(经典分析方法)比较,结果一致。

表6 镍试验结果(n=6)
3 结论
本文在EDTA络合滴定方法基础上采用铜离子选择电极为指示电极,Ag/AgCl电极为参比电极,Cu-EDTA溶液为指示剂,以EDTA为滴定剂,优化仪器参数,运用自动电位滴定法直接测定镍。本方法比普通EDTA滴定法及重量法更简单方便,减少了试剂消耗,自动化程度高。本方法测定镍结果准确,RSD为0.17%~1.10%加标回收率分别为101.3%和100.8%,无需再用氯化锌标准溶液返滴定,不存在判断终点所造成的人为误差,结果准确,可以作为硫酸镍中主体镍的测定方法推广使用。
1 李华昌,陈潮炎.矿石及有色金属分析法[M].北京:科学出版社,1973.
Determination of Nickel in Nickel Sulfate by EDTA Complex Potentiometric Titration
Zhang Xia1,2, Chen Chaoyan2
(1.BGRIMM-Xuzhou Institute of Metai Recycling, Xuzhou 221002,China;2.Beijing General Research Institute of Mining and Metallurgy, Beijing 102628, China)
Absrtact:In this paper, the copper ion selective electrode was used as the electrode, Ag/AgCl electrode as the reference electrode, Cu-EDTA solution as the indicator, EDTA as the titrant, and optimized the parameters of the automatic potentiometric titrator to determine the best test conditions, Direct Determination of Nickel in Nickel Sulfate by Automatic Potentiometric Titration.Method is simpler and more convenient than EDTA titration, high degree of automation, no need to use zinc chloride standard solution for titration, the maximum extent to reduce the error caused by the end point, the results are accurate.
nickel sulfate; EDTA potentiometric titration; nickel
TQ153.2 < class="emphasis_bold">文献标识码:A文章编号
1008-9500(2017)10-0020-03
2017-08-22
张侠(1982-),女,江苏徐州人,硕士研究生,工程师,从事有色金属贵金属分析工作,Email:13056236200@163.com。
