模拟联合制碱法制备纯碱实验的优化设计
2017-12-06张志明
张志明
摘要:通过模拟工业制纯碱方法的实验设计及课堂教学,加深学生对两种工业制纯碱方法——氨碱法、联合制碱法反应原理的认识。应用化学平衡移动原理,根据不同种盐存在的溶解度差异,分析、解释复分解反应的条件以及应用复分解反应制备盐类的方法。通过控制化学反应条件,对碳酸氢钠晶体的析出进行实验探究及优化设计。
关键词:工业制纯碱;模拟实验;复分解反应;溶解度差异;混合物分离
文章编号:1005–6629(2017)11–0066–03 中图分类号:G633.8 文献标识码:B
纯碱是碳酸钠Na2CO3的俗称,又称苏打,碱灰。纯碱的工业制法是中等职业学校、普通高中学生所接触的化工生产工艺流程及反应原理之一。我们参考模拟工业制备纯碱实验设计的相关资料[1~4],针对实验的每一个细节,进行了认真的挖掘、整合,对实验过程进行了改进。通过模拟工业制备纯碱实验,使学生加深理解物质之间的转化是有条件的,可以通过控制反应的条件来控制化学反应,并进一步认识混合物的分离、提纯在工农业生产中的实际应用。
1 模拟工业制备纯碱的实验原理
氨碱法(又称索尔维制碱法)和联合制碱法(又称侯氏制碱法)是工业制备纯碱两种生产方式。两种制碱法的基本原理是相同的:在氯化钠饱和水溶液中首先通入氨气构成饱和氨盐水溶液后,通入二氧化碳气体形成溶解度较小的白色碳酸氢钠沉淀和氯化铵溶液。其反应的化学方程式为:
2 模拟工业氨碱法制备纯碱的实验设计
2.1 实验装置设计
制取纯碱的第一步是制取碳酸氢钠,实验装置如图1所示。A是稀盐酸与石灰石反应制取二氧化碳的简易装置;B是用饱和碳酸氢钠溶液洗除被二氧化碳气体带出的氯化氢气体的装置;C是制取氨气的实验装置,即在常温下,在固体氢氧化钠中滴入浓氨水来制取氨气;D是制取碳酸氢钠的装置;E是尾气吸收装置。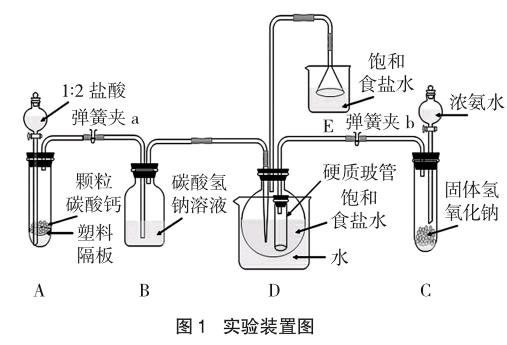
2.2 實验仪器和药品
仪器:天平、量筒、铁架台、试管、500mL烧杯、圆底烧瓶、洗气瓶、硬质玻璃管、玻璃导管、尖嘴玻璃管、双孔塞、三孔塞、酒精灯、普通漏斗、分液漏斗、弹簧夹、蒸发皿、玻璃棒、乳胶管、滤纸
试剂:1:2盐酸溶液、石灰石(主要成分是碳酸钙)颗粒、氢氧化钠、饱和碳酸氢钠溶液、浓氨水、氯化钠、酚酞试液
2.3 实验操作步骤
(1)如图1所示,连接组装好实验仪器,进行实验装置的气密性检查。
(2)配制1000毫升食盐饱和溶液备用。在室温时,氯化钠的溶解度约为36.0g/100g水。
(3)在图1装置D的圆底烧瓶中加入30毫升食盐饱和溶液,滴加1~2滴酚酞试液。立即打开盛有50毫升浓氨水的分液漏斗及弹簧夹b,把生成的氨气通入图1装置D的饱和食盐水中,观察到溶液由无色→粉红色→深红色的变化,同时,在饱和食盐水上方形成白雾。继续通入15~25分钟氨气,再打开装有50毫升1:2盐酸的分液漏斗及弹簧夹a,把生成的二氧化碳气体经洗气瓶进入图1装置D的氨化饱和食盐水中,控制水浴温度在30~35℃,并控制通入经过洗涤、干燥的二氧化碳大约5~8分钟,饱和食盐氨水溶液开始变浑浊,大概10~15分钟后,有大量的白色沉淀(即碳酸氢钠固体)形成。在持续通入二氧化碳情况下,把圆底烧瓶移入冰水中,冷却后充分析出沉淀。
(4)把圆底烧瓶中的碳酸氢钠固体和溶液静置、过滤,少量冷却水淋洗操作两次。并把滤纸上吸干的碳酸氢钠晶体全部合并放入蒸发皿中,在石棉网上用酒精灯加热灼烧,且用玻璃棒不断地搅拌,使碳酸氢钠固体受热均匀,以防止结块。大约30分钟后制得白色粉末状的碳酸钠固体(纯碱)。停止加热,冷却到室温。
(5)在上述过滤后滤液的主要成分为NH4Cl,在低温(5~10℃)条件下,加入适量细粉状NaCl粉末,通入氨气形成氯化铵沉淀析出,经过滤、洗涤和干燥就得到氯化铵。将上述析出氯化铵后滤液(基本上是氯化钠的饱和溶液)中,通入氨气和二氧化碳气体仍然可以用于碳酸氢钠的制取,这样滤液就能够反复循环使用。
3 模拟工业氨碱法制备纯碱实验的讨论
3.1 制取气体仪器装置的气密性
实验证明,密封性能好,实验效果才好。在实验装置图1的D中导管下端接一粗的玻管是防止倒吸现象的发生;二氧化碳通入氨化食盐水溶液的尖嘴导管比平口导管的实验效果要好。
3.2 制取纯碱的关键是生成碳酸氢钠反应条件的控制
3.2.1 温度的选择
根据这四种盐在不同温度下的溶解度的差异,大致可以判断出从复分解反应体系中分离盐的条件、分离方法及其实验操作步骤。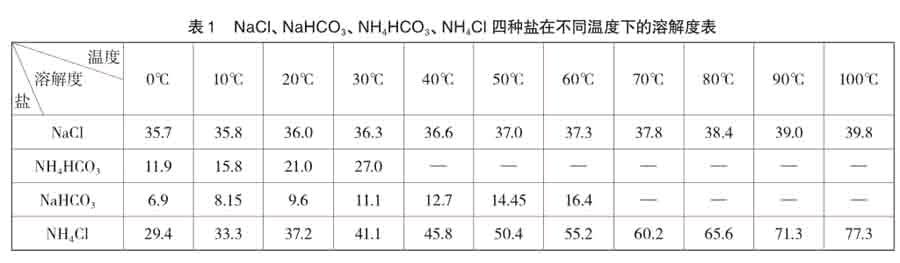
从表1可以看出,在NaCl、NaHCO3、NH4HCO3、NH4Cl组成的水溶液体系中,这四种盐在同一温度下,碳酸氢钠的溶解度是最小的,而温度超过35℃,又会引起碳酸氢铵的分解,温度过低其溶解度又会降低,不利于复分解反应的进行。同时,温度过高,氨化食盐水溶液中的氨挥发,造成氨的损失,温度过低,反应速率降低。所以,只有在温度为30~40℃,才是适宜制备碳酸氢钠的条件。
3.2.2 控制溶液的酸碱度

因此,实验成功的关键:使用的食盐水一定要达到饱和;通入的氨气和二氧化碳必须纯净干燥;二氧化碳通入氨化食盐水溶液的导管应选用尖嘴导管。通过观察酚酞试液作为氨气和二氧化碳发生化学反应指示剂的颜色变化,来调控二氧化碳和氨气的实验操作。
化学实验教学就是通过让学生提出问题、查找资料、进行实验分析的过程,从化学的视角来处理工农业生产中的理论与实践相结合的问题;通过学生对实验事实的加工整理及其在科学逻辑推理的基础上进行交流、讨论与反思,让学生经过实验探究,提升实验探究与实验设计的能力,培养实验操作能力,树立学生发展的观念,逐步形成让学生有成功感和获得感的教学策略。
参考文献:
[1]王绪岩.联合制碱法反应原理的模拟实验设计[J].化学教学,2008,(5):12~13.
[2]陆丽洁,刘丽君.模拟工业制备纯碱的实验设计[J].化学教学,2014,(1):52~54.
[3]焦桓,冯会军,李淑妮,陈琳,何地平,白云山,徐玲.氨碱法制取碳酸钠实验方法的改进探讨[J].化学教育,2015,(24):43~45.
[4]孙根班,易慧霞,李崧,欧阳津,蒋福宾.模拟工业制碱法的微型化实验设计[J].实验技术与管理,2015,(8):40~44.endprint
