促进学生知识结构化的盐类水解复习教学研究
2017-12-06徐宇峰彭小平
徐宇峰+彭小平
摘要:通过调研发现学生对盐类水解相关内容的知识结构化程度不高,学生习惯从宏观、定性、静态和孤立的角度解释盐类水解问题,对盐溶液中微粒间相互作用关系的理解不够深刻。针对上述学情,提出在盐类水解的复习课教学中以弱电解质电离平衡为思考起点,以平衡常数为核心,从微观、动态、定量和系统的角度理解盐类水解概念和规律,并帮助学生将相关知识建立起清晰的逻辑链,提高知识结构化程度。
关键词:盐类水解;复习教学;平衡常数;知识结构化
文章编号:1005–6629(2017)11–0049–04 中图分类号:G633.8 文献标识码:B
盐类水解是中学化学中的核心概念和原理,是离子反应、化学平衡、弱电解质电离平衡、水的电离及溶液酸碱性等知识的综合运用,对学生的知识基础和逻辑思维能力要求较高。通过新课学习,学生已经对盐类水解有初步认识,但难以主动将之前所学的化学平衡、弱电解质电离等内容整合形成系统的认识。复习课的重要任务之一是促进学生知识结构化,要做到这一点,教师需要深刻了解学生现有的认识水平,分析其在知识和能力上存在的不足,這既是复习教学起点也是确定复习课目标、重难点的依据。
1 学生对盐类水解原理的认识水平分析
笔者对温州市某重点中学高二学生进行调研,15位调研对象是化学选考班的学生,已经学习过了盐类水解的相关内容,他们的化学学科综合水平在班级处于中等。调研测试情况见表1。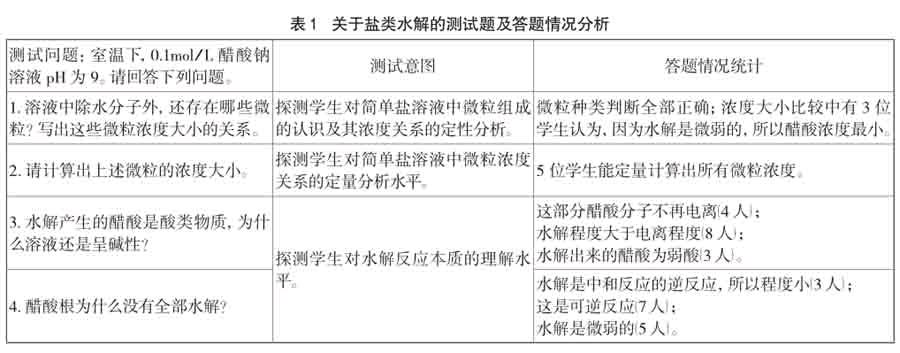
通过进一步访谈,笔者发现学生对盐类水解的认识存在以下问题:
(1)学生在对水解本质的认识上深刻性和系统性不够。学生未能深入认识到弱电解质电离和盐类水解的内在关联,普遍存在机械记忆现象(如:水解是微弱的)。在分析问题中习惯于从宏观、定性和静态的角度或直接用某些结论(如:水解是中和反应的逆反应,所以程度小)进行说明。
(2)学生忽略了平衡常数在盐类水解中的价值。大多数学生对盐溶液中微粒浓度大小关系的认识只停留在定性水平,这反映出学生对盐溶液中微粒间相互作用的认识水平不足。没有认识到平衡常数的价值,自然不能运用平衡常数这个工具进行定量计算。
盐类水解是一个高度综合的知识,对抽象思维、微观想象的能力要求很高,上述问题看似简单,但是要准确回答需要将酸碱反应、化学平衡、弱电解质电离、溶液酸碱性和盐类水解等知识根据学科内在的逻辑进行有效整合,利用逻辑推理的方法从微观、定量和动态的角度才能分析出问题的本质。
2 盐类水解原理的知识结构分析
笔者认为溶液中的离子反应(非氧化还原反应)本质上就是微粒的解离和结合,盐溶于水的过程就是不同的微粒在解离、结合的竞争过程中达到动态平衡,可用平衡常数衡量各种微粒的定量关系。
以醋酸钠溶液为例,醋酸钠为可溶性强电解质,在中学阶段一般视为在水中完全电离。醋酸和水都是弱电解质,即醋酸根和氢氧根都具有结合氢离子的能力,根据醋酸和水的电离常数可知氢氧根结合氢离子能力远远超过醋酸根离子。因此醋酸钠溶液中醋酸根水解本质是:醋酸根和氢氧根同时在竞争氢离子的动态过程,竞争的直观结果就是溶液酸碱性的变化(水解产生的弱电解质通常难以检测)。
不同的弱电解质(包括水)电离能力的差异性使阴离子结合氢离子(或阳离子结合氢氧根)的能力不同,其衡量标准就是电离常数。由于水的电离常数比常见的弱电解质小得多,因此通常盐类水解是微弱的,由此可以进一步推出溶液中各种微粒的浓度大小。如果某弱电解质的电离常数接近于水甚至小于水,那么其盐的水解程度将非常大。比如,乙醇的pKa为15.9[1],因此乙醇钠的水溶液碱性极强,在有机反应中常常作为重要的强碱性催化剂。
综上所述,在进行盐类水解复习教学时,我们需要用系统、整体的思维,以弱电解质电离平衡为思考起点,以平衡常数为核心,经过严密的逻辑推理帮助学生从定量角度进一步理解盐类水解的本质,进而对酸碱反应、化学平衡、弱电解质电离、溶液酸碱性和盐类水解等概念和原理整合形成一个充分体现学科内在逻辑的知识结构。
3 促进学生知识结构化的盐类水解复习课教学设计
3.1 教学目标
(1)能从微粒间相互作用的强弱关系(定性)和平衡常数(定量)的角度重构对盐类水解本质的认识,进而深入理解影响盐类水解的因素。
(2)以平衡常数为分析工具,学会判断常见溶液中的微粒成分及其浓度大小比较。
(3)以醋酸钠溶液为例,在分析盐类水解的本质过程中感受到逻辑推理的重要价值,并能运用逻辑推理的方法解决类似的化学问题(氯化铵、碳酸钠、氯化铁等溶液)。
(4)能在思考分析过程中倾听他人意见,相互启发,体会到合作交流的重要。
3.2 教学重难点
以平衡常数为分析工具,整体考虑溶液中微粒的行为,从“竞争”、“动态平衡”的视角理解盐类水解的本质及其影响因素,对混合溶液中微粒浓度大小比较进行有序的分析。
3.3 教学结构图
教学结构见图1。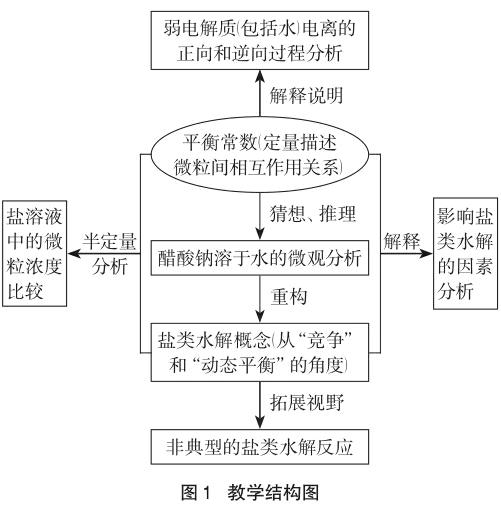
3.4 教学流程
3.4.1 重构盐类水解的概念
引入:(投影)盐类水解、溶液中的离子反应和化学反应速率平衡的思维导图。
教师指出:盐类水解是化学平衡的典型运用,平衡常数是理解和解决盐类水解问题的关键。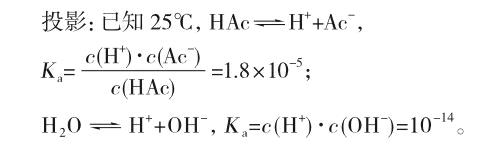
思考1:平衡常数大小可以衡量可逆反应的进行程度,K值越小,反应进行程度越低,所以H2O比HAc更难电离。那么逆反应进行程度如何?逆反应分别代表哪一类反应?endprint

设计意图:(1)从学生熟悉的弱电解质电离平衡入手,根据可逆反应的特点,以平衡常数为纽带将“弱电解质的电离、强酸制弱酸”等已有的知识进行整合,初步形成逻辑链,再根据这个逻辑链推理出盐溶于水时微粒在溶液中的各种行为及程度大小,促使学生从“竞争”和“动态平衡”的角度深入理解盐类水解本质,同时也提高了相关知识的结构化水平。(2)根据弱电解质(醋酸和水)电离平衡常数推导出水解平衡的平衡常数数值,促进学生将原有的定性认识逐步发展到定量认识。
3.4.2 形成分析微粒浓度大小的有序思维
情境创设:无论通过实验测定还是运用K值计算,均可得到如下结论:
25℃时,1mol/L醋酸溶液,醋酸的电离度约为0.14%;1mol/L醋酸钠溶液,醋酸根的水解程度约为0.01%;醋酸钠固体溶于水,视为100%电离;纯水的电离度约为10-7%。
问题解决1:根据K分析,弱酸HX及其钠盐NaX形成浓度均为0.1mol/L的混合溶液pH为6,请分析溶液中的微粒成分及浓度大小关系。
问题解决2:根据溶液pH,进一步分析上述微粒的具体浓度大小。
学生通过计算发现:虽然都是“>”,但其差别非常大:c(X-)、c(Na+)和c(HX)极为接近,c(HX)远大于c(H+)。
设计意图:利用平衡常数将不同物质电离程度进行半定量化,既有助于学生对“微弱”有直观认识,也便于学生在分析溶液中微粒浓度大小时能形成主次有序的思维方法,促进学生有序思维的发展[2]。通过进一步计算具体浓度,可以促进学生对常见的“比较大小”、电荷守恒和物料守恒有更加深刻直观的认识。
3.4.3 对盐类水解影响因素的再认识
思考4:在盐类水解学习中我们常常说“越弱越水解”,能否从平衡常数的角度进行说明?
学生:酸根水解的平衡常数表达式为Kw/Ka,酸越弱,Ka越小,则水解平衡常数越大,即水解程度越大。
思考5:已知室温下HX,Ka=10-6,HY,Ka=10-7。请分析NaX溶液和NaY溶液的pH大小关系。请解释原因。影响水解程度大小的因素有哪些?
学生:不能比较,因为水解程度大小与物质的性质有关,也与浓度、温度和溶液中的某些微粒(如氢离子、氢氧根等)有关。
思考6:以1L 0.1mol/L NaAc溶液为例,当溶液稀释到2L时,请从平衡常数的角度进行说明“越稀越水解”?
学生讨论得出:根据K和Qc的比较可以判断出,稀释促使水解平衡正向进行,即水解程度增大。
设计意图:在新课教学中对影响盐类水解程度因素的分析是通过实验和勒夏特列原理展开的,学生常常记住一些诸如“越弱越水解”的结论,本环节的设计在于从平衡常数角度分析影响水解程度的因素,将定性的经验结论上升到定量的理论依据,从而促进学生对水解规律的深刻认识。
3.4.4 拓宽盐类水解的固有思维
拓展视野:如果某种弱酸HQ的电离程度略小于水的电离程度。则将适量的NaQ固体溶入水中,请推测Q-的水解程度大小,并写出其水解离子方程式。
學生讨论,得出结论:由于HQ电离程度略小于水,意味着Q-比OH-结合H+能力略强,从微粒间“竞争和动态平衡”角度分析,因此会有大部分Q-发生了水解。
阅读材料:(百度百科)乙醇的Ka=10-16,比水更难电离。乙醇钠,又称乙氧基钠,白色或微黄色吸湿性粉末,可溶于无水乙醇而不分解,遇水分解成氢氧化钠和乙醇;用作强碱性催化剂、乙氧基化剂以及作为一种凝聚剂和还原剂用于有机合成中。
师生共同研读阅读材料。
设计意图:盐类的水解通常是微弱的。学生往往将此作为“重要结论”,在分析微粒浓度大小的时候,这个观点是重要依据。实质上,其根本原因在于常见弱电解质的电离常数比水要大得多。以假想的HQ为对象,利用刚刚学习过的知识方法分析其水解反应,再提供乙醇钠相关的阅读材料目的在于让学生对盐类水解的理解更加全面,避免认识固化。
4 教学反思
中学化学属于化学学科教育的基础阶段,需要对一些概念和原理进行简化处理便于学生初步认识化学学科。为了帮助学生学习特别是为了解题需要,教师常常归纳出一些经验性方法或结论,这些经验性的方法或结论适用范围较窄或不够严谨,也容易导致学生机械记忆,因此学生对化学学科内在的逻辑性感受不如物理学科那么深刻。细细考察盐类水解原理的知识结构,我们发现盐类水解具有良好的逻辑性,平衡常数是逻辑链的核心,在复习教学中充分体现学科内在的逻辑结构,既能帮助学生深入理解概念、原理,又能让学生对化学学科特点有新的认识。
布鲁纳在《教育过程》中指出:任何学科都具有其固有的基本结构,学科基本结构指知识的整体性和事物的普遍联系,而非孤立的事实本身和零碎的知识结论。教师需要充分考察学生的认知水平,精心设计教学以促进学生的认知结构与化学知识结构相吻合,一般而言,学生的认知结构与化学学科知识结构吻合度越高,其合理性就越大,就更具有迁移应用的能力。在本节课的设计中从弱电解质(以醋酸和水为例)电离平衡开始,根据平衡常数特点分析电离的逆向过程,初步认识到微粒间的相互作用关系,进而猜想醋酸钠固体溶于水时的微粒行为,又用平衡常数证明了猜测结果,水到渠成地重新建构了盐类水解概念,再继续推演出微粒浓度比较的基本方法和影响盐类水解的因素。本节课凸显了将宏观-微观和定性-定量之间充分结合,依据严密的逻辑推理形成新的知识,使新、旧知识之间通过牢固的逻辑链,形成结构良好的知识组块,这不仅有助于学生的知识建构,也有助于知识的提取和迁移,为化学问题解决提供了基本思路。
参考文献:
[1]邢其毅.基础有机化学(第3版)[M].北京:高等教育出版社,2005:29.
[2]徐宇峰,彭小平.理清学生解题错误原因,提高习题教学效率——从一个教学案例说起[J].化学教育,2015,(13):36~39.endprint
