青蒿琥酯对脂多糖诱导人结肠上皮细胞炎症反应影响的分子机制研究
2017-12-06张兴强
蒋 师,张兴强
青蒿琥酯对脂多糖诱导人结肠上皮细胞炎症反应影响的分子机制研究
蒋 师a,张兴强b*
目的探讨青蒿琥酯对脂多糖诱导人结肠上皮细胞炎症反应的影响,并研究青蒿琥酯对人结肠上皮细胞炎症治疗作用的可能机制。方法体外原代培养人结肠上皮细胞,并分为空白对照组,LPS诱导组,青蒿琥酯低、中、高剂量组,CCK-8法检测青蒿琥酯对人结肠细胞增殖的影响,ELISA法检测青蒿琥酯对人结肠上皮细胞分泌IL-6和TNF-α炎症因子的影响,Western blot检测青蒿琥酯对Traf6/p65信号通路的影响。结果与LPS诱导组相比,青蒿琥酯能显著改善LPS对人结肠上皮细胞增殖的抑制作用(P<0.05);与LPS诱导组相比,各剂量青蒿琥酯均显著降低了人结肠上皮细胞分泌的IL-6和TNF-α水平(P<0.05);免疫印迹法检测发现,各剂量青蒿琥酯组相对LPS诱导组细胞中Traf6和p-p65表达水平明显降低(P<0.05)。结论青蒿琥酯可抑制人结肠上皮细胞炎症反应,进而改善炎症对细胞增殖的抑制作用,其作用机制可能与下调Traf6/p65信号通路活化有关。
青蒿琥酯;人结肠上皮细胞;炎症;信号通路
0 引言
青蒿琥酯(Artesunate)是青蒿素的一种半合成衍生物,对疟疾的治疗有显著效果,还具有抗炎和免疫调节作用[1]。青蒿琥酯能有效抑制自身免疫的发生,且其毒性较低,引起的不良反应较少[2]。青蒿琥酯抑制关节炎症主要通过抑制NF-κB信号通路传导途径中由LPS诱导的炎症因子的分泌[3]。青蒿琥酯在炎症治疗中的研究越来越多,而其在消化系统中相关作用的研究较少。结肠炎是炎症性肠病,主要病变位置在黏膜层与黏膜下层,多累及直肠与远端结肠,甚至整个结肠,严重影响患者的生活质量[4]。因此,笔者研究了青蒿琥酯对原代人结肠上皮细胞炎症反应的影响,并探讨青蒿琥酯对介导炎症反应Traf6/p65信号通路活化的影响,以期对结肠炎的治疗奠定理论基础。
1 材料及方法
1.1 试剂及仪器 青蒿琥酯(百灵威科技有限公司,批号:88495-63-0,≥98%);HIEC培养基(美国ScienCell公司)、抗细菌/真菌溶液(美国ScienCell公司)、Ⅳ型胶原酶溶液(美国Sigma公司)、Ⅰ型胶原酶溶液(美国Sigma公司)、胰蛋白酶(美国Sigma公司);CCK-8试剂盒购自北京智杰方远科技有限公司;BCA蛋白浓度测定试剂盒(上海谷歌生物有限公司,批号:P0012S-07);ELISA试剂盒购自武汉华美生物有限公司;TBS粉末(武汉谷歌生物有限公司);一抗稀释液(上海吉诺公司,批号:C154855);ECL显色液(Sigma公司);β-actin、Traf6、p65和p-p65一抗均购自美国Cell Signaling Technology;二抗羊抗兔IgG购自美国LI-COR Biosciences。单人超净台(北京六一仪器厂);CB15C02细胞培养箱(北京六一仪器厂);Victor3 1420 Multilable Counter酶标仪(美国BD,FACS AriaⅢ);HD-3000凝胶成像仪(上海上天精密仪器有限公司)。
1.2 青蒿琥酯储备液制备 精密称取青蒿琥酯10 mg于1.5 mL微量管中,加入40 μL DMSO后涡旋促使充分溶解,得到2.5×105μg/mL储备液,置于-20 ℃冰箱冷冻储存。
1.3 原代人结肠上皮细胞培养[5]取结肠组织置于无菌培养皿中,加入抗细菌/真菌溶液清洗干净,将组织剪成1 mm3组织块。将组织块放入离心管中,用PBS反复吹打、洗涤5次。静置0.5 h,弃去PBS,加入0.1% Ⅳ型胶原酶溶液+0.1% Ⅰ型胶原酶溶液(1∶1)混合消化液,消化0.5 h。消化完毕,用吸管反复吹打5 min,静置1 min,将上清移至另一离心管中。重复上述步骤2~3次,收集上清液,1 000 r/min离心5 min,弃上清,加入培养基吹打,再以1 000 r/min离心5 min,重复上一步骤5~6次后加入培养液,将细胞密度调节至(4~5)×104/mL,直接在培养瓶或板上种植。于37 ℃、5% CO2的培养箱中培养。每2天换1次培养液,并在倒置显微镜下观察细胞生长状态。
1.4 CCK-8法检测细胞增殖情况 取对数生长期的原代人结肠上皮细胞,胰蛋白酶消化后,将细胞以5×103/孔接种至96孔板中,每组设置6个复孔,37 ℃、5% CO2的培养箱中培养过夜。加入不同浓度青蒿琥酯(0.1、0.2、0.4 mmol/L)和LPS(1 μg/mL)处理细胞,每孔终体积为100 μL。培养24 h后,弃旧培养基,每孔加入含10 μL CCK-8试剂的新鲜培养基100 μL。继续培养1 h后置于酶标仪中450 nm处测定吸光度OD值。并计算细胞的相对存活率,根据相对存活率确定青蒿琥酯的实验浓度。
1.5 ELISA法检测细胞上清中IL-6及TNF-α炎症因子水平 取不同浓度青蒿琥酯(0.1、0.2、0.4 mmol/L)和LPS(1 μg/mL)共培养细胞的上清,收集于Ep管中离心20 min,转速设定为1 000 r/min,取上清-20 ℃冷冻备用。IL-6及TNF-α水平的检测按照ELISA试剂盒操作说明书进行。
1.6 Western blot检测Traf6/p65信号通路活化情况 收集不同浓度青蒿琥酯(0.1、0.2、0.4 mmol/L)和LPS(1 μg/mL)共培养的细胞裂解液,BCA试剂检测各组蛋白浓度,再加入蛋白上样缓冲液,于100 ℃加热煮沸10 min。每孔加入50 μg蛋白上样,在12%的SDS-PAGE凝胶中电泳分离,浓缩胶电泳分离时电压设置为70 V;分离胶电泳时电压设置为120 V;分离完成后在275 mA电流转膜60 min;再将NC膜用5%脱脂奶粉室温封闭1 h;一抗孵育过夜后,在二抗常温下孵育1 h,洗膜3次,显色成像。
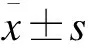
2 结果
2.1 CCK-8法检测细胞增殖情况 青蒿琥酯作用原代人结肠细胞24 h后,低、中、高剂量药物对细胞相对存活率的影响与空白对照组比较差异无统计学意义(P>0.05),结果见图1。青蒿琥酯对LPS诱导炎症引起的细胞增殖情况如图1所示,LPS诱导组细胞增殖率显著低于空白对照组(P<0.05);而经过低、中、高剂量青蒿琥酯处理后,细胞相对存活率显著高于LPS诱导组,差异均有统计学意义(P<0.05)。可见随着青蒿琥酯浓度升高,细胞增值率显著升高,说明青蒿琥酯呈浓度依赖性影响LPS诱导人结肠上皮细胞炎症导致增殖情况的变化。
2.2 ELISA法检测IL-6及TNF-α分泌情况 青蒿琥酯作用原代人结肠细胞24 h后,低、中、高剂量药物对细胞分泌IL-6及TNF-α的影响如表1所示。LPS诱导组细胞分泌的IL-6及TNF-α水平显著高于空白对照组(P<0.05);而经过低、中、高剂量青蒿琥酯处理后,IL-6及TNF-α分泌水平显著低于LPS诱导组,差异均有统计学意义(P<0.05)。可见随着青蒿琥酯浓度上升,IL-6及TNF-α分泌水平显著降低,说明青蒿琥酯呈浓度依赖性影响LPS诱导人结肠上皮细胞炎症反应。

图1 青蒿琥酯对人结肠上皮细胞增殖的影响(n=6)注:与空白对照组比较,*P<0.05;与LPS诱导组比较,#P<0.05。 1.空白对照组,2.LPS诱导组,3.LPS+低剂量青蒿琥酯组, 4.LPS+中剂量青蒿琥酯组,5.LPS+高剂量青蒿琥酯组 表1 青蒿琥酯对人结肠上皮细胞分泌炎症因子的影响(pg/mL,n=6)

组别IL-6TNF-α空白对照组624±12075±9LPS诱导组1820±340*184±34*LPS+低剂量青蒿琥酯组1260±257#167±25LPS+中剂量青蒿琥酯组1032±224#136±18#LPS+高剂量青蒿琥酯组840±184#106±12#
注:与空白对照组比较,*P<0.05;与LPS诱导组比较,#P<0.05
2.3 Western blot法检测Traf6/p65信号通路活化情况 青蒿琥酯对人结肠上皮细胞中Traf6/p65信号通路活化情况的影响如图2所示。结果表明,LPS诱导组中Traf6表达水平及p65磷酸化水平显著高于空白对照组(P<0.05),说明LPS可诱导Traf6/p65信号通路活化引起炎症反应。经过低、中、高剂量青蒿琥酯作用后,Traf6表达水平及p65磷酸化水平显著低于LPS诱导组,差异均有统计学意义(P<0.05)。可见随着青蒿琥酯浓度上升,Traf6表达水平及p65磷酸化水平显著降低,说明青蒿琥酯呈浓度依赖性地影响LPS诱导人结肠上皮细胞中Traf6/p65信号通路活化。
3 讨论
结肠炎分为特异性结肠炎和非特异性结肠炎,临床以腹痛、腹泻、黏液血便、里急后重、大便次数增多、不成形、粪质稀薄迁延不愈超过3周和反复发作为特点。目前对结肠炎治疗研究的分子机制较少,但中医药对慢性结肠炎的治疗研究较为多见[6]。因此,本实验从细胞水平研究了青蒿琥酯对结肠炎治疗的分子机制,以期为后期的临床应用奠定基础。原代培养人结肠上皮细胞,采用LPS诱导构建细胞炎症模型[7],结果发现,LPS诱导组细胞增殖率显著低于空白对照组,并且炎症因子IL-6及TNF-α分泌水平显著高于空白对照组,说明细胞炎症模型构建成功。利用低、中、高剂量青蒿琥酯与LPS共同孵育细胞,结果发现,不同浓度青蒿琥酯均能显著升高人结肠上皮细胞的相对存活率,并且降低细胞中炎症因子IL-6及TNF-α的分泌,说明青蒿琥酯可以改善人结肠上皮细胞的炎症反应。

图2 青蒿琥酯对人结肠上皮细胞Traf6/p65信号通路活化的影响(n=3)
注:与空白对照组比较,*P<0.05;与LPS诱导组比较,#P<0.05。
1.空白对照组,2.LPS诱导组,3.LPS+低剂量青蒿琥酯组,4.LPS+中剂量青蒿琥酯组,5.LPS+高剂量青蒿琥酯组
研究表明,革兰阴性菌中的脂多糖(LPS)可通过与Toll样受体4(TLR4)结合,从而激活多种炎症通路[8]。NF-κB参与炎症反应的调节,可通过调控炎症基因的表达及细胞因子的生成来调节免疫反应[9-10]。Traf6衔接蛋白不仅可以传导膜上TNF受体家族介导的信号,还可以传导Toll/IL受体家族介导的信号。LPS刺激可引起Traf6的泛素化,与转化生长因子β活化激酶1(TAK1)形成复合物,进一步激活IKKs,促使NF-κB向细胞核内转移,导致炎症反应的发生[11]。实验发现,LPS刺激人结肠上皮细胞后,Traf6表达水平及p65磷酸化水平显著升高,而经过低、中、高剂量青蒿琥酯处理细胞后,Traf6表达水平及p65磷酸化水平显著降低。说明青蒿琥酯可通过抑制Traf6/p65信号通路的活化降低炎症反应的发生。
综上所述,青蒿琥酯可通过抑制人结肠上皮细胞Traf6/p65信号通路的激活,从而抑制细胞炎症因子的分泌,达到抗炎症的效果。
[1] 胡玉贞,李淼,张桐桐,等.青蒿琥酯脂质体粉雾剂的制备及其治疗大鼠急性肺损伤的作用[J].药学学报,2016,51(12):1906-1912.
[2] 黄蕾,李作孝.青蒿琥酯对实验性自身免疫性脑脊髓炎大鼠脑组织前列腺素E2表达的影响[J].临床合理用药杂志,2015,8(6C):18-20.
[3] 张长城,潘蕾,崔向军.青蒿琥酯对胶原诱导性关节炎大鼠滑膜细胞增殖及TNF-α和IL-1β分泌的影响[J].广东医学,2009,30(7):1048-1049.
[4] 庄宁.美沙拉嗪联合灌肠治疗溃疡性结肠炎的疗效探讨[J].当代医学,2013,19(22):109-110.
[5] 张伟平,聂占国,代忠明,等.人结肠上皮细胞的原代培养[J].现代肿瘤医学,2012,20(8):1546-1548.
[6] 刘超,刘敬霞,虎喜成,等.中医药治疗慢性结肠炎的临床研究进展[J].中华中医药杂志,2016,31(4):1365-1367.
[7] 陈锦团,柯晓,张歆,等.清化肠饮对脂多糖诱导的人结肠上皮细胞NF-κB激活的影响[J].中国中西医结合杂志,2015,35(11):1356-1360.
[8] Yao L,Kan EM,Lu J,et al.Toll-like receptor 4 mediates microglial activation and production of inflammatory mediators in neonatal rat brain following hypoxia:role of TLR4 in hypoxic microglia[J].J Neuroinflammation,2013,10:23.
[9] Wang S,Wang H,Jing H,et al.Anti-inflammatory effects of isopropyl 3-(3,4-dihydroxyphenyl)-2-hydroxypropanoate,a novel metabolite from Danshen,on activated microglia[J].Chin J Physiol,2012,55(6):428-434.
[10]Park HY,Kim TH,Kim CG,et al.Purpurogallin exerts anti-inflammatory effects in lipopolysaccharide-stimulated BV2 microglial cells through the inactivation of the NF-κB and MAPK signaling pathways[J].Int J Mol Med,2013,32(9):1171-1178.
[11]Song F,Zeng K,Liao L,et al.Schizandrin A inhibits microglia-mediated neuroninflammation through inhibiting TRAF6-NF-κB and Jak2-Stat3 signaling pathways[J].PLoS One,2016,11(2):e0149991.
EffectsofartesunateoninflammatoryreactionofLPS-inducedhumancolonepithelialcellsanditsmolecularmechanism
JIANG Shia,ZHANG Xing-qiangb*
(a.Department of Gastroenterology,b.Department of Radiology,Central Hospital of Enshi Autonomous Prefecture,Enshi 445000,China)
ObjectiveTo explore the effects of artesunate on inflammatory reaction of lipopolysaccharide (LPS)-induced human colon epithelial (HCE) cells,and study the potential mechanism of artesunate treatment for HCEC inflammation.MethodsPrimary human colon epithelial cells were culturedinvitro,and HCE cells were divided into five groups,including control group,LPS-induced group,low-dose-,medium-dose-,and high-dose-artesunate groups.The effects of artesunate on the proliferation of HCE cells were observed using CCK-8 assay.ELISA was used to investigate the influence of artesunate on the secretory levels of inflammatory cytokine (IL-6 and TNF-α).Western blot was used to assess the impacts of artesunate on the Traf6/p65 signaling pathway.ResultsArtesunate could significantly improve the inhibitory effect on LPS-induced HCE cells proliferation (P<0.05).Varying concentrations of artesunate could significantly inhibit the secretion of IL-6 and TNF-α in HCE cells,compared with LPS-induced group (P<0.05).Western blot results showed that the expression levels of Traf6 and p-p65 in all artesunate groups were lower than those of LPS-induced group (P<0.05).ConclusionArtesunate can significantly inhibit the inflammatory reaction of HCE cells and its molecular mechanism may involve the down-regulation of activation of Traf6/p65 signaling pathway.
Artesunate;Human colon epithelial cells;Inflammation;Signaling pathway
2017-03-31
恩施土家族苗族自治州中心医院a.消化内科,b.放射科,湖北 恩施 445000
*
10.14053/j.cnki.ppcr.201711007
