橄榄果实游离氨基酸测定方法的优化
2017-12-06,,,,,*,
, , ,,,*,
(1.福建农林大学园艺学院,福建福州 350002;2.福州市经济作物站,福建福州 350003)
橄榄果实游离氨基酸测定方法的优化
彭真汾1,王威1,谢倩1,叶清华1,陈清西1,*,许长同2
(1.福建农林大学园艺学院,福建福州 350002;2.福州市经济作物站,福建福州 350003)
探索一种适于橄榄果实游离氨基酸含量测定的方法。通过单因素实验初筛茚三酮显色法中的条件,如pH、显色剂含量、加热温度和加热时间,并通过稳定性、精密性、重复性和加样回收实验进行方法学验证。结果发现:茚三酮显色法的最佳反应条件为最大吸收波长568 nm、pH6.6的磷酸缓冲液、0.5 mL 2%茚三酮溶液、加热温度100 ℃和加热时间25 min,在30 min内OD值改变0.41%,稳定性RSD=0.34%(n=9)、精密性RSD=0.09%(n=9)、重复性RSD=1.71%(n=6)、回收率达100.34%、RSD=2.21%(n=6)。表明茚三酮显色法测定橄榄果实游离氨基酸含量在此条件下稳定且精密性、重复性和回收率良好,可用于橄榄果实游离氨基酸的快速简便测定。
茚三酮显色法,橄榄果实,游离氨基酸
橄榄[Canariumalbum(Lour.)Raeusch.]为橄榄科(Burseraceae)橄榄属(Canarium)植物[1],主要分布于我国闽粤两省,是我国南方特有的热带、亚热带果树[2-3]。橄榄果实营养价值高,富含维生素C、钙等营养物质[2-3],兼具较高的药用价值[4-8],是一种药食两用的水果[9]。研究表明,氨基酸是橄榄果实中除多酚和糖之外另一对果实风味有重要影响的组分[2-3,10]。
氨基酸是构成蛋白质的基本单位,是参与人体正常代谢和生理活动的重要物质,具有抗菌[11]、保肝保肾[12]、降血脂[13]等作用,对人体健康十分重要。根据氨基酸的状态,可分为结合态的水解氨基酸和游离态的游离氨基酸[14-15]。游离氨基酸一方面能形成芳香性气味物质,增加植物气味感官;另一方面其本身可划分为呈味氨基酸和药用氨基酸,增加食物的风味和药用价值[16-17],其比例和种类是评价植物品质优劣的主要指标之一[18]。因此,测定游离氨基酸含量对于橄榄果实品质评价具有重要的作用。
目前,测定游离氨基酸的常用方法主要有色谱法[19-20]、氨基酸自动分析仪法[21]和分光光度计法[22]等。色谱法能对氨基酸进行分离,同时测定多种氨基酸组分,但一般需对氨基酸进行衍生化才能测定,技术及成本要求较高[23];氨基酸自动分析仪是专门测定氨基酸含量的仪器,但其一方面需对氨基酸进行柱后衍生,另一方面仪器价格昂贵且用途单一,存在一定的局限性;分光光度计法能测定某种氨基酸或游离氨基酸总量,虽不能进行氨基酸分离分析测定,但此方法快捷简便、成本较低,在大多实验室具有可操作性[22]。当只需对植物氨基酸含量进行初步测定时,具有明显的优势。
本实验利用分光光度计法进行橄榄果实游离氨基酸含量的测定优化,并通过方法学进行验证,探索一种适于橄榄果实游离氨基酸含量测定的方法。
1 材料与方法
1.1材料与仪器
“长营”橄榄 于2015年11月17日采自福建省闽侯县城关农场,采样品后,置于4 ℃保温箱中带回实验室,洗净,晾干,取果肉置于液氮中,后用冷冻干燥机冻干并粉碎,过40目筛保存于-40 ℃冰箱中备用;亮氨酸、十二水合磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·H2O)、茚三酮(苯骈戊三酮)、无水乙醇 分析纯,国药集团化学试剂有限公司。
LGJ-25C型冷冻干燥机 北京四环科学仪器厂有限公司;FW177中草药粉碎机 天津市泰斯特仪器有限公司;KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;Allegra 64R台式高速冷冻离心机 贝克曼库尔特(美国)、DK-S22电热恒温水浴锅 上海精宏实验设备有限公司;UV WinLab V6紫外可见分光光度计 铂金埃尔默仪器(上海)有限公司。
1.2实验方法
1.2.1 橄榄果实游离氨基酸溶液的提取 称取橄榄粉末0.5 g(精确至0.0001 g)于50 mL离心管中,按料液比1∶41 (g/mL)加入60%乙醇,在超声功率270 W、超声温度50 ℃下超声提取20 min,后在常温下10000 r/min离心10 min,吸取上清液1 mL于20 mL具塞试管中,用蒸馏水稀释至刻度,作为橄榄果实游离氨基酸溶液。
1.2.2 试剂配制
1.2.2.1 亮氨酸标准溶液的配制 准确称取亮氨酸标准品100 mg定容于100 mL容量瓶中,配制浓度为1 mg/mL的母液;吸取7.5、10和20 mL母液于100 mL的容量瓶中,分别配制浓度为0.075、0.1和0.2 mg/mL的亮氨酸标准溶液。
1.2.2.2 磷酸缓冲液的配制 首先配制0.2 mol/L Na2HPO4溶液作为A液,配制0.2 mol/L NaH2PO4溶液作为B液,再通过添加一定比例的A、B液来调得相应pH的磷酸缓冲液[24]。
1.2.2.3 2%茚三酮溶液的制备 称取2.0 g(精确至0.0001 g)茚三酮粉末,加入少许无水乙醇溶解,后用蒸馏水定容于100 mL棕色容量瓶中,摇匀后置于4 ℃冰箱保存。
1.2.3 茚三酮显色法 分光光度计法测定游离氨基酸含量,是根据茚三酮与游离氨基酸在弱酸条件下的间接氧化还原的显色原理实现的。首先α-氨基酸被氧化形成CO2、NH3和醛,茚三酮被还原后与另一分子氨和茚三酮脱水缩合生成蓝紫色物质[24-25]。本文参照吴月娜[26]方法优化并稍作改进。吸取0.1 mg/mL亮氨酸标准溶液或橄榄果实游离氨基酸溶液2 mL于20 mL具塞试管中,分别加入一定pH的磷酸缓冲液0.5 mL和一定体积的2%茚三酮溶液,于一定温度恒温水浴锅中加热一定时间后冷却,蒸馏水定容至刻度,在最大吸收波长下测定吸光度。
1.2.4 单因素实验
1.2.4.1 最大吸收波长的选择 按1.2.3项下进行茚三酮显色法的操作,固定反应条件磷酸缓冲液pH6.6、2%茚三酮溶液0.5 mL、加热温度100 ℃、加热时间15 min,考察不同波长(400~700 nm)对吸光度的影响。
1.2.4.2 pH的选择 按1.2.3项下进行茚三酮显色法的操作,固定反应条件2%茚三酮溶液0.5 mL、加热温度100 ℃、加热时间15 min、测定波长568 nm,考察不同pH(5.8、6.2、6.6、7.0、7.4、7.8)对吸光度的影响。
1.2.4.3 显色剂用量的选择 按1.2.3项下进行茚三酮显色法的操作,固定反应条件磷酸缓冲液pH6.6、加热温度100 ℃、加热时间15 min、测定波长568 nm,考察不同体积(0.1、0.3、0.5、0.7、0.9 mL)2%茚三酮溶液对吸光度的影响。
1.2.4.4 加热温度的选择 按1.2.3项下进行茚三酮显色法的操作,固定反应条件磷酸缓冲液pH6.6、2%茚三酮溶液0.5 mL、加热时间15 min、测定波长568 nm,考察不同加热温度(60、70、80、90、100 ℃)对吸光度的影响。
1.2.4.5 加热时间的选择 按1.2.3项下进行茚三酮显色法的操作,固定反应条件磷酸缓冲液pH6.6、2%茚三酮溶液0.5 mL、加热温度100 ℃、测定波长568 nm,考察不同加热时间(10、15、20、25、30、35、40 min)对吸光度的影响。
1.2.5 标准曲线的配制 分别吸取0.2 mg/mL的亮氨酸标准品0.5、0.625、0.75、0.875、1、1.125、1.25、1.375、1.5、1.625和1.75 mL,并用蒸馏水分别补足至2 mL于20 mL具塞试管中,加入pH6.6磷酸缓冲液0.5 mL和2%茚三酮溶液0.5 mL,摇匀,于100 ℃恒温水浴锅中加热25 min,冷却,蒸馏水定容至刻度,在波长568 nm下测定吸光度。以亮氨酸标准品溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,所得回归方程为:y=10.482x-0.4947,R2=0.9996。亮氨酸标准品溶液在0.05~0.175 mg/mL浓度范围内线性关系良好。
1.2.6 方法学验证实验 以下方法学验证实验均以茚三酮显色法优化实验筛选出的最佳条件进行。
1.2.6.1 稳定性实验 按1.2.1项下通过改变料液比配制高(1∶20 (g/mL))、中(1∶30 (g/mL))、低(1∶40 (g/mL))浓度的游离氨基酸溶液,在568 nm处分别测定吸光度,每隔5 min测定1次,共测定30 min。
1.2.6.2 精密性实验 按1.2.2.1项下方法配制高(0.2 mg/mL)、中(0.1 mg/mL)、低浓度(0.075 mg/mL)的亮氨酸标准品溶液,按1.2.5标准曲线的配制方法测定吸光度,重复测定6次。
1.2.6.3 重复性实验 称取6份0.5 g(精确至0.0001 g)橄榄粉末,按1.2.1项下方法制备游离氨基酸溶液,后按1.2.5标准曲线的配制方法测定吸光度。
1.2.6.4 加样回收实验 称取6份0.5 g(精确至0.0001 g)橄榄粉末,按1.2.1项下方法制备游离氨基酸溶液,后按1.2.5标准曲线的配制方法测定吸光度,计算得出游离氨基酸含量,后依据其含量在游离氨基酸溶液中分别加入低、中、高含量的亮氨酸标准品粉末,测定吸光度,计算回收率。
1.2.7 橄榄果实游离氨基酸含量的测定与计算 吸取1.2.1项下制备的橄榄果实游离氨基酸溶液2.0 mL代替1.2.5中亮氨酸标准品溶液,并以2.0 mL蒸馏水作为空白对照,按1.2.5项下进行实验,测定吸光度。游离氨基酸含量的计算公式如下:
式中:c为游离氨基酸浓度(mg/mL),从标曲上获得;V为提取液总体积(mL);n为稀释倍数;m为橄榄粉末质量(g)。
1.2.8 数据处理 数据整理和图表的绘制采用Excel 2003完成,显著性分析采用SPSS 17.0完成。
2 结果与分析
2.1单因素实验结果
2.1.1 最大波长的选择 由图1可知,橄榄游离氨基酸溶液和亮氨酸标准品的最大波长均在568 nm处,与吴月娜[26]的结果一致,且张鉴棠[27]等研究得出除赖、脯、羟脯氨酸外,其余常见氨基酸的最大吸收峰相同,因此选择568 nm作为游离氨基酸检测波长。

图1 波长扫描图
2.1.2 pH的选择α-氨基酸和茚三酮适宜在弱酸性条件下反应[24]。通过设置一系列的弱酸性环境来寻找最佳pH。由图2可知,亮氨酸标准品在不同的pH条件下,其与茚三酮的显色反应有所不同,呈现出先上升后下降的趋势,在pH6.6时达到最大值,表明在pH6.6条件下亮氨酸标准品与茚三酮显色最佳。

图2 pH条件的选择
2.1.3 显色剂用量的选择 由图3可知,随着显色剂用量的增加,吸光度呈现先增加后趋于稳定的趋势,在2%茚三酮显色剂用量为0.5 mL时吸光度达到最大值,再增加显色剂的用量对吸光度无显著(p<0.05)改变,从节省显色剂含量的角度出发,选择0.5 mL的显色剂用量最佳。
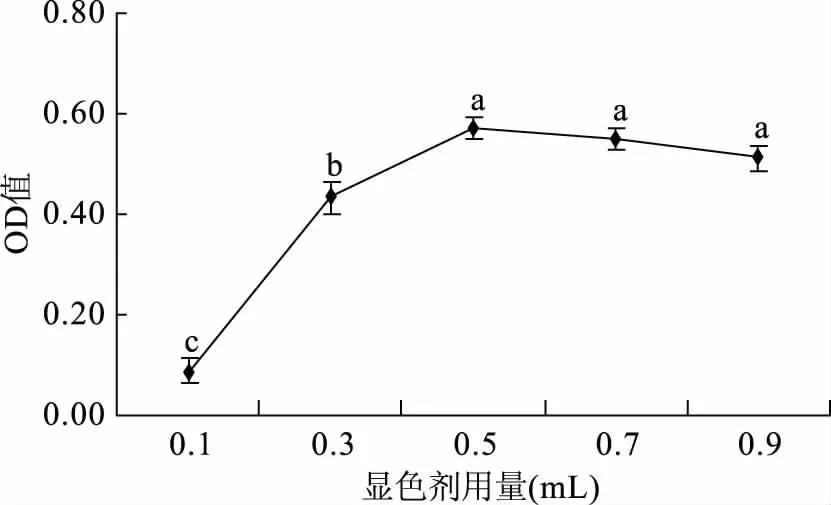
图3 显色剂用量的选择
2.1.4 加热温度的选择α-氨基酸与茚三酮反应需要在共热的条件下生成蓝紫色的二酮茚-二酮茚胺,达到显色的目的[24]。由图4可知,随着加热温度的升高,吸光度逐渐升高。在60、70 ℃的水浴环境下加热时,并未出现蓝紫色产物,在80、90、100 ℃时颜色逐渐加深,100 ℃时颜色最深,显色反应最好,因此选择100 ℃为反应温度。

图4 加热温度的选择

表1 稳定性实验结果
2.1.5 加热时间的选择 在α-氨基酸与茚三酮显色反应中,加热时间的长短主要取决于反应是否完全[28]。由图5可知,随着加热时间的增加,吸光度先增加后趋于稳定。在25 min时达到最大吸光度,往后增加加热时间,已没有显著(p<0.05)变化,表明在加热时间25 min时,亮氨酸标准溶液与茚三酮已反应完全,因此选择25 min为加热时间。
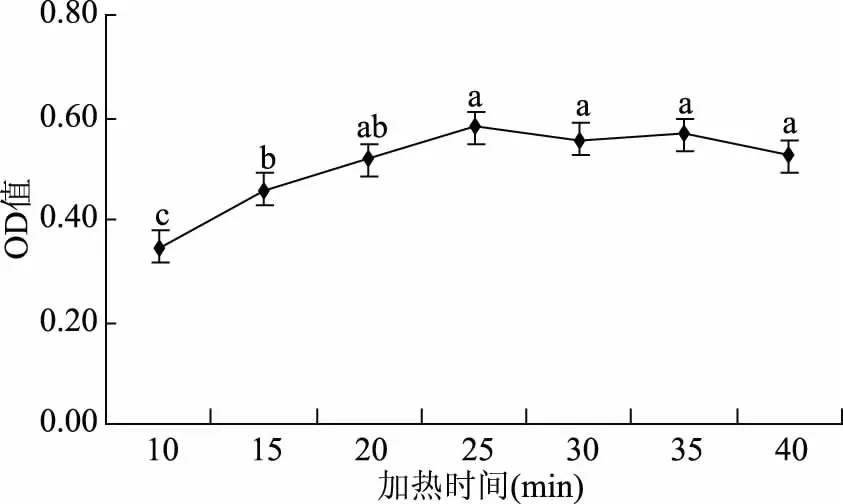
图5 加热时间的选择

表3 重复性实验结果

表4 加样回收实验结果
2.2方法学验证结果
2.2.1 稳定性实验 通过稳定性实验结果(见表1)发现高、中、低浓度的橄榄游离氨基酸溶液RSD值分别为0.25%(n=3)、0.29%(n=3)和0.48%(n=3),平均RSD为0.34%;5 min内OD值平均改变0.11%,30 min内改变0.41%<1%,表明配制的游离氨基酸溶液在30 min内基本稳定。
2.2.2 精密性实验 通过精密性实验结果(见表2)发现高、中、低浓度的亮氨酸标准品的RSD值分别为0.19%(n=3)、0.02%(n=3)和0.07%(n=3),平均RSD为0.09%<2%,表明精密性良好。

表2 精密性实验结果
2.2.3 重复性实验 通过重复性实验结果(见表3)发现橄榄游离氨基酸RSD为1.71%<3%(n=6),表明方法重复性良好。
2.2.4 加样回收实验 通过加样回收实验结果(见表4),发现平均回收率为100.34%,在95%~105%之间,RSD=2.21%<3%,表明回收率结果良好。
3 讨论
在茚三酮与游离氨基酸反应过程中,反应条件如pH、茚三酮溶液、加热温度和时间等都会对结果产生影响。其中,由于反应体系的标准品的选择与pH对测定结果的影响较大,使各学者优化工艺结果不尽相同,均存在一定差异[22,29-32]。标准品的选择主要造成pH的差异[27],本实验在参考了王学奎[24]和吴月娜[26]的基础上选择了亮氨酸作为标准品,亮氨酸为中性氨基酸,溶液本身呈中性,减少对pH选择的影响。从实验结果可知,橄榄选择中性氨基酸亮氨酸为标准品优化获得最佳显色磷酸缓冲液pH为6.6,此结果与李红武[29]选择中性氨基酸缬氨酸、酸性氨基酸谷氨酸和碱性氨基酸组氨酸的中性混合液组成为标准品获得的pH6.7磷酸缓冲液相接近,与邵金良[33]以酸性氨基酸茶氨酸为标准品得出最佳pH为8.0的磷酸缓冲液不同,不同研究选取的磷酸缓冲液pH的不同,主要是因为各种α-氨基酸由于自身酸度不同,使得中性、酸性和碱性氨基酸溶液pH存在显著差异[34],通过调整磷酸缓冲液来使反应体系pH为弱酸性,以满足茚三酮的显色条件。并且反应溶液pH还会影响氨基酸与茚三酮显色反应的成色速度、产物颜色以及分子内其他基团对茚三酮反应的灵敏度,造成反应时长的不同和稳定性的差异[34]。其中,反应时长主要根据具体颜色变化而定,若反应时间太短则反应不完全[28]。本实验在加热10 min时就有淡紫色颜色出现,随着反应时长的增加,反应物的颜色越来越深,在25 min时达到蓝紫色,并通过稳定性实验得知其在30 min内均有良好的稳定性;而茚三酮显色法测定青天葵中游离氨基酸含量的方法[26]加热时长为19 min,要求尽量在5 min内完成测定,与之相比,本实验优化结果的稳定性更佳。
4 结论
茚三酮法测定橄榄果实游离氨基酸含量的最佳条件为:pH6.6的磷酸缓冲液、0.5 mL 2%的茚三酮溶液、沸水浴反应25 min,冷水冷却后在568 nm下测定游离氨基酸含量。此方法操作简便、稳定性、重复性、精密性良好,回收率可达到100.34%。
[1]中国科学院中国植物志编辑委员会. 中国植物志[Z]. 北京:科学出版社,1997.
[2]林玉芳.福建橄榄(Canariumalbum(Lour.)Raeusch)若干功能成分和品质相关指标的研究[D]. 福州:福建农林大学,2012.
[3]谢倩.橄榄(Canariumalbum(Lour.)Raeusch.)果实发育成熟过程多酚及相关酶活性研究[D]. 福州:福建农林大学,2014.
[4]林聪.闽江流域橄榄(CanaviumalbumRaeusch)生产与产业化对策研究[D]. 福州:福建农林大学,2011.
[5]彭勃,苗明三,朱平生,等. 橄榄解酒饮对小鼠急性酒精性肝损伤胃肠组织病理学的影响[J]. 中医药学刊,2003,21(8):1231-1236.
[6]彭勃,苗明三,王颖芳,等. 橄榄解酒饮对大鼠急性酒精性肝损伤肝组织病理形态的影响[J]. 中国医药学报,2004,19(8):468-470.
[7]王占恩,王燕青,李升刚,等. 青果蠲毒散救治河豚鱼中毒临床观察[J]. 中国中西医结合杂志,2003,23(8):592.
[8]杨桂林,何颖,董小娟,等. 青果总黄酮的急性毒性及镇痛作用研究[J]. 安徽农业科学,2012(5):2674-2675.
[9]王燕平,陈勤,周志钦,等. 橄榄基因组AFLP扩增体系的优化[J]. 果树学报,2012,29(3):505-511.
[10]李泽坤.橄榄(Canariumalbum(Lour.)Raeusch)果实成熟发育蔗糖代谢变化研究[D]. 福州:福建农林大学,2016.
[11]陈月开,徐军,曲运波,等. 氨基酸的抑菌作用研究[J]. 中国生化药物杂志,2001,22(1):29-30.
[12]陆丽虹,缪长虹,张荃,等. 老年胃肠道肿瘤患者术中输注氨基酸对术后肝肾功能的影响[J]. 中国癌症杂志,2015,25(8):614-618.
[13]李俊明,贺强,袁超,等. 苏氨酸的营养生理功能及其在畜禽日粮中的应用[J]. 中国饲料,2014(11):35-38.
[14]王齐,朱伟伟,苏丹,等. 蒲桃中氨基酸组成与含量对其营养与风味的影响[J]. 食品科学,2012,33(16):204-207.
[15]鲁敏,安华明,赵小红. 无籽刺梨与刺梨果实中氨基酸分析[J]. 食品科学,2015,36(14):118-121.
[16]Pripis-nicolau L,De R G,Bertrand A,et al. Formation of flavor components by the reaction of amino acid and carbonyl compounds in mild conditions.[J]. Journal of Agricultural and Food Chemistry,2000,48(9):3761-3766.
[17]Chen G,Li J,Sun Z,et al. Rapid and sensitive ultrasonic-assisted derivatisation microextraction(UDME)technique for bitter taste-free amino acids(FAA)study by HPLC-FLD[J]. Food Chemistry,2014,143:97-105.
[18]叶发荣,韩秀梅,肖钧,等. ‘红阳’猕猴桃果实氨基酸含量及组成分析[J]. 中国园艺文摘,2015,28(5):1-3.
[19]Pereira V,Pontes M,Camara J S,et al. Simultaneous analysis of free amino acids and biogenic amines in honey and wine samples using in loop orthophalaldeyde derivatization procedure[J]. Journal of Chromatography A,2008,1189(1-2):435-443.
[20]张佳,王川丕,阮建云. GC-MS及GC测定茶叶中主要游离氨基酸的方法研究[J]. 茶叶科学,2010,30(6):445-452.
[21]何子顺,李芳芳,张绍铃,等. 库尔勒香梨果实中脂肪酸和氨基酸变化及受套袋的影响[J]. 果树学报,2016,4(11):22-26.
[22]杨远帆,倪辉,吴黎明. 茚三酮法测定蜂蜜及果葡糖浆中的氨基酸含量[J]. 中国食品学报,2013,13(2):171-176.
[23]车兰兰.液相色谱及液质联用法测定三种山西特色食品中游离氨基酸[D]. 山西:山西大学,2013.
[24]王学奎. 植物生理生化实验原理与技术[M]. 第2版. 北京:高等教育出版社,2006.
[25]陈忠云.α-氨基酸和茚三酮显色反应机理[J]. 教材通讯,1991(2):36-37.
[26]吴月娜.青天葵中总氨基酸的提取纯化工艺及指纹图谱研究[D]. 广州:广州中医药大学,2011.
[27]张鉴棠,汤秀玉,韩红. 不同pH对氨基酸与茚三酮呈色反应的影响[J]. 南京铁道医学院学报,1992(2):126-128.
[28]王昂,王丽丽,仪宏,等. 茚三酮比色法测定谷氨酸含量的研究[J]. 中国调味品,2005(8):50-52.
[29]李红武,王璐,周桂园,等. 用茚三酮显色反应测定烟草中氨基酸含量[J]. 安徽农业科学,2010,38(27):14926-14928.
[30]张永芳,张琪,王润梅,等. 茚三酮呈色法测定谷子种子中的游离氨基酸含量[J]. 种子,2014(1):111-113.
[31]张雪娇,齐暑华,刘春叶,等. 茚三酮显色法测定壳聚糖含量[J]. 化学研究与应用,2015(3):407-411.
[32]黄松,吴月娜,刘梅,等. 茚三酮比色法测定青天葵中总游离氨基酸的含量[J]. 中国中医药信息杂志,2010(12):50-52.
[33]邵金良,黎其万,董宝生,等. 茚三酮比色法测定茶叶中游离氨基酸总量[J]. 中国食品添加剂,2008(2):162-165.
[34]陈忠云.α-氨基酸和茚三酮反应的颜色与条件[J]. 邵阳师专学报,1995(5):56-59.
OptimizationoftestingmethodforfreeaminoacidofChineseolive
PENGZhen-fen1,WANGWei1,XIEQian1,YEQing-hua1,CHENQing-xi1,*,XUChang-tong2
(1.College of Horticulture,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2.Fuzhou Technique Extension Station for Cash Crops,Fuzhou 350003,China)
The aim of this article was to exploring optimal method of testing the free amino acid of Chinese olive.The conditions of Ninhydrin Colorization method,such as pH,chromogenic agent content,heating temperature and heating time,were selected through single factor experiment,and through the methodology experiment included stability test,exactness test,repeatability test and sample recovery test to verify it. The results showed that the optimal reaction conditions of Ninhydrin Colorization method,such as the maximum absorption wavelength was 568 nm,the optimal pH of phosphate buffer was pH6.6,the optimal content of 2% chromogenic agent was 0.5 mL,the optimal heating temperature was 100 ℃ and the optimal heating time was 25 min.The methodology validation results showed that the OD was change 0.41% in 30 minutes,the stability of RSD was equal to 0.34%(n=9),the exactness of RSD was equal to 0.09%(n=9),the repeatability test of RSD was equal to 1.71%(n=6),the sample recovery test of RSD was equal to 2.21%(n=6)and the recovery rate was 100.34%. It stated that Ninhydrin chromogenic method of testing free amino acids for Chinese olive was feasible,and it performed very well in the area of the stability,the exactness,the repeatability and recovery rate under this condition. Therefore the method was sui
Table for testing free amino acids for Chinese olive quickly and easily.
ninhydrin colorization method;Chinese olive;free amino acid
2017-05-16
彭真汾(1992-),女,硕士研究生,主要从事果树生理生态研究,E-mail:390689340@qq.com。
*
陈清西(1964-),男,博士,教授,主要从事园艺植物栽培生理和科研工作,E-mail:cqx0246@163.com。
农业科技园区花果良种选育及集约化种植技术研究与示范(2013NZ0002-4)。
TS255.7
A
1002-0306(2017)22-0263-05
10.13386/j.issn1002-0306.2017.22.051
