澳洲坚果青皮多酚提取工艺优化及其抗氧化活性
2017-12-06,,,
,,,
(中国热带农业科学院南亚热带作物研究所,农业部热带果树生物学重点实验室,广东湛江 524091)
澳洲坚果青皮多酚提取工艺优化及其抗氧化活性
张明,帅希祥,杜丽清*,涂行浩
(中国热带农业科学院南亚热带作物研究所,农业部热带果树生物学重点实验室,广东湛江 524091)
以新鲜澳洲坚果青皮为原料,研究了澳洲坚果青皮多酚的提取工艺及抗氧化活性。在单因素实验的基础上,通过4因素3水平的正交实验优化澳洲坚果青皮多酚提取工艺,并以Trolox为对照,研究其对DPPH自由基和ABTS+自由基的清除能力以及总抗氧化能力。正交实验结果表明:提取时间为90 min、料液比为1∶50 (g/mL)、提取温度为50 ℃、乙醇体积分数为40%为最佳提取工艺条件,在此条件下澳洲坚果青皮多酚提取量达到(1027.47±10.76) mg/100 g。抗氧化实验结果表明:澳洲坚果青皮多酚对DPPH自由基和ABTS+自由基的半数清除率IC50分别为4.13、112.94 mg/L,且其总抗氧化能力约为Trolox的1.7倍。由此可知,澳洲坚果青皮多酚具有很强的抗氧化能力,可用于制备天然抗氧化剂。
澳洲坚果青皮,多酚,提取,抗氧化
澳洲坚果(Macadamiaintegrifolia)又称澳洲核桃、夏威夷果等,山龙眼科澳洲坚果属[1]。20世纪60~70年代开始引入我国,在我国南部山区,如云南、广西、广东和贵州等地均有种植[2]。目前,澳洲坚果在我国种植面积约为6万公顷,产量约为9千吨[3]。澳洲坚果果实由青皮、果壳和果仁组成,果仁为可食部分,占鲜果重量1/2的青皮和占壳果重量2/3的果壳为澳洲坚果加工的副产物。当前国内外对果壳组成成分[4-5]和制备活性炭[6]、磁性纳米吸附剂[7]和碳(氮)化纳米颗粒[8]等吸附材料报道较多,对青皮的研究仅限于青皮组成成分[9]和抑菌[10]、抗氧化[11]等功能性质[10-11]方面的研究,但对澳洲坚果青皮多酚的提取工艺优化及体外抗氧化活性的系统研究却鲜见报道。因此,本实验将研究提取时间、料液比、乙醇体积分数以及提取温度四个因素对澳洲坚果青皮多酚提取的影响并进行工艺优化,同时,以水溶性维生素E(Trolox)为阳性对照,研究澳洲坚果青皮多酚对2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基、1,1-二苯基-2-苦肼基(DPPH)自由基的清除能力和总抗氧化还原能力,进而评价其体外抗氧化活性,以期为澳洲坚果青皮多酚的开发、应用提供参考以及实现澳洲坚果加工副产物的高值化利用。
1 材料与方法
1.1材料与仪器
澳洲坚果青皮:南亚1号 中国热带农业科学院南亚热带作物研究所提供;福林酚、没食子酸(>99%)、水溶性维生素E(Trolox)、Fe3+-三吡啶三吖嗪(TPTZ)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-苦肼基(DPPH) Sigma公司;无水乙醇、盐酸、醋酸 天津富宇精细化工有限公司;碳酸钠 广州化学试剂厂;六水氯化铁 广东光华科技股份有限公司。
分析天平 奥康斯仪器有限公司;ST40高速冷冻离心机 赛默飞世尔科技(中国)有限公司;FZ-06六两装高速药材调料粉碎机 浙江温岭市百乐粉碎设备厂产;UV2007型紫外-可见分光光度计 岛津企业管理(中国)有限公司;BCD-539WT冰箱 青岛海尔股份有限公司;DF-101S集热式恒温加热磁力搅拌器 郑州杜甫仪器厂。
1.2实验方法
1.2.1 澳洲坚果青皮多酚提取 澳洲坚果青皮多酚提取流程为:澳洲坚果青皮→粉碎→过筛→提取→离心→提取液备用。
新鲜澳洲坚果青皮经粉碎、过40目筛保存于-20 ℃冰箱;称取一定量澳洲坚果青皮,按实验设计的提取温度、提取时间、料液比和乙醇体积分数进行提取;提取结束后,在8000 r/min条件下离心15 min,上清液保存于4 ℃冰箱待测。
1.2.2 单因素实验设计
1.2.2.1 提取时间对澳洲坚果青皮多酚提取的影响 在料液比为1∶30 (g/mL),提取次数为1次,磁力搅拌速率为150 r/min,提取温度为40 ℃,乙醇体积分数为70%的条件下,考察提取时间(15、30、60、90、120 min)对澳洲坚果青皮多酚提取的影响。
1.2.2.2 料液比对澳洲坚果青皮多酚提取的影响 在提取时间为90 min,提取次数为1次,磁力搅拌速率为150 r/min,提取温度为40 ℃,乙醇体积分数为70%的条件下,考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50 g/mL)对澳洲坚果青皮多酚提取的影响。
1.2.2.3 乙醇体积分数对澳洲坚果青皮多酚提取的影响 在料液比为1∶40 (g/mL),提取次数为1次,磁力搅拌速率为150 r/min,提取温度为40 ℃,提取时间为90 min的条件下,考察乙醇体积分数(30%、40%、50%、60%、70%)对澳洲坚果青皮多酚提取的影响。
1.2.2.4 提取温度对澳洲坚果青皮多酚提取的影响 在料液比为1∶40 (g/mL),提取次数为1次,磁力搅拌速率为150 r/min,提取时间90 min,乙醇体积分数为40%的条件下,考察提取温度(20、30、40、50、60 ℃)对澳洲坚果青皮多酚提取的影响。
1.2.3 澳洲坚果青皮多酚提取正交实验 在1.2.2澳洲坚果青皮多酚提取单因素实验基础上,采用四因素三水平L9(34)正交实验对澳洲坚果青皮多酚提取工艺进行优化,正交实验因素水平表见表1。
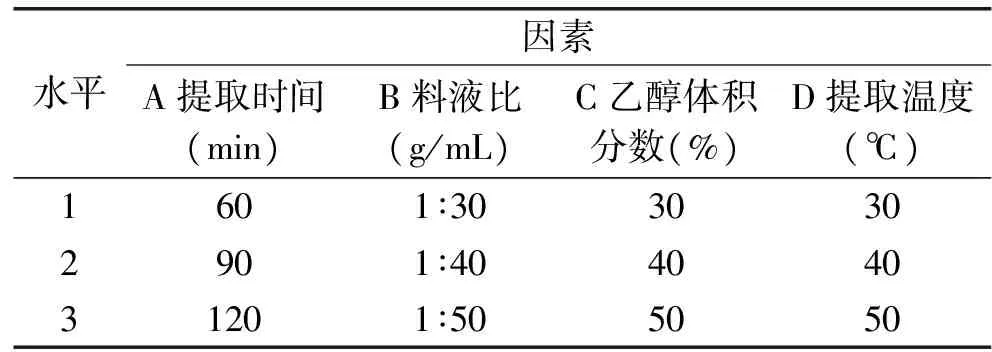
表1 正交实验因素水平表
1.2.4 澳洲坚果青皮多酚提取量测定
1.2.4.1 多酚标准曲线的制作 多酚含量测定采用Pantelidis等[12]修改后的方法。准确称取一定质量没食子酸标准品,用无水乙醇配制100 mg/L的没食子酸标准溶液,然后分别移取0.05、0.1、0.2、0.4、0.8、1.0 mL没食子酸标准溶液于10 mL容量瓶中,加入4 mL去离子水,再加入2 mL 10%福林酚试剂和2 mL 10% Na2CO3溶液,最后用去离子水定容,摇匀后避光反应45 min,以不加没食子酸标准溶液为参比液,在760 nm处测吸光值。以吸光度为纵坐标,以没食子酸标准溶液浓度为横坐标制作标准曲线:y=0.0923x+0.01(R2=0.9969)。
1.2.4.2 澳洲坚果青皮多酚提取量测定 澳洲坚果青皮提取液离心后,取0.2 mL上清液于10 mL容量瓶中,按上述多酚标准曲线制作过程加入各试剂,避光反应45 min后于760 nm处测吸光值,平行测3次。澳洲坚果青皮多酚提取量计算公式如下所示。
其中:X:经标准曲线查得的提取液中多酚浓度,mg/L;V:提取液体积,mL;M:澳洲坚果青皮质量,g。
1.2.5 澳洲坚果青皮多酚体外抗氧化活性研究
1.2.5.1 澳洲坚果青皮多酚对DPPH自由基清除能力的研究 采用修改后的Muhammad等[13]的方法。用100%无水乙醇配制浓度为2.0×10-4mol/L的DPPH溶液,避光保存备用。取2 mL DPPH溶液和2.0 mL 40%乙醇溶液于具塞试管中,充分混合30 min,以40%乙醇溶液作参比液,于517 nm测吸光度A0;分别取多酚浓度为2.01、2.52、3.36、4.04、5.04、6.73、10.09 mg/L的澳洲坚果青皮多酚提取液、Trolox溶液2.0 mL和DPPH溶液2 mL于具塞试管中,在上述条件下测吸光度A1,并以相同浓度的Trolox溶液为阳性对照,平行测定3次。DPPH自由基清除率(P)计算公式为:

1.2.5.2 澳洲坚果青皮多酚对ABTS+自由基清除能力的研究 采用修改后的Roberta Re等[14]的方法。分别用蒸馏水配制7 mmol/L ABTS和2.45 mmol/L K2S2O8溶液,两种溶液1∶1混合避光反应12~16 h即为ABTS+溶液,用40%乙醇溶液稀释ABTS+溶液至732 nm处吸光值为0.70±0.02,备用;分别取多酚浓度为20.19、40.37、78.49、100.93、150.46、201.86 mg/L的澳洲坚果青皮多酚提取液、Trolox溶液50 μL和4 mL ABTS+溶液于具塞试管中,37 ℃水浴10 min,以40%乙醇溶液为参比液,于732 nm处测吸光值A1,平行测定3次;取50 μL 40%乙醇溶液和4 mL ABTS+溶液于具塞试管中,在上述条件下测吸光值A0,并以相同浓度的Trolox溶液为阳性对照,平行测定3次。ABTS+自由基清除率(P)计算公式如下所示。

1.2.5.3 澳洲坚果青皮多酚总抗氧化能力的研究 采用修改后的Benzie等[15]的方法。分别配制10 mmol/L TPTZ溶液、20 mmol/L六水氯化铁溶液和pH3.6的0.3 mmol/L醋酸缓冲液,然后将三种溶液按1∶1∶10的比例配置FRAP溶液,取20 μL澳洲坚果青皮多酚提取液、1 mL水和1.8 mL FRAP溶液,37 ℃水浴中反应10 min,以40%乙醇溶液为参比液,于593 nm处测定吸光值,平行测定3次。以Trolox为标准物质制作标准曲线计算其总抗氧化能力。
1.3数据处理与分析
采用SPSS 17.0数据处理软件对实验数据进行处理与分析。
2 结果与分析
2.1澳洲坚果青皮多酚提取单因素实验结果
2.1.1 提取时间对澳洲坚果青皮多酚提取量的影响 从图1可知,澳洲坚果青皮多酚提取量随提取时间的延长呈现先增加后减少的趋势:当提取时间为15~90 min时,澳洲坚果青皮多酚提取量随提取时间的延长而增加;提取时间为90 min之后,澳洲坚果青皮多酚提取量随提取时间延长而减少。提取时间为90 min时澳洲坚果青皮多酚提取量最高,为600.82 mg/100 g。提取时间对澳洲坚果青皮多酚提取具有双重作用:一是澳洲坚果青皮中多酚随提取时间延长逐渐向提取溶剂中扩散并达到溶解平衡,因此提取量不断增加;二是澳洲坚果青皮多酚随提取时间延长,多酚氧化速率大于其向溶剂扩散速率,从而造成提取量下降[16]。同时,由于提取时间的延长,会造成能源的过度消耗,因此,综合考虑,提取时间宜选为90 min。
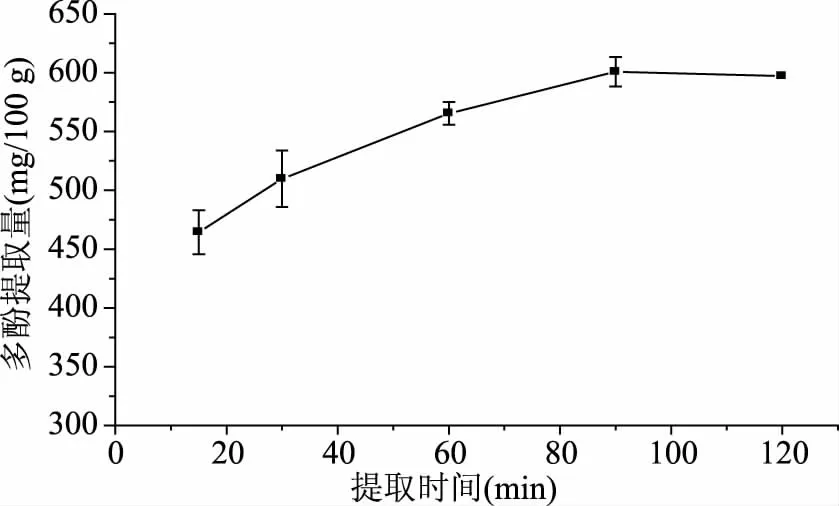
图1 提取时间对澳洲坚果青皮多酚提取量的影响
2.1.2 料液比对澳洲坚果青皮多酚提取量的影响 从图2可知,当料液比从1∶10 (g/mL)增加到1∶40 (g/mL)时,澳洲坚果青皮多酚提取量随料液比的增加而升高;当料液比高于1∶40 (g/mL)时,澳洲坚果青皮中多酚含量随料液比的增加而降低。当料液比为1∶40 (g/mL)时,澳洲坚果青皮中多酚含量最高,达到642.31 mg/100 g。料液比增加有利于澳洲坚果青皮多酚与溶剂充分接触并向溶剂中扩散,但当料液比达到某一临界值时,再增加料液比反而会抑制多酚向溶剂中扩散[17],且会造成溶剂的浪费与环境污染,因此,料液比宜选为1∶40 (g/mL)。

图2 料液比对澳洲坚果青皮多酚提取量的影响
2.1.3 乙醇体积分数对澳洲坚果青皮多酚提取量的影响 酚类化合物的提取和分离取决于溶剂和酚类物质的极性[18]。从图3可知,乙醇体积分数从30%增加到40%时,澳洲坚果青皮多酚提取量从919.02 mg/100 g增加到989.90 mg/100 g,这可能是澳洲坚果青皮多酚在提取溶剂中的溶解度随乙醇体积分数的增加而增加所致;乙醇体积分数高于40%时,澳洲坚果青皮多酚提取量随乙醇体积分数增加而降低。澳洲坚果青皮多酚提取量在乙醇体积分数为40%时最高,为989.90 mg/100 g。Spigno等[19]的研究也表明乙醇体积分数为50%时葡萄籽中多酚提取量最高,本实验研究结果与其趋势一致。同时,增加乙醇体积分数,会增加乙醇使用量,因此,乙醇体积分数宜选为40%。
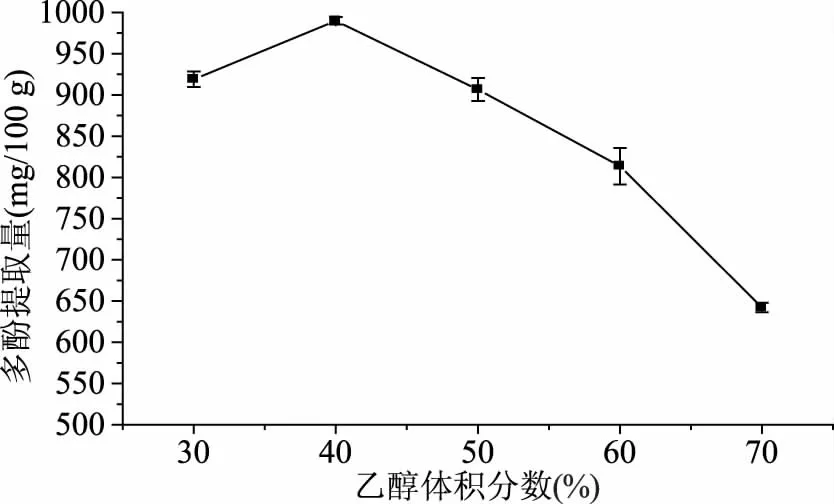
图3 乙醇体积分数对澳洲坚果青皮多酚提取量的影响
2.1.4 提取温度对澳洲坚果青皮多酚提取量的影响 从图4可知,澳洲坚果青皮多酚提取量随提取温度的升高而增加,当提取温度从20 ℃升高到40 ℃时,澳洲坚果青皮多酚提取量随提取温度的增加显著升高,当提取温度从40 ℃升高到60 ℃时,澳洲坚果青皮多酚提取量从972.28 mg/100 g增加到998.90 mg/100 g,增加了26.62 mg/100 g,澳洲坚果青皮多酚提取量增加减缓。这可能是在温度较高时,澳洲坚果青皮中的多糖、水溶性蛋白和色素等非多酚类物质在提取溶剂中的溶解度增加,并与多酚类物质竞争与乙醇-水的结合,从而抑制了多酚向提取溶剂中的扩散;而且温度较高会导致多酚类物质的氧化[20];同时温度越高,能耗越大,综合考虑,提取温度宜选为40 ℃。
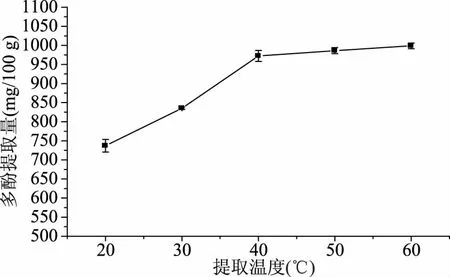
图4 提取温度对澳洲坚果青皮多酚提取量的影响
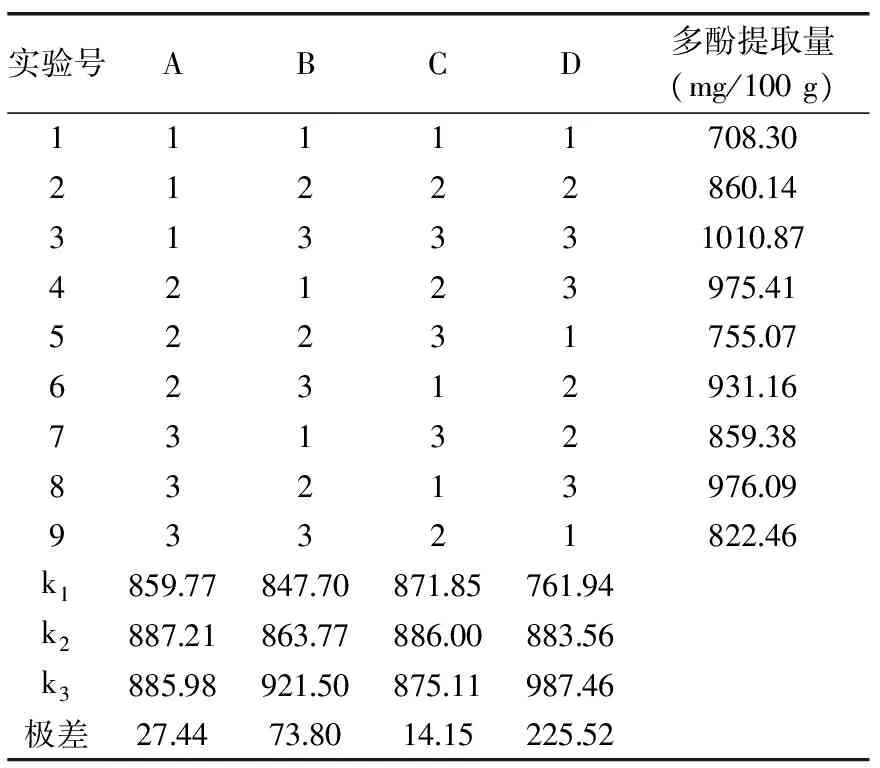
表2 正交实验结果
2.2澳洲坚果青皮多酚提取正交优化实验结果
由表2和表3极差和方差分析可知,各因素对澳洲坚果青皮多酚提取量的影响顺序依次为:乙醇体积分数(C)、料液比(B)、提取时间(A)和提取温度(D),A、B、C为极显著,D为不显著。最佳工艺条件为:A2B3C2D3,即提取时间为90 min、料液比为1∶50 g/mL、乙醇体积分数为40%、提取温度为50 ℃。此最佳工艺组合不在已知的9组正交实验中,需进行验证实验。在最佳工艺组合条件下对澳洲坚果青皮中多酚进行提取,澳洲坚果青皮多酚提取量为(1027.47±10.76) mg/100 g,高于其他实验组,但与正交实验中较优组合A1B3C3D3无显著差异性。综合考虑溶剂消耗、能量消耗等,澳洲坚果坚果青皮多酚提取最佳工艺条件为A2B3C2D3。

表3 正交实验方差分析表
2.3澳洲坚果青皮多酚抗氧化能力研究
2.3.1 澳洲坚果青皮多酚对DPPH自由基清除能力的研究 从图5中可知,在2.0~10.0 mg/L浓度范围内,Trolox和澳洲坚果青皮多酚DPPH自由基清除能力与浓度呈正相关。澳洲坚果青皮多酚对DPPH自由基的IC50为4.13 mg/L,Trolox对DPPH自由基的IC50为18.56 mg/L,由此可知,在等浓度条件下,澳洲坚果青皮多酚对DPPH自由基的清除能力远高于Trolox。
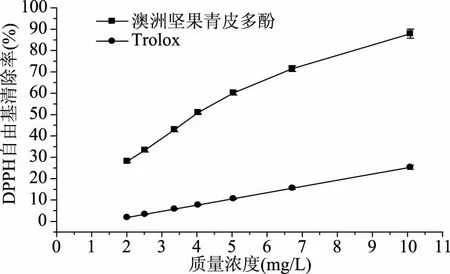
图5 澳洲坚果青皮多酚与Trolox对DPPH自由基的清除作用
2.3.2 澳洲坚果青皮多酚对ABTS+自由基清除能力的研究 从图6中可知,Trolox和澳洲坚果青皮多酚对ABTS+自由基清除能力与其对DPPH自由基清除能力结果一致,在20.0~200.0 mg/L浓度范围内,随Trolox和澳洲坚果青皮多酚浓度的增加,其对ABTS+自由基清除能力不断增加。澳洲坚果青皮多酚对ABTS+自由基的IC50为112.94 mg/L,Trolox对ABTS+自由基的IC50为293.83 mg/L,由此可知,澳洲坚果青皮多酚对ABTS+自由基清除能力远高于同浓度下的Trolox。
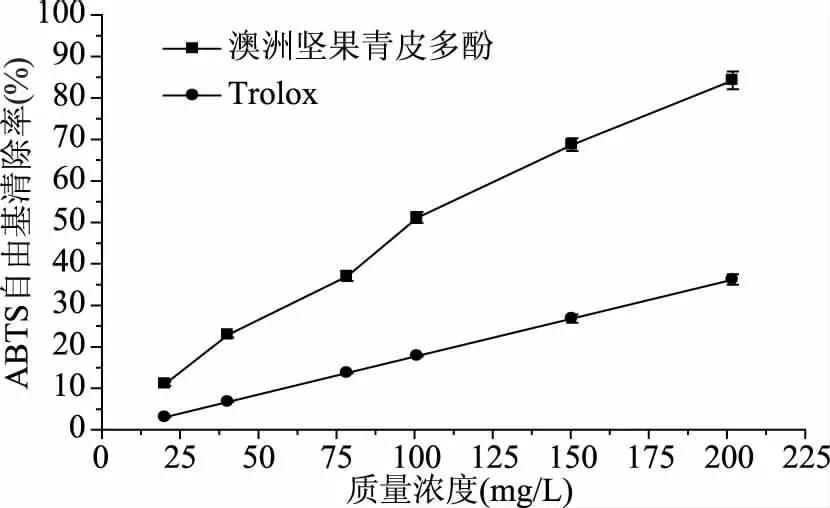
图6 澳洲坚果青皮多酚与Trolox对ABTS+自由基的清除作用
2.3.3 澳洲坚果青皮多酚总抗氧化能力的研究 以Trolox为标准物质,根据浓度与吸光值得关系,制作标准曲线:y=0.00123x+0.07672(其中:y为吸光值;x为Trolox浓度,mg/L;R2=0.9990),见图7。当澳洲坚果青皮多酚浓度为201.86 mg/L时,由Trolox标准曲线查的Trolox浓度为(343.32±10.35) mg/L,即澳洲坚果青皮多酚浓度为201.86 mg/L时,其总抗氧化能力相当于343.32 mg/L的Trolox,由此可知,澳洲坚果青皮多酚的总抗氧化能力约为Trolox的1.7倍。
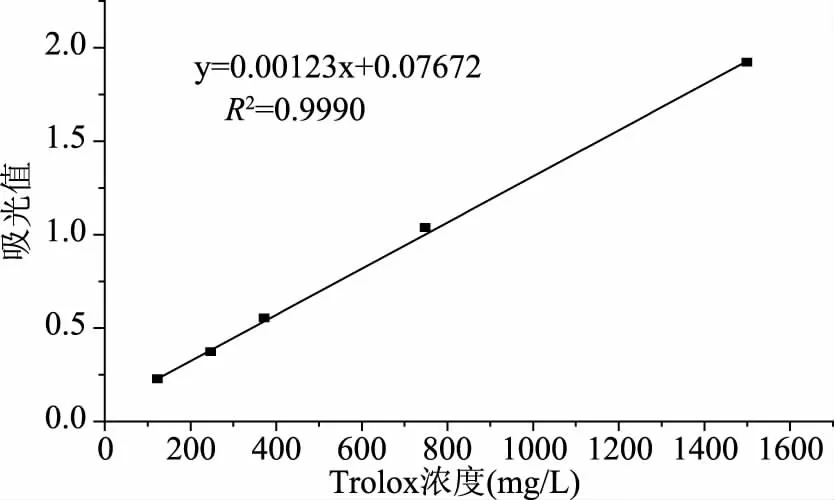
图7 总抗氧化能力标准曲线
3 结论
通过正交实验极差分析与方差分析明确了各因素对澳洲坚果青皮多酚提取的影响顺序依次为:乙醇体积分数、料液比、提取时间和提取温度,并确定了最佳工艺条件:提取时间为90 min、料液比为1∶50 (g/mL)、提取温度为50 ℃、乙醇体积分数为40%;在此条件下,澳洲坚果青皮多酚提取量(1027.47±10.76) mg/100 g。
以Trolox为阳性对照,评价澳洲坚果青皮多酚的体外抗氧化活性。澳洲坚果青皮多酚对DPPH自由基和ABTS+自由基的IC50分别为4.13、112.94 mg/L,与Trolox相比,分别低了14.43 mg/L和180.89 mg/L;澳洲坚果青皮多酚总抗氧化能力约为Trolox的1.7倍。由此可知,澳洲坚果青皮多酚具有较强的抗氧化能力,可用于制备天然抗氧化剂,为澳洲坚果副产物高值化利用及延伸澳洲坚果加工产业链提供基础。
[1]Duxbury D. Lipid scientists shake healthy macadamia nut tree[J]. Food Processing,1995,54(6):83.
[2]刘建福,黄莉.澳洲坚果的营养价值及其开发利用[J].中国食物与营养,2005(2):25-26.
[3]杜丽清,曾辉,邹明宏,等.澳洲坚果品种Ikaika(333)主要性状研究[J].中国农学通报,2008,24(12):473-479.
[4]涂行浩,张秀梅,刘玉革,等.澳洲坚果壳色素的理化性质
及稳定性研究[J].食品科学,2015,36(15):35-39.
[5]杨为海,张明楷,曾辉,等.澳洲坚果种壳矿质元素含量研究[J].湖北农业科学,2011,50(23):4958-4961.
[6]Nuchjira Dejang,Onpailin Somprasit,Sirinuch Chindaruksa. A preparation of activated carbon from macadamia shell by microwave irradiation activation[J]. Energy Procedia,2015,79:727-732.
[7]Surachai Wongcharee,Vasantha Aravintha,Laszlo Erdei,et al. Use of macadamia nut shell residues as magnetic nanosorbents[J]. Intetnational Biodeterioration and Biodegradation,2017,ISSN 0964-8305,http://dx.doi.org/10.1016/j.ibiod.2017.04.004.
[8]Ravindra Rajarao,Veena Sahajwalla. A cleaner,sustainable approach for synthesising high purity silicon carbide and silicon nitride nanopowders using macadamia shell waste[J]. Journal of Cleaner Production,2016,133:1277-1282.
[9]张明楷,杨为海,曾辉,等.澳洲坚果果皮中主要功能性成分分析[J].热带农业科学,2011,31(5):73-75.
[10]李彪,熊智,王金华,等.澳洲坚果青皮提取物对思茅松毛虫的杀虫活性研究[J].中国农学通报,2011,27(31):264-268.
[11]林文秋,杨为海,邹明宏,等.澳洲坚果果皮不同溶剂提取物的含量和抗氧化活性[J].江苏农业科学,2017(1):171-174.
[12]Pantelidis G E,Vasilakakis M,Manganaris G A,et al. Antioxidant capacity,phenol,anthocyanin and ascorbic acid contents in raspberries,blackberries,red currants,gooseberries and Cornelian cherries[J]. Food Chemistry,2007,102(3):777-783.
[13]W Brand-Williams,M E Cuvelier,C Berset. Use of a free radical method to evaluate antioxidant activity[J]. Lebensmittel-Wissenschaft and Technologie,1995,28(1):25-30.
[14]Roberta Re,Nicoletta Pellegrini,Anna Proteggente,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Racical Biology Medicine,1999,26(9-10):1231-1237.
[15]Iris F F Benzie,J J Strain. The ferric reducing ability of plasma(FRAP)as a measure of “Antioxidant Power”:The FRAP assy[J].Analytical Biochemistry,1996,239(1):70-76.
[16]旷慧,迟超,吕长山,等. 红树莓多酚的醇法提取工艺优化[J]. 食品科学,2016,37(10):88-93.
[17]伍春,徐立,刘骏驰. 响应曲面法优化新疆药桑桑皮总多酚提取工艺[J]. 食品科学,2011,32(2):104-107.
[18]K Nagendra Prasad,Fouad Abdulrahman Hassan,Bao Yang,et al. Response surface optimization for the extraction of phenolic compounds and antioxidant capacities of underutilized Mangifera pajang Kosterm.peels[J]. Food Chemistry,2011,128:1121-1127.
[19]Spigno G.,Tramelli L.,Faveri D M D. Effects of extraction time,temperature and solvent on the concentration and antioxidant activity of grape marc phenolics[J]. Journal of Food Engineering,2007,81(1):200-208.
[20]赵国建,席东亮,段江莲.核桃青皮多酚提取工艺优化[J].陕西农业科学,2013,59(4):3-8.
Optimizationofextractionandantioxidantactivityofpolyphenolsfrommacadamiagreenpeel
ZHANGMing,SHUAIXi-xiang,DULi-qing*,TUXing-hao
(Key Laboratory of Tropical Fruit Biology of the Ministry of Agriculture,South Subtropical Crops Research Institute ofthe Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091,China)
The study focus on the optimization of extraction and antioxidant activity of polyphenols from fresh macadamia green peel. The four factors and three level orthogonal test was carried out on the basis of single factor experiment. The evaluation of antioxidant activity of the polyphenols that extracted from macadamia green peel was carried out by DPPH,ABTS+radical scavenging and total antioxidant capacity in comparison to Trolox. The optimized conditions were determined as follows:extraction time 90 min,solid-liquid ratio 1∶50 (g/mL),extraction temperature 50 ℃,40% ethanol. And the polyphenols yield was up to(1027.47±10.76) mg/100 g under the optimized conditions. In the DPPH,ABTS+radical scavenging assays,the IC50value of the polyphenols that extracted from macadamia green peel were 4.13,112.94 mg/L,respectively. And the total antioxidant capacity was about 1.7 times of Trolox. Moreover,the antioxidant capacity of the polyphenols that extracted from macadamia green peel was very strong and it can be used to prepare natural antioxidants.
macadamia green peel;polyphenols;extraction;antioxidant
2017-05-18
张明(1989-),硕士研究生,研究方向:休闲农产品加工,E-mail:zhangmingqau@163.com。
*
杜丽清(1976-),硕士,研究员,研究方向:休闲农业,E-mail:duliqing927618@163.com。
中央级公益性科研院所基本科研业务费专项资金项目(1630062016007);中国热带农业科学院基本科研业务费专项资金(1630062017018);中国热带农业科学院基本科研业务费专项资金(1630062016012);公益性行业(农业)科研专项(201303077)。
TS202.1
B
1002-0306(2017)22-0195-05
10.13386/j.issn1002-0306.2017.22.038
