水提酸沉法提取蜂王浆水溶性蛋白的工艺优化
2017-12-06,
,
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
水提酸沉法提取蜂王浆水溶性蛋白的工艺优化
张越,付莉*
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
以黑龙江密山蜂王浆作为原料,水溶性蛋白提取率作为评价指标,在单因素实验和PB实验的基础上,利用响应面法对水提酸沉法提取蜂王浆水溶性蛋白的工艺进行优化。实验结果显示,最佳工艺参数为离心转速10000 r/min、离心时间25 min、料水质量比1∶20、超声波提取时间41 min、沉淀时间43 min,此条件下蜂王浆水溶性蛋白提取率达到69.97%,是蜂王浆水溶性蛋白提取的较好方法。
水提酸沉法,蜂王浆,水溶性蛋白,提取工艺,优化
蜂王浆(Royal jelly,RJ)是可供人类直接服用并能被人体很好吸收的含高活性成分的超级营养食品,具有多种生物活性且大多跟蜂王浆中所含的丰富的蛋白质密切相关[1-2]。蜂王浆中水溶性蛋白质约占蜂王浆总蛋白的46%~89%,是蜂王浆中最主要的活性成分。但是由于国内外市场上销售的仅有新鲜蜂王浆或其冻干粉产品,因此研发蜂王浆水溶性蛋白相关的新产品十分必要[3-5]。
目前对蜂王浆水溶性蛋白的提取多采用碱溶酸沉、盐提酸沉法等方法,与这些方法相比,水提酸沉法具有成本低、操作简单、可保存被分离物生物活性等优点[6-7]。因此,本实验采用水提酸沉法对蜂王浆水溶性蛋白的提取工艺进行研究,以水溶性蛋白提取率为评价指标,通过单因素实验、PB和响应面优化分析,对蜂王浆水溶性蛋白的提取工艺进行优化,获得水提酸沉法提取蜂王浆水溶性蛋白的最佳提取条件。
1 材料与方法
1.1材料与仪器
蜂王浆 黑龙江密山蜂场,-20 ℃冻藏;牛血清蛋白 北京索莱宝科技有限公司;盐酸、硫酸钾、95%乙醇、考马斯亮蓝G-250、85%磷酸等 均为分析纯,天津市科密欧化学试剂有限公司。
UV-6300型紫外可见分光光度计 上海美普达仪器有限公司;KND-04型微量凯氏定氮装置 上海新嘉电子有限公司;KQ3200B型超声清洗器 昆山市超声仪器有限公司;立式高速冷冻离心机 湖南赫西仪器装备有限公司。
1.2实验方法
1.2.1 蜂王浆水溶性蛋白提取工艺 10 g蜂王浆(按一定比例加入蒸馏水)→超声波提取(150 W)一定时间→4 ℃离心(一定离心转速、一定时间)→去沉淀→收集上清液→用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液调节pH至等电点→沉淀→4 ℃、12000 r/min离心20 min→去上清液→收集沉淀得到含盐蛋白质→透析除盐→蛋白提取物。
1.2.2 蜂王浆水溶性蛋白质等电点的测定 预实验:将10 g蜂王浆与蒸馏水以1∶5的比例进行混合,搅拌使其充分混匀,4 ℃浸提1 h,12000 r/min离心20 min,收集上清液。分别取5 mL上清液加入到5支干净的具塞刻度比色管中,编号为1、2、3、4、5,并用0.1 mol/L盐酸和0.1 mol/L氢氧化钠调节其pH分别为3.0、3.5、4.0、4.5、5.0,并用蒸馏水定容至25 mL,4 ℃静置5 h后,观察5支比色管中溶液的浑浊程度(即蛋白质的沉淀量)[8]。
分别取上述5 mL上清液加入到11支干净的具塞刻度比色管中,编号为1~11,并用0.1 mol/L盐酸和0.1 mol/L氢氧化钠调节其pH分别为4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0,并用蒸馏水定容至25 mL,4 ℃静置5 h后,观察11支比色管中溶液的浑浊程度(即蛋白质的沉淀量)[8]。
1.2.3 蜂王浆水溶性蛋白提取工艺优化
1.2.3.1 单因素实验 采用1.2.1的工艺提取蜂王浆水溶性蛋白,重新溶于蒸馏水并于波长595 nm处测定吸光度,提取条件为:超声波提取30 min,10000 r/min离心20 min,沉淀40 min,考察不同料水质量比(1∶5、1∶10、1∶15、1∶20、1∶25)对水溶性蛋白提取率的影响;料水质量比1∶20,10000 r/min离心25 min,沉淀40 min,考察不同超声波提取时间(10、20、30、40、50 min)对水溶性蛋白提取率的影响;料水质量比1∶20,超声波提取30 min,离心20 min,沉淀40 min,考察不同离心转速(4000、6000、8000、10000、12000 r/min)对水溶性蛋白提取率的影响;料水质量比1∶20,超声波提取30 min,离心转速10000 r/min,沉淀40 min,考察不同离心时间(15、20、25、30、35 min)对水溶性蛋白提取率的影响;料水质量比1∶20,超声波提取40 min,10000 r/min离心25 min,考察不同沉淀时间(20、30、40、50、60 min)对水溶性蛋白提取率的影响。
1.2.3.2 PB实验选取显著性因素 以上述单因素实验结果为依据进行N=12的PB实验,对上述5个因素加以考察,每个因素选择-1和1两个水平,将蜂王浆水溶性蛋白提取率作为响应值[9]。PB实验设计因素水平和编码如表1所示。

表1 PB实验设计因素水平和编码
1.2.3.3 响应面优化设计 PB实验选定因素进行响应面实验,确定最佳提取条件。离心转速10000 r/min,离心时间25 min。实验设计因素水平如表2所示。
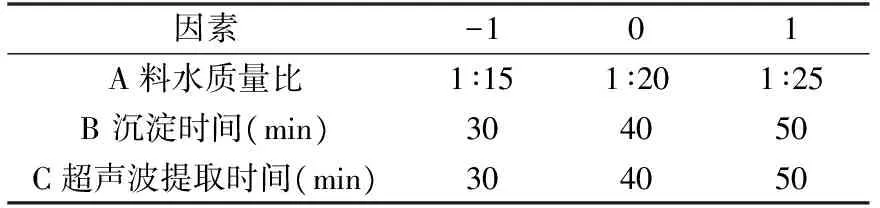
表2 响应面实验因素水平及编码
1.2.3.4 蜂王浆水溶性蛋白提取率测定 参考GB 5009.5-2016中方法测定蜂王浆总蛋白含量。参考《进出口危险化学品安全实验方法》中第20部分Bradford法测定提取所得蜂王浆水溶性蛋白含量,得到线性回归方程:y=0.0062x+0.0621,R2=0.9999,表明Bradford法中吸光度(y)与牛血清蛋白含量(x)之间有非常明显的线性关系,将样品吸光度代入该方程,即可得样品蜂王浆中所含水溶性蛋白含量,再根据式(1)计算出蜂王浆水溶性蛋白的提取率。
蜂王浆水溶性蛋白提取率(%)=蜂王浆水溶性蛋白含量/蜂王浆总蛋白含量×100
式(1)
1.3数据处理
PB实验与响应面的设计、数据分析利用Design-Expert 8.0软件。
2 结果与分析
2.1蜂王浆水溶性蛋白质等电点的测定
预实验结果显示,在pH4和pH5时,水溶性蛋白沉淀量最大,为了更精确地测定水溶性蛋白的等电点,在pH4和pH5之间每隔0.1个单位调节一个pH,结果如表1所示,pH4.4时沉淀量最大,因此蜂王浆水溶性蛋白等电点为pH4.4。

表3 水溶性蛋白等电点的测定
注:“+”表示沉淀量的多少,“+”越多表示沉淀量越多。
2.2单因素实验
2.2.1 料水质量比对水溶性蛋白提取率的影响 如图1所示,水溶性蛋白提取率随着料水质量比的增大出现先增高后降低的趋势,并且料水质量比在1∶20时最高。这可能是因为料水质量比太低,水溶性蛋白不能完全溶于水中,随着料水质量比的增大,水溶性蛋白逐渐溶于水中,而过高的料水质量比会使得体系中的蛋白质太过分散,有效组分含量减少,难以全部回收,导致水溶性蛋白提取率降低[10],因此,料水质量比选取1∶20。
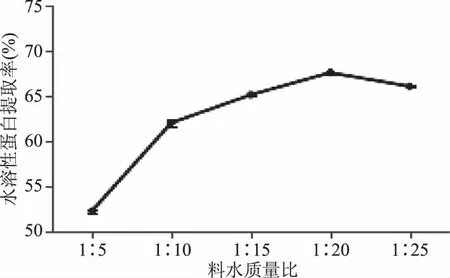
图1 料水质量比对水溶性蛋白提取率的影响
2.2.2 超声波提取时间对水溶性蛋白提取率的影响 如图2所示,蜂王浆水溶性蛋白提取率随着超声波提取时间的增加,出现先升高后降低的趋势,并且在超声波提取40 min时最高。超声波通过波源的振荡作用,使提取物的外表受到机械损伤和破碎,使溶胀的时间大大地减少。超声空化作用使得蛋白质在较短时间内最大限度的溶出,而超声空化作用时间过长会使得蛋白质变性,从而导致水溶性蛋白提取率降低[11-12]。因此,超声波提取时间选择40 min。
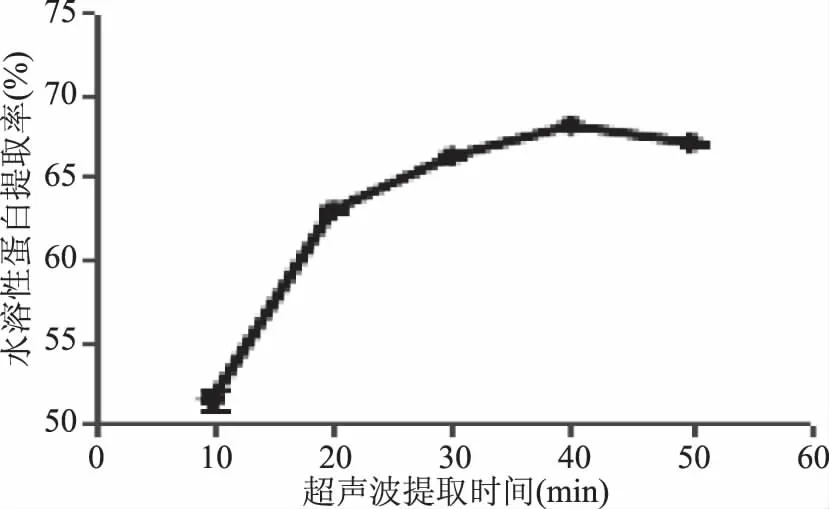
图2 超声波提取时间对水溶性蛋白提取率的影响
2.2.3 离心转速对水溶性蛋白提取率的影响 如图3所示,蜂王浆水溶性蛋白提取率随着离心转速的增大,呈现先降低后增高再降低的趋势,并且离心转速4000 r/min时最高。但是离心转速4000 r/min和6000 r/min时,溶液呈浑浊状,不溶性蛋白质的混入导致了结果偏高;而离心转速在8000~12000 r/min时,10000r/min的水溶性蛋白提取率最高。因此离心转速选取10000 r/min。
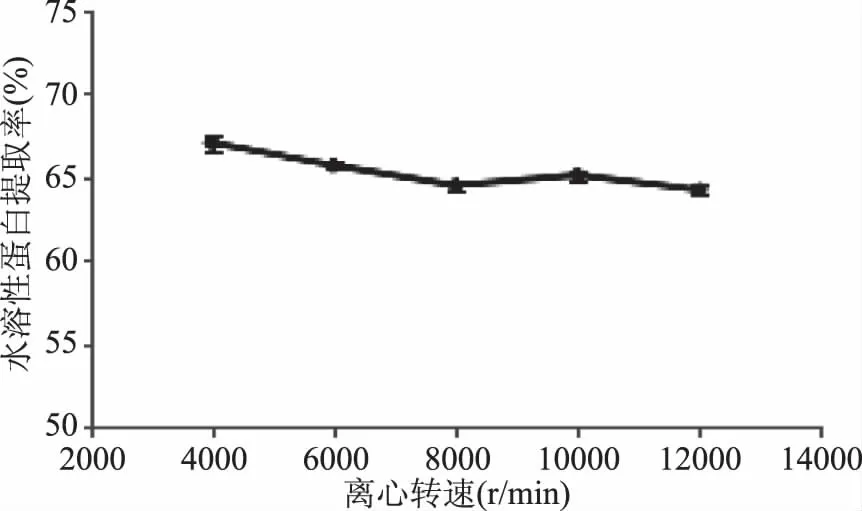
图3 离心转速对水溶性蛋白提取率的影响
2.2.4 离心时间对水溶性蛋白提取率的影响 如图4所示,蜂王浆水溶性蛋白提取率随着离心时间的增加,呈现降低并趋于恒定的趋势,并且在离心时间15 min时最高。但是离心时间15 min和20 min时,溶液呈浑浊状,不溶性蛋白质的混入导致了结果偏高[13],而25~35 min范围内,水溶性蛋白提取率趋于恒定,所以综合考虑,离心时间选择25 min。
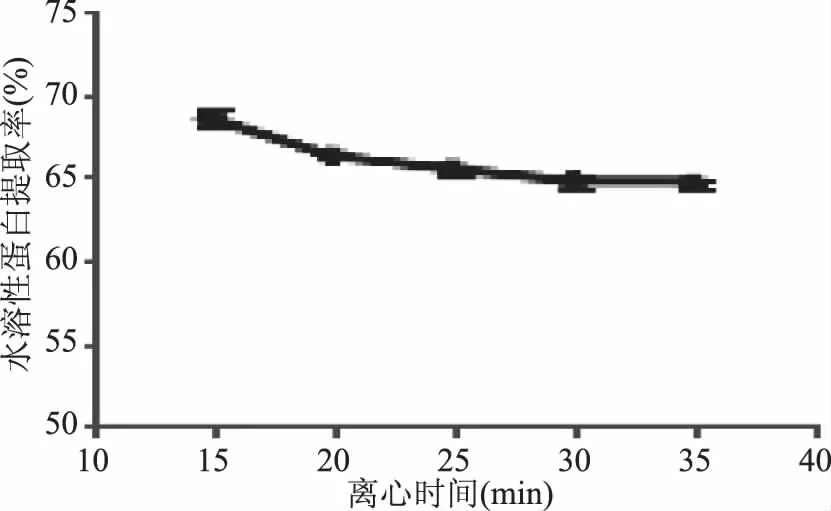
图4 离心时间对水溶性蛋白提取率的影响
2.2.5 沉淀时间对水溶性蛋白提取率的影响 如图5所示,蜂王浆水溶性蛋白提取率随着沉淀时间的增加,呈现先增高后趋于稳定的变化趋势,并且在沉淀时间60 min时最高。但40~60 min逐渐趋于最大沉降限度,水溶性蛋白提取率趋于恒定。所以考虑节约资源问题,沉淀时间选择40 min。
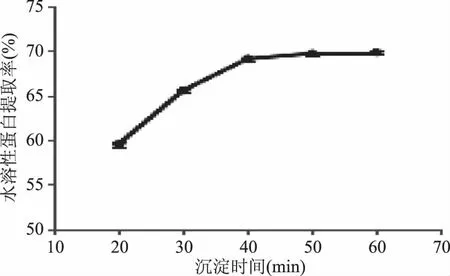
图5 沉淀时间对水溶性蛋白提取率的影响
2.3PB实验结果与分析
2.3.1 PB实验结果 以单因素实验结果为依据进行N=12的PB实验,对上述5个因素加以考察,结果如表4所示。
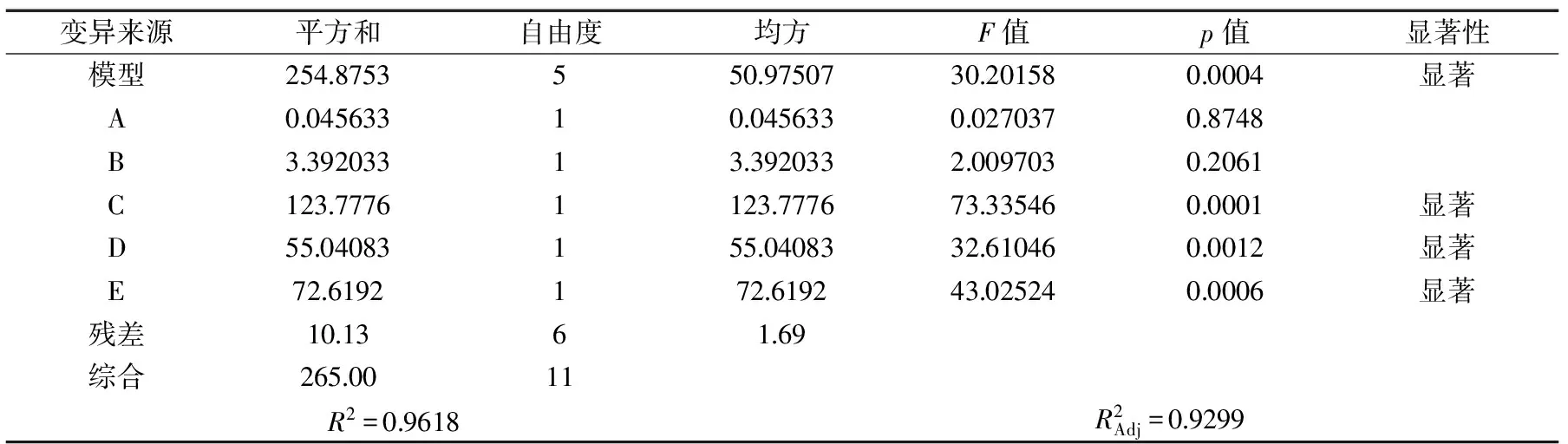
表5 PB实验方差分析
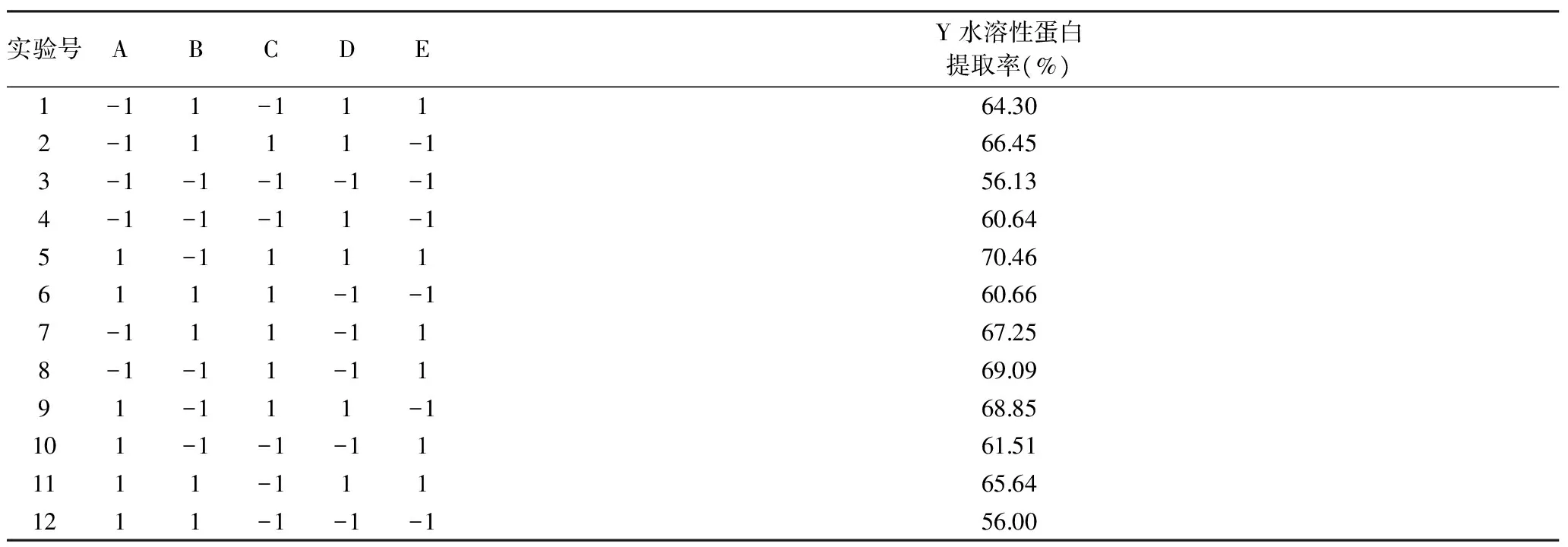
表4 PB实验设计与结果
2.3.2 PB实验方差分析 利用Design-Expert 8.0软件进行回归拟合,得到回归方程为:蜂王浆水溶性蛋白提取率(%)=63.92-0.062A-0.53B+3.21C+2.14D+2.46E。方差分析如表5所示,R2=0.9618,且回归模型(p<0.05)显著,具有统计学意义。五个因素中只有料水质量比、超声波提取时间、沉淀时间对蜂王浆水溶性蛋白提取率影响显著,因此选定该三个因素进行接下来的响应面优化分析。
2.4响应面优化实验
2.4.1 实验设计与数据分析 以单因素及PB实验结果为基础,选择料水质量比(A)、沉淀时间(B)、超声波提取时间(C)三个因素,水溶性蛋白提取率(Y)为响应值,利用响应面软件设计水提酸沉法提取蜂王浆水溶性蛋白实验方案。结果如表6所示。
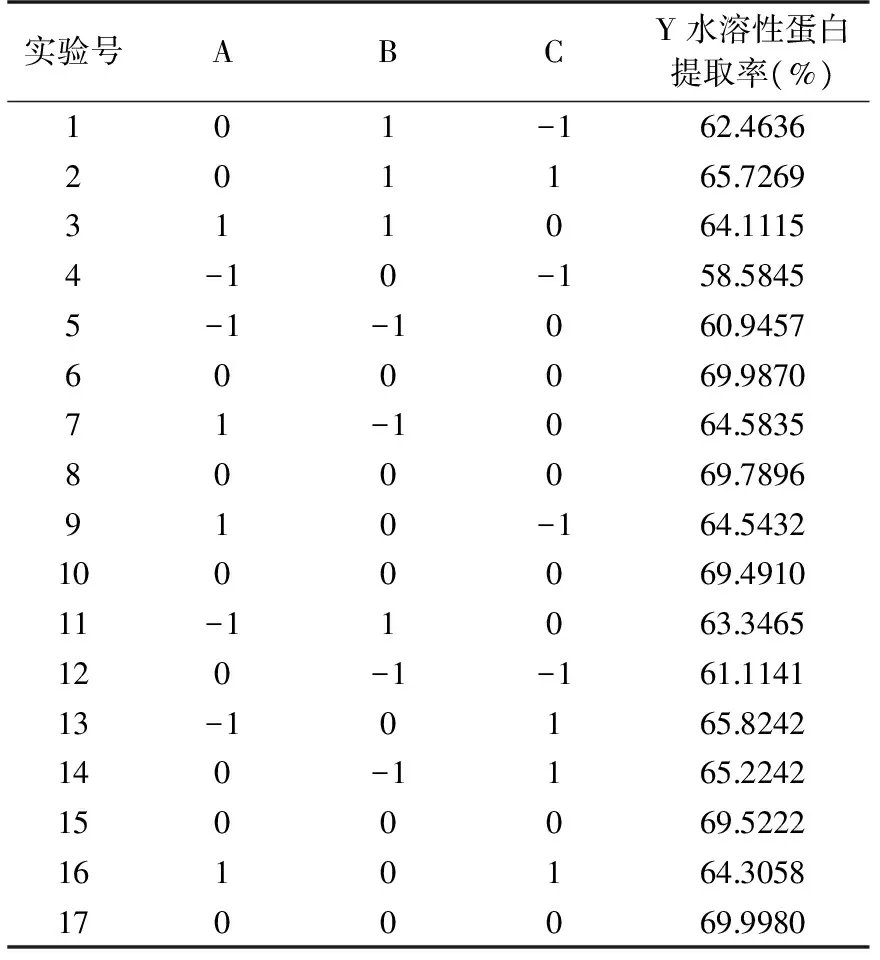
表6 响应面实验设计与结果
2.4.2 回归模型的方差分析 运用响应面软件将实验数据回归拟合,得到蜂王浆水溶性蛋白提取率与料水质量比、沉淀时间、超声波提取时间三因素间的回归方程:Y:水溶性蛋白提取率(%)=69.76+1.11A+0.47B+1.80C-0.72AB-1.87AC-0.21BC-3.41A2-3.10B2-3.03C2。该方程的二次项系数均为负值,初步推断响应面开口向下,在各因素所选水平范围内具有极大值点,能够进行蜂王浆水溶性蛋白提取率工艺的优化分析[14-15]。
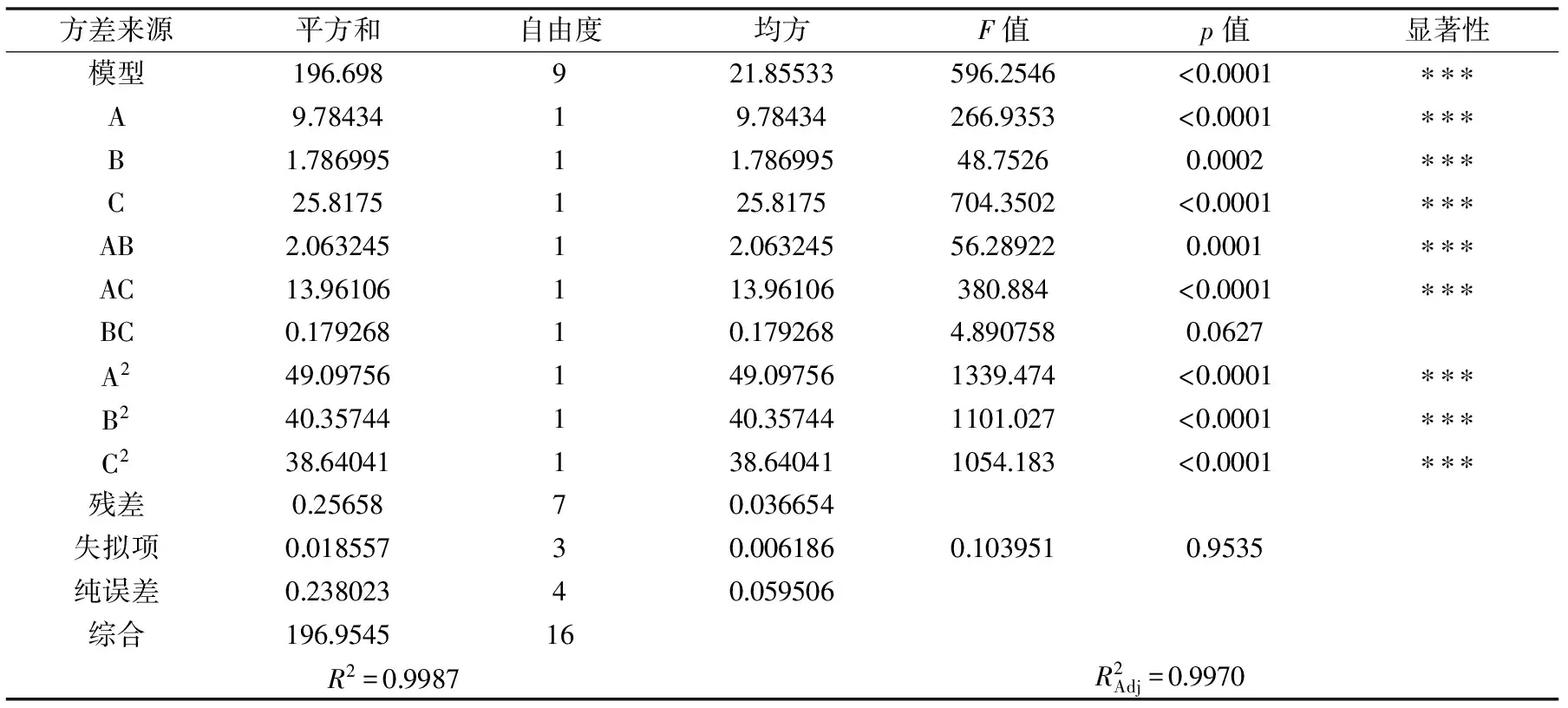
表7 回归模型的方差分析结果
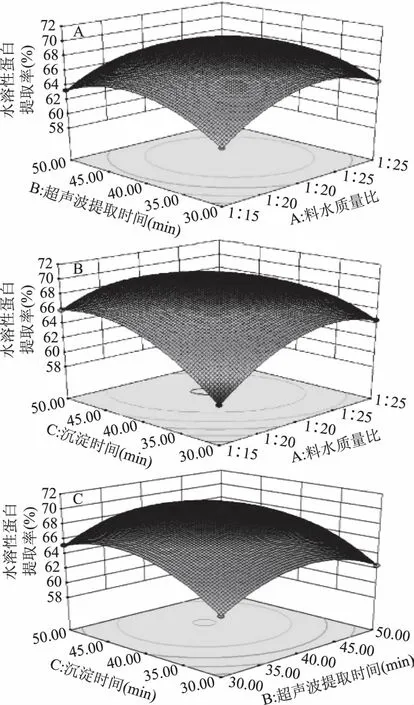
图6 AB、AC、BC交互作用对蜂王浆水溶性蛋白提取率影响的响应面图
注:***:p<0.001为极显著;**:p<0.01为非常显著;*:p<0.05显著。
回归模型的方差分析结果如表7所示,该模型p<0.001(极显著),失拟项=0.9549>0.05(不显著),表明该回归模型与实验数据很吻合,实验误差较小。回归模型R2=0.9987,即拟合优度为99.87%,表示该回归模型与实验数据拟合程度较高,自变量和响应值间有明显的线性关系,所以该模型可对蜂王浆水溶性蛋白提取工艺优化实验进行理论推测。料水质量比、超声波提取时间和沉淀时间的p值均小于0.001,说明三因素对蜂王浆水溶性蛋白提取率影响均极显著。F值大小能够反映出各因素对响应值的影响程度,并呈正相关[16],因此,可得出三者对蜂王浆水溶性蛋白提取率的影响程度依次是超声波提取时间>料水质量比>沉淀时间。交互项AB、AC影响极显著(p<0.001),交互项BC影响不显著(p>0.05)。
2.4.3 响应面分析图 从图6中可以得出,各因素及其交互作用对蜂王浆水溶性蛋白提取率的影响。从图6(A)中可以看出,随着料水质量比和超声波提取时间的增加,蜂王浆水溶性蛋白提取率均呈现先增加后减少的趋势,响应面图形曲面弧度较大,表明二者交互作用对蜂王浆水溶性蛋白提取率影响显著。从图6(B)中可以看出,随着料水质量比和沉淀时间的增加,蜂王浆水溶性蛋白提取率均呈现先增加后减少的趋势,响应面图形曲面陡峭[16],表明二者间交互作用对蜂王浆水溶性蛋白提取率的影响显著。从图6(C)中可以看出,随着超声波提取时间和沉淀时间的增加,蜂王浆水溶性蛋白提取率均呈现先增加后减少的趋势,响应面图形曲面弧度小,表明二者间交互作用对蜂王浆水溶性蛋白提取率的影响不显著。
2.5验证实验
根据上述回归模型,通过响应面优化实验所得水提酸沉法提取蜂王浆水溶性蛋白的最佳条件是:料水质量比1∶20、超声波提取时间40.57 min、沉淀时间42.69 min,并得到蜂王浆水溶性蛋白提取率的预测值是70.05%。为检验该结果的可靠性,拟采用上述响应面优化实验所得水提酸沉法提取的条件,并结合实际情况,在料水质量比1∶20、超声波提取时间41 min、沉淀时间43 min的条件下,经过3次重复实验,得到蜂王浆水溶性蛋白提取率的平均值为69.97%,与响应面优化实验所得预测值接近,表明回归模型预测结果与实际结果很好拟合,响应面优化分析回归模型可信度较高,所得最佳条件具有可行性。
3 结论
采用水提酸沉法提取蜂王浆水溶性蛋白,并在单因素实验和PB实验的基础上,利用响应面优化分析并结合实际情况,确定水提酸沉法提取蜂王浆水溶性蛋白的最佳条件:料水质量比1∶20、超声波提取时间41 min、沉淀时间43 min。通过该最佳提取条件得到蜂王浆水溶性蛋白提取率的平均值为69.97%,与理论预测值的误差小于0.1%,表明所建蜂王浆水溶性蛋白提取回归模型成功。
[1]李俊霖. 10-HDA对G~+抑菌活性及机制的研究[D].济南:齐鲁工业大学,2014.
[2]唐雨薇,宁方勇. 蜂产品的保健医疗作用[J]. 信息化建设,2015(5):115-116.
[3]Kamakura M. Royalactin induces queen differentiation inhoneybees[J].Nature,2011,473(7348):478-483.
[4]沈立荣,张璨文,丁美会,等.蜂王浆的营养保健功能及分子机理研究进展[J].中国农业科技导报,2009,11(4):41-47.
[5]Salazar-Olivo L A,Paz-Gonzales V.Screening of biologicalactivities present in honeybee(Apismellifera)royal jelly[J].ToxicologyinVitro,2005,19(5):645-651.
[6]胡熠凡,陈忠周,田文礼,等. 蜂王浆中主蛋白成分(MRJP2)的分离纯化及圆二色谱分析[J]. 食品科学,2013,39(23):57-61.
[7]魏文挺. 基于蜂王浆与盐酸显色反应和脂肪酸组成的蜂王浆质量控制研究[D].杭州:浙江大学,2014.
[8]刘合生.蜂王浆活性蛋白的分离、纯化、生物活性及结构初步表征[D].武汉:华中农业大学,2009.
[9]刘细霞,卢思帆,侯建军,等. Plackett-Burman实验结合响应面分析法优化“黑金刚”马铃薯紫红色素的提取工艺条件[J]. 食品工业科技,2016(22):285-289,295.
[10]高飞,韩春然,石彦国,等. 南极磷虾蛋白质提取条件优化[J]. 天然产物研究与开发,2016(2):307-312,194.
[11]张乐,宋洪波,周林燕,等. 超声波提取金针菇根中的蛋白质[J]. 食品与发酵工业,2013,39(12):204-208.
[12]黄国平. 玉米醇溶蛋白的超声波提取、改性与释药性能的研究[D].广州:华南理工大学,2004.
[13]高飞,韩春然,石彦国,等. 南极磷虾蛋白质提取条件优化[J]. 天然产物研究与开发,2016(2):307-312,194.
[14]李琳,王正全,张晶晶,等. 暗纹东方鲀肌肉组织蛋白酶B提取工艺优化[J]. 食品科学,2016,37(3):91-96.
[15]于张颖,肖发,柳丹丹,等. 蜂王浆主蛋白提取工艺优化及质量分析[J]. 食品工业科技,2014,39(19):185-188.
[16]孙文怡,刘金阳,刘瑜,等. 响应面法优化小刺猴头菌寡糖的纯化工艺研究[J]. 长春师范学院学报,2011,31(10):59-62.
Optimizationofwater-solubleproteinextractionprocessofroyaljellybywaterextractionandacidprecipitation
ZHANGYue,FULi*
(College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121000,China)
This experiment chose the royal jelly from Heilongjiang Mishan as raw material and took water-soluble protein extraction rate as evaluation indicator.Based on single factor experiment and Plackett-Burman design,the response surface optimization method was used to optimize the extraction of water-soluble protein from royal jelly by water extraction acid precipitation.The experiment showed that the optimum technological parameters were centrifugal speed 10000 r/min,centrifugation time 25 minutes,material water mass ratio 1∶20,ultrasonic extraction time 41 minutes,precipitation time 43 minutes.Under the condition,the water-soluble protein extraction rate of royal jelly was up to 69.97%,this method was the better way to extract royal jellywater-soluble protein .
water extraction and acid precipitation method;royal jelly;water-soluble protein;extraction process;optimization
2017-06-09
张越(1992-),女,硕士,研究方向:食品科学,E-mail:zy505188099@163.com。
*
付莉(1979-),女,博士,副教授,研究方向:食品科学,E-mail:fuli1979119@126.com。
辽宁医学院校内课题(LYHX20120810)。
TS201.2
B
1002-0306(2017)22-0184-06
10.13386/j.issn1002-0306.2017.22.036
