化学添加剂对裂壶藻突变株发酵产DHA的影响
2017-12-06,,,,,,*
,, , , ,,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.嘉必优生物工程(武汉)有限公司,湖北武汉 430073;3.中国科学院武汉病毒研究所,湖北武汉 430071)
化学添加剂对裂壶藻突变株发酵产DHA的影响
林源锋1,谢鑫磊1,付杰2,田华1,陈涛3,何东平1,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.嘉必优生物工程(武汉)有限公司,湖北武汉 430073;3.中国科学院武汉病毒研究所,湖北武汉 430071)
为了研究外源化学添加剂对裂壶藻(Schizochytriumlimacinum)突变株发酵合成脂肪酸(SFAs、PUFAs和DHA)的影响,采用基于气相色谱-质谱(GC-MS)联用技术分析裂壶藻突变株产油脂肪酸的组成。通过单因素和正交实验设计,优化了乙醇胺(ETA)、萘氧乙酸(BNOA)和水杨酸(SA)三种化学添加剂的最佳添加条件。结果表明,添加150 mg/L的乙醇胺(ETA)、10 mg/L萘氧乙酸(BNOA)和1 mg/L水杨酸(SA),裂壶藻突变株的DHA产量最高,达到6.18 g/L,比对照组提高了12.77%。综上所述,添加适量的化学添加剂可以提高裂壶藻突变株DHA的含量。
裂壶藻突变株,化学添加剂,GC-MS,DHA
裂壶藻(Schizochytriumlimacinum,又称裂殖壶菌)属于真菌门、网粘菌纲、破囊壶菌目、破囊壶菌科的单细胞海洋微藻,是继寇氏隐甲藻之后已报道的一种极具实现工业化生产DHA的海洋微藻[1-3]。目前,大多数企业都是利用裂壶藻发酵来制备DHA,由于其体积小,生长繁殖快,不受季节影响,生产周期短,油脂产量高等优点[4]已成为了近年来研究的热点。
二十二碳六烯酸(docosahexenoic acid)简称DHA,是维持大脑和视力正常功能所必需的脂肪酸,人体内合成极少,需要从食物中补充,在促进脑细胞生长发育和预防心脑血管疾病等方面具有显著功效[5-6]。虽然DHA的主要来源为深海鱼油,但是深海鱼油所产DHA的产量和品质都难以满足现有的需求[7-8]。藻油中的含量远远高于鱼油中的DHA含量,并且藻油DHA产品已于2010年被中国卫生部批准用于婴幼儿配方食品及其它多种食品中[9]。DHA对于婴幼儿大脑的健康发育极其重要,婴幼儿可以通过母乳获得也可以通过含DHA的奶粉等食物获得,DHA产品一直是儿童营养品的研究热点[10]。另外,DHA还具有预防老年痴呆[11],提高人体免疫力、延缓衰老[12]、以及消炎、抗癌和预防精神疾病等作用。
研究表明,除了优化发酵培养基组分及数量可以提高不饱和脂肪酸含量,化学添加剂也可以增加裂壶藻的脂质积累。王申强等[13]同时添加生物素、苹果酸和洛伐他汀能够显著提高DHA的产量,最高产量达到11.55 g/L,相比对照组提高了71.87%;周立树等[14]将五种维生素以最合适的浓度同时添加到发酵培养基中发现DHA产量与对照组相比提高了53.8%,远高于添加单一维生素的效果;任路静等[15]研究发现添加浅蓝菌素有利于DHA及不饱和脂肪酸含量的提高,当添加浅蓝菌素0.1 mg/L时,DHA占细胞干质量分数可达12.2%;冯云等[16]考察了40 g/L谷氨酸钠条件下培养菌种,发酵后DHA质量分数达到53.25%。本实验选用实验室保藏的裂壶藻突变株,在裂壶藻突变株发酵对数期添加乙醇胺(ETA)、萘氧乙酸(BNOA)和水杨酸(SA),首先进行单因素筛选,得到最佳浓度。在此基础上通过正交实验,筛选出最佳配方,本文旨在为DHA的发酵调控提供一种新思路。
1 材料与方法
1.1材料与仪器
裂壶藻ATCC20888 由广东微生物菌种保藏中心提供,经过等离子诱变获得的裂壶藻突变株15k-160s-2-3,本实验室保藏;葡萄糖 天津博迪化工股份有限公司;氯化钠 国药集团化学试剂有限公司;磷酸二氢钾、硫酸镁、氯化钙 天津市凯通化学试剂有限公司;碳酸氢钠、氯化钾 天津市广成化学试剂有限公司;酵母膏 北京奥博星生物技术有限责任公司;谷氨酸钠 上海如吉生物科技发展有限公司;纤维素酶(10~140万U/g)、碱性蛋白酶(20万U/g) 江苏锐阳生物科技有限公司;所用试剂 均为分析纯;乙醇胺(ETA)、萘氧乙酸(BNOA)和水杨酸(SA),萘氧乙酸和水杨酸溶解于乙醇,乙醇胺溶解于双蒸水,三种试剂使用前均过滤除菌 山东西亚化学股份有限公司;固体培养基 葡萄糖5%、谷氨酸钠3%、酵母膏0.6%、氯化钠0.8%、磷酸二氢钾0.2%、硫酸镁0.6%、氯化钙0.05%、碳酸氢钠0.02%、硫酸铵0.2%、金属离子混合液、维生素混合液、琼脂2%,pH6.5,115 ℃、30 min;种子培养液 葡萄糖8.5%、谷氨酸钠6.5%、酵母膏0.6%、氯化钠2.0%、磷酸二氢钾0.65%、硫酸镁2.2%、氯化钙0.03%、碳酸氢钠0.03%、硫酸钠0.03%、金属离子混合液、维生素混合液,pH6.5,115 ℃、30 min;发酵培养液 葡萄糖7.5%、谷氨酸钠1.5%、酵母膏1.1%、氯化钠0.2%、磷酸二氢钾0.5%、硫酸镁0.6%、氯化钙0.06%、碳酸氢钠0.06%、氯化钾0.04%、金属离子混合液、维生素混合液,pH6.5,115 ℃、30 min。
LDZX-75KB型立式蒸汽灭菌器 武汉利天科技仪器有限公司;SPX-150C型恒温恒湿箱 上海博讯实业有限公司医疗设备厂;TDL-5-A型台式离心机 上海安亭科学仪器厂;SW-CJ-1F型单人双面净化工作台 苏州净化设备有限公司;HYQ-150S型恒温摇床 武汉汇诚生物科技有限公司;GZX-9070MBE型电热鼓风干燥箱 上海博讯实业有限公司医疗设备厂;RE-52C型旋转蒸发器 上海亚荣生化仪器厂;Agilent 7890A型气相色谱质谱仪 安捷伦科技(中国)有限公司。
1.2实验方法
1.2.1 培养条件
1.2.1.1 藻种活化 将本实验室保藏的裂壶藻突变株转接于固体培养基,于26 ℃恒温恒湿培养箱中培养2~3 d,挑取生长较好的单菌落转接于固体斜面培养基,26 ℃条件下培养3 d进行活化。
1.2.1.2 一级种子 用接种环从固体斜面培养基挑取活化的藻种接入装有50 mL种子培养液的250 mL三角瓶中,置于摇床上,在26 ℃,180 r/min条件下培养48 h。
1.2.1.3 二级种子 取5 mL的一级种子,接入装有100 mL种子培养液的500 mL三角瓶中,置于摇床上,在26 ℃,180 r/min条件下培养48 h。
1.2.1.4 发酵培养 将种子液按照10%的接种量接种到发酵培养液中,在26 ℃、180 r/min的条件下振荡培养120 h,得到裂壶藻发酵培养液,待后续使用。
1.2.2 化学添加剂的添加 取0.1 g萘氧乙酸溶于10 mL 50%乙醇,制得母液,经过滤除菌后备用;取0.1 g水杨酸溶于10 mL 50%乙醇,制得母液,经过滤除菌后备用;取1 mL乙醇胺溶于9 mL双蒸水经过滤除菌后备用。枪头灭菌,裂壶藻发酵培养48 h后用移液枪分别吸取不同质量浓度的三种化学添加剂加入裂壶藻发酵培养液中摇瓶发酵72 h。
1.2.3 油脂提取及产量测定
1.2.3.1 油脂的提取 收集裂壶藻发酵培养液在5000 r/min的条件下离心10 min,离心两次,去除上清液,将离心得到的藻泥与水按料液比1∶1 (g/mL)混合均匀,置于恒温磁力搅拌器中,温度55 ℃下搅拌。按发酵液的0.5%和0.025%分别加入碱性蛋白酶和纤维素酶,酶解6~8 h,真空冷冻干燥至质量恒定,研磨成藻粉。利用索氏抽提法用乙醚抽提至藻粉无色,旋转蒸发残留溶剂,得到藻油,置于烘箱干燥至两次质量变化<0.2 mg,计算油脂产量。
1.2.3.2 油脂产量 计算公式如下:
1.2.4 脂肪酸甲酯化处理和DHA测定方法
1.2.4.1 脂肪酸甲酯化处理 精密称取0.2 g藻油于20 mL试管中,加入0.5 mol/L的NaOH-甲醇溶液3 mL,60 ℃水浴加热,直至油样完全溶解(约30 min),冷却后加入25%的BF3-甲醇溶液2 mL,60 ℃水浴酯化20 min。冷却后加入3 mL正己烷(色谱纯)并振荡,再加入2 mL饱和NaCl溶液并振荡。静置30 min后取上层有机相于一只干燥试管中,并加入少量无水硫酸钠以去除微量水分,经气相色谱质谱分析得到DHA相对含量,相对含量以峰面积百分比表示。
1.2.4.2 DHA产量 计算公式如下:
DHA产量(g/L)=油脂产量(g/L)×DHA含量(%)
1.2.5色谱条件 选用Agilent SP-2560色谱柱(100 m×25 μm,0.2 μm);升温程序:初始温度100 ℃,保持4 min,然后以3 ℃/min升温至230 ℃,保持20 min,载气(N2)流速25 mL/min,压力2.4 kPa,进样量1 μL;分流比30∶1。
1.2.6 质谱条件 电子轰击(EI)离子源;电离能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;接口温度250 ℃;全扫描模式,质量扫描范围m/z 50~500。
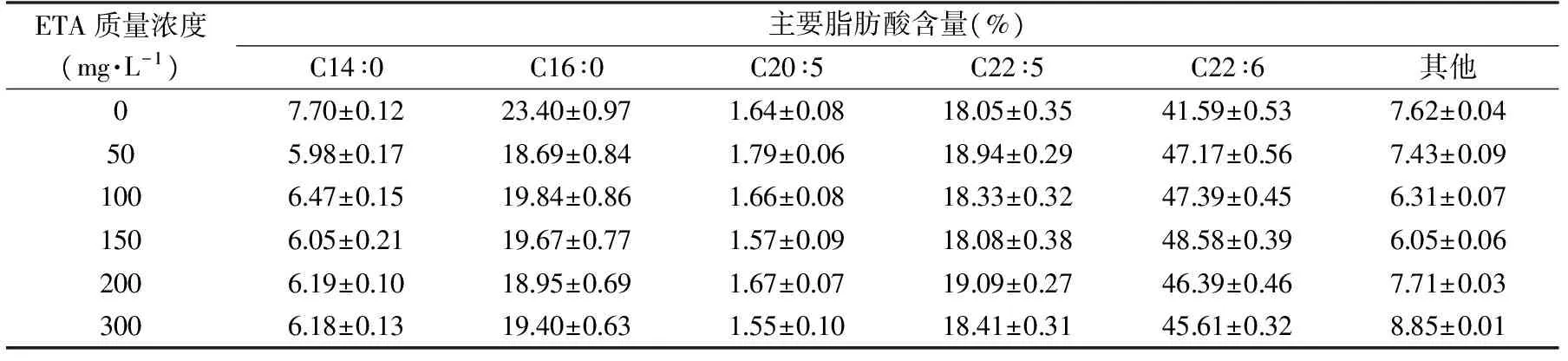
表2 乙醇胺质量浓度对裂壶藻突变株脂肪酸分布的影响
1.3实验设计
1.3.1 单因素实验 分别考察乙醇胺、萘氧乙酸、水杨酸对DHA含量的影响。乙醇胺加入的质量浓度分别为50、100、150、200、300 mg/L;萘氧乙酸加入的质量浓度(mg/L)分别为4、6、8、10、15;水杨酸加入的质量浓度(mg/L)分别为0.2、0.5、1、1.5、2。每组实验重复3次,取平均值。
1.3.2 正交实验设计 通过单因素实验表明,分别在裂壶藻突变株发酵期添加乙醇胺、萘氧乙酸和水杨酸都能提高裂壶藻突变株合成DHA的能力。在单因素的基础上,以乙醇胺、萘氧乙酸和水杨酸的质量浓度为因素采用L9(34)正交表,设计3因素3水平正交实验,正交实验因素和水平见表1。
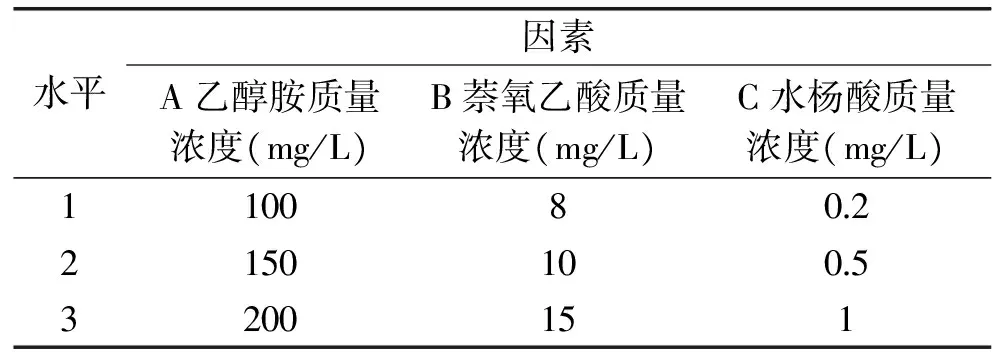
表1 正交实验因素水平
1.4数据处理
利用GC-MS分析,通过化学工作站G1701BA的数据处理系统,利用Nist11标准质谱库检索鉴定成分,按面积归一化法进行定量分析,测得其相对百分含量。
2 结果与分析
2.1单因素实验
2.1.1 乙醇胺质量浓度对藻油DHA的影响 乙醇胺是膜脂的重要组成成分,在磷脂酰合成酶的作用下,合成膜脂中重要的二磷酸甘油酯之一的磷脂酰乙醇胺,有研究表明乙醇胺可以提高斜生栅藻的脂质积累量[17]。由表2可以看出,添加乙醇胺后可以有效地提高DHA(C22∶6)占藻油中总脂肪酸的量,而且会导致裂壶藻突变株自身饱和脂肪酸和不饱和脂肪酸含量发生变化,其中饱和脂肪酸棕榈酸(C16∶0)的含量由23.40%±0.97%降低至18.69%±0.84%;在添加150 mg/L的乙醇胺后,不饱和脂肪酸DHA在总脂肪酸中的含量从41.59%±0.53%升高到48.58%±0.39%,比对照组提高了16.81%。继续添加外源乙醇胺后,DHA的含量开始减少,在添加300 mg/L的乙醇胺时,DHA的含量降至45.61%±0.32%,这说明添加适量的乙醇胺有利于裂壶藻突变株DHA的合成。
在添加乙醇胺后,短链不饱和脂肪酸棕榈酸的含量有所降低,与对照组相比,DHA的含量明显增加,在150 mg/L的最适浓度下达到最高,可能是脂肪酸合成途径受乙醇胺的影响,迫使细胞合成更多的不饱和脂肪酸以维持细胞生长。
2.1.2 萘氧乙酸质量浓度对藻油脂肪酸构成的影响 萘氧乙酸是具有生长素生物活性的生长调节剂,可以促进细胞的生长和代谢[18]。添加外源萘氧乙酸对裂壶藻突变株发酵产DHA的影响如表3所示,添加外源萘氧乙酸后可以增加藻油脂质积累量,提高DHA(C22∶6)含量,而降低饱和脂肪酸含量。在添加10 mg/L的萘氧乙酸后,DHA占油脂含量由41.10%±0.11%提高到47.48%±0.46%,比对照组提高了15.52%。饱和脂肪酸棕榈酸含量降低至22.87%±0.19%,比对照组降低了11.59%。在添加10 mg/L萘氧乙酸时,DHA含量达到最高,而棕榈酸含量最低。说明添加适量的外源萘氧乙酸有利于菌株不饱和脂肪酸的合成(包括DHA),这种促进作用可能在多条途径上影响DHA生物合成,具体影响机理还需进一步研究。
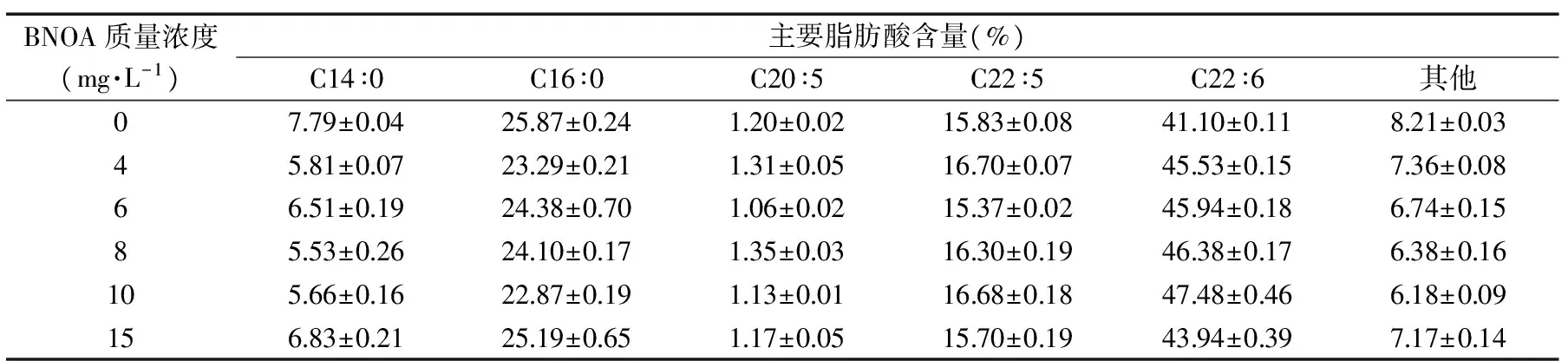
表3 萘氧乙酸质量浓度对裂壶藻突变株脂肪酸分布的影响
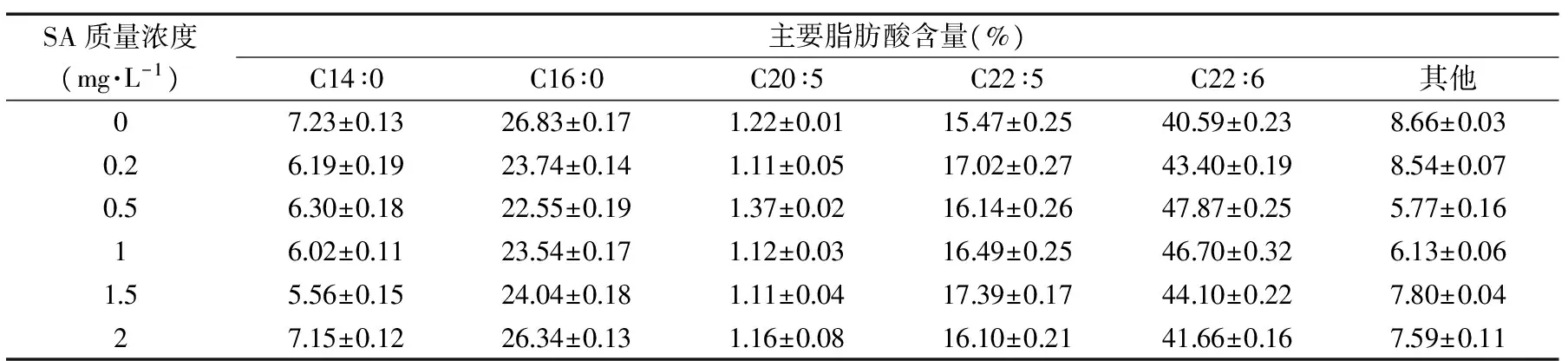
表4 水杨酸质量浓度对裂壶藻突变株脂肪酸分布的影响
2.1.3 水杨酸质量浓度对藻油DHA的影响 外源水杨酸是诱导植物形成系统获得抗性必不可少的信号分子,诱导相关抗氧化酶基因的表达,提高相关抗氧化酶的活性,对细胞的代谢过程起到调控作用[19]。由表4可知,当添加0.2 mg/L的外源水杨酸时,棕榈酸(C16∶0)由26.83%±0.17%下降至23.74%±0.14%并且呈下降趋势,但DPA(C22∶5)和DHA的含量由15.47%±0.25%和40.59%±0.23%分别升高到17.02%±0.27%和43.40%±0.19%,表明外源水杨酸对不饱和脂肪酸的积累有适当的刺激作用。
当添加水杨酸的质量浓度为0.5 mg/L时,DHA占细胞干质量分数为47.87%±0.25%,相比对照组提高了17.94%。而当外源水杨酸的质量浓度进一步升高时,DHA含量逐渐下降,这说明高浓度的外源水杨酸对菌株积累DHA合成不利。可能是由于高浓度的水杨酸抑制了细胞的生长代谢,甚至死亡。
2.2正交实验结果与分析
在单因素的基础上,设计L9(34)正交实验,结果见表5。
通过正交实验分析发现,对于油脂产量来说,A1,A2相差不大,对于DHA产量来说,A是最主要的影响因素,故选取A2作为该因素的优水平;对于油脂产量,取C2最好,但是C2,C3相差不大,而且C因素是较次要因素,而对于DHA产量来说,取C3最好,所以选取C3为该因素的优水平;综合以上分析,优方案为A2C3B2,即乙醇胺质量浓度为150 mg/L,水杨酸质量浓度为1 mg/L,萘氧乙酸质量浓度为10 mg/L。在此条件下油脂产量和DHA产量分别达到11.40 g/L和6.18 g/L,相比于对照组DHA产量提高了12.77%。
2.3脂肪酸分析
利用正交实验设计的最佳添加浓度对裂壶藻进行发酵验证实验,藻油主要脂肪酸组成见表6。
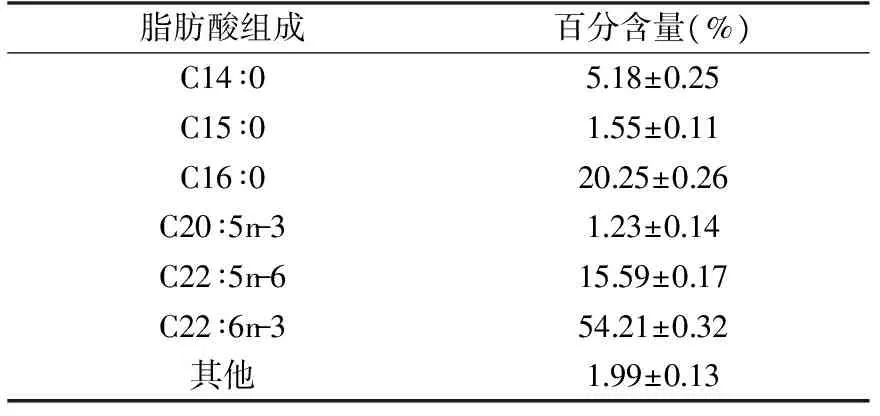
表6 主要脂肪酸组成结果
3 结论
本文运用单因素实验考察了3种外源化学添加剂对裂壶藻突变株发酵合成脂肪酸的影响,得出通过添加适量的化学调节剂可以促进裂壶藻突变株合成DHA。然后设计正交实验,得到化学添加剂的最佳质量浓度(mg/L)为:乙醇胺150,萘氧乙酸10,水杨酸1。在此条件下,油脂产量为11.40 g/L,DHA产量为6.18 g/L,优化后的DHA产量比对照组提高了12.77%。此外,本文为DHA的发酵调控提供了新的思路,可适当使用外源化学添加剂来提高DHA产量,但考虑到成本,后期可继续拓宽调控思路,开发更为廉价的调控方法。
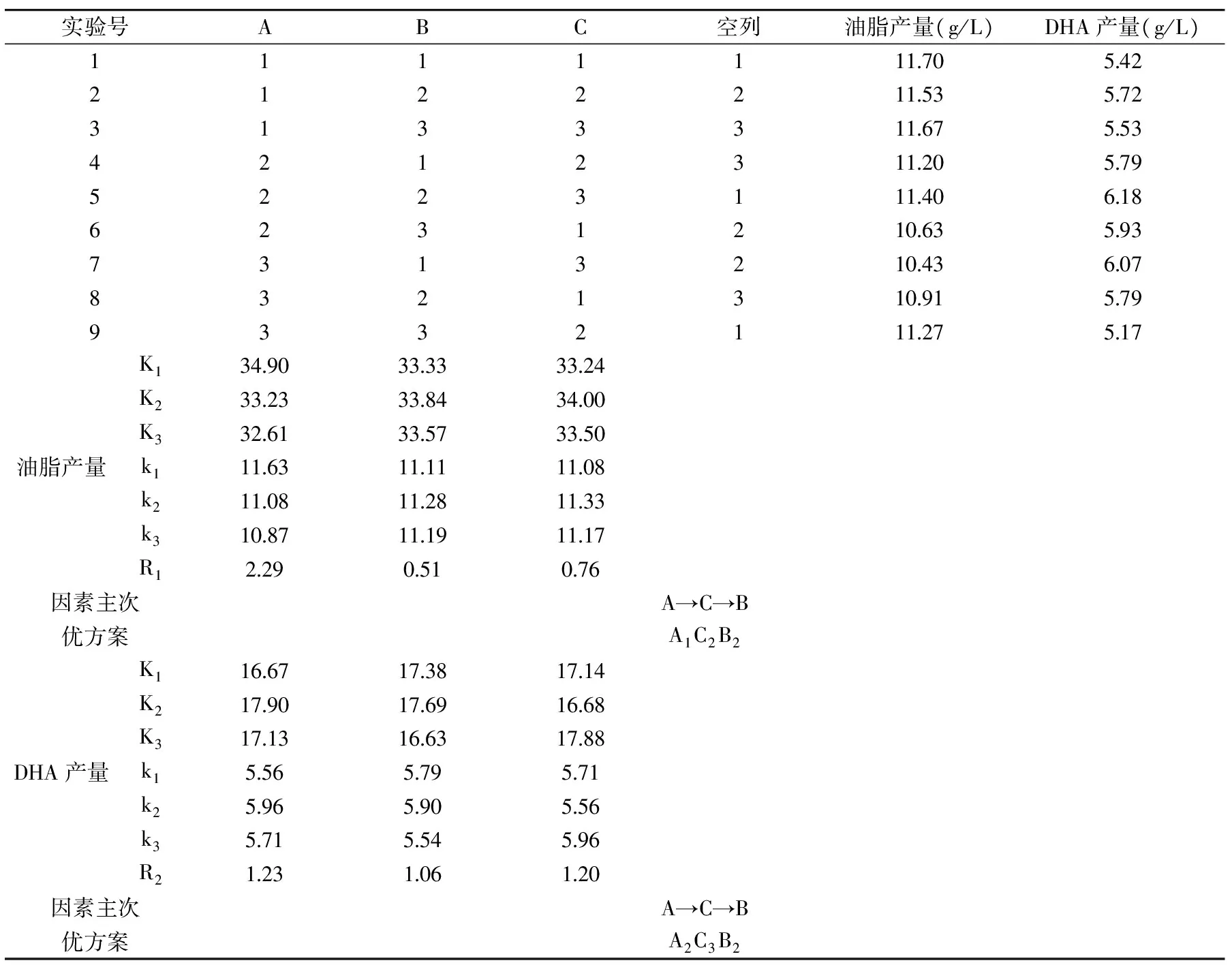
表5 正交实验结果与分析
[1]魏萍,马小琛,任路静,等. 裂殖壶菌发酵生产DHA研究进展[J]. 食品工业科技,2010(10):398-401,404.
[2]Ren Lu-Jing,Sun Guan-nan,Ji Xiao-jun,et al. Compositional shift in lipid fractions during lipid accumulation and turnover inSchizochytrium[J]. Bioresource Technology,2014:107-113.
[3]谢辰. 裂殖弧菌高产DHA的发酵技术研究[D]. 武汉:华中科技大学,2012.
[4]夏小乐,杨海麟,王武,等. 碳氢比对Schizochytriumsp.JN-3发酵产DHA的影响及其中试研究[J].安徽农业科学,2011,39(36):22201-22203.
[5]Lauritzen L,Hansen H S,Jorgensen M H,et al. The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina[J].Progress in Lipid Research,2001,40(1-2):1-94.
[6]Nordoy A,Marchioli R,Arnesen H,et al. n-3 Polyunsaturated fatty acids and cardiovascular diseases[J].Lipids,2001,36:127-129.
[7]朱路英,张学成,王淑芳,等. 一种海洋真菌——裂壶藻突变株的营养成分分析[J].食品科学,2009,30(24):272-275.
[8]Gro van der Meeren,Michael F,Tlusty,et al. Effects of dietary DHA and EPA on neurogenesis,growth,and survival of juvenile American lobster,Homarus americanus[J].New Zealand Journal of Marine and Freshwater Research,2009,43(1):225-232.
[9]中华人民共和国卫生部.关于批准DHA藻油、棉籽低糖等7种物品为新资源食品及相关规定的公告(2010年第3号)[Z].2010
[10]SIJTSMA L,SWAAF M E. Biotechnological production and applications of the ω-3 polyunsaturated fatty acid docosahexaenoic acid[J]. Applied Microbiology and Biotechnology,2004,64(2):146-153.
[11]Morley R. Nutrition and cognitive development[J]. Nutrition,1997,53(1):752-754.
[12]Kim YJ,Chung HY. Antioxidative and anti-inflammatory actions of docosahexaenoic acid and eicosapentaenoic acid in renal epithelial cells and macrophages[J]. J Med Food,2007,10(2):225-231.
[13]王申强,罗玮,姜易彤,等. 外源添加剂促进裂殖壶菌合成DHA[J]. 生物加工过程,2013(5):21-25.
[14]周立树,沈健增,蔡宇杰,等. 维生素对裂殖壶菌发酵产DHA的影响[J]. 食品与生物技术学报,2013(9):927-932.
[15]任路静,魏萍,冯云,等. 添加生物素和浅蓝菌素对裂殖壶菌发酵产DHA的影响[J]. 生物加工过程,2012,1:42-45.
[16]冯云,任路静,瞿亮,等. 种子培养基成分对裂殖壶菌发酵产DHA的影响[J]. 生物加工过程,2013,5:26-31.
[17]Cheng J S,Niu Y H,Lu S H,et al. Metabolome analysis reveals ethanolamine as potential marker for improving lipid accumulation of model photosynthetic organisms[J]. Chem Technol Biotechnol,87(10):1409-1418.
[18]夏赞成,苏娇莲,邓继勇,等. 植物生长调节剂萘氧乙酸的合成工艺研究[J]. 辽宁化工,2002,11:463-464,478.
[19]韩艳,韩晨光,崔荣华,等. 外源水杨酸对UV-B增强下花生叶片光合特性的影响[J]. 中国农业气象,2016(4):437-444.
EffectofchemicalmodulatorsonDHAproductionbyfermentationofSchizochytriumlimacinummutantstrain
LINYuan-feng1,XIEXin-lei1,FUJie2,TIANHua1,CHENTao3,HEDong-ping1,*
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China;2.CABIO Bioengineering(Wuhan)Co.,Ltd.,Wuhan 430073,China;3.Wuhan Institute of Virus,Chinese Academy of Sciences,Wuhan 430071,China)
In order to investigate the effects of chemical modulators on the synthesis of fatty acids(SFAs,PUFAs and DHA)inSchizochytriumlimacinummutant strain,the composition of fatty acids inSchizochytriumlimacinummutant strain was analyzed by chromatography-mass spectrometry(GC-MS). The optimum addition conditions of three chemical modulators,ethanolamine(ETA),naphthalene acetic acid(BNOA)and salicylic acid(SA)were optimized by single factor and orthogonal design. The results showed that the adding ethanol amine 150 mg/L(ETA),10 mg/L naphthoxyacetic acid(BNOA)and 1 mg/L salicylic acid(SA),the DHA production ofSchizochytriumlimacinummutant strain was the highest,reaching 6.18 g/L,which was 12.77% higher than control group. It was suggested that the adding appropriate amount of chemical modulators could improve DHA content ofSchizochytriumlimacinummutant strain.
Schizochytriumlimacinummutant strain;chemical modulators;GC-MS;DHA
2017-04-28
林源锋(1992-),男,硕士研究生,研究方向:微生物油脂,E-mail:yfLin33@qq.com。
*
何东平(1957-),男,博士,教授,研究方向:粮食、油脂及植物蛋白,E-mail:hedp123456@163.com。
国家粮食局粮食公益性行业科研专项(201313012-03)。
TS201.2
A
1002-0306(2017)22-0125-05
10.13386/j.issn1002-0306.2017.22.025
