杨梅素对α-葡萄糖苷酶的抑制活性机理研究
2017-12-06,,,,,
, , ,,,
(重庆三峡学院生命科学与工程学院,重庆 404100)
杨梅素对α-葡萄糖苷酶的抑制活性机理研究
韩林,刘益,罗梅,邓雪婷,杨人乙,宋友佳
(重庆三峡学院生命科学与工程学院,重庆 404100)
为了揭示杨梅素对α-葡萄糖苷酶活性抑制作用的机理,本文利用现代光谱分析方法,结合原子力显微镜和分子模拟对接技术对杨梅素与α-葡萄糖苷酶之间的相互作用进行了研究。结果表明,杨梅素对α-葡萄糖苷酶的活性具有很强的抑制作用,IC50值为0.99×10-5mol/L。酶抑制动力学研究发现杨梅素对α-葡萄糖苷酶的抑制作用属于典型的竞争型抑制,α-葡萄糖苷酶中存在一个或一类杨梅素的抑制位点,同时杨梅素可与α-葡萄糖苷酶中的荧光发色团发生相互作用,静态淬灭其内源性荧光。分子模拟对接实验表明,杨梅素可以与TYR158、GLN279、GLU277、ASP215和ASP352氨基酸之间形成氢键,改变α-葡萄糖苷酶周围的微环境,使其产生聚集的现象。从而起到抑制作用。
杨梅素,α-葡萄糖苷酶,抑制作用
近年来,2型糖尿病已发展成为世界上严重危害人类身体健康的慢性疾病之一,预计到2035年全球糖尿病人群将高达近6亿[1]。控制餐后血糖是预防糖尿病,防止其并发症的有效手段,而抑制肠道中碳水化合物消化酶,如α-淀粉酶和α-葡萄糖苷酶活性,是降低餐后血糖非常有效的方法。目前,市场上有3种药物可作为α-葡萄糖苷酶抑制剂控制餐后血糖,分别是阿卡波糖、伏格列波糖和米格列酮,但由于这些药物的生产工艺复杂并且副作用较大,限制了它们的广泛使用[1]。因此,从天然产物中发掘新的毒副作用较小的α-葡萄糖苷酶抑制剂显得迫在眉睫。
杨梅素,又名杨梅树皮素、杨梅黄酮,为3,5,7,3′,4′,5′-六羟基黄酮,广泛存在于杨梅科、葡萄科、豆科等天然植物中[3]。大量研究表明,杨梅素具有广泛的药理活性,如抗炎、抗氧化、抗癌、镇痛、保肝和抑菌等活性[3],同时杨梅素还可以降低餐后血糖水平,预防糖尿病[4]。
体内和体外实验均表明,杨梅素对α-葡萄糖苷酶活性具有显著的抑制作用,可有效控制糖尿病大鼠餐后血糖水平,并且其抑制活性较其它活性物质如槲皮素和山奈酚还强[5-6],然而杨梅素对α-葡萄糖苷酶活性的抑制作用机制尚未见报道。因此,本研究利用现代光谱分析方法,结合原子力显微镜和分子模拟对接技术,深入阐明杨梅素对α-葡萄糖苷酶活性抑制作用的机理,为开发天然α-葡萄糖苷抑制剂提供理论依据。
1 材料与方法
1.1材料与仪器
α-葡萄糖苷酶(来自酿酒酵母,26 U/mg)、p-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)和阿卡波糖 Sigma公司;杨梅素 纯度为98%,上海源叶生物科技有限公司;磷酸氢二钠、磷酸二氢钠、无水乙醇等其它试剂 均为国产分析纯。
VICTOR X3酶标仪、LS55荧光分光光度计 美国Perkin Elmer公司;AL104电子分析天平 梅特勒-托利多仪器(上海)有限公司;Multimode-8原子力显微镜 美国布鲁克公司;HH-4数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司。
1.2实验方法
1.2.1 杨梅素溶液的配制 用无水乙醇将杨梅素标准品配制成1 mg/mL的母液,然后再用0.1 mol/L pH6.8的PBS缓冲液稀释至所需浓度后进行使用。
1.2.2 杨梅素对α-葡萄糖苷酶活性的抑制作用 用0.1 mol/L pH6.8的PBS缓冲液配制不同浓度的α-葡萄糖苷酶(3.0×10-7mol·L-1)和pNPG溶液(3.0×10-4mol·L-1)。准确移取25 μLα-葡萄糖苷酶溶液,分别加入25 μL不同浓度的杨梅素稀释液(5、4、3、2、1、0.8、0.6、0.4、0.2、0 μg/mL),37 ℃恒温孵育15 min,再加入50 μL pNPG溶液(0.3 mmol/L),立即置于37 ℃酶标仪中在波长405 nm处每隔30s测定吸光度,以阿卡波糖作阳性对照,同时做空白实验[7]。按如下公式计算杨梅素对α-葡萄糖苷酶的抑制活性:
抑制率(%)=(ΔA空白-ΔA样品)/ΔA空白×100
1.2.3 杨梅素对α-葡萄糖苷酶活性抑制作用的可逆性 准确移取50 μL不同浓度的α-葡萄糖苷酶溶液(0、0.75、1.5、3.0、6.0×10-7mol/L),分别加入50 μL不同浓度的杨梅素溶液(0、0.39、0.79、1.57、3.14×10-6mol/L),混合均匀后于37 ℃恒温条件下孵育15 min,加入50 μL 0.3 mmol/L的pNPG溶液,立即置于37 ℃酶标仪中于405 nm处每隔1 min测定吸光度,共测5次[8]。
1.2.4 杨梅素对α-葡萄糖苷酶活性的抑制动力学 准确移取50 μLα-葡萄糖苷酶(3.0×10-7mol·L-1)于96孔板中,分别加入50 μL不同浓度的杨梅素稀释液(0、6.28、9.43、12.57×10-6mol/L),37 ℃恒温孵育15 min,再分别加入50 μL 不同浓度的pNPG溶液(1.0、2.0、4.0和8.0×10-3mol/L),立即置于37 ℃酶标仪中于405 nm处每隔60 s测定吸光度。通过Lineweaver-Burk方程计算杨梅素对α-葡萄糖苷酶的抑制动力学,再由如下方程求出二级曲线,如果该曲线表现出良好的线性关系,则表明杨梅素在α-葡萄糖苷酶上只存在一个或一类抑制位点[9]。
其中,Ki和Km分别是抑制常数和米氏常数,[I]为杨梅素浓度,Vmax为最大反应速率。
1.2.5 荧光光谱分析 准确移取2.0 mLα-葡萄糖苷酶(3.0×10-7mol/L)于1 cm荧光池中,对其荧光光谱进行扫描后,逐次加入杨梅素溶液,每次5 μL,调整其最终浓度分别为0、3.65、7.29、10.94、14.58、18.23、21.88、25.52、29.17、32.81、36.46、40.11和43.75×10-6mol/L,混合均匀后静置5 min,分别在298、304和310 K温度下,扫描混合样品在300~500 nm范围内的荧光光谱(激发波长为280 nm)。激发和发射狭缝均为5.0 nm[10]。并利用Stern-Volmer方程(如下所示)计算荧光淬灭常数(Ksv)[11]:

其中,F0和F分别为加入和未加入杨梅素时α-葡萄糖苷酶的荧光强度;Ksv为淬灭常数;Kq为淬灭速率常数,[Q]为杨梅素的浓度;τ0是荧光的平均时长,为10-8s。
同时,分别以激发和发射波长间距(Δλ)为15和60 nm,狭缝为5.0 nm对混合样品进行同步荧光光谱扫描。所有荧光吸光度均扣除紫外吸收矫正处理后进行分析[12]。
1.2.6 原子力显微镜观察 准确移取20 μLα-葡萄糖苷酶(6.0×10-7mol/L),加入20 μL 杨梅素稀释液(6.28×10-6mol/L),置于37 ℃恒温条件下孵育15 min,然后均匀平铺于干净的云母片上,室温干燥12 h后置于原子力显微镜中使用轻敲模式进行检测[13]。
1.2.7 分子模拟对接 使用Sybyl 2.0软件画出并优化杨梅素的3D结构,从PDB中获取一种高度同源性的α-葡萄糖苷酶晶体结构(PDB ID:3A4A;gi编号:411229)[14]。去掉α-葡萄糖苷酶晶体结构中的所有水分子和配体,添加Gasteiger-Huckel电荷和氢原子,以杨梅素3D结构作为配体,利用Sybyl 2.0软件中的Surflex-Dock操作进行分子模拟对接。
2 结果与分析
2.1杨梅素对α-葡萄糖苷酶活性的抑制作用

图1 杨梅素对α-葡萄糖苷酶活性的抑制率
由图1可知,杨梅素对α-葡萄糖苷酶的活性具有很强的抑制作用,随着其质量浓度的增加,抑制率也快速上升,在实验浓度范围内(0.31~1.57×10-5mol/L),杨梅素对α-葡萄糖苷酶活性的抑制率高达90.74%,远远高于阿卡波糖对α-葡萄糖苷酶的抑制作用,两者的IC50值分别为0.99×10-5和11.63×10-5mol/L,说明杨梅素较阿卡波糖显示了更好的α-葡萄糖苷酶抑制活性。
2.2杨梅素对α-葡萄糖苷酶活性抑制作用的可逆性
杨梅素对α-葡萄糖苷酶抑制作用的可逆性如图2所示,由图可知不同浓度的杨梅素对不同浓度α-葡萄糖苷酶的抑制速率都呈线性关系,随着杨梅素浓度的增加,线性关系的斜率逐步下降,同时所有线性方程都经过原点,表明杨梅素对α-葡萄糖苷酶的抑制作用是一个可逆过程[15]。

图2 杨梅素对α-葡萄糖苷酶抑制作用的可逆性
2.3杨梅素对α-葡萄糖苷酶活性的抑制动力学
杨梅素对α-葡萄糖苷酶活性的抑制动力学如图3所示。由图3(A)可知,在相同杨梅素浓度条件下,1/v和1/[pNPG]呈线性关系,随着杨梅素浓度的增加,这些线性方程的斜率也逐步增加,并且相交于第一象限,说明杨梅素对α-葡萄糖苷酶的抑制作用属于典型的竞争型抑制[16]。深入分析发现各线性方程的斜率对不同浓度的杨梅素呈线性关系,表明α-葡萄糖苷酶中只有一个或一类杨梅素的抑制位点[8]。

图3 杨梅素对α-葡萄糖苷酶活性的抑制动力学
2.4荧光光谱分析
2.4.1 杨梅素对α-葡萄糖苷酶的荧光淬灭作用α-葡萄糖苷酶中含有一些芳香族氨基酸,如色氨酸、酪氨酸和苯丙氨酸属于荧光发色团,在280 nm激发波长下,可以在340 nm处产生荧光发射波峰。当小分子物质与α-葡萄糖苷酶发生相互作用时,α-葡萄糖苷酶的内源性荧光可以被淬灭,这种淬灭作用有两种类型:静态淬灭和动态淬灭。通过研究α-葡萄糖苷酶的内源性荧光光谱,可以进一步分析其与小分子物质之间的相互作用[17-18]。不同温度条件下,不同浓度杨梅素对α-葡萄糖苷酶内源性荧光的淬灭作用所图4所示。由图可知,杨梅素本身几乎没有荧光效应(图4中的曲线0),但随着杨梅素浓度的增加(图4中1→13),α-葡萄糖苷酶的荧光强度逐渐降低,说明杨梅素对α-葡萄糖苷酶的内源性荧光产生了淬灭作用。同时,加入杨梅素后,最大荧光发射波长还发生了红移。进一步分析表明,随着温度的升高,淬灭常数Ksv逐步下降,表现为Stern-Volmer线性关系的斜率减小(如图4(D)所示),说明杨梅素对α-葡萄糖苷酶内源性荧光的淬灭类型为静态淬灭[19]。
2.4.2 同步荧光光谱 同步荧光光谱是在固定激发与发射波长间距(Δλ)的同时扫描激发和发射单色器所得到的光谱。当Δλ分别设为15 nm和60 nm时,所得到的同步荧光光谱可以反映α-葡萄糖苷酶中酪氨酸和色氨酸周围微环境的变化,从而判断活性物质对α-葡萄糖苷酶结构的影响[20]。从图5可以看出,随着α-葡萄糖苷酶溶液中杨梅素浓度的增加,其荧光强度逐步减少,与上述结果相似。当Δλ=15 nm时,最大荧光强度发生了微弱的蓝移,而Δλ=60 nm时则没有影响,说明杨梅素对α-葡萄糖苷酶中的酪氨酸残基产生一定影响,而与色氨酸残基几乎没有发生相互作用。
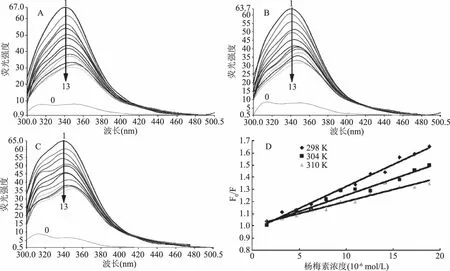
图4 杨梅素与α-葡萄糖苷酶相互作用的荧光光谱图

图5 杨梅素与α-葡萄糖苷酶相互作用的同步荧光光谱图
2.5原子力显微镜观察
原子力显微镜是一种研究物质表面微观结构的分析仪器,在许多方面都有应用,特别是在研究生物大分子的结构方面。杨梅素与α-葡萄糖苷酶之间相互作用的原子力显微镜图如图6所示。由图6(A)可知,在没有杨梅素存在的条件下,α-葡萄糖苷酶可均匀的分布于云母基质上,表现为图中白点比较分散,没有聚集。当与6.28×10-6mol/L的杨梅素作用后,可明显观察到α-葡萄糖苷酶之间发生了聚集的现象,如图6(B)所示。许多因素可以导致蛋白之间发生聚集作用,如pH、金属离子等,同时蛋白之间疏水作用力的减弱也会导致其聚集。当α-葡萄糖苷酶溶液中加入一定浓度的杨梅素后,由于杨梅素与酶之间的相互作用改变了蛋白酶周围的微环境,导致酶与酶之间的相互作用平衡被打破,从而发生聚集现象[21]。

图6 杨梅素与α-葡萄糖苷酶相互作用的原子力显微镜图
2.6分子模拟对接
杨梅素与α-葡萄糖苷酶相互作用的分子模拟对接结果如图7所示。由图可知,杨梅素可以结合到α-葡萄糖苷酶的活性中心(绿色区域),从而“占据”了α-葡萄糖苷酶与其底物结合进行催化作用的位置,影响酶的活性。深入分析表明,杨梅素Ⅰ环7-OH,Ⅱ环3-OH和4=O,Ⅲ环3′,4′和5′-OH分别可以与α-葡萄糖苷酶中的TYR158、GLN279、GLU277、ASP215和ASP352氨基酸之间形成氢键,键长分别为2.02、2.07、2.18、2.60、1.97,1.83和2.01 Å,平均键长为2.10 Å,说明氢键是杨梅素与α-葡萄糖苷酶之间相互影响的主要作用力,同时这些形成氢键结合的位点也是α-葡萄糖苷酶发挥催化活性的关键氨基酸[22]。黄酮类化合物中,B环上羟基的数量直接影响该化合物对α-葡萄糖苷酶的抑制作用[23]。杨梅素B环上存在三个羟基,与α-葡萄糖苷酶中的氨基酸残基形成了三个氢键,同时其C环和A环上的羟基也与氨基酸残基形成了三个氢键,说明羟基在杨梅素与α-葡萄糖苷酶之间的相互作用中扮演着重要的角色。
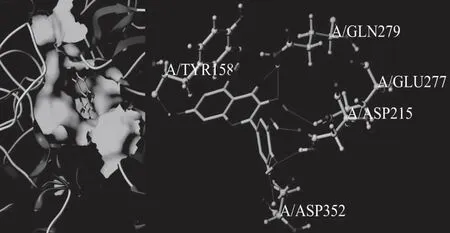
图7 杨梅素与α-葡萄糖苷酶相互作用的分子模拟对接图
3 结论
本文利用现代光谱分析方法,研究发现杨梅素对α-葡萄糖苷酶的活性具有很强的抑制作用,在一定实验浓度范围内抑制率可达90.74%,远远高于阳性对照药物阿卡波糖,其IC50值为0.99×10-5mol/L,并且这种抑制作用属于可逆性抑制。抑制动力学表明杨梅素对α-葡萄糖苷酶的抑制属于典型的竞争型抑制,同时α-葡萄糖苷酶中只有一个或一类杨梅素的抑制位点。荧光光谱实验结果表明,杨梅素可作用于α-葡萄糖苷酶中的荧光发色团,如色氨酸、酪氨酸和苯丙氨酸等,静态淬灭α-葡萄糖苷酶的内源性荧光,改变这些基团周围的微环境,从而影响α-葡萄糖苷酶的活性。通过原子力显微镜的检测,我们更直接的观察到了α-葡萄糖苷酶在未加和加入杨梅素后形态的显著变化,进一步证实了上述实验结果,并利用分子模拟对接技术更深入阐明了杨梅素主要与α-葡萄糖苷酶中的TYR158、GLN279、GLU277、ASP215和ASP352氨基酸之间通过氢键相互作用直接抑制其活性。
[1]Bellesia A,Tagliazucchi D. Cocoa brew inhibitsinvitro,α-glucosidase activity:The role of polyphenols and high molecular weight compounds[J]. Food Research International,2014,63:439-445.
[2]张秀娟,黄清玲,季宇彬. 杨梅素的药理活性研究进展[J].天津药学,2008,20(5):57-60.
[3]林国钡,谢燕,李国文. 杨梅素的研究进展[J]. 国际药学研究杂志,2012,39(6):483-487.
[4]Kumar S D,Badoni S R,Sandra C,et al. Myricetin:A dietary molecule with diverse biological activities[J]. Nutrients,2016,8(2):1-31.
[5]Tadera K,Minami Y,Takamatsu K,et al. Inhibition of alpha-glucosidase and alpha-amylase by flavonoids.[J]. Journal of Nutritional Science and Vitaminology,2006,52(2):149-53.
[6]Kang S J,Park J H Y,Choi H N,et al.α-glucosidase inhibitory activities of myricetin in animal models of diabetes mellitus[J]. Food Science and Biotechnology,2015,24(5):1897-1900.
[7]Xiao H,Liu B,Mo H,et al. Comparative evaluation of tannic acid inhibitingα-glucosidase and trypsin[J]. Food Research International,2015,76:605-610.
[8]Zeng L,Zhang G,Lin S,et al. Inhibitory mechanism of apigenin onα-glucosidase and synergy analysis of flavonoids[J]. Journal of Agricultural and Food Chemistry,2016,64(37):6939-6949.
[9]Xi P,Zhang G,Liao Y,et al. Inhibitory kinetics and mechanism of kaempferol onα-glucosidase[J]. Food Chemistry,2016,190:207-215.
[10]Peng X,Zhang G,Zeng L. Inhibition ofα-glucosidase by vitamin D3 and the effect of vitamins B1 and B2.[J]. Food & Function,2016,7(2):982-991.
[11]Mariam J,Dongre P M,Kothari D C. Study of interaction of silver nanoparticles with bovine serum albumin using fluorescence spectroscopy.[J]. Journal of Fluorescence,2011,21(6):2193-2199.
[12]Wang Y,Zhang G,Pan J,et al. Novel insights into the inhibitory mechanism of kaempferol on xanthine oxidase[J]. Journal of Agricultural and Food Chemistry,2015,63(2):526-534.
[13]Han L,Fang C,Zhu R,et al. Inhibitory effect of phloretin onα-glucosidase:Kinetics,interaction mechanism and molecular docking[J]. International Journal of Biological Macromolecules,2017,95:520-527.
[14]Lee Y,Kim S,Kim J Y,et al. Binding mode analyses and pharmacophore model development for stilbene derivatives as a novel and competitive class ofα-glucosidase inhibitors.[J]. Plos One,2014,9:e85827.
[15]闫家凯. 木犀草素对黄嘌呤氧化酶、α-葡萄糖苷酶抑制机理的探讨[D]. 南昌:南昌大学,2014.
[16]Phan M A T,Wang J,Tang J,et al. Evaluation ofα-glucosidase inhibition potential of some flavonoids from Epimedium brevicornum[J]. LWT-Food Science and Technology,2013,53(2):492-498.
[17]Xiao H,Liu B,Mo H,et al. Comparative evaluation of tannic acid inhibitingα-glucosidase and trypsin[J]. Food Research International,2015,76:605-610.
[18]Zhang G,Wang L,Pan J. Probing the binding of the flavonoid diosmetin to human serum albumin by multispectroscopic techniques.[J]. Journal of Agricultural & Food Chemistry,2012,60(10):2721-2729.
[19]Wang Y,Liu A,Ran Y,et al. Transglutaminase-induced crosslinking of gelatin-calcium carbonate composite films[J]. Food Chemistry,2015,166:414-422.
[20]Alam P,Chaturvedi S K,Anwar T,et al. Biophysical and molecular docking insight into the interaction of cytosineβ-D arabinofuranoside with human serum albumin[J]. Journal of Luminescence,2015,164(12):123-130.
[21]Gao W,Li N,Chen Y,et al. Study of interaction between syringin and human serum albumin by multi-spectroscopicmethod and atomic force microscopy[J]. Journal of Molecular Structure,2010,983(1-3):133-140.
[22]Park H,Hwang K Y,Oh K H,et al. Discovery of novelα-glucosidase inhibitors based on the virtual screening with the homology-modeled protein structure[J]. Bioorganic & Medicinal Chemistry,2008,16(1):284-292.
[23]Jianbo Xiao,Guoyin Kai,Koichiro Yamamoto,et al. Advance in dietary polyphenols asα-glucosidases inhibitors:A review on structure-activity relationship aspect[J]. Critical Reviews in Food Science and Nutrition,2013,53(8):818-36.
Theinhibitionactivityandmechanismsofmyricetinonα-glucosidase
HANLin,LIUYi,LUOMei,DENGXue-ting,YANGRen-yi,SONGYou-jia
(College of Life Science and Engineering,Chongqing Three Gorges University,Chongqing 404100,China)
In order to further research the inhibiting mechanisms of myricetin on the activity ofα-glucosidase,different modern spectral analysis methods were used in this paper,combined with atomic force microscope(AFM)and molecular docking,to investigate the interactions between myricetin andα-glucosidase. The results indicated that myricetin showed strong inhibition function on the activity ofα-glucosidase and the value of IC50was 0.99×10-5mol/L. The kinetic study revealed that the inhibiting effect between myricetin andα-glucosidase belong to competitive inhibition,and there was a single inhibition site onα-glucosidase,moreover the fluorescence ofα-glucosidase was quenched by myricetin through a static quenching mechanism. The molecular docking showed that myricetin could form hydrogen bonds with the amino acids of TYR158,GLN279,GLU277,ASP215 and ASP352 to change the micro-environments ofα-glucosidase,which leaded a clustering phenomenon and then had the inhibition activity.
myricetin;α-glucosidase;inhibition activity
2017-03-16
韩林(1985-),男,硕士,讲师,研究方向:果蔬深加工与综合利用,E-mail:hanlin730@163.com。
重庆市教委科学技术研究项目(KJ1601010);重庆三峡学院青年项目(15QN10)。
TS255.1
A
1002-0306(2017)22-0051-06
10.13386/j.issn1002-0306.2017.22.011
