慢性应激对大鼠肾脏水通道蛋白1的影响及机制研究*
2017-12-06朱叶卫郅星陈晓帆张国兴
朱叶,卫郅星,陈晓帆,张国兴
(苏州大学医学部 基础医学与生物科学学院生理学系,江苏 苏州 215123)
基础研究·论著
慢性应激对大鼠肾脏水通道蛋白1的影响及机制研究*
朱叶,卫郅星,陈晓帆,张国兴
(苏州大学医学部 基础医学与生物科学学院生理学系,江苏 苏州 215123)
目的研究慢性应激(足底电击)对大鼠肾脏水通道蛋白1(AQP1)的影响及其机制。方法以足底电击SD雄性大鼠为慢性应激模型,分为对照组、电击组、肾交感神经切除组、肾交感神经切除+电击组、注射血管紧张素转换酶抑制剂(卡托普利)+电击组、注射抗氧化剂(Tempol)+电击组,每组6只大鼠。应用尾套法测量大鼠的血压,实时荧光定量聚合酶链反应(qRT-PCR)测定各组大鼠肾脏AQP1 mRNA的表达变化,免疫组织化学法(IHC)观察AQP1在各组大鼠肾脏中的表达及分布。结果电击组大鼠肾脏AQP1及血压与对照组比较,均差异有统计学意义(P<0.05),电击组大鼠肾脏AQP1表达明显,血压升高;肾交感神经切除组大鼠肾脏AQP1与对照组比较,差异有统计学意义(P<0.05),AQP1表达减少,血压未见升高。肾交感神经切除+电击组、注射卡托普利+电击组、注射Tempol+电击组大鼠肾脏AQP1表达及血压与电击组比较,差异有统计学意义(P<0.05),肾脏AQP1表达均减少,血压均降低。结论交感神经可调节AQP1的表达,足底电击通过兴奋肾交感神经上调AQP1,另外,AQP1还受氧化应激及肾素-血管紧张素系统调控。AQP1在慢性应激诱导的高血压中可能起着一定的作用。
水通道蛋白1;应激性高血压;氧化应激;肾交感神经
高血压是严重危害人类心脑血管健康的首要危险因素,目前全球已有超过10亿人需要终身服药,防治形式不容乐观,而各种社会慢性应激因素已被公认为是人类高血压发病的重要原因[1-3]。近年来的研究表明,肾脏中水通道蛋白家族(Aquaporins,AQPs)的表达异常在高血压的形成中扮演了重要的角色,其中水通道蛋白1(Aquaporin-1,AQP1)的表达情况与高血压的形成更是息息相关[4-6]。AQP1主要表达在肾脏近端小管的顶质膜和基底侧膜,以及髓襻降支细段和直小血管降支,在肾小球毛细血管内皮细胞内也有AQP1阳性表达,从而维持水的正常转运以及机体血容量稳定[7-8]。虽然AQP1表达情况与高血压的形成密切相关,但在发生高血压以及采取相关降压措施后,肾脏中AQP1表达情况的具体改变以及机制却尚未有相关的报道。因此本实验希望通过复制慢性足底电击诱导高血压大鼠模型来探究肾脏中AQP1表达的变化、机制及其与高血压的关系。
1 材料与方法
1.1 动物
成年雄性SD大鼠36只,体重200~250 g,由苏州大学医学部实验动物中心提供。分为对照组、电击组、肾交感神经切除组、肾交感神经切除+电击组(肾交感神经切除电击组)、注射血管紧张素转换酶抑制剂(卡托普利)+电击组(注射卡托普利电击组)、注射抗氧化剂-4-羟基-2,2,6,6-四甲基哌啶-1-氧自由基(superoxide dismutase mimetic,Tempol)+电击组(注射Tempol电击组),每组6只大鼠。本实验方案经苏州大学实验动物护理和使用委员会批准后进行。
1.2 仪器和试剂
XH101型大鼠血压心率仪(北京新航兴业科贸有限公司),Tempol(美国Sigma-Aldrich公司),DEPC水(广州碧云天生物技术研究所),RNAiso Plus(日本TaKaRa公司),逆转录试剂盒(Roche中国公司)。大鼠GAPDH引物(大连宝生物工程公司):正向5'-GGAGATTACTGCCCTGGCTCCTA-3',反向5'-GAC TCATCGTACTCCTGCTTGCTG-3',大鼠 AQP1 引物(日本TaKaRa公司,gene bank收录号NM_012778.1片段长度 20 bp):正向 5'-GACCTGATGCTGTGGCTTCT-3',反向5'-GAATGTGGCTCTCGGTTCAC-3',兔抗大鼠AQP1抗体(Abcam中国公司),免疫组织化学试剂盒(福州迈新公司),美国ABI 7500型实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)系统。
1.3 实验方法
1.3.1 模型复制 足底电击应激高血压大鼠模型:电击组大鼠刺激周期为14 d。每天上、下午分别给予一次足底电刺激,每次2 h,电流强度为2~4 mA,电压输出为75 V,脉冲间隔5~30 s,波宽50~100 ms。凡收缩压比应激前高出20 mmHg(大于正常血压3个标准差),且高于115 mmHg者确定为应激高血压模型。对照组大鼠每天于相同时间置于相同的鼠箱,但不给予应激刺激。肾交感神经切除模型:将雄性SD大鼠麻醉(腹腔注射1 ml/100 g的水合氯醛溶液)后经腰部纵行,切口沿腹膜后路径暴露左侧肾脏、肾动脉和肾神经,于接近腹主动脉处的肾动脉和肾静脉附近仔细游离出肾交感神经,用手术剪切断后缝合,右侧同左侧,之后静养1周,获得大鼠肾交感神经切除模型。
1.3.2 给药方法 血管紧张素转换酶抑制剂卡托普利:在注射卡托普利电击组大鼠中,每天按大鼠体重100 mg/kg腹腔注射该药物,浓度为10%,注射时间为电击实验前1 h,1次/d,共14 d。抗氧化剂Tempol:Tempol是一种超氧化物歧化酶模拟剂,结构式为4-羟基-2,2,6,6-四甲基哌啶-1-氧自由基,在注射Tempol电击组大鼠中,每天按大鼠体重100 mg/kg腹腔注射该药物,浓度为10%,注射时间为当日首次电击实验前1 h,1次/d,共14 d。
1.3.3 大鼠收缩压测定 实验开始后每3天为1个周期,尾套法测定收缩压。测量血压前大鼠预置于38~40℃温室10~20 min,使尾部动脉扩张后将尾部套于压敏传感器上,在动物适应环境、行为稳定后,开主机电源。连续测3次,取其均值,每次测量均在下午应激后0.5 h进行。
1.3.4 标本采集 各组大鼠经处理14 d后,解剖大鼠,收集双侧肾脏,放入-80℃冰箱保存。
1.3.5 qRT-PCR检测 用Trizol试剂提取肾组织总RNA;总RNA进行浓度检测;按照qRT-PCR Kit说明书逆转录,反应条件如下:29℃,10 min 48℃,60 min 85℃,5 min 4℃至结束;扩增目的cDNA片断,反应条件如下:95℃,2 min预变性;95℃,15 s,60℃,1 min,40循环;95℃,15 s,60℃,1 min,95℃,30 s,60℃,15 s延伸。
1.3.6 肾组织AQP1免疫组织化学染色 将4%甲醛固定48 h的肾脏组织进行脱水、透明、浸蜡后包埋成蜡块,制作成组织切片进行AQP1的免疫组织化学染色,于显微镜下观察蛋白表达情况。参照Fromowitz方法并稍加改进进行半定量分析:随机观察10个高倍视野(×400),计数各视野中阳性细胞数的平均百分数作为该切片的阳性细胞百分比进行计分。计分标准:0%~5%,0分;6%~25%,1分;26%~50%,2分;51%~75%,3分;>75%为4分。染色强度以多数阳性细胞呈现的染色特征为标准计分:细胞未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。最后以阳性细胞的百分比和染色强度计分之和所得的总分进行结果判定:0~1分为阴性,2~7分为阳性,按阳性率(%)=阳性细胞数/(阳性细胞数+阴性细胞数)×100%公式计算AQP1的表达情况[9]。
1.4 统计学方法
采用SPSS19.0软件进行统计学分析,本实验所有的数据都采用均数±标准差(±s)表示。多组之间比较采用单因素方差分析,方差分析有意义的基础上两组间再行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 电击期间各组大鼠收缩压比较
根据实验室前期研究结果,从第7天开始至第14天,电击组大鼠血压与对照组比较,差异有统计学意义(P<0.05),电击组高于对照组,提示慢性足底电击所造成的应激导致了大鼠高血压的形成;而从第7天开始至第14天,肾交感神经切除电击组、注射卡托普利电击组、注射Tempol电击组血压与电击组比较,差异有统计学意义(P<0.05),这3组低于电击组,提示切除肾交感神经、注射卡托普利或Tempol可以有效抑制血压的升高。见图1。
2.2 各组大鼠肾脏AQP1 mRNA表达比较
通过对各组大鼠肾脏中AQP1的qRT-PCR检测,发现电击组及肾交感神经切除组大鼠AQP1表达量与对照组比较,差异有统计学意义(P<0.05),电击组大鼠AQP1表达量增加,肾交感神经切除组大鼠AQP1表达量减少。这一结果说明电击和肾交感神经可以通过改变AQP1的表达情况来影响大鼠血压的变化。而肾交感神经切除电击组、注射卡托普利电击组、注射Tempol电击组大鼠肾脏中AQP1表达量与电击组比较,差异有统计学意义(P<0.05),3组均减少,提示肾交感神经切除、注射卡托普利、注射Tempol的降压机制可能是通过减少大鼠肾脏中AQP1的表达来实现的。在这个过程中,肾交感神经、氧化应激以及肾素-血管紧张素系统的调控可能起到了重要的作用。见图2。
2.3 各组大鼠肾脏AQP1阳性表达以及阳性细胞率比较

图1 电击期间各组大鼠收缩压比较
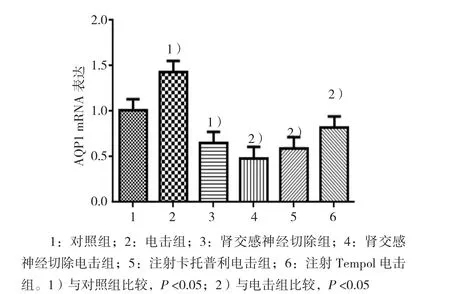
图2 各组大鼠肾脏AQP1 mRNA表达
由实验结果可知,AQP1阳性信号主要定位于近曲小管胞膜上,呈淡黄色或棕黄色,且不同处理组大鼠肾脏AQP1表达程度不同(见图3)。通过对各组大鼠肾脏中阳性细胞计数,可知各组大鼠肾脏AQP1的表达总分均>1,按评分标准可判断其表达均为阳性,同时发现:电击组和肾交感神经切除组大鼠肾脏AQP1表达程度与对照组比较,差异有统计学意义(P <0.05),电击组大鼠肾脏AQP1表达程度增高,肾交感神经切除组则降低;肾交感神经切除电击组、注射卡托普利电击组、注射Tempol电击组大鼠肾脏AQP1表达程度与电击组比较,差异有统计学意义(P <0.05),3组均降低(见图4)。这与qRT-PCR对各组大鼠肾脏AQP1 mRNA检测结果的整体趋势吻合,进一步说明了在发生高血压以及采取相关降压措施后大鼠肾脏AQP1的表达情况的确发生了变化,而且其表达情况与高血压的形成密切相关。

图3 各组大鼠肾脏AQP1阳性表达比较 (免疫组织化学×400)
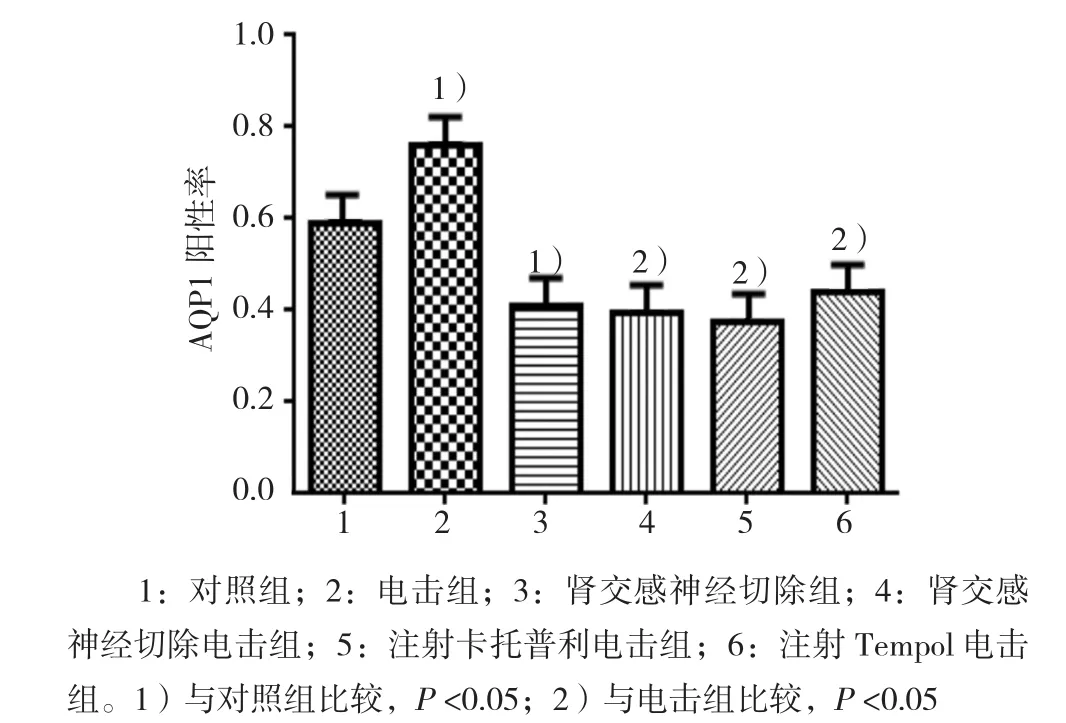
图4 各组大鼠肾脏AQP1阳性率比较
3 讨论
高血压的发生与血容量密切相关,肾小管中约65%~70%的水在近端小管被重吸收,而髓襻降支细段对水的通透性也较高,因而主要定位于肾脏近端小管、髓襻降支细段的AQP1可以介导水重吸收、增加血容量,在高血压的形成过程中扮演了重要的角色。通过对实验结果的分析,可知肾脏AQP1的表达情况与大鼠血压变化的关系密切。
与对照组相比,肾交感神经切除组和电击组大鼠AQP1的表达变化不同,在肾交感神经切除组大鼠肾脏AQP1表达减少,血压降低,差异有统计学意义。根据国外相关实验证明[10],肾交感神经切除后肾脏的AQP1表达程度会降低,交感神经在肾脏AQP1的表达中起到了特殊的调节作用。因此在肾交感神经切除组大鼠中,由于缺少了肾交感神经的作用,大鼠肾脏近端小管、髓襻降支细段AQP1表达减少,对水的重吸收也相应地减少,因而血容量减少,血压也相应地降低。单纯电击组大鼠肾脏AQP1的表达增加,同时,大鼠血压也升高,其差异有统计学意义。其可能的机制是:由于应激(电击)条件的刺激,交感神经兴奋,根据之前已述肾脏交感神经和AQP1表达的关系,交感神经的兴奋引起AQP1在近端小管以及髓襻降支细段表达增加,水的重吸收增加,导致大鼠血容量增加,血压升高。
与电击组相比,肾交感神经切除电击组、注射卡托普利电击组、注射Tempol电击组大鼠均出现了AQP1表达减少,同时大鼠血压下降,其差异有统计学意义。在这3组中,AQP1的变化同样与肾交感神经以及氧化应激关系密切。肾交感神经切除电击组大鼠AQP1表达减少的机制可能是由于大鼠经肾交感神经切除处理,阻断了交感神经的特殊作用,电击则无法兴奋肾交感神经,肾交感神经增加AQP1表达的作用也就无法实现,故本组大鼠肾脏AQP1表达相对电击组减少,致使肾脏对水的重吸收功能降低,血容量下降,从而使血压降低,这也进一步说明了交感神经在高血压形成过程中的重要作用。注射卡托普利电击组大鼠,因应激激活RAS系统,导致 血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)释放增多,国外已有文章报道[11-12],AngⅡ是机体的内在氧化剂,AngⅡ可促使氧化应激的发生,而氧化应激又可以增强交感神经系统活性。而血管紧张素转换酶抑制剂卡托普利能够降低中枢交感神经递质的释放,阻止AngⅡ的产生[13],同时能够抑制ACE1,阻止AngⅠ转换成AngⅡ,从而减少AngⅡ引起的氧化应激对肾交感神经的刺激。因此在本组大鼠中,由于血管紧张素转化酶抑制剂卡托普利的使用,机体内在氧化剂AngⅡ的生成减少,结合之前所述肾交感神经与AQP1表达情况的关系,此时AQP1表达减少,肾小管对水的重吸收减少,血容减少,血压下降。在注射Tempol电击组大鼠中,相关研究表明足底电击可以使大鼠平均动脉压升高,中枢和外周RAS活化,脂质过氧化物增加,应激激素水平上升,形成应激性高血压[14]。使用抗氧化剂Tempol之后,其作为一种稳定的氮氧化物抗氧化剂,可降低体内活性氧自由基,从而降低交感神经的兴奋程度。因此,在注射Tempol电击组由于Tempol清除了氧自由基,交感神经的兴奋性下降,因此结合交感神经和AQP1表达的关系可知,此时AQP1的表达也相应地减少,水的重吸收减少,血容量减少,血压下降。
综上所述,本实验证明了应激在提高AQP1表达量从而导致血压升高这一过程的重要作用,较详尽地探究了其机制,目前尚未有相关文献报道。应激通过上调AQP1表达介导血压升高的过程又受到了氧化应激以及RAS系统的调节,这也是本实验的新发现。应激刺激肾交感神经可以直接引起AQP1表达的增加,氧化应激则通过增多的超氧化物刺激肾交感神经引起AQP1表达的增加;同时RAS激活导致AngⅡ释放增加同样可引起AQP1表达增加,近端小管和髓襻降支细段主要由AQP1调控的水的重吸收增加,从而引起血压的升高。通过对AQP1的相关研究能为阐明应激性高血压的发病机制提供新的思路,也为防治应激性高血压提供了可能,因此,AQP1有希望成为应激性高血压治疗的一个全新的靶点。
[1]LIFTON R P, GHARAVI A G, GELLER D S. Molecular mechanisms of human hypertension[J]. Cell, 2001, 104(3): 545-556.
[2]SERRA A V. Stress and cardiovascular disease[J]. Rev Port Cardiol,2002, 21(10): 1173-1187.
[3]JOHNSON R J, HERRERA-ACOSTA J, SCHREINER G F, et al. Subtle acquired renal injury as a mechanism of salt-sensitive hypertension[J]. N Engl J Med, 2002, 346(2): 913-923.
[4]LEE J, KIM S, KIM J, et al. Increased expression of renal aquaporin water channels in spontaneously hypertensive rats[J].Kidney Blood Press Res, 2006, 29(1): 18-23.
[5]PROCINO G, ROMANO F, TORIELLI L, et al. Altered expression of renal aquaporins and alpha-adducin polymorphisms may contribute to the establishment of salt-sensitive hypertension[J].Am J Hypertens, 2011, 24(7): 822-828.
[6]PATIL R V, XU S X, VAN HOEK A N, et al. Rapid identification of novel inhibitors of the human aquaporin-1 water channel[J]. Chem Biol Drug Des, 2016, 87(5): 794-805.
[7]SOGAMI M, ERA S, MURAKAMI M, et al. Application of the transition state theory to water transport across cell membranes[J].Biochim Biophys Acta, 2001, 1511(1): 42-48.
[8]张日欣, 于寺明, 陈淑良, 等. 大鼠肾脏热缺血再灌注损伤过程中水通道蛋白的表达变化[J]. 中国组织工程研究与临床康复,2009, 13(53): 10499-10503.
[9]刘昕, 胡崇宇, 高小平, 等. 癫痫持续状态NKCC1、GABAARα 1蛋白在大鼠海马的表达及脑源性神经营养因子对其的影响[J]. 中国现代医学杂志, 2015, 25(18): 1-7.
[10]LEE J, YOO K, KIM S W, et al. Decreased expression of aquaporin water channels in denervated rat kidney[J]. Nephron Physiol, 2006, 103(4): 170-178.
[11]CAMPESE V M, YE S H, ZHONG H Q. Oxidative stress mediates angiotensin II-dependent stimulation of sympathetic nerve activity[J]. Hypertension, 2005, 46(3): 533-539.
[12]SHOKOJI T, NISHIYAMA A, FUJISAWA Y, et al. Renal sympathetic nerve responses to tempol in spontaneously hypertensive rats[J]. Hypertension, 2003, 41(2): 266-273.
[13]王蔚, 樊均明. 交感神经兴奋性亢进对慢性肾功能不全的影响[J]. 国外医学(泌尿系统分册), 2002, 22(1): 9-12.
[14]董涛. 慢性应激引发的高血压及深静脉血栓机制的研究[D].苏州: 苏州大学, 2015.
(张蕾 编辑)
Effect of chronic stress on renal aquaporin-1 expression in rats and its mechanism*
Ye Zhu, Zhi-xing Wei, Xiao-fan Chen, Guo-xing Zhang(Department of Physiology, School of Basic Medicine and Biological Sciences, Medical College of Soochow University, Suzhou, Jiangsu 215123, China)
ObjectiveTo investigate the effect of chronic stress (induced by foot shock) on renal aquaporin-1(AQP1) expression in rats and its mechanism.MethodsThe chronic stress model was established in male Sprague-Dawley (SD) rats by foot shock. The rats were divided into control group, foot shock group, renal sympathetic nerve denervation group, renal sympathetic nerve denervation plus foot shock group, Captopril plus foot shock group and Tempol plus foot shock group (6 in each group). Tail-cuff method was applied to measure blood pressure of the rats. RT-PCR was applied to detect the AQP1 mRNA level in the kidney tissues. Immunohistochemistry was used to observe the expression and distribution of AQP1 in rat kidneys.ResultsCompared to the control group, the expression of AQP1 and the blood pressure markedly increased in the foot shock group (P< 0.05), the expression of AQP1 in the kidney tissues was decreased in the renal sympathetic nerve denervation group (P< 0.05) without significant increase of blood pressure. Compared to the foot shock group, the expression of AQP1 was decreased in the renal sympathetic nerve denervation plus foot shock group, the Captopril plus foot shock group and the Tempol plus foot shock group accompanied by reduction of blood pressure (P< 0.05).ConclusionsRenal AQP1 expression in rats is regulated by sympathetic nerves. Foot shock causes the increase of AQP1 expression, which is due to the increased renal sympatheic activity. In addition, oxidative stress and renin-agiontensin system regulate the expression of AQP1. AQP1 may play a certain role in the regulation of hypertension induced by chronic stress.
AQP1; stress-induced hypertension; oxidative stress; renal sympathetic nerve system
R363
A
10.3969/j.issn.1005-8982.2017.28.001
1005-8982(2017)28-0001-05
2016-12-06
国家自然科学基金(No:81270316,81470563);国家级大学生创新训练项目(No:2015suda047)
张国兴,E-mail:zhangguoxing@suda.edu.cn;Tel:15895587582
