血清25-羟-维生素D与类风湿关节炎相关性研究
2017-12-06杨孝兵孙颖慧
杨孝兵 孙颖慧 邵 丰 蒋 峰
血清25-羟-维生素D与类风湿关节炎相关性研究
杨孝兵 孙颖慧 邵 丰 蒋 峰
类风湿关节炎;25-羟基维生素D
类风湿关节炎(RA)是以关节滑膜炎症为特征的,以慢性进行性、多发性外周关节炎为表现的自身免疫病。病因与遗传、性别、免疫等多因素相关[1]。维生素D具有免疫调节的功能,可能与RA的发病及疾病活动度相关[2-4]。国外研究表明,大多数的RA患者出现维生素D含量不足[5-6]。本研究探讨血清25(OH)D与RA的疾病活动度、炎症指标及骨侵蚀、骨密度等的相关性分析。
1 临床资料
1.1 一般资料 选取2014年6月—2016年3月间本院风湿科门诊和住院确诊的RA患者,共118例,男 42例,女 76例,年龄 30~51岁,平均(43.92±5.73)岁。对照组选取同期我院就诊的非RA患者70例,男 28例,女 42例,年龄 26~52岁,平均(46.24±6.01)岁。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 (1)RA诊断标准采用中华医学会风湿病学分会制定的《类风湿关节炎诊断治疗指南》[7]中的的RA分类标准和/或2010年欧洲风湿病联盟和美国风湿病学会(EULAR/ACR)分类标准[8]。所有RA均为新确诊病例,之前未使用慢作用抗风湿药;(2)所有RA患者的治疗按照ACR、EULAR及中华医学会风湿病学分会制定的《类风湿关节炎诊断治疗指南》进行。标准方案:口服甲氨蝶呤片2.5mg×4片,每周1次和羟氯喹片0.1×2片,1天2次治疗。甲氨蝶呤禁忌者予来氟米特片10mg,1天1次替代。对症治疗按照常规处理;(3)所有研究对象,男性均在50岁以下,女性尚未绝经;(4)本研究获得本院伦理委员会批准,研究对象均签署知情同意书。
1.3 排除标准 (1)长期卧床或不能到户外接受阳光照射者;(2)不能正常饮食者;(3)存在肿瘤、糖尿病、肝肾疾病者;(4)RA病情加重或存在严重并发症或合并其他严重疾病,需采用非常规治疗者;(5)12周内曾接受维生素D类似物治疗者;(6)不能配合观察及自动退出者。
2 方法
检测两组血清25(OH)D;检测RA患者血沉(ESR)、C 反应蛋白(CRP)、28个关节关节压痛数(TJC28)及肿胀数(SJC28),患者疼痛视觉模拟量表(VAS)评分等。(1)25(OH)D 分级:目前国际上尚无统一的维生素D的参考值标准,依据相关文献研究[9-11],按含量分为下列3个等级:维生素D缺乏:<20ng/mL;维生素 D 不足:20~30ng/mL;维生素 D 正常:30~100ng/mL。(2)RA患者病情分度标准:根据EULAR推荐的RA28关节疾病活动性评分系统(DAS28)[12],DAS28>5.1为病情高度活动组,3.2≤DAS28≤5.1为病情中度活动组,DAS28<3.2为病情低度活动组。计算公式如下。注:TJC28:压痛关节计数;SJC28:肿胀关节计数;Ln:自然对数;VAS:RA受试者基于100mm视觉模拟标尺(VAS)对疼痛的评价;ESR:血沉(mm/h)。(3)RA 患者骨侵蚀分期标准:按照X线分期标准[13]分成严重骨侵(Ⅳ期)、骨侵(Ⅲ期)、非骨侵(Ⅰ期和Ⅱ期);(4)RA 患者骨密度:采用双能X线吸收法(DXA)测定骨密度,参照WHO推荐的诊断标准[14],DXA测定骨密度值低于同性别、同种族健康成人的骨峰值不足1个标准差为正常(T值≥-1.0SD);降低1~2.5个标准差为骨量低下或骨量减少(-2.5SD<T值<-1.0SD);降低程度等于或大于2.5个标准差为骨质疏松(T值≤-2.5SD)。T值用于表示绝经后妇女和大于50岁男性的骨密度水平,Z值用于儿童、绝经前及小于50岁男性。
统计学方法:应用SPSS17.0统计软件进行处理。计数资料用率、构成比来描述,计量资料用(±s)或M(P75-P25)表示;计数资料组采用χ2检验,计量资料组间比较采用t检验、方差分析、秩和检验;秩相关用于相关性方面的分析;回归分析采用线性与二分类Logistic回归方法。P<0.05为差异有统计学意义。
3 结果
3.1 RA组和对照组25(OH)D比较 RA组118例患者血清25(OH)D充足13例(11.02%),不足32例(27.12%),缺乏 73例(61.86%);25(OH)D 值为24.65~17.58ng/mL,平均 19.09ng/mL。非 RA 对照组70例血清25(OH)D充足40例(57.14%),不足20例(28.57%),缺乏10例(14.29%);25(OH)D值为56.21~23.42ng/mL,平均41.17ng/mL。两组血清25(OH)D含量和维生素D分级构成比较,秩和检验显示差异有统计学意义(P<0.05),RA组维生素D缺乏者明显高于对照组。
3.2 RA患者25(OH)D与临床基本情况和实验室指标相关分析 RA患者平均病程(2.13±1.10)年,平均血清 25(OH)D(19.09±10.86)ng/mL,平均关节压痛数(TJC)(5.06±2.42) 个,平均关节肿胀数(SJC)(1.96±1.32)个,平均 ESR(28.41±12.81)mm/h,平均CRP(20.11±8.12)mg/L。Pearson相关性分析显示,血清25(OH)D与CRP不存在统计学相关(r=-0.173,P=0.061),与 TJC 数(r=-0.464)、SJC 数(r=-0.528)和ESR(r=-0.580)存在负相关关系(P<0.05),相关系数依次为-0.464、-0.528、-0.58。
3.3 RA患者血清25(OH)D与病情活动度的关系118例患者DAS28低活动7例,中活动75例,高活动 36 例,25(OH)D 值分别为(38.47±12.64)ng/mL、(20.53±10.34)ng/mL、(12.32±3.81)ng/mL。方差分析显示,不同DAS28活动组间血清25(OH)D差异有统计学意义(P<0.05)。一元线性回归分析显示血清25(OH)D 的偏回归系数为-0.055,95%CI为-0.065,-0.046。回归方程为 Y=-0.055X+5.714[Y代表DAS28,X 代表 25(OH)D]。说明血清 25(OH)D 对DAS28具有负影响,见图1~2。
3.4 98例RA患者骨侵蚀程度与血清25(OH)D相关分析 98例患者双手X线片检查,无骨侵蚀26例,平均 25(OH)D(33.52±11.52)ng/mL,骨侵蚀 64例,平均 25(OH)D(15.17±6.39)ng/mL,严重骨侵蚀 8例,平均 25(OH)D(13.38±4.48)ng/mL。方差分析显示,不同骨侵蚀程度组间血清25(OH)D比较,差异有统计学意义(F=58.477,P<0.001)。

图1 DAS28疾病活动度分级与血清25(OH)D的关系
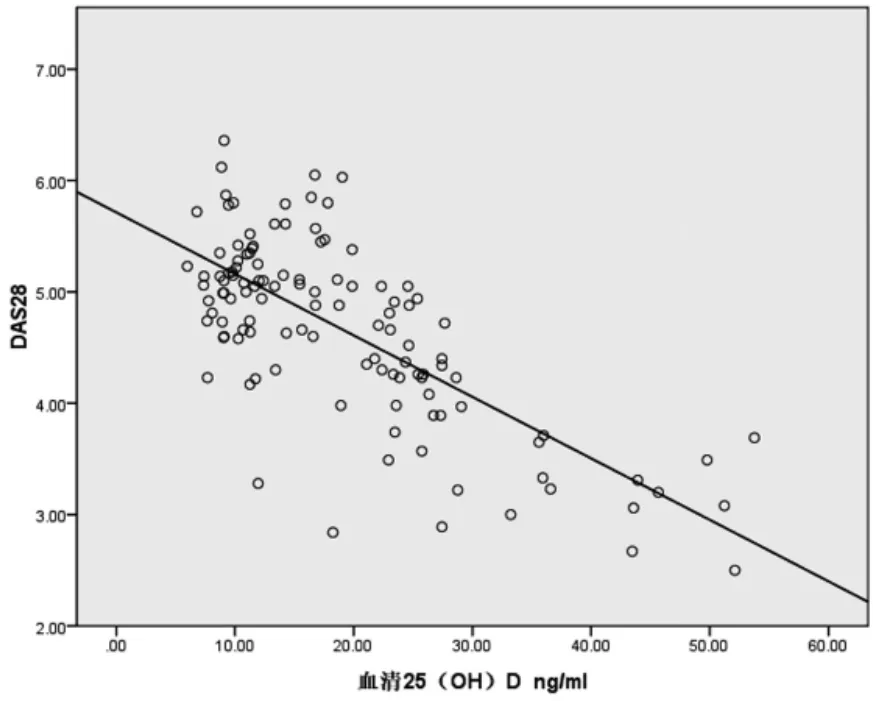
图2 血清25(OH)D与DAS28疾病活动度关系
3.5 90例RA患者骨密度与血清25(OH)D相关分析 90例患者中骨量正常21例,骨量减少26例,骨质疏松 43例,血清 25(OH)D 值分别为(35.51±2.19)ng/mL、(21.60±5.31)ng/mL、(11.82±3.53)ng/mL。不同骨密度患者间血清25(OH)D比较,方差分析比较显示差异有统计学意义(F=137.361,P<0.01)。Logistic回归分析血清25(OH)D对骨质疏松患病的影响,显示年龄和血清25(OH)D与骨质疏松患病相关(P=0.01、P<0.01),OR 值和 95%CI分别为 1.348(1.122,1.620)、0.569(0.416,0.779),提示年龄是患骨质疏松最危险的因素,患骨质疏松的几率,年龄大者是年龄小的1.348倍;血清25(OH)D是保护因素,含量高者是低者的0.569倍。
4 讨论
RA是一种自身免疫病,多种免疫因素参与。维生素D除了作用于钙磷代谢及骨形成和钙化上,还具备免疫调节的能力,在固有免疫应答及T、B的适应性免疫应答中均发挥作用[15-16]。研究[17]发现有84%RA患者存在维生素D不足(<30ng/m1);本研究显示,RA患者维生素D不足高达88.98%,高于国外的报道,和对照组(42.86%)比较差异有统计学意义。RA患者血清25(OH)D水平与其TJC、SJC、ESR负相关,回归分析结果也进一步提示25(OH)D水平对DAS28具有负影响,低水平25(OH)D是RA疾病活动性的危险因素,与Patel等[18]报道一致。本研究显示76.67%RA患者存在骨密度异常,低水平血清25(OH)D与骨侵蚀程度和骨质疏松的发生相关;高龄是骨质疏松患病的危险因素,而高25(OH)D水平是保护因素,这与国外的研究结果[19]一致。
RA患者应早期检测并给予补充维生素D治疗,尤其是老年RA患者。RA患者理想的维生素D血清浓度尚未明确,有国外有研究表明补充维生素D达到并维持血清浓度>38ng/mL对RA具有抑制作用[17],此有待进一步研究。
[1]蒋明,David Yu,林孝义,等.风湿病学[M].第 2 版.北京:华夏出版社,2004:697-738.
[2]Rossini M,Maddali Bongi S,La Montagna G,et al.Vitamin D deficiency in rheumatoid arthritis:prevalence,determinants and associations with disease activity and disability[J].Arthritis Researchamp;Therapy,2010,12(6):216.
[3]Rosen Y,Daich J,Soliman I,et al.Vitamin D and autoimmunity[J].Scandinavian Journal of Rheumatology,2016,45(6):439-447.
[4]Kostoglou-Athanassiou I,Athanassiou P,Lyraki A,et al.Vitamin D and rheumatoid arthritis[J].Therapeutic Advances in Endocrinology and Metabolism,2012,3(6):181-187.
[5]Yang J,Liu L,Zhang Q et al.Effect of vitamin D on the recurrence rate of rheumatoid arthritis[J].Experimental and Therapeutic Medicine,2015,10(5):1812-1816.
[6] Craig SM,Yu F,Curtis JR,et al.Vitamin D status and its associations with disease activity andseverity in African Americans with recent onset rheumatoid arthritis[J].The Journal Rheumatology,2010,37(2):275-281.
[7]中华医学会风湿病学分会,类风湿关节炎诊断及治疗指南[J].中华风湿病学杂志,2010,14(4):265-267.
[8] Aletaha D,Neogi T,Silman AJ,et al.2010 rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Arthritis and Rheumatism,2010,62(9):2569-2581.
[9] Holick MF.Vitamin D deficiency[J].The New England Journal of Medicine,2007,357(19):1980-1981.
[10]Bischoff-Ferrari HA.Optimal serum 25-hydroxyvitamin D levels for Multiple health outcomes[J].Advances in Experimental Medicine and Biology,2014,8(10):500-525.
[11] Durazo-Arvizu RA,Dawson-Hughes B,Sempos CT,et al.Three-phase model harmonizes estimates of the maximal suppression of parathyroid hormone by 25-hydroxyvitamin D in persons 65 years of age and older[J].The Journal of Nutrition,2010,140(3):595-599.
[12] Wells G,Becker JC,Teng J,et al.Validation of the 28-joint Disease Activity Score(DAS28)and European League Against Rheumatism response criteria based on C-reactive protein againstdisease progression in patients with rheumatoid arthritis,and comparis on with the DAS28 based on erythrocyte sedimentation rate[J].Annals of the Rheumatic Disease,2009,68(6):954-960.
[13] Agustín Escalante,Inmaculada Del Rincón,John E.Cornell.Latent variable approach to the measurement of physical disability in rheumatoid arthritis[J].Artiritis and Rheumatism,2004,51(3):399-407.
[14]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松诊治指南(2011)[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(1):2-17.
[15]Jeffery LE,Wood AM,Qureshi OS,et al.Availability of 25-hydroxyvitamin D(3)to APCs controls the balance between regulatoryand inflammatory T cell responses[J].Journal of Immunology,2012,189(11):5155-5164.
[16] Urry Z,Chambers ES,Xystrakis E,et al.The role of 1α,25-dihydroxyvitamin D3 and cytokines in the promotion of distinct Foxp3+and IL10+CD4+Tcells[J].European Journal and Immunology,2012,42(10):2697-2708.
[17]Kerr GS,Sabahi I,Richards JS,et al.Prevalence of vitamin D insufficiency/deficiency in rheumatoid arthritis and associations with disease severity and activity[J].The Journal of Rheumatology,2011,38(1):53-59.
[18]Patel S,Farragher T,Berry J,et al.Association between se-Yilln vitamin D metabolite levels and disease activity in patients with early inflammatory polyarthritis[J].Arthritis Rheum,2007,56(7):2143-2149.
[19] Lee SG,Park YE,Park SH,et a1.Increased frequency of osteoporosis and BMD below the expected range for age among South Korean wonlcn with rheumatoid arthritis[Int J].Rhcam Dis,2012,15(3):289-296.
浙江省湖州市科技计划项目(No:2013GYB09)
浙江省湖州市第三人民医院风湿免疫科(杨孝兵、邵丰、蒋峰)、耳鼻咽喉科(孙颖慧)(湖州 313000)
杨孝兵,Tel:15088354361;E-mail:yxb0516@126.com
(收稿:2017-02-23 修回:2017-05-19)
