培养工程化软骨的新方法
2017-12-05雷忱陈国杰王彪
雷忱+陈国杰+王彪


摘要:目的 探索组织工程室用于体内培养大体积工程化软骨的可行性。方法 取成年雄性新西兰大白兔10只,分别于耳部切取0.2 ml软骨切碎植入于背部同期构建的组织工程室内,1个月时,进行取材。结果 1个月时,组织工程室内构建物基本充满工程室,软骨组织平均体积(1.869±0.187)ml,较原始体积增大约(543.4±71.3)%。组织形态学观察:新生软骨区域明显,其中含有大量细胞外基质及软骨细胞,部分软骨细胞形态已较成熟。结论 组织工程室作为培养大体积工程化软骨的新方法可行,效果显著。
关键词:小耳畸形;组织工程软骨;轴心血管;组织工程室
中图分类号:R318 文献标识码:A 文章编号:1006-1959(2017)23-0028-03
A New Method of Cultivating Engineering Cartilage
LEI Chen,CHEN Guo-jie,WANG Biao
(Department of Plastic Surgery,the First Affiliated Hospital,Fujian Medical University,Fuzhou 350005,Fujian,China)
Abstract:Objective To explore the feasibility of tissue engineering room for in vivo culture of large volume engineering cartilage.Methods 10 adult male New Zealand white rabbits were cut into 0.2 ml cartilage and cut into the tissue engineering room at the same time.The specimens were harvested at 1 month.Results At 1 month,the indoor building full of tissue engineering cartilage tissue engineering chamber,the average volume (1.869±0.187)ml,compared with the original volume increased by about(543.4±71.3)%.Observe morphology:new cartilage region is obvious,which contains large amounts of extracellular matrix and cartilage cells form part of cartilage cells is mature.Conclusion Tissue engineering room is a new method to cultivate large volume of engineered cartilage,and the effect is remarkable.
Key words:Microtia;Tissue engineering cartilage;Axial vessel;Tissue engineering room
世界小耳癥发病率约9/10000。目前常见的小耳再造术式是以Nageta及firmin为代表的直埋法[1-5]。以及Park[6]、张庆国[7]为代表的扩张法。但两种方法均是以自体肋软骨移植为基础的术式。随之带来3~6根肋软骨的缺损、供区胸壁瘢痕的形成,组织类型为透明软骨,弹性差;甚至为了取得足量用于移植的软骨,不得已将手术年龄推迟至10岁左右。单纯的支架植入在出现皮瓣坏死后难以解决支架外露的问题。而目前利用细胞培养复合支架的方法虽然已取得初步成效。但存在传代过程中去分化、转移至体内后宿主排斥反应等缺点。
组织工程室是基于Hofer[8]等人在2003年发表的原始模型,利用在体的血管的动静脉环吻接(AVL),并将吻接环置入有一定硬度的惰性容器中,发现沿血管轴心生长的肉芽组织填满了惰性容器。Morrison[9-10]等在此基础上更进一步,利用了含AVL的血管化组织工程室模型,成功的诱导了心肌细胞的再生。而尚未有实验将组织工程室技术应用于软骨组织的培养。因此,本实验试图通过将组织工程室技术应用于软骨组织培养,验证此法可行性,为进一步临床探索奠定基础。
1 材料与方法
1.1实验动物
取成年雄性新西兰大白兔10只,每只体重约2.0~2.2 kg(福建医科大学动物实验中心提供)。实验动物均为SPF级,层流室内饲养。
1.2组织工程室准备
取边长2 cm×2 cm×1 cm长方体方体型硅胶模具,并于各侧壁打孔,间隔0.5 cm。完成后高压消毒备用。
1.3组织工程室模型构建方法
手术前1 d,兔背部、耳部备毛。手术当天,使用10%水合醛0.3 ml/100 g腹腔注射麻醉,麻醉满意后,在兔耳取约3 cm手术切口,分离至耳软骨表面,切取约1.5 cm长梭型耳软骨(约0.1 ml),切碎备用。背部正中取5 cm手术切口,切开至皮下,分离两侧肩胛骨上脂肪瓣,裸化其供血轴心血管。将裸化血管植入预先高压消毒的工程室中,调整位置后丝线固定于兔背部。最后将剪碎耳软骨由侧壁孔洞均匀铺入组织工程室内。关闭皮肤创面。
1.4形态学及免疫组化染色
于1个月时完整切取组织工程室内工程化组织,保存于多聚甲醛固定24 h,然后石蜡包埋切片,行苏木素-伊红(HE)染色及马松三色染色。endprint
1.5统计学方法
计量资料以(x±s)表示,应用SPSS 13.0统计软件分析,组间比较采用随机资料单因素方差分析,以P<0.05为差异学有统计意义。
2 结果
2.1组织工程软骨的大体观察
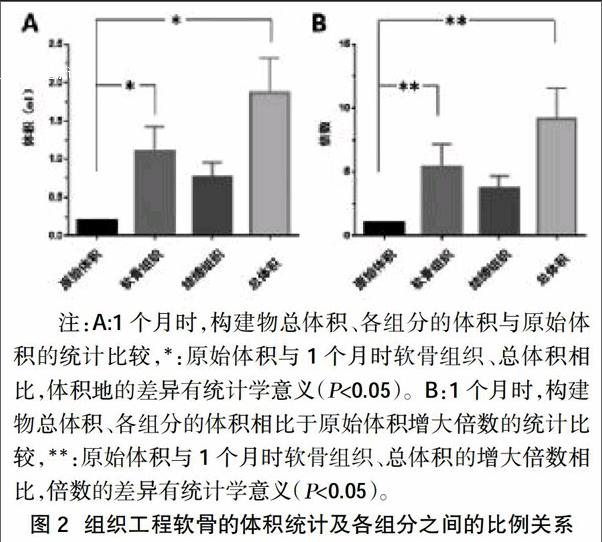
新西兰大白兔对手术操作耐受良好,1个月时取材,麻醉后由原切口入路,可见组织工程室表面覆盖包膜,打开包膜后见大量渗出液,肉芽组织基本充满组织工程室,除去组织工程室后可见原轴心血管保留完好,软组织块表面血管化良好。连带轴心血管将软组织块游离,仔细剥离软组织块表面组织,可见内部软骨样组织,并形成接近正方形块状结构,剖开后可见光滑质韧软骨样组织(见图1B)。工程化软骨体积及其在软骨质块中体积比统计见图2B。1个月时,软骨组织平均体积(1.869±0.187)ml,较原始体积增大约(543.4±71.3)%。在软骨样组织周围,可见较多纤维肉芽组织增生,包裹软骨组织。
2.2组织形态学观察
1个月时,HE显示原有软骨组织边界较为清晰,界限内软骨组织形态基本良好,部分软骨细胞略肥大,偶见少量钙化。而在软骨组织间隙中,存在新生软骨细胞区域(见图3),其中软骨细胞形态良好,部分已出现成熟软骨细胞形态(图3黑色箭头示)未见明显软骨细胞肥大及钙化,且在细胞周围可见大量细胞外基质(图3白色箭头示)。并且,新生软骨细胞呈现出越靠近原有软骨,组织形态越加成熟的趋势,提示原有软骨在组织工程室环境下被诱导再生的可能性。
3 讨论
利用残耳软骨是目前耳再造中既避免继发缺损,又能获得弹性软骨的重要手段。但残耳软骨体积有限,要求较高的体外扩增倍数。而体外培养后的去分化现象却限制了通过传代获得大量软骨细胞及组织的方法。虽然从健侧切取耳软骨能一定程度上弥补基础软骨量的不足。但实现更大倍数的体积扩增才是解决问题的根本手段。本实验中已经诱导原有软骨体积在1个月内增大了5倍以上,并且这种再生很可能来源于原有软骨。虽然增大的体积还未达到可供临床使用的体积,在先前的报道中,组织工程室技术已经成功诱导出比原始体积增大15倍的脂肪组织[11]。考虑一方面和实验动物本身体积相关,另一方面考虑培养时间较短,在一项肋软骨的临床长期观察中发现,软骨的重塑過程可持续长达10个月[12-13]。同时,取材时工程化软骨组织基本位于工程室底部,考虑如能使软骨碎块在工程室内更加均匀地分布,有望更加均匀地诱导软骨组织地再生。同有报道通过加入自体富血小板血浆(PRP)作为自体支架培养软骨,并已取得良好的效果,但此法同样需要通过酶消化法获得单个软骨细胞,并进行体外培养及传代,无法保证外源性添加试剂的安全性。而组织工程室中早期亦可添加PRP使植入软骨分布在空间上更加均匀,下一步的实验将在这一方向上继续改进,进一步扩大组织工程软骨扩增倍数。并继续探索组织工程室诱导软骨体积增大的相关机制。
参考文献:
[1]Bly RA,Bhrany AD,Murakami CS,et al.Microtia Reconstruction[J].Facial Plastic Surgery Clinics of North America,2016,24(4):577-591.
[2]Wilkes GH,Wong J,Guilfoyle R.Microtia Reconstruction[J].Plastic and Reconstructive Surgery,2014,134(3):464-479.
[3]Ruder RO,Graham JJ.Evaluation and treatment of the deformed and malformed auricle[J].Clin Pediatr(Phila),1996,35(9):461-465.
[4]Chen ZC,Goh RC,Chen PK,et al.A new method for the second-stage auricular projection of the Nagata method:ultra-delicate split-thickness skin graft in continuity with full-thickness skin[J].Plast Reconstr Surg,2009,124(5):1477-1485.
[5]Firmin F.State-of-the-art autogenous ear reconstruction in cases of microtia[J].Adv Otorhinolaryngol,2010(68):25-52.
[6]Park C.Subfascial expansion and expanded two-flap method for microtia reconstruction[J].Plast Reconstr Surg,2000,106(7):1473-1487.
[7]Qian J,Li Z,Liu T,et al.Auricular Reconstruction in Hemifacial Microsomia with an Expanded Two-Flap Method[J].Plastic and Reconstructive Surgery,2017,139(5):1200-1209.
[8]Hofer S O,Knight K M,Cooper-White J J,et al.Increasing the volume of vascularized tissue formation in engineered constructs:an experimental study in rats[J].Plast Reconstr Surg,2003,111(3):1186-1192,1193-1194.endprint
[9]Morritt A N,Bortolotto S K,Dilley R J,et al.Cardiac tissue engineering in an in vivo vascularized chamber[J].Circulation,2007,115(3):353-360.
[10]Dolderer J H,Abberton K M,Thompson E W,et al.Spontaneous large volume adipose tissue generation from a vascularized pedicled fat flap inside a chamber space[J].Tissue Eng,2007,13(4):673-681.
[11]Wan J,Dong Z,Lei C,et al.Generating an Engineered Adipose Tissue Flap Using an External Suspension Device[J].Plast Reconstr Surg,2016,138(1):109-120.
[12]Kawanabe Y,Nagata S.A New Method of Costal Cartilage Harvest for Total Auricular Reconstruction:Part I.Avoidance and Prevention of Intraoperative and Postoperative Complications and Problems[J].Plastic and Reconstructive Surgery,2006,117(6):2011-2018.
[13]Kawanabe Y,Nagata S.A New Method of Costal Cartilage Harvest for Total Auricular Reconstruction:Part II.Evaluation and Analysis of the Regenerated Costal Cartilage[J].Plastic and Reconstructive Surgery,2007,119(1):308-315.編辑/成森endprint
