痛风性关节炎骨质疏松患者血清LEP、OPG与IL-6、TNF-α相关性研究
2017-12-05蒲泽宴李祥坤胥国强
周 游,蒲泽宴,李祥坤,胥国强
(四川省遂宁市中心医院检验科 629000)
论著·临床研究
痛风性关节炎骨质疏松患者血清LEP、OPG与IL-6、TNF-α相关性研究
周 游,蒲泽宴△,李祥坤,胥国强
(四川省遂宁市中心医院检验科 629000)
目的分析痛风性关节炎骨质疏松患者血清瘦素(LEP)、骨保护素(OPG)与炎症因子白细胞介素(IL-6)、肿瘤坏死因子α(TNF-α)相关性。方法选择痛风性关节炎患者48例为研究对象(GA组),其中伴有骨质疏松19例(OP组),不伴有骨质疏松29例(非OP组),另选择健康体检者45例为对照。以双能X线骨密度吸收仪测定骨密度,ELISA检测血清LEP、OPG及IL-6、TNF-α水平并分析相关性。结果GA组患者骨质疏松发生率39.6%明显高于对照组的13.3%(P=0.004),各部位骨密度明显低于对照组(Plt;0.05)。与对照组及非OP组相比,OP组患者血清LEP水平明显升高,OPG水平明显降低,差异有统计学意义(Plt;0.05)。非OP组患者血清LEP水平明显高于对照组(Plt;0.05),但OPG水平差异无统计学意义(Pgt;0.05)。OP组患者血清IL-6、TNF-α水平明显高于非OP组及对照组(Plt;0.05),非OP组明显高于对照组(Plt;0.05)。OP组患者血清LEP与IL-6、TNF-α呈正相关(Plt;0.05),血清OPG与IL-6、TNF-α呈负相关(Plt;0.05)。结论痛风性关节炎伴发骨质疏松患者血清LEP、OPG呈异常变化,其与IL-6、TNF-α有一定相关性。
关节炎,痛风性;骨质疏松;瘦素;骨保护素;白细胞介素-6;肿瘤坏死因子α
痛风性关节炎是嘌呤代谢紊乱而致关节局部形成尿酸盐晶体所引起的无菌性炎性疾病,反复发生的急性或慢性骨损伤是其特征表现之一。骨质疏松被认为是痛风性关节炎患者关节畸形和致残的因素之一,尤其是反复慢性炎症反应导致的骨和软骨破坏极易引起患者骨质疏松的发生[1]。瘦素(LEP)和骨保护素(OPG)参与骨代谢,LEP可通过对成骨细胞的作用而抑制骨形成,而OPG可抑制破骨细胞活性,促进破骨细胞凋亡,在终末阶段抑制破骨形成,同时还可促进病态骨吸收、增加骨密度,是机体对抗骨质疏松的重要因子[2]。慢性痛风性关节炎患者体内长期处于微炎症状态,此种环境下分泌的白细胞介素(IL)-6、肿瘤坏死因子α(TNF-α)等细胞因子可能会刺激破骨前体细胞分泌,抑制骨胶原合成及骨钙化[3],促进骨质疏松的发生与进展。本研究检测痛风性关节炎骨质疏松患者血清LEP、OPG及IL-6、TNF-α水平,并分析其相关性,以期为该病发病机制研究提供新思路。
1 资料与方法
1.1一般资料 选取本院2015年1月至2016年6月收治的痛风性关节炎患者48例为研究对象(GA组),其中伴有骨质疏松19例(OP组),不伴有骨质疏松29例(非OP组),均为男性,年龄22~68岁,中位年龄46岁,病程2~18年,平均(10.7±6.2)年。所有患者均符合1977年美国风湿病协会(ACR)制定的痛风诊断标准[4]。排除标准:(1)除痛风性关节
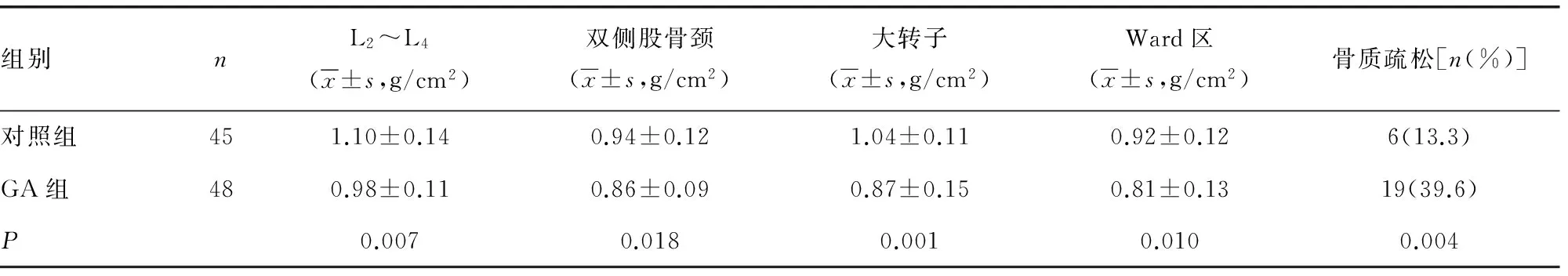
表1 骨质疏松发生率及各部位骨密度比较
炎外伴有其他关节炎性疾病,如类风湿性关节炎、强直性脊柱炎等;(2)继发性痛风;(3)长期服用补钙药物;(4)合并高血压、糖尿病、高血脂等代谢性疾病,合并恶性肿瘤或自身免疫性疾病;(5)伴有其他可能导致体内炎症因子升高的疾病。另选择同期健康体检者45例为对照组,年龄25~65岁,中位年龄45岁,均为男性。3组一般资料比较差异无统计学意义(Pgt;0.05),具有可比性。
1.2方法
1.2.1骨密度测定 采用Osteocore 3型双能X线骨密度测定仪(法国Medlink公司)对患者腰椎前后位(L2~L4)、双侧股骨颈、大转子、Ward区骨密度进行测定,以g/cm2表示。骨质疏松诊断:当有1个或1个以上检测部位骨密度值低于正常同性峰值1个标准差判定为骨量减少,低于正常同性峰值2.5个标准差判定为骨质疏松。骨密度正常及骨量减少者纳入非OP组,骨质疏松者纳入OP组。
1.2.2血清LEP、OPG及IL-6、TNF-α水平测定 患者入院后次日清晨取空腹静脉血于促凝管,上下颠倒5~10次,静置2 h,3 500 r/min离心5 min,取上层液体即为血清,置于5 mL EP管,-80 ℃保存待测。ELISA试剂盒,LEP、OPG试剂盒购自上海通蔚生物科技有限公司,IL-6、TNF-α试剂盒购自博士德生物工程有限公司。所有操作均严格按照试剂盒说明书进行,检测当天实验室温度、湿度均符合说明书要求,室内质控显示在控。
2 结 果
2.1骨密度情况 GA组患者在L2~L4、双侧股骨颈、大转子、Ward区骨密度值均低于对照组(Plt;0.05),骨质疏松发生率明显高于对照组(Plt;0.05)。见表1。
2.2血清LEP、OPG水平 与对照组及非OP组相比,OP组患者血清LEP水平明显升高,OPG水平明显降低,差异有统计学意义(Plt;0.05)。非OP组患者血清LEP水平明显高于对照组(Plt;0.05),但OPG水平差异无统计学意义(Pgt;0.05)。见图1。
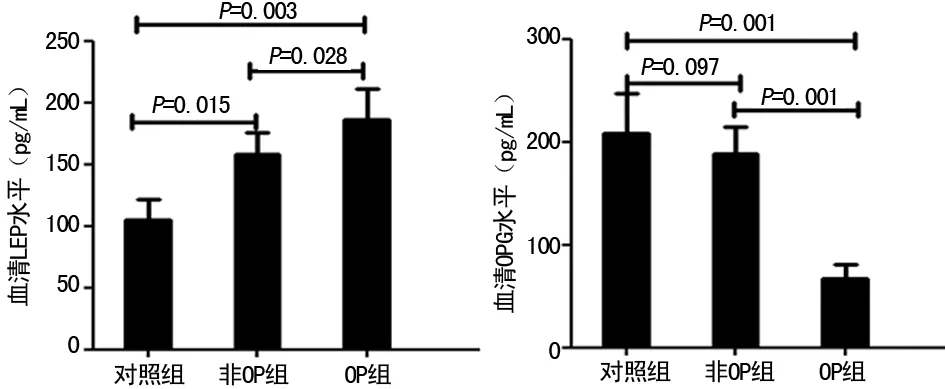
图1 受试者血清LEP、OPG水平比较
2.3血清IL-6、TNF-α水平 OP组患者血清IL-6、TNF-α水平明显高于非OP组及对照组(Plt;0.05),非OP组明显高于对照组(Plt;0.05)。见图2。
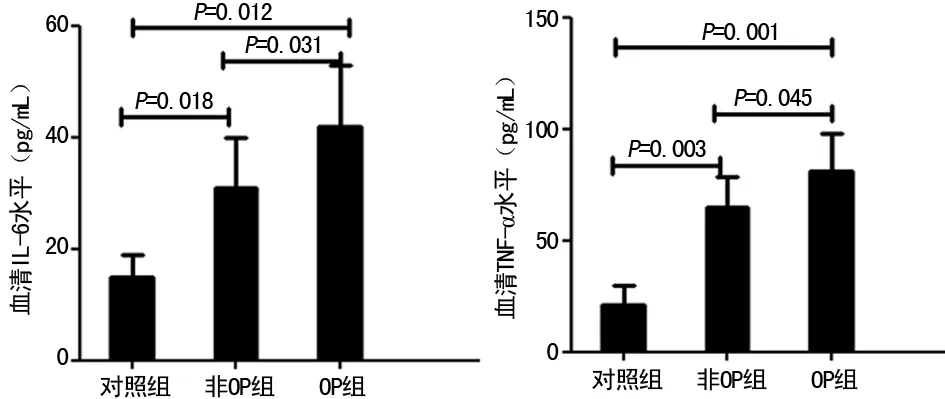
图2 受试者血清IL-6、TNF-α水平比较
2.4OP组患者血清LEP、OPG与IL-6、TNF-α水平相关性分析 OP组患者血清LEP与IL-6、TNF-α呈正相关(r=0.631、0.532,Plt;0.05),血清OPG与IL-6、TNF-α呈负相关(r=-0.581、-0.466,Plt;0.05)。见图3。

图3 OP组患者血清LEP、OPG与IL-6、TNF-α水平相关性分析
3 讨 论
骨质疏松是一种临床常见骨骼脆性和骨折危险性增加的代谢障碍性疾病,骨微结构损坏及改变、骨量减少、骨密度下降是其主要病理特征,常伴有严重并发症。骨质疏松的发生可能与年龄、药物不良反应、自身炎性疾病等有一定关系,在系统性红斑狼疮、2型糖尿病、关节炎性疾病高发[5]。痛风是尿酸盐晶体从超饱和的细胞外液转移并沉积于软骨、皮下、骨膜等局部组织,引起局部炎症应答的一组临床综合征,当累及关节并导致相应临床症状时则为痛风性关节炎。骨性关节炎主要是软骨下骨发生病理改变,当局部软骨下骨被痛风性关节炎性病变侵及时,会造成骨丢失增加、骨量减少、骨密度下降等现象,而这会导致骨质疏松发生和促进其进一步发展[1]。Lee等[6]对超过1 000例女性类风湿性关节炎患者行骨密度检测,发现骨质疏松发病率高达46.8%,并且由此导致的骨折风险是健康人群的2.14倍(95 %CI:1.52~3.02)。而同为关节炎性疾病的痛风性关节炎,也被认为可能是骨质疏松发生的危险因素之一[7]。本研究结果显示,痛风性关节炎患者骨质疏松发生率明显高于健康体检人群,说明痛风性关节炎患者更易发生骨质疏松。而在骨密度比较中,痛风性关节炎患者明显低于健康体检者,这表明痛风性关节炎会导致骨密度下降,这可能也是直接导致患者骨质疏松发生的关键因素之一[6-7]。
LEP和OPG是病理或生理状态下参与骨代谢的重要物质。LEP是肥胖基因编码的一种肽类激素,是一种具有内分泌作用、高度保守的蛋白质。骨形成和骨重建受到下丘脑调控,而LEP可能通过某种下丘脑物质或者中枢神经系统来抑制骨形成,这也是瘦素-骨骼相互作者的路径之一[8]。在神经调节之外,成骨细胞可能是LEP发挥抑骨作用的另一靶点,成骨细胞表面存在LEP受体蛋白,这种蛋白可以使得LEP与成骨细胞高亲和性、特异性结合,导致成骨细胞丧失其成骨活性[9]。OPG是一种具有调节骨吸收和骨形成的分泌型糖蛋白,在2型糖尿病、甲状腺功能亢进、甲状旁腺功能亢进等疾病引起的骨质疏松患者体内,发现OPG呈低表达状态[10]。破骨细胞是OPG参与骨代谢的主要靶细胞之一,OPG可以抑制破骨细胞分化、成熟及活化,并且还可有效诱导成熟的破骨细胞发生凋亡[10-11]。在卵巢切除小鼠模型中,降低OPG水平可以导致小鼠发生严重骨质疏松,而注射OPG是治疗绝经后妇女骨质疏松的方法之一[12-13]。研究发现,在类风湿性关节炎伴骨质疏松患者体内存在LEP和OPG的异常表达[14]。本研究结果显示,痛风性关节炎伴骨质疏松患者LEP呈高表达,OPG呈低表达,提示LEP、OPG可能参与到痛风性关节炎诱发骨质疏松,与其他类似研究结果相符合[13-14]。
痛风性关节炎是由尿酸盐晶体作为刺激因子诱发的局部无菌炎性疾病,长期、反复的炎症反应会导致机体处于一种微炎症环境,而炎症因子大多对破骨细胞分化、成熟有促进作用,打破骨形成和骨吸收之间的平衡,使得骨量减少、骨密度下降,导致痛风性关节炎患者发生骨质疏松。本研究分析结果发现,IL-6、TNF-α在痛风性关节炎骨质疏松患者表达最高,明显高于痛风性关节炎不伴骨质疏松患者及健康体检者。在痛风性关节炎骨质疏松患者中,血清IL-6、TNF-α与LEP、OPG水平呈明显相关性。这些研究结果均提示,LEP、OPG可能参与到痛风性关节炎骨质疏松的发生,并且可能与体内IL-6、TNF-α高表达有一定关系。TNF-α可诱导破骨细胞分化,在低浓度条件下即可明显增强破骨细胞形成,同时TNF-α也是破骨细胞激活因子,可以通过多种途径发挥抑骨作用。OPG属于肿瘤坏死因子受体超家族成员,在体外实验中发现[15],TNF-α可能会抑制OPG合成,进而导致骨量减少,而本研究显示OPG与TNF-α呈负性相关,可能与此有关。IL-6主要通过促进破骨祖细胞增殖,抑制成骨细胞功能,同时还是TNF-α调节破骨细胞分化不可缺少的下游细胞因子。此外IL-6还可以作用于核因子κB受体活化因子受体(RANK)-核因子κB受体活化因子受体配体(RANKL)-OPG功能轴,通过前两者来抑制OPG的表达及功能[16]。
综上所述,痛风性关节炎患者易发骨质疏松,LEP、OPG可能参与到痛风性关节炎骨质疏松的发生与进展,此过程可能与炎症因子IL-6、TNF-α相关。但是本研究受制于病例量少,缺乏基础研究支撑,不能阐述LEP、OPG与IL-6、TNF-α具体作用机制,还需进一步结合临床与基础进行更深入的研究。
[1]Kotrych D,Dziedziejko V,Safranow K,et al.TNF-α and IL10 gene polymorphisms in women with postmenopausal osteoporosis[J].Eur J Obstet Gynecol Reprod Biol,2016,199(1):92-95.
[2]Legiran S,Brandi ML.Bone mass regulation of leptin and postmenopausal osteoporosis with obesity[J].Clin Cases Miner Bone Metab,2012,9(3):145-149.
[3]Kim BJ,Bae SJ,Lee SY,et al.TNF-α mediates the stimulation of sclerostin expression in an estrogen-deficient condition[J].Biochem Biophys Res Commun,2012,424(1):170-175.
[4]Wallace SL,Robinson H,Masi AT,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[5]Rossini M,Adami S,Bertoldo F,et al.Guidelines for the diagnosis,prevention and management of osteoporosis[J].Reumatismo,2016,68(1):1-39.
[6]Lee JH,Sung YK,Choi CB,et al.The frequency of and risk factors for osteoporosis in Korean patients with rheumatoid arthritis[J].BMC Musculoskelet Disord,2016,17(17):98.
[7]Chen YL,Weng SF,Shen YC,et al.Obstructive sleep apnea and risk of osteoporosis:a population-based cohort study in Taiwan[J].J Clin Endocrinol Metab,2014,99(7):2441-2447.
[8]Ahmed HH,Morcos NY,Eskander EF,et al.Potential role of leptin against glucocorticoid-induced secondary osteoporosis in adult female rats[J].Eur Rev Med Pharmacol Sci,2012,16(10):1446-1452.
[9]Bayhan I,Dogan NU,Ozaksit G,et al.Effect of Strontium ranelate on serum leptin and bone turnover markers in women with established postmenopausal osteoporosis[J].J Reprod Med,2013,58(7/8):319-323.
[10]Poudyal H,Brown L.Osteoporosis and its association with non-gonadal hormones involved in hypertension,adiposity and hyperglycaemia[J].Curr Drug Targets,2013,14(14):1694-1706.
[11]Horst-Sikorska W,Ignaszak-Szczepaniak M.The role of anorexia nervosa in secondary osteoporosis development with the risk for low energy fractures[J].Endokrynol Pol,2011,62(1):45-47.
[12]Ishikawa S,Ogawa Y,Tamaki M,et al.Influence of palmatine on bone metabolism in ovariectomized mice and cytokine secretion of osteoblasts[J].In Vivo,2015,29(6):671-677.
[13]Kim J,Kim H,Ku SY,et al.Polymorphisms in period genes and bone response to hormone therapy in postmenopausal Korean women[J].Climacteric,2016,19(1):85-90.
[14]Lamghari M,Tavares L,Camboa N,et al.Leptin effect on RANKL and OPG expression in MC3T3-E1 osteoblasts[J].J Cell Biochem,2006,98(5):1123-1129.
[15]García-LópezS,VillanuevaR,MeikleMC.AlterationsinthesynthesisofIL-1β,TNF-α,IL-6,andtheirdownstreamtargetsRANKLandOPGbymousecalvarialosteoblastsinvitro:inhibitionofboneresorptionbycyclic mechanical strain[J].Front Endocrinol (Lausanne),2013,4(4):160.
[16]Wei Y,Sun X,Hua M,et al.Inhibitory effect of a novel antirheumatic drug T-614 on the IL-6-Induced RANKL/OPG,IL-17,and MMP-3 expression in synovial fibroblasts from rheumatoid arthritis patients[J].Biomed Res Int,2015,2015:214683.
CorrelationbeweenserumleptinandosteoprotegerinwithIL-6andTNF-αinpatientswithgoutarthritisosteoporosis*
ZhouYou,PuZeyan△,LiXiangkun,XuGuoqiang
(DepartmentofClinicalLaboratory,SuiningMunicipalCentralHospital,Suining,Sichuan629000,China)
ObjectiveTo analyze the correlation between serum leptin and osteoprotegerin with IL-6 and TNF-α in the patients with gout arthritis osteoporosis.MethodsForty-eight cases of gout arthritis were selected as the research subjects (GA group),including 19 cases of complicating osteoporosis(OP group) and 29 cases of non-complicating osteoporosis(non-OP group).Other 45 individuals undergoing healthy physical examination were selected as the control group.The bone mineral density (BMD) was measured by dual energy X-ray BMD absorptionmetry instrument and the levels of serum LEP,OPG,IL-6 and TNF-α were detected by ELISA.ResultsThe incidence rate of osteoporosis in the GA group was significantly higher than that in the control group (39.6%vs.13.3%,P=0.004),and BMD in various sites was significantly lower than that of the control group(Plt;0.05).The serum LEP level in the OP group was significantly increased compared with that in the non-OP group and control group(Plt;0.05),and the OPG level was significantly decreased,the difference was statistically significant(Plt;0.05).The serum LEP level in the non-OP group was significantly higher than that in the control group (Plt;0.05),but the OPG level had no statistical difference between non-OP group and control group(Pgt;0.05).The serum IL-6 and TNF-α levels in the OP group were significantly higher than those in the non-OP group and control group(Plt;0.05),and the non-OP group was significantly higher than the control group(Plt;0.05).The serum LEP level in the OP group was positively correlated with IL-6 and TNF-α(Plt;0.05),and the serum OPG level was negatively correlated with IL-6 and TNF-α(Plt;0.05).ConclusionThe serum LEP and OPG levels have abnormal change in the patients with gout arthritis osteoporosis,which has a certain correlation with IL-6 and TNF-α.
arthritis,gouty;osteoporosis;leptin;osteoporotegerin;interleukin-6;tumor necrosis factor-alpha
10.3969/j.issn.1671-8348.2017.33.016
四川省卫生和计划生育委员会科研课题(17PJ067)。
周游(1989-),检验师,硕士,主要从事痛风性疾病的临床与基础研究。△
,E-mail:1825361906@qq.com。
R44
A
1671-8348(2017)33-4653-03
2017-06-26
2017-09-06)
