P-糖蛋白在大鼠脑缺血再灌注后的表达变化
2017-12-05王晓娟于建云郭泽云
赵 敏,王晓娟,陈 波,李 洁,于建云,郭泽云△,杨 力▲
(昆明医科大学:1基础医学院人体解剖学与组织胚胎学系;2.科研中心;3.高等教育研究所,昆明 650500)
·论著·基础研究
P-糖蛋白在大鼠脑缺血再灌注后的表达变化
赵 敏1,王晓娟1,陈 波2,李 洁1,于建云3,郭泽云1△,杨 力1▲
(昆明医科大学:1基础医学院人体解剖学与组织胚胎学系;2.科研中心;3.高等教育研究所,昆明 650500)
目的观察大鼠局灶性脑缺血90 min再灌注后P-糖蛋白(P-gp)在脑组织中的表达及其变化规律。方法采用线栓法建立大鼠脑缺血再灌注模型,选取26只成年健康SD雄性大鼠,其中1只用于2,3,5-三苯基氯化四氮唑(TTC)染色,其余25只随机分为对照组(n=5)、假手术组(n=5)、脑缺血再灌注1、3、7 d组(n=5)。用免疫组织化学DAB单标,观察P-gp在正常脑组织和缺血脑组织中的分布变化;用Mdr-1抗体分别和神经元标记物(Neun)、星形胶质细胞标记物(GFAP)、微血管内皮细胞标记物(CD31)进行免疫荧光双标,观察P-gp在缺血再灌注后脑组织的表达;用实时定量PCR技术检测脑缺血再灌注后大脑皮质及纹状体微血管P-gp mRNA的表达变化。结果对照组仅在脑组织微血管内皮细胞表达P-gp,缺血再灌注组除微血管内皮细胞表达P-gp外,在部分神经元及星形胶质细胞的突起也有表达。脑缺血再灌注后1 d皮质P-gp mRNA表达降低,但3 d表达明显增高,7 d又下降,其升高和降低水平与对照组及假手术组比较,差异有统计学意义(Plt;0.05)。脑缺血再灌注后1、3、7 d纹状体P-gp mRNA表达均增多,其中以1、3 d增多明显,与对照组和假手术组比较,差异有统计学意义(Plt;0.05)。结论脑缺血再灌注后P-gp在大脑皮层及纹状体微血管P-gp的表达呈现不同的趋势,这可能是脑组织的自我保护机制之一。
P-糖蛋白;脑缺血;再灌注;ABC结合盒蛋白
脑缺血-再灌注损伤(cerebral ischemia reperfusion injury,CIRI)对脑组织的损伤会进一步加重,最终导致脑内神经元及内皮细胞凋亡或坏死,脑血管结构改变,血脑屏障(blood-brain barrier,BBB)功能破坏[1]。BBB微血管内皮的一种转运蛋白P-糖蛋白(P-glycoprotein,P-gp)能将进入脑组织的药物转运回微血管中,使进入脑组织的药物不能达到有效治疗浓度,这可能是导致治疗效果不尽如人意的重要原因之一。越来越多的证据表明P-gp在癫痫[2]、阿尔茨海默病、帕金森和肌萎缩性侧索硬化症等中枢神经系统疾病的发病及治疗中担任重要角色[3]。然而,国内外有关脑缺血时P-gp的表达变化与作用的报道尚不多见。本研究复制大鼠大脑中动脉缺血(middle cerebral artery occlusion,MCAO)再灌注模型,对脑缺血再灌注后P-gp的表达变化进行系统的观察,以期了解脑缺血再灌注后P-gp的表达规律,为脑缺血后给予有效的P-gp逆转剂,抑制P-gp的表达,有效治疗缺血性脑损伤提供依据。
1 材料与方法
1.1实验动物 成年健康SD雄性大鼠26只(昆明医科大学实验动物中心提供),体质量250~280 g,1只用于MCAO再灌注后脑切片TTC染色,其余25只采用随机数字编号法分为3组:对照组(n=5)、假手术组(n=5)和脑缺血再灌注组,后者按大鼠大脑中动脉阻断90 min再灌后1、3、7 d分为3个亚组(n=5)。动物均于实验前置于实验室适应环境1周,自由进食、饮水;室温控制在(23±2)℃,自然光照,术前禁食12 h。
1.2方法
1.2.1大鼠脑缺血再灌注模型的复制 参照Longa等[4]的方法建立大鼠MCAO再灌注模型。动物以3%戊巴比妥钠(0.1 ml/100 g)腹腔注射麻醉,颈正中切口剪开浅筋膜,钝性分离胸锁乳突肌与胸骨舌骨肌间的肌间隙,暴露右侧颈总动脉(CCA)和迷走神经。钝性撕开颈动脉鞘,分离CCA。分离右侧颈外动脉(ECA)、颈内动脉(ICA),并结扎ECA远心端,微动脉夹夹住CCA近心端和ICA,在ECA距动脉分叉3~5 mm处剪一小口,插入预先处理好的线栓,插入长度(18.5±0.5)mm(从CCA分叉处计算),90 min后缓慢拔出线栓,扎紧ECA开口近心端,逐层缝合,术后于温床保暖,给予其充足的鼠粮和水。假手术组大鼠除不栓塞大脑中动脉外,其余处理同缺血组。术后大鼠参照Longa等[4]的评分法,0分:无神经缺损症状;1分:不能完全伸展左侧前爪;2分:向外侧转圈;3分:向左侧倾斜;4分:不能行走或昏迷。1~4分为有效模型,纳入实验分组,出血较多,梗死灶不明显或提前死亡的大鼠均剔除。
1.2.22,3,5-三苯基氯化四氮唑(TTC)染色 大鼠MCAO再灌注术后1 d断头取脑,将脑组织经-20 ℃冰箱冻存20 min,去除嗅球、小脑和低位脑干后沿冠状面5等分连续切片,置于37 ℃的水浴箱中避光染色30 min,期间每隔10 min翻动1次脑片,使其染色均匀,取出脑组织浸入2%的多聚甲醛充分固定,数码相机拍照。
1.2.3组织样品制备与染色
1.2.3.1组织样品制备 各组大鼠按MCAO再灌注术后的时间点用3%戊巴比妥钠腹腔注射麻醉,随后断头取脑,用4%多聚甲醛缓冲液于4 ℃冰箱后固定24 h。脑组织经梯度乙醇脱水、二甲苯透明、烤箱内浸蜡,石蜡包埋。AO切片机连续切片,切片厚度10 μm,间隔5片取1片。脑组织切片过30%乙醇后放入水浴箱中展平,粘贴于用铬矾明胶处理过的载玻片上,烤干后备用。
1.2.3.2免疫组织化学DAB单标染色 脑组织切片常规脱蜡水化,浸于预热的柠檬酸盐抗原修复液中,微波炉高温修复15 min后,采用即用型超敏试剂盒(福州迈新生物技术开发公司)进行S-P(streptavidin-peroxidase)法免疫组化染色。一抗为小鼠抗兔单克隆Mdr-1抗体(1∶100,Santa公司),4 ℃冰箱,过夜;二抗为生物素标记的抗体(羊抗兔);后再滴加链霉素抗生物素蛋白-过氧化物酶溶液;室温下避光DAB显色10 min;乙醇梯度脱水、二甲苯透明、中性树胶封片。免疫组化阴性对照实验分别用PBS液和羊血清代替一抗,其余步骤相同。
1.2.3.3免疫荧光双标染色 用抗Mdr-1抗体分别与神经元的标记物(Neun)及星形胶质细胞的标记物(GFAP)和血管内皮标记物(CD31)进行免疫荧光双标染色。将脑组织切片脱蜡后,用柠檬酸盐抗原修复液微波炉高温修复15 min,滴加一抗(Mdr-1抗体,1∶100;Neun抗体,1∶100);(Mdr-1抗体1∶100;GFAP抗体,1∶1 000);(Mdr-1抗体,1∶100;CD31抗体,1∶100),室温过夜;滴加红色荧光(Cy3)标记IgG(1∶100)和绿色荧光(FITC)标记的IgG(1∶100)的二抗,室温避光孵育1h;荧光封片剂封片;激光共聚焦显微镜(FV1000,Olympus company Pte Ltd,日本)观察结果。
1.2.4实时荧光定量PCR 参考GenBank和以往文献设计P-gp引物(Abcb1a),序列为:5′-TTG AAG AAA GCG CAC GTC TTT GGG-3′(上游引物),5′-TTC GCG TAG TCA GGA GCG AAT GAA-3′(下游引物);β-actin作为内参,引物序列为:5′-TTG CTG ACA GGA TGC AGA AGG AGA-3′(上游引物),5′- ACT CCT GCT TGC TGA TCC ACA TCT -3′(下游引物)。迅速分离各组大鼠右侧皮质及纹状体,速冻后于-80 ℃保存。采用Trizol法提取总RNA,根据逆转录试剂盒说明(Takara.Cat.#RR047Q)进行逆转录反应,得到互补DNA(cDNA),再进行二Realtime PCR反应,反应体系为:SYBR绿色染料10 μL,cDNA 5 μL,上下游引物各1 μL,dNTP 1 μL,Taq酶2 μL,ddH2O 30 μL,总体积50 μL。反应条件:95 ℃预变性10 min;95 ℃、15 s,60 ℃、1 min,60 ℃、15 s,40个循环。用2-ΔΔCt法分析P-gp在脑缺血再灌注后各个时间点不同部位的相对量。

2 结 果
2.1大鼠MCAO再灌注模型复制 各组大鼠MCAO再灌注后,观察到得分介于1~4分,均为有效模型。取MCAO再灌注1 d后大鼠脑组织进行TTC染色,结果显示红色区域为非梗死部位,白色区域为梗死灶(图1),梗死灶与大脑中动脉供血区域相吻合,通过神经功能检查及冠状切片染色证明模型复制成功。
2.2P-gp在正常脑组织和缺血脑组织的分布变化 免疫组化DAB单标染色显示,正常脑组织可见P-gp表达在微血管内皮细胞,呈棕色或棕褐色的逗点状、条索状或小管状结构(图2A),但未见其他细胞有P-gp的阳性表达。然而MCAO再灌注后却可见P-gp既表达在微血管内皮细胞上,又表达在其他细胞上(图2B)。免疫荧光双标染色结果显示,MCAO再灌注后脑组织缺血侧可见P-gp(图3A)与微血管内皮(图3B)有共表达(图3C),P-gp(图3D)与神经元(图3E)有共表达(图3F),P-gp(图3G)与星形胶质细胞的突起(图3H)有共表达(图3I)。
2.3MCAO再灌注后不同位置P-gp mRNA的表达变化 实时荧光PCR定量结果显示,MCAO再灌注后1 d皮质P-gp mRNA表达降低,但3 d表达明显增高,7 d又下降(图4),其升高和降低水平与对照组及假手术组比较,差异有统计学意义(Plt;0.05)。MCAO再灌注后1、3、7 d纹状体P-gp mRNA表达均增多,其中以1、3 d增多明显(图5),与对照组和假手术组比较,差异有统计学意义(Plt;0.05)。
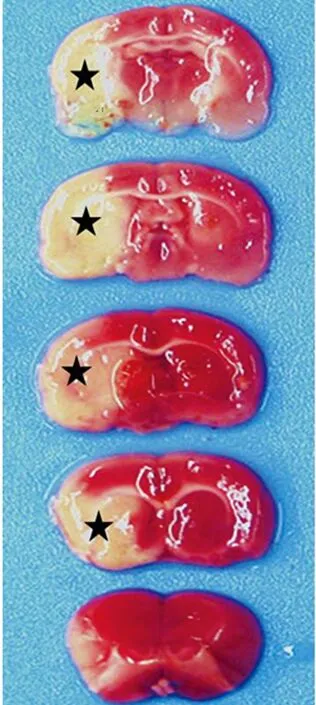
红色区域:非梗死部位;★:梗死灶
图1 MCAO再灌注模型大鼠脑组织TTC染色
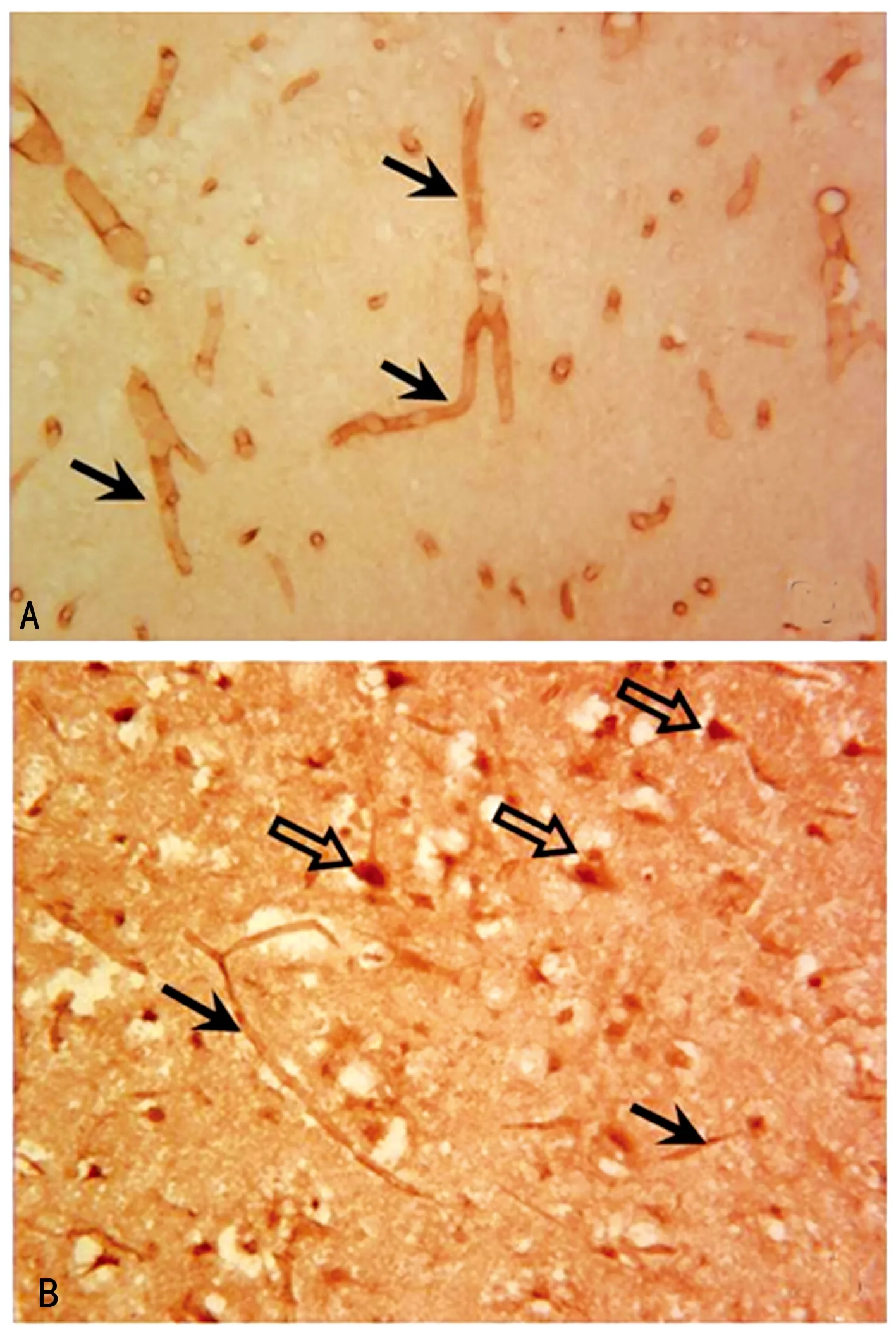
A:实心箭头为正常脑组织微血管内皮细胞的P-gp阳性表达;B:实心箭头为MCAO再灌注后的微血管内皮细胞的P-gp阳性表达,空心箭头为MCAO再灌注后的神经元或神经胶质细胞的P-gp阳性表达
图2正常大鼠及MCAO再灌注后大鼠脑组织P-gp免疫组化染色(×400)

A、D、G:红色荧光为P-gp的阳性表达;B:绿色荧光为CD31标记的微血管内皮细胞;E:绿色荧光为Neun标记的神经元;H:绿色荧光为GFAP标记的星形胶质细胞;C:箭头所示为P-gp与CD31共表达于微血管内皮细胞;F:箭头所示为P-gp与Neun共表达于神经元;I:箭头所示为P-gp与GFAP共表达于星形胶质细胞
图3免疫荧光双标检测大鼠MCAO再灌注后脑组织P-gp的表达(×400)

a:Plt;0.05,与对照组及假手术组比较
图4各组大鼠缺血侧皮质P-gp mRNA的表达
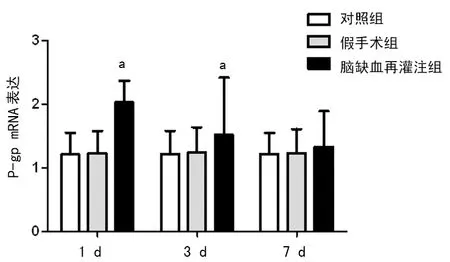
a:Plt;0.05,与对照组及假手术组比较
图5各组大鼠缺血侧纹状体P-gp mRNA的表达
3 讨 论
P-gp属于ABC结合盒蛋白家族成员之一。关于P-gp在大脑中的表达,大多数研究显示其表达于脑内微血管内皮上[5-6];但有学者在体外的研究发现,P-gp在小胶质细胞和星形胶质细胞上也存在表达[7];也有学者发现癫痫状态下,P-gp在神经元、星形胶质细胞及小胶质细胞中均出现过表达的现象[8];但也有学者未观察到神经元表达P-gp[9]。本研究结果提示正常脑组织P-gp仅表达在微血管内皮上,但脑缺血后,除微血管内皮外,部分神经元及星形胶质细胞的突起也能表达P-gp,与Aronica等[8]的研究结果相似。
本研究发现缺血后微血管内皮的P-gp表达升高,缺血3 d时P-gp表达达到高峰,且缺血侧P-gp的表达高于对侧,推测其增高的原因可能和脑缺血后缺血对侧血流下降有关。有研究发现急性脑缺血时缺血对侧镜像区有细胞凋亡的现象[10];而应用SPECT、PET、Xe-CT 等对脑缺血的临床研究和动物实验中观察到缺血对侧脑血流下降的现象,并且多数认为与“神经功能联系不能”有关[11]。本研究还发现,大鼠MCAO再灌注后部分神经元可表达P-gp,这可能是脑缺血/再灌注时,神经元在局部被激活,可释放或表达肿瘤坏死因子-α(TNF-α)[12]、核转录因子κB(NF-κB)[13]、一氧化碳(NO)[14]、环氧合酶-2(Cox-2)[15]、促红细胞生成素(EPO)[16]等多种物质,而这些物质与上调P-gp的表达密切相关[17-18]。本研究还观察到MCAO再灌注后星形胶质细胞突起可表达P-gp,这可能与其返祖表达细胞表面标记物波形蛋白和巢蛋白有关,而缺血缺氧作为一种信号,激活NF-κB与核内靶基因结合,从而诱导Mdr1基因表达[13],而脑缺血后星形胶质细胞可分泌EPO[16];且EPO参与第二信使NF-кB途径,激活 NF-кB,从而诱导P-gp的表达。星形胶质细胞是中枢神经系统中的一种神经胶质细胞,对神经元起支持和绝缘作用,同时其伸出的突起是BBB的重要组成部分,脑缺血后BBB的结构和功能发生相应的变化。BBB通透性的变化反过来又影响脑缺血的病理生理过程;星形胶质细胞突起P-gp的外排作用将有利于BBB的中枢神经保护功能和毒性物质的主动清除。
此外,本文进一步研究了MCAO再灌注后不同部位P-gp mRNA的表达变化,发现MCAO再灌注后缺血侧的皮质及纹状体P-gp mRNA的表达有不同趋势,MCAO再灌注后1 d皮质P-gp mRNA表达降低,但3 d表达明显增高,7 d又下降,而MCAO再灌注后1、3、7 d纹状体P-gp mRNA表达均增多,其中以1、3 d增多明显。MCAO再灌注后缺血侧皮质及纹状体P-gp mRNA均在3 d时出现表达高峰,可能和脑缺血后炎症反应有关。有学者对缺血90 min再灌注模型的研究中发现在缺血3 d时缺血面积趋于稳定,此时各项炎症反应也最严重,诸多炎性因子可通过不同途径诱导P-gp的表达,使P-gp在脑内的表达到达高峰。
MCAO再灌注后部分神经元、星形胶质细胞的突起和微血管内皮细胞均表达P-gp,借助P-gp的外排泵作用将脑内的炎性介质及毒性物质排出脑外,其意义可能是脑组织的自我保护机制之一。然而,P-gp mRNA在MCAO再灌注后1 d及7 d在缺血侧皮质及纹状体的表达变化规律不同,可能与两者血管的分布数量、内皮细胞、神经元及星形胶质细胞对脑缺血后的炎症反应的敏感性不同有关,其原因有待进一步探索。
[1]朱贤富,王振华.脑缺血/再灌注损伤机制的研究现状[J].医学综述,2010,16(18):2786-2789.
[2]Aronica E,Sisodiya SM,Gorter JA.Cerebral expression of drug transporters in epilepsy[J] Adv Drug Deliv Rev,2011,11(3):229-237.
[3]Rapposelli S,Digiacomo M,Balsamo A.P-gp transporter and its role in neurodegenerative diseases[J].Curr Top Med Chem 2009,9(5):209-217.
[4]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery:occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[5]Cen J,Liu L,Li MS,et al.Aheration in P-glycoprotein at the blood-brain barrier in the early period of MCAO in rats[J].J Pharm Pharmacol,2013,65(5):665-672.
[6]杨力,闰航,杨蕾,等.P-糖蛋白在永久性脑缺血大鼠脑内的表达[J].神经解剖学杂志,2013,29(3):228-232.
[7]Kumar A,Tripathi D,Paliwal VK,et al.Role of P-glyco-protein in refractoriness of seizures to antiepileptic drugs in lennox-gastaut syndrome[J].J Child Neurol,2015,30(2) :223-227.
[8]Aronica E,Sisodiya SM,Gorter JA.Cerebral expression of drug transporters in epilepsy[J].Adv Deliv Rev,2012,64(10) :919-929.
[9]Spudich A,Kilic E,Xing HY,et al.Inhibition of multidrug resistance transporter-1 facilitates neuroprotective therapies afterfocal cerebral ischemia[J].Nat Neurosci,2006,9(4):487-488.
[10]陈唯唯,漆剑频,吴静等.急性脑缺血时缺血对侧血流动力学动态变化的实验研究[J].放射学实践,2006,11(21):95-97.
[11]Rubin G,Levy EI,Scarrow AM,et al.Remote effects of acute ischemic stroke:A xenon CT cerebral blood flow study[J].Cerebrovasc Dis,2000,10(3):221-228.
[12]王玉梅,商亚珍.血管性痴呆的研究进展[J].承德医学院学报,2011,28(3):320-322.
[13]何娟,刘晓磊,彭文兴.P-糖蛋白介导的肿瘤多药耐药逆转机制研究进展[J].中国药房,2006,17(3):218-220.
[14]李红丽,孙榆.免疫荧光染色与组织化学双标技术的应用评价[J].免疫学杂志,2002,1(18):230-232.
[15]梁文杰,单保恩.中药拮抗P2GP介导的肿瘤细胞MDR机制的研究进展[J].中草药,2004,34(4):466-469.
[16]原相丽,刘珂,毛兴爱,等.促红细胞生成素对大鼠局灶性脑缺血再灌注神经元的保护作用及P53蛋白的表达[J].现代生物医学进展,2008,8(5):828-831.
[17]Bauer B,Hartz AM,Miller DS.Tumor necrosis factor alpha and endothelin-1 increase P-glycoprotein expression and transport activity at the blood- brain barrier[J].Mol Pharmacol,2007,71(3):667-675.
[18]Poller B,Drewe J,Krähenbühl S,et al.Regulation of BCRP(ABCG2) and P-glycoprotein(ABCB1) by cytokines in a model of the human blood-brain barrier[J].Cell Mol Neurobiol,2010,30(1):63-70.
ChangesofexpressionofP-glycoproteinaftercerebralischemiareperfusioninrats*
ZhaoMin1,WangXiaojuan1,ChengBo2,Lijie1,YuJianyun3,GuoZeyun1△,YangLi1▲
(1.DepartmentofAnatomyandHistology/Embryology,BasicMedicalCollege;2.ScientificResearchCenter;3.HigherEducationResearchInstitute,KunmingMedicalUniversity,Kunming,Yunnan650500,China)
ObjectiveTo observe the changes of the expression of P-glycoprotein(P-gp) after 90 min focal cerebral ischemia reperfusion in rats.MethodsThe model of focal cerebral ischemia induced by blocking middle cerebral artery was made by using an intraluminal filament technique.A total of 26 adult SD male rats was used for experiment.One of them was applied for the 2,3,5-triphenyl tetrazolium chloride(TTC) staining to detect whether the focal cerebral ischemia model was successfully made,and the remaining rats were randomly divided into control group(n=5),sham operation group(n=5),and cerebral ischemia reperfusion for 1,3,7 d group(n=5).The immunohistochemistry single staining was used to observe the changes of P-gp in the normal and repefued ischemial brain tissue.The immunofluorescence double staining was used to observe the expression of P-gp in the normal and repefued ischemial brain tissue with Mdr-1 antibody,Neun antibody(marker of the neuron),GFAP antibody(marker of the astrocytes),and CD31 antibody(marker of capillary endothelium).Meanwhile the changes of P-gp in ischemic cerebral cortex and striatum capillary were analyzed by using real-time quantitative PCR technique.ResultsIn control group,P-gp was only located in cerebral microvascular endothelial cells,while in cerebral ischemia reperfusion group,it also could be detected in some neurons and astrocytes.After cerebral ischemia reperfusion,the mRNA expression of P-gp in cerebral cortex was decreased on day 1,significantly increased on day 3,and then decreased on day 7.There was significantly statistical difference of the mRNA expression of P-gp cortex in cerebral ischemia reperfusion for 1,3,7 d group compared with control group and sham group(Plt;0.05).After cerebral ischemia reperfusion,the mRNA expression of P-gp in cerebral striatum was increased on day 1,day 3 and day 7,especially on day 1 and day 7,and the difference in cerebral ischemia reperfusion group was statistically significant compared with the other two groups(Plt;0.05).ConclusionP-gp can only be expressed in cerebral microvascular endothelial cells in normal rats,while it can also be expressed in neurons and astrocytes in rats after the brain′s subjection to ischemia reperfusion,and it showed different tendencies between cortex and striatum,which may be regarded as one of the self-protection mechanisms in brain tissue.
P-glycoprotein;brain ischemia;reperfusion;ABC binding cassette protein
10.3969/j.issn.1671-8348.2017.32.003
国家自然科学基金资助项目(81060101);云南省应用基础研究计划项目(2013FZ056);昆明医科大学青年教师培养特殊支持计划项目(J1301306612)。
赵敏(1982-),讲师,硕士,主要从事基础医学教学和神经病理损伤研究工作。△
,E-mail:guozeyun1@163.com。▲共同通信作者,E-mail:yanglikm@163.com。
R743.31
A
1671-8348(2017)32-4473-04
2017-04-13
2017-07-18)
