乙酰水杨酸姜黄素酯对血管紧张素II诱导的血管平滑肌细胞增殖的影响及相关机制
2017-12-05孙四玉杨冬梅夏伯候庹勤慧
孙四玉,杨冬梅,戴 娜,夏伯候,庹勤慧*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.湖南中医药大学医学院,湖南 长沙 410208)
乙酰水杨酸姜黄素酯对血管紧张素II诱导的血管平滑肌细胞增殖的影响及相关机制
孙四玉1,杨冬梅1,戴 娜2,夏伯候1,庹勤慧2*
(1.湖南中医药大学药学院,湖南 长沙 410208;2.湖南中医药大学医学院,湖南 长沙 410208)
目的探讨乙酰水杨酸姜黄素酯(curcumin acetylsalicylate,CA)对血管紧张素II(Angiotensin II,AngII)诱导的血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖的抑制作用及其相关机制。方法建立AngII诱导的VSMC增殖模型。采用MTT法、流式细胞术观察CA干预对细胞活力和周期的影响。Western blot检测其对第10号染色体同源缺失性磷酸酶张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)、磷酸化 AKT(p-AKT)、AKT 蛋白表达的影响。结果1、3、10 μmol/L CA可以显著抑制AngII诱导的细胞活力,其中3 μmol/L为最佳浓度(P<0.05)。在CA的干预下,与AngII组比较,流式细胞术显示VSMC G0/G1期细胞数量明显增加,S期明显减少;Western blot显示其可以促进PTEN蛋白表达,从而抑制AKT激活(P<0.05)。结论 CA可以抑制AngII诱导的VSMC增殖,其机制与阻滞VSMC G0/G1期向S期转化,以及调节PTEN/AKT信号通路有关。
乙酰水杨酸姜黄素酯;血管紧张素II;血管平滑肌细胞增殖;PTEN;AKT
经皮冠状动脉介入治疗(PCI)是治疗心血管疾病的主要方法之一,但术后6个月内膜增生发生率却高达30%~50%,给临床带来新的难题。血管平滑肌细胞(vascular smooth muscle cells,VSMC)异常增殖与迁移是内膜增生的特征之一[1]。第10号染色体同源缺失性磷酸酶张力蛋白 (phosphatase and tensin homolog deleted on chromosome ten,PTEN)可以抑制VSMC的增殖与迁移,还可以抑制血管损伤后的内膜增生,主要通过介导磷脂酰肌醇3-激酶(PI3K)/蛋白激酶 B(AKT)信号通路实现其功能[2]。
乙酰水杨酸姜黄素酯 (curcumin acetylsalicylate,CA)是乙酰水杨酸和姜黄素的酯化衍生物,目前动物实验已经证实其可以通过抑制核转录因子(NF-KB)信号通路而抑制高脂喂养的APOE鼠的动脉粥样硬化的形成[3],但其作用机制需要进一步探讨。本研究拟通过AngII刺激的VSMC增殖模型[4],观察CA对体外培养VSMC活力的影响,并探讨其机制是否与PTEN有关。
1 材料
1.1 细胞与药物
大鼠胸主动脉血管平滑肌细胞株(VSMC)购自中南大学湘雅细胞库,乙酰水杨酸姜黄素酯由湖南中医药大学药学院提供 (质量分数>98%),溶于DMSO 中(终浓度小于 0.1%)。
1.2 试剂与仪器
胎牛血清(FBS)来自PAN公司;培养基DMEM、0.25%Trypsin-EDTA、磷酸盐缓冲液(PBS)来自 Hyclone公司,兔单克隆抗体PTEN,兔单克隆抗体p-AKT、兔单克隆抗体AKT均来自Cell signaling公司;兔多克隆抗体Beta Actin来自proteintech公司;Ang II溶于 PBS 中,0.22 μm 膜滤过,-20 ℃保存。其他试剂购自于Sigma公司。LX800酶联免疫仪(美国伯腾仪器有限公司);流式细胞分析仪(BD公司);凝胶成像分析系统(美国Alpha Innotech公司)。
2 方法
2.1 细胞培养
VSMC用含10%FBS的高糖培养基(DMEM)于37℃,5%CO2,饱和湿度的培养箱中培养。细胞培养至80%~90%进行传代操作。所有实验选择对数期细胞。
2.2 细胞分组
为检测CA对细胞活力的影响,实验分组为:对照组, 1 μmol/L AngII组, 含 1 μmol/L AngII的不同浓度 CA 药物处理组(0.1,0.3,1,3,10 μmol/L),含1 μmol/L AngII的姜黄素(10 μmol/L)组。确定最佳浓度后,后续实验将细胞分为:(1)对照组;(2)1 μmol/L AngII组;(3)3 μmol/L CA+1 μmol/L AngII组;(4)3 μmol/L CA 组。
2.3 MTT法检测细胞活力实验
细胞以5 000/孔接种于96孔板,待细胞融合度达到60%~80%时,1%FBS同步化处理24 h后,加入不同处理因素孵育24 h(药物组提前加入不含AngII的不同浓度药物孵育2 h)。加入0.5 mg/mL 100 μL MTT 孵育 4 h,弃上清,150 μL DMSO 溶解紫色结晶沉淀,450 nm波长处测OD值。
细胞活力=实验组OD值/对照组OD值×100%。
2.4 流式细胞术检测细胞周期
VSMC细胞以4×105接种于60 mm皿中,待细胞融合度达到60%~80%时,1%FBS同步化24 h。然后用1 μmol/L AngII和含AngII的CA分别孵育24 h,收集细胞。PBS洗涤1~3次,用80%乙醇-20℃固定 24 h。离心弃乙醇,PBS洗涤 1次,50 ng/mL PI(含 200 g/mL RNase A)37 ℃避光染色30 min,染色细胞用流式细胞仪分析周期变化。
2.5 Western blot
取各组实验处理后细胞,用预冷的PBS洗3次,加入RIPA裂解液和PMSF的混合液100 μL(比例为100∶1)置于冰上裂解30 min,用细胞刮刮下蛋白,4℃,12 000 r/min离心15 min,收集上清。BCA蛋白定量的方法测量蛋白浓度。每个样取30 μg并加入5×SDS凝胶上样缓冲液,100℃煮沸5 min,使其变性。配制8%聚丙烯酰胺凝胶,进行电泳分离(浓缩胶 80 V, 分离胶 120 V),0.22 μm PVDF 膜 300 mA湿转70 min,5%脱脂牛奶慢摇封闭1h,加入一抗PTEN(1∶1 000),p-AKT(1∶2 000),AKT(1∶1 000),β-actin(1∶3 000),4℃孵育过夜,TBST洗5次,每次5 min,按1∶5 000的比例加入稀释的辣根过氧化物酶标记的山羊抗兔二抗室温孵育1 h,然后用TBST洗膜5次,每次5 min,用化学发光显影法进行显影,AlphaImager 2200分析光密度值。
2.6 统计学方法
3 结果
3.1 MTT检测CA对AngII诱导的VSMC活力影响
如图1所示,与对照组相比,1 μmol/L AngII刺激24 h后可以显著增强VSMC的活力,说明模型组构建成功 (P<0.05)。 经不同浓度 CA干预后,VSMC 活力逐渐下降,1、3、10 μmol/L CA 具有统计学意义,其中CA浓度为3 μmol/L时抑制效果最明显,故选择 3 μmol/L 作为后续实验浓度(P<0.05)。

图 1 CA对 AngII诱导的 VSMC活力影响 (n=5,±s)
3.2 流式细胞术检测CA对AngII诱导的VSMC周期影响
如表1所示,与对照组相比,AngII组S期细胞比例明显增加(P<0.05)。 而在 CA 的干预下,G0/G1期细胞比例明显增加 (P<0.05),S期细胞比例减少(P<0.05)。结果表明 CA 抑制 AngII诱导的 VSMC 增殖,主要通过阻滞G0/G1期向S期转化实现。
表1 CA对AngII诱导的VSMC增殖的周期影响 (n=3,±s)

表1 CA对AngII诱导的VSMC增殖的周期影响 (n=3,±s)
注:与对照组比较,*P<0.05;与 AngII组比较,**P<0.05。
组别 G0/G1期(%) S期(%) G2/M期(%)对照组 76.48±1.92 5.52±0.06 18.00±1.94 AngII组 69.24±7.90* 12.40±4.60* 18.82±3.39 CA+AngII组 78.91±1.11** 5.32±0.99** 15.23±1.24 CA 组 77.29±3.10 4.88±1.22 17.82±2.03
3.3 CA对AngII诱导的 VSMC的PTEN, p-AKT,AKT蛋白的影响
如图2所示,与对照组相比,AngII组PTEN蛋白表达呈下降趋势 (P<0.05); 与模型组相比,CA+AngII组PTEN蛋白表达显著上升(P<0.05)。如图3所示,与对照组相比,AngII组p-AKT蛋白含量显著上升 (P<0.05); 与模型组比较,CA+AngII组 p-AKT蛋白含量下降(P<0.05)。

图2 CA对AngII诱导的VSMC的PTEN蛋白的影响 (n=3,±s)
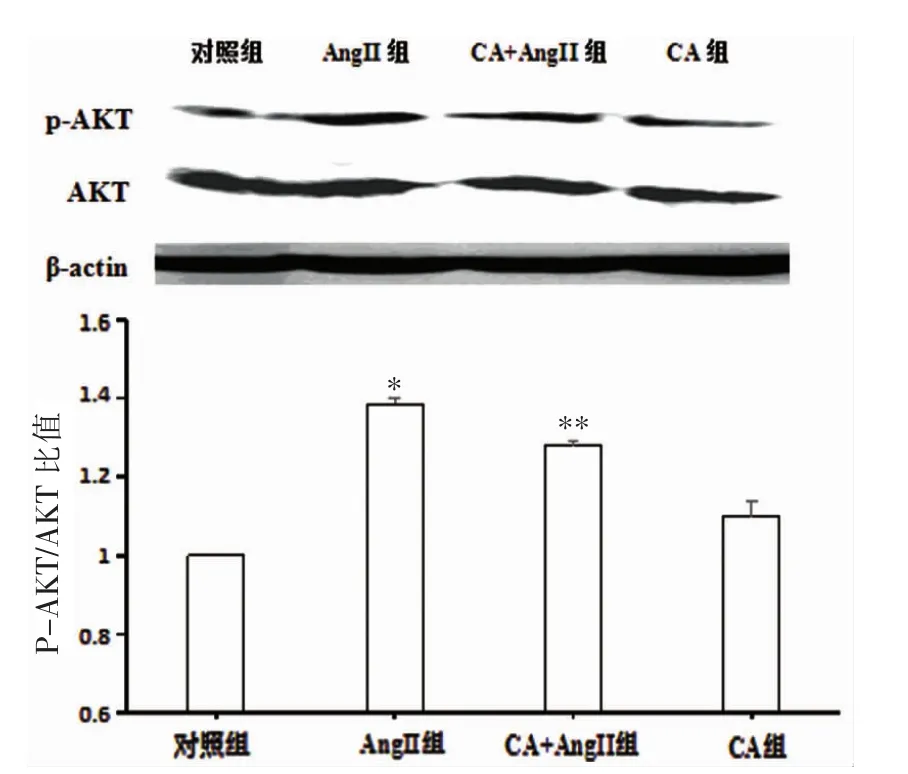
图3 CA对AngII诱导的VSMC的p-AKT/AKT比值的影响 (n=3,±s)
4 讨论
支架内血管再狭窄是PCI术后的主要并发症,VSMC过度增殖,迁移至内膜是其发生的主要原因之一。目前研究发现,将抗血栓药物和抗增殖药物包被于支架内可以明显降低血管再狭窄的发生率。因此,寻找特异性抗VSMC增殖药物是治疗血管再狭窄的方法之一[5]。姜黄素作为传统中药姜黄的主要成分,已经被证实具有调脂、保护血管内皮、抑制斑块形成、稳定斑块、保护心肌,抑制心肌重构、改善心功能等多重作用,但由于其生物利用度低等缺点限制了这一化合物的临床应用[6-7]。乙酰水杨酸,即阿司匹林,是应用最早,最普遍的解热镇痛抗风湿药,还具有抗血小板聚集,抗血栓等方面的药理作用,发挥药效迅速,药效稳定。有文献表明,姜黄素、阿司匹林和胡萝卜素联合应用小剂量即可抑制人胰腺癌细胞的增殖[8]。姜黄素和阿司匹林对VSMC增殖和迁移也都有抑制作用[9-11]。目前,为了改变姜黄素在应用中的吸收缺陷问题及提高药物疗效,国内外研究者对姜黄素进行酯化改善,发现其酯化物抗氧化、抗菌、抗肿瘤等效果明显优于姜黄素[12]。为了改善姜黄素的生物利用度和加强疗效,我们将姜黄素和乙酰水杨酸酯化得到CA,期望得到具有抗炎、抗血栓以及高效抑制VSMC增殖能力的药物。本研究结果显示1 μmol/L AngII能显著增强VSMC活力,说明模型组构建成功。3 μmol/L CA可以显著抑制AngII诱导的VSMC活力。进一步流式细胞术检测周期发现,CA主要通过阻滞细胞由G0/G1期向S期转换,从而抑制AngII诱导的VSMC增殖。
PTEN是至今发现的第一个具有双重磷酸酶活性的抑癌基因,其对细胞的增殖、迁移、分化、黏附、凋亡等多种生物学行为有重要影响。最近实验结果表明,PTEN可以抑制AngII和PDGF诱导的VSMC的增殖与迁移,还可以抑制血管损伤后的内膜增生,主要通过介导PI3K/AKT信号通路实现其功能[2,13]。因此,PTEN是影响VSMC增殖的重要靶点之一。本研究结果显示,CA可能通过增加PTEN的表达,从而抑制AKT的激活,拮抗AngII诱导的VSMC增殖。
综上所述,CA抑制Ang-II诱导的VSMC细胞增殖,其可能与上调PTEN蛋白表达,降低AKT活性有关,为CA应用于动脉粥样硬化和血管狭窄等疾病的防治提供了一定的实验依据。同时也说明姜黄素酯化衍生物有很大的发展空间,为姜黄素酯化衍物的临床应用研究提供了一些科学依据。
[1]梁刚柱,张福先,罗小云,等.单用硫酸氯吡格雷及联合华法林预防股胭动脉经皮腔内血管成形术后再狭窄的随机对照研究[J].中华外科杂志,2012,50(8):704-708.
[2]Sedding DG,Widmerteske R,Mueller A,et al.Role of the Phosphatase PTEN in Early Vascular Remodeling[J].Plos One,2013,8(3):e55445.
[3]龚勇珍,孙少卫,杨慧仙,等.小凹蛋白1-NFκB通路介导乙酰水杨酸姜黄素酯的抗动脉粥样硬化作用[J].中国现代医学杂志,2015,25(9):21-26.
[4]Xu C,Chen J,Zhang J,et al.Naringenin inhibits angiotensin II-induced vascular smooth muscle cells proliferation and migration and decreasesneointimalhyperplasia in balloon injured rat carotid arteries through suppressing oxidative stress[J].Biological&Pharmaceutical Bulletin,2013,36(10):1549-1555.
[5]Tang R,Chen S.Smooth muscle-specific drug targets for next generation Drug-eluting stent[J].Expert Review of Cardiovascular Therapy,2014,12(1):21-23.
[6]Jiang S,Han J,Li T,et al.Curcumin as a potential protective compound against cardiac diseases[J].Pharmacological Research,2017,119:373-383.
[7]周 曙,田 芳,金海蓉,等.姜黄素调节Bcl-2,Bax蛋白表达诱导增生性瘢痕成纤维细胞凋亡国[J].湖南中医药大学学报,2015,35(4):6-9.
[8]Thakkar A,Sutaria D,Grandhi BK,et al.The molecular mechanism of action of aspirin,curcumin and sulforaphane combinations in the chemoprevention of pancreatic cancer[J].Oncology reports,2013,29(4):1671-1677.
[9]Qin L,Yang YB,Tuo QH,etal.Effectsand underlying mechanisms of curcumin on the proliferation of vascular smooth muscle cells induced by Chol:MbetaCD.[J].Biochemical&Biophysical Research Communications,2009,379(2):277-282.
[10]Xin G,Yu L,Min C,et al.miR-145 mediated the role of aspirin in resisting VSMCs proliferation and anti-inflammation through CD40[J].Journal of Translational Medicine,2016,14(1):1-10.
[11]Mottola G,Chatterjee A,Wu B,et al.Aspirin-triggered resolvin D1 attenuates PDGF-induced vascular smooth muscle cell migration via the cyclic adenosine monophosphate/protein kinase A(cAMP/PKA)pathway[J].Plos One,2017,12(3):e0174936.
[12]王丽华,彭永练,姜玉才.姜黄素化合物酯缩合前药及活性研究进展[J].海峡药学,2015,27(6):3-8.
[13]Dong X,Yu LG,Sun R,et al.Inhibition of PTEN expression and activity by angiotensin II induces proliferation and migration of vascular smooth muscle cells[J].Journal of Cellular Biochemistry,2013,114(1):174-182.
(本文编辑 苏 维)
Effect and Mechanism of Curcumin Acetylsalicylate on Angiotensin II Induced Proliferation in Vascular Smooth Muscle Cells
SUN Siyu1,YANG Dongmei1,DAI Na2,XIA Bohou1,TUO Qinhui2*
(1.School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.Medical School,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo investigate the effect and mechanism of curcumin acetylsalicylate (CA)on Angiotensin II(AngII)induced proliferation in vascular smooth muscle cells(VSMC).MethodsVSMC proliferation model was induced by AngII.Flow cytometry was used to observe the effect of CA on cell proliferation and cycle.The expressions of PTEN,p-AKT and AKT was detected by Western blot.Results1,3,10 μmol/L CA led to a significant inhibition of Ang II-induced proliferation of VSMCs and 3 μmol/L CA was proved to be an optimal inhibitory concentration (P <0.05).Flow cytometry showed that the number of cells in G0/G1 phase increased significantly and the number of S phase decreased significantly by the intervention of CA.Western blot showed that it could promote the expression of PTEN protein and inhibit the activation of AKT (P<0.05).ConclusionCA can obviously inhibit the VSMC proliferation induced by AngII,and its mechanism is related to the inhibition of transformation from G0/G1 phase to S phase and the regulation of PTEN/Akt signaling pathway.
curcumin acetylsalicylate;angiotensin II;vascular smooth muscle cells proliferation;PTEN;AKT
R285.5
A
10.3969/j.issn.1674-070X.2017.11.013
本文引用:孙四玉,杨冬梅,戴 娜,夏伯候,庹勤慧.乙酰水杨酸姜黄素酯对血管紧张素Ⅱ诱导的血管平滑肌细胞增殖的影响及相关机制[J].湖南中医药大学学报,2017,37(11):1222-1225.
2017-05-25
国家自然科学基金项目(81673722);湖南省杰出青年基金(14JJ1024);省自然科学基金(2015JJ2117);湖南省教育厅重点项目(16A156)。
孙四玉,女,在读硕士研究生,研究方向:心血管药理。
*庹勤慧,女,教授,博士研究生导师,E-mail:qhtuo@aliyun.com。
