聚合酶链反应诊断细菌和真菌性中枢神经系统感染的临床价值
2017-12-02曹敬荣高世超王培昌
陈 静, 曹敬荣, 高世超,闵 嵘, 王培昌
聚合酶链反应诊断细菌和真菌性中枢神经系统感染的临床价值
陈 静1,2, 曹敬荣1, 高世超1,闵 嵘1, 王培昌1
目的探讨聚合酶链反应(PCR)在细菌和真菌性中枢神经系统感染快速诊断中的临床价值。方法收集137例中枢神经系统感染患者留存的脑脊液进行DNA提取,采用细菌和真菌通用引物扩增病原体DNA并进行序列测定,对比同期脑脊液培养方法与PCR方法的检测结果。结果137份脑脊液标本中PCR检测到细菌50株,真菌6株,脑脊液培养检测到细菌38株,真菌5株;PCR检测法灵敏度为40.9%,特异度为100%,阳性预测值为100%,阴性预测值为38.2%,诊断效率为56.7%;传统培养法则分别为31.4%、100%、100%、34.7%、44.4%。PCR的灵敏度、阴性预测值和诊断效率均明显优于传统培养方法,特异度和阳性预测值与培养法相当,两方法鉴定菌种的符合率为97.7%。结论通用引物PCR扩增法具有快速、特异、灵敏、准确等特点,对细菌和真菌性中枢神经系统感染的病原学快速诊断具有重要的应用价值。
感染,中枢神经系统; 脑脊液; 细菌; 真菌; 聚合酶链反应
中枢神经系统(CNS)感染严重威胁人类生命,致残率和病死率高,病原体种类的确定是临床诊治成功的关键。细菌和真菌是引起CNS感染的重要病原体。目前,诊断主要依赖显微镜检查和微生物培养方法。由于抗生素的使用使得脑脊液表现不典型、培养结果阴性或病原体含量少、培养耗时长等导致临床不能及时准确地获得病原学诊断信息而延误治疗。为此,我们利用细菌和真菌通用引物,PCR扩增细菌16S rDNA和真菌基因组内部转录间隔区 (internal transcribed spacer,ITS)[1-3],通过序列测定技术对脑脊液进行检测筛选,并与同期脑脊液培养方法对照,探讨PCR技术快速诊断由细菌和真菌引起的CNS感染中临床价值和意义。
1 材料与方法
1.1 材料
1.1.1标本采集 选择首都医科大学宣武医院2013年11月-2015年4月CNS感染患者137例作为试验组,其中男83例,平均年龄(51±19)岁,女54例,平均年龄(53±21)岁。患者诊断参照《神经病学》(第7版)[4]及“医院感染诊断标准(试行)”[5]中CNS感染的诊断标准,符合下列条件之一即考虑CNS感染:(1)高热、颅内高压症状(头痛、呕吐、婴儿前囟张力高、意识障碍)、脑膜刺激征(颈抵抗、布/克氏征阳性、角弓反张),并有脑脊液炎性改变(白细胞>10×106/L,葡萄糖<2.25 mmol/L,蛋白>0.45 g/L);(2)发热、颅高压症状、脑膜刺激征及脑脊液白细胞轻至中度升高或呈上升趋势,经抗菌药物治疗后症状体征消失、脑脊液恢复正常;(3)出现发热、不典型颅内高压症状体征、脑脊液白细胞轻度增多,并具有下列情况之一:①脑脊液中抗病原体特异性的IgM达诊断标准,或病程中IgG呈4倍升高,或脑脊液涂片或培养找到病原菌;②有颅脑侵袭性操作(如颅脑手术、颅内穿刺、颅内植入物)史,或颅脑外伤或腰椎穿刺史;③脑膜附近有感染灶(如头皮切口感染、颅骨骨髓炎等)或有脑脊液漏者;④新生儿血培养阳性。同时选择同期有脑脊液检查指征非CNS感染患者50例作为对照组。每例患者取脑脊液进行生化、常规和培养,并留取1~2 mL脑脊液标本置于-80 ℃超低温冰箱保存进行PCR扩增。本研究经首都医科大学宣武医院伦理委员会批准,并获得患者或家属知情同意。
1.1.2主要试剂与仪器 Pathogen Lysis Tubes(L)(QIAGEN,德国), QIAamp®UCP Pathogen Mini Kit (QIAGEN,德国),Premix Taq,DL2000 DNA Marker(大连宝生物公司)。涡旋振荡器(Vortex-Genie 2, Scientific Industries,美国),PCR仪(Veriti9902, Applied Biosystems,美国),电泳仪(北京六一DYY-7C),凝胶成像仪(U-Genius, Gene Company,英国),离心机(Eppendorf AG22331, Hamburg,德国),生物安全柜(Thermo scientific,中国),全自动微生物鉴定仪(VITEK 2-Compact,bioMerieux,法国),全自动血培养仪(BD BACTEC9120,美国)。
1.2 方法
1.2.1脑脊液培养及鉴定 无菌操作将2 mL脑脊液接种于血培养瓶中,放入BD BACTEC9120血培养仪中增菌培养。仪器提示阳性后涂片镜检,并转种血平皿及巧克力琼脂平皿或沙保弱培养基进行培养(48 h~5 d),菌落生长后选择合适的VITEK鉴定卡上机鉴定。
1.2.2脑脊液基因组DNA提取 将1.5 mL脑脊液加入Pathogen Lysis Tube中,13 400 r/min离心5 min,弃上清液,加入试剂盒配套缓冲液ATL(含试剂DX)悬浮颗粒,涡旋振荡器振荡10 min,短暂离心,吸取400 μL上清液于无菌EP管中。后续实验操作按QIAamp®UCP Pathogen Mini Kit说明书进行。获得的DNA模板(20~100 μL)置于-20℃保存。
1.2.3PCR扩增 根据文献 [2-3]合成细菌通用引物(1492R,27F)和真菌通用引物(P1,P2)。引物序列为1492R:5'-GGTTACCTTGTTACGACTT-3' 和27F:5'-AGAGTTTGATCCTGGCTCAG -3’;P1: 5'-ATCAATAAGCGGAGGAAAAG-3'和P2:5'-CTCTGGCTTC ACCCTATTC-3'。PCR反应总体积为50 μL,反应体系为:Premix Taq 25 μL,上下游引物各2 μL(浓度10 μmol/L),模板DNA10 μL,无菌双蒸水11 μL。细菌反应条件为:94 ℃预变性3 min,随后94 ℃ 45 s,60 ℃ 45 s,72 ℃ 1.2 min,35个循环,最后72 ℃延伸7 min,目的条带约1 500 bp。真菌反应条件为:94 ℃ 30 s,40 ℃ 1 min,72 ℃ 2 min,40个循环,目的条带约800 bp。PCR阴性对照以无菌双蒸水代替模板DNA,阳性对照为标准菌株大肠埃希菌ATCC25922和白念珠菌ATCC10231配制的菌悬液按上述DNA提取方法提取的DNA。PCR反应产物用1%琼脂糖凝胶电泳(电场强度5 V/cm,30 min),紫外凝胶成像仪下成像观察条带。引物合成委托英潍捷基(上海)贸易有限公司。
1.2.4PCR产物测序 将PCR扩增阳性产物交由英潍捷基(上海)贸易有限公司进行DNA测序,所测序列在GenBank上进行BLAST比对以确定菌种。
1.2.5PCR法检出限检测 将大肠埃希菌ATCC25922和白念珠菌ATCC10231定量菌液浓度分别作倍比稀释,对不同浓度的菌液提取DNA,并进行PCR扩增、琼脂糖凝胶电泳,测试PCR扩增阳性所需最低的样本含菌量(cfu/mL)。
1.2.6统计分析 应用SPSS17.0统计软件,计数资料采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细菌、真菌培养及鉴定结果
137例CNS感染患者脑脊液标本有43例细菌或真菌培养阳性。其中细菌38例,真菌5例,见表1。对照组脑脊液标本培养均为阴性。
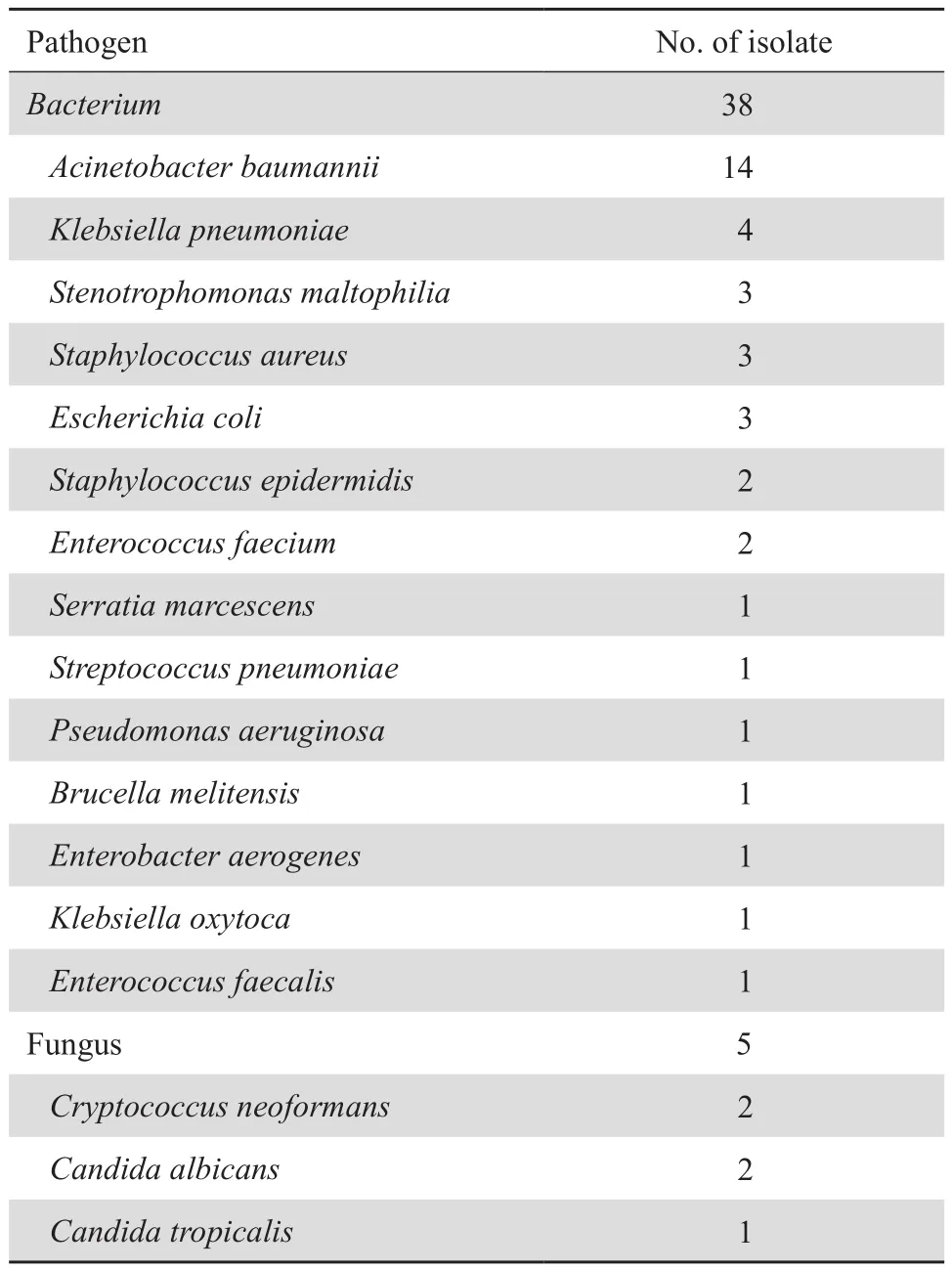
表1 脑脊液细菌、真菌培养鉴定结果Table 1 The bacterial and fungal pathogens identified from cerebrospinal fluid samples by conventional culture
2.2 PCR扩增及测序鉴定结果
137例CNS感染患者脑脊液PCR法阳性56例,其中细菌50例,真菌6例,见表2。对照组均为阴性。PCR法阳性标本测序结果经BLAST比对确定菌种。部分脑脊液标本PCR产物电泳结果见图1。
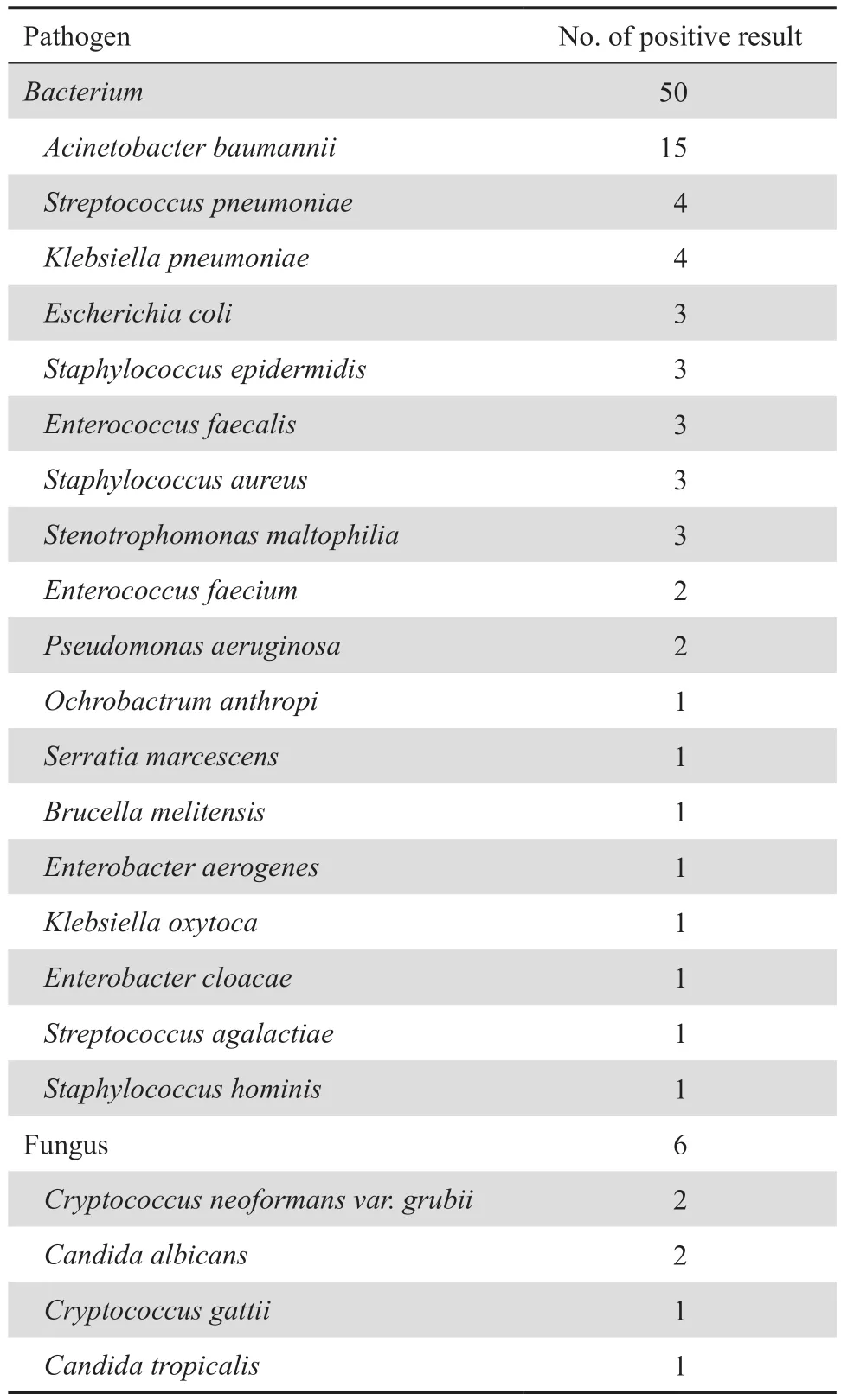
表2 脑脊液PCR扩增测序结果Table 2 The bacterial and fungal pathogens identified from cerebrospinal fluid samples by PCR amplification and sequencing analysis
2.3 PCR法与培养法检测结果比较
PCR检测法灵敏度为40.9%,特异度为100%,阳性预测值为100%,阴性预测值为38.2%,诊断效率为56.7%;培养法则分别为31.4%、100%、100%、34.7%、44.4%,PCR法的灵敏度、阴性预测值和诊断效率均明显优于培养方法,特异度和阳性预测值与培养法相当。见表3。
2.4 PCR法与培养法符合率比较
培养法阳性标本43例经仪器鉴定确定菌种,PCR法阳性标本56例测序后经BLAST确定菌种,其中42例与培养法结果一致,符合率97.7%(42/43)。1例培养菌株Vitek鉴定为新生隐球菌,但PCR测序确定结果为格特隐球菌,原因为YST鉴定板不能区分新生隐球菌和格特隐球菌。格特隐球菌部分测序结果见图2。

图1 部分标本PCR扩增产物琼脂糖凝胶电泳结果Figure 1 PCR amplification and agarose gel electrophoresis of selected samples

表3 PCR扩增与培养方法检测CNS感染标本比较Table 3 Detection of central nervous system infection by PCR amplification versus conventional culture method(n)
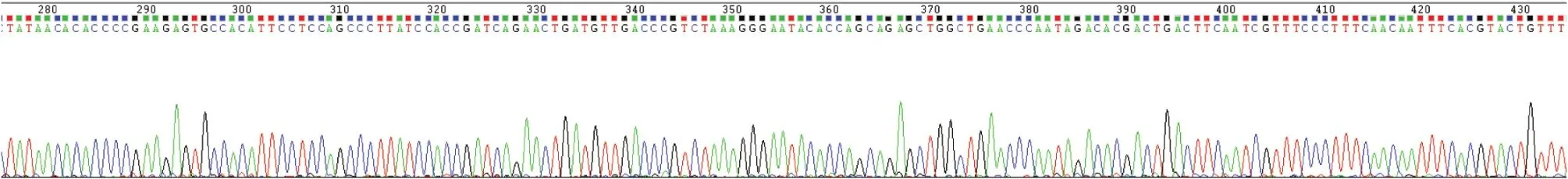
图2 格特隐球菌部分测序结果Figure 2 Partial result of sequencing analysis of Cryptococcus gattii

图3 不同浓度细菌的PCR扩增产物琼脂糖凝胶电泳结果Figure 3 PCR amplification and agarose gel electrophoresis of bacterial DNA at different concentrations
2.5 PCR法检出限确定
对不同浓度大肠埃希菌ATCC25922进行PCR检测,最低检测浓度为10 cfu/mL,白念珠菌ATCC10231最低检测浓度为102cfu/mL。不同浓度大肠埃希菌和白念珠菌PCR后的琼脂糖凝胶电泳图分别见图3、图4。
3 讨论
目前,诊断细菌和真菌性CNS感染的实验室检查主要依赖微生物培养方法,但存在周期长、病原菌检出阳性率低[6-7],从而影响了临床诊断和治疗。因此寻找快速有效的检测方法非常重要。本实验对137例CNS感染患者的脑脊液样本进行PCR检测并与同期培养法结果对照,结果显示PCR法的灵敏度、阴性预测值和诊断效率均明显优于培养方法,特异度和阳性预测值则与培养法相当。培养法阳性率低可能与以下因素有关:早期抗生素的使用使脑脊液中病原菌数量下降(约为102cfu/mL)导致直接培养常为阴性[8-9];苛养菌、生长缓慢的病原菌或厌养菌需要特殊培养条件,也可导致培养阴性结果[10-11]。而PCR技术可避免此类影响因素,使得检测阳性率较高。Rajesh等[12]研究发现,脑脊液放置2 h和4 h后培养化脓性脑膜炎的漏检率分别为52.6%和78.9%。PCR扩增技术所需标本量少,无论活菌、死菌均能检测,尤其对于苛养菌及难培养和鉴定的细菌或真菌也能准确检出,大大提高了可检测的病原体种类,在早期诊断和判断疗效方面具有显著优势。本研究中有1例培养阳性菌株鉴定为新生隐球菌,但PCR测序确定为格特隐球菌,分析其原因,为YST鉴定板不能区分新生隐球菌和格特隐球菌,这也说明PCR法在菌株的准确鉴定上有其独特的优势。
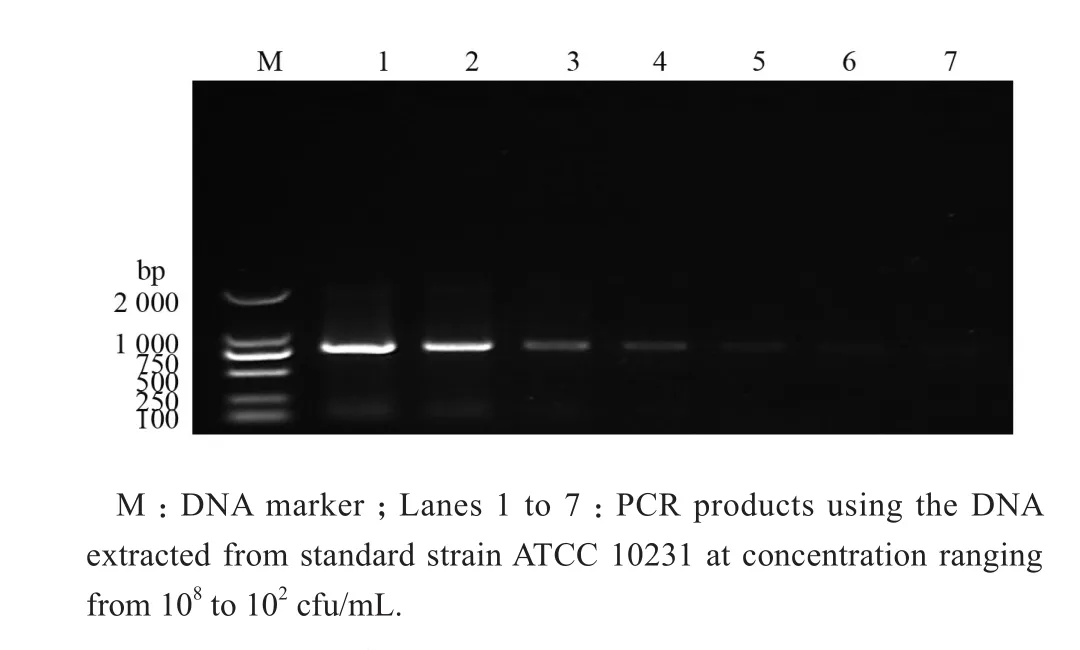
图4 不同浓度真菌的PCR扩增产物琼脂糖凝胶电泳结果Figure 4 PCR amplification and agarose gel electrophoresis of fungal DNA at different concentrations
对于PCR检测灵敏度和假阳性问题关乎整个检测过程,若在脑脊液标本的采集、DNA提取、PCR操作任何一个环节出现污染,均可导致PCR检测出现假阳性误导临床,因此PCR检测整个过程应设阴性对照[13]。脑脊液标本中病原体DNA提取量直接与PCR扩增结果相关,若不能有效提取病原体基因组DNA,则有可能导致PCR扩增阴性造成漏检[14]。针对革兰阳性菌和真菌细胞壁较厚,本实验在DNA提取过程中,加入了溶菌酶和含微小无菌玻璃珠的Pathogen Lysis Tube振荡研磨,有效破坏革兰阳性菌及真菌的细胞壁,以利于基因组DNA的提取。因PCR检测不能区分脑脊液中病原体为活菌或死菌,使用抗生素后,病原体可能死亡裂解,但PCR检测仍可为阳性,此时应结合临床予以综合判断。PCR检测平均时间远低于培养方法,本研究中PCR扩增产物需送公司测序,测序时间为24~48 h,使得总体检测平均时间为48 h,若实验室有相关测序设备,则可大大缩短PCR检测时间。本研究显示PCR最低可检测病原菌含量为10 cfu/mL(细菌)或102cfu/mL(真菌)样本中的病原体,但研究中所用菌液为无菌双蒸水配制,而脑脊液标本实际检测中可能会受细胞、离子等物质干扰,检出限可能略有差异。
综上所述,本研究结果显示,PCR检测技术相对于培养方法,具有快速、准确、灵敏等优点。在诊断细菌或真菌性CNS感染过程中,尤其怀疑病原体为苛养菌、厌氧菌、难以培养、生长缓慢的病原体或使用抗生素后的患者,可同时采用培养方法及PCR扩增方法以提高检测阳性率,为临床诊断、治疗提供病原学依据。
[1]STACKEBRANDT E, GOODFELLOW M. Nucleic acid techniques in bacterial systematics[M]. Chichester: Wiley,1991:115-175.
[2]SANDHU GS, KLINE BC, STOCKMAN L,et al. Molecular probes for diagnosis of Fungal infections[J]. J Clin Microbiol,1995, 33(11): 2913-2919.
[3]SAROOKHANI MR, AYAZI P, ALIZADEH S, et al .Comparison of 16S rDNA-PCR amplification and culture of cerebrospinal fluid for diagnosis of bacterial meningitis[J]. Iran J Pediatr,2010, 20(4):471-475.
[4]贾建平,陈生弟. 神经病学[M]. 7版. 北京:人民卫生出版社,2013.
[5]中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志,2001,81(5):314-349.
[6]SCHURMAN T, BOER R, KOOISTRA-SMID AM, et al.Prospective study of use of PCR amplification and sequencing meningitis of 16S ribosomal DNA from CSF for diagnosis of bacterial meningitis in a clinical setting[J]. J Clin Microbiol,2004, 42(2):734-740.
[7] 梁志娟,侯晓霖,王振海,等. 细菌性脑膜炎患者脑脊液细菌基因组DNA的提取及16S rDNA的鉴定[J]. 华中科技大学学报(医学版) ,2013,42(3):314-316.
[8]LALITHA G, CHRISTINA M, SCHEEL CD, et al. Detection of Fungal DNA in human body fluids and tissues during a multistate outbreak of fungal meningitis and other infections[J].Eukaryot Cell,2013, 12(5): 677-683.
[9] 闫玲,张润玲,王应芳,等.浓集脑脊液中细菌的方法学研究[J].第四军医大学学报,2008, 29(6):546-548.
[10]PANDID L, KUMAR S, KARUNASAGAR I, et al. Diagnosis of partially treated culture-negative bacterial meningitis using 16S rRNA universal primers and restriction endonuclease digestion[J]. J Med Microbiol,2005,54 (Pt 6):539-542.
[11]CORLESS CE, GUIVER M, BORROW R, et al. Simultaneous detection ofNeisseria meningitidis,Haemophilus influenzae,andStreptococcus pneumoniaein suspected cases of meningitis and septicemia using real-time PCR[J]. J Clin Microbiol,2001,39(4):1553-1558.
[12]RAJESH NT, DUTTA S, PRASAD R, et al. Effect of delay in analysis on neonatal cerebrospinal fluid prameters[J]. Arch Dis Child Fetal Neonatal Ed, 2010,95(1):25-29.
[13]SAHA DC, XESS I, BISWAS A, et al . Detection ofCryptococcusby conventional, serological and molecular methods[J]. J Med Microbiol,2009, 58(Pt 8):1098-1105.
[14]DELBUE S, TREMOLADA S, FERRANTE P. Application of molecular tools for the diagnosis of central nervous system infections[J]. Neurol Sci,2008, 29 (S2):s283-s285.
Clinical value of polymerase chain reaction in diagnosis of bacterial and fungal infection of central nervous system
CHEN Jing, CAO Jingrong, GAO Shichao, MIN Rong, WANG Peichang.
(Department of Clinical Laboratory,Xuanwu Hospital of Capital Medicine University, Beijin100053, China)
ObjectiveTo examine the clinical value of polymerase chain reaction (PCR) in rapid diagnosis of bacterial and fungal infection of central nervous system.MethodsThe cerebrospinal fluid (CSF) samples were collected from 137 patients for DNA extraction. PCR was used to amplify the DNA of pathogenic bacteria and fungi using universal primers. The PCR products were subjected to DNA sequencing analysis for identifying microbial species. The conventional culture of pathogens was carried out simultaneously as control.ResultsPCR revealed bacterial pathogen in 50 of the 137 CSF samples, fungal pathogen in 6 of the 137 CSF samples. Conventional culture of CSF reported positive bacterial infection in 38 cases, fungal infection in 5 cases. PCR provided diagnostic sensitivity of 40.9%, specificity 100%, positive predictive value 100%, negative predictive value 38.2%. The diagnostic efficiency was 56.7%. In contrast, the conventional culture achieved the results of 31.4%, 100%, 100%, 34.7%, 44.4%, respectively.The sensitivity, negative predictive value, and diagnostic efficiency of PCR were significantly better than conventional culture method. The coincidence rate between PCR and conventional culture was 97.7%. Conclusions Universal primer-based PCR is characteristic of short turnaround time, specificity, sensitivity and accuracy, which is very useful for rapid diagnosis of the pathogenic bacteria and fungi in central nervous system infections.
infection, central nervous system; cerebrospinal fluid; bacterium; fungus; polymerase chain reaction
R741
A
1009-7708 ( 2017 ) 06-0637-06
10.16718/j.1009-7708.2017.06.005
首都临床特色重点专项课题(Z141107002514012)。
1.首都医科大学宣武医院检验科,北京 100053; 2. 江西卫生职业学院检验系。
陈静(1979—)女,硕士,副主任检验技师,主要从事微生物检验及细菌耐药机制研究。
王培昌,E-mail:pcw1905@126.com。
2017-02-27 修回日期:2017-06-08
