海马和mPFC参与联合运动学习的调节及其机制研究进展
2017-12-01吴广延隋建峰中国人民解放军第4医院精神卫生中心重庆40004济南军区第89中心医院神经外科第三军医大学基础医学部基础医学教学实验中心共同第一作者通讯作者mailaaa07com
陆 地,王 晓,姚 娟,吴广延,李 轩,隋建峰,吴 冰(中国人民解放军第4医院精神卫生中心,重庆 40004;济南军区第89中心医院神经外科;第三军医大学基础医学部基础医学教学实验中心;共同第一作者;通讯作者,E-mail:aaa07@6.com)
中图分类号: R338 文献标志码: A 文章编号: 1007-6611(2017)11-1198-04 DOI:10.13753/j.issn.1007-6611.2017.11.024
海马和mPFC参与联合运动学习的调节及其机制研究进展
陆 地1*,王 晓2#,姚 娟3,吴广延3,李 轩3,隋建峰3,吴 冰3*(1中国人民解放军第324医院精神卫生中心,重庆 400041;2济南军区第89中心医院神经外科;3第三军医大学基础医学部基础医学教学实验中心;#共同第一作者;*通讯作者,E-mail:aaa3027@163.com)
中图分类号: R338文献标志码: A文章编号: 1007-6611(2017)11-1198-04DOI:10.13753/j.issn.1007-6611.2017.11.024
联合运动学习是个体为适应环境通过联合学习而获得的条件化运动行为。联合学习需要两个刺激事件以一定的时间关系重复发生,并最终导致刺激在脑内形成关联[1-4]。联合运动学习对于个体的自我防御、生存进化具有重要意义,但目前对其调节的回路机制知之甚少。由于神经回路的异常是许多神经及心理疾病重要的发病基础,探讨联合运动学习及其调节的回路机制不仅有助于理解特定行为的脑机制,对于研究运动调节和运动障碍性疾病的病理生理机制也具有十分重要的意义。瞬目条件反射(eyeblink conditioning,EBC)作为一种简单的联合运动学习,其基本的中枢回路机制近年来已得到充分阐明,但目前其调节机制仍不明确,本综述回顾了近年来在EBC调节相关领域的研究进展。
1 海马和前额叶参与联合运动学习的调节
与联合学习的分类一致,联合运动学习也可分为两类基本形式:延迟型及痕迹型(见图1)。在延迟型,两个刺激事件在时间上有部分重叠从而导致两者在脑内易于建立关联;而在痕迹型,两个刺激事件在时间上完全分离从而增加了两者在脑内建立关联的难度。长期以来,多个研究领域以简单的联合运动学习条件化瞬目行为为模型,在神经回路、细胞,甚至分子水平上进行了大量卓越的研究工作,深入探讨了EBC联合运动学习的神经回路机制及其调节,取得了许多重要进展[2,4-9]。已经明确的是,延迟型EBC联合运动学习主要依赖于以小脑为中心的基本回路(介导回路),小脑平行纤维——蒲氏细胞突触的LTD是联合运动学习的细胞基础[8-10]。而对于痕迹型EBC,除了依赖基本回路外尚依赖于由大量皮层或皮层下结构广泛参与组成的调节回路,特别是海马以及内侧前额叶(medial prefrontal cortex,mPFC)参与其中[1,5,10-14]。
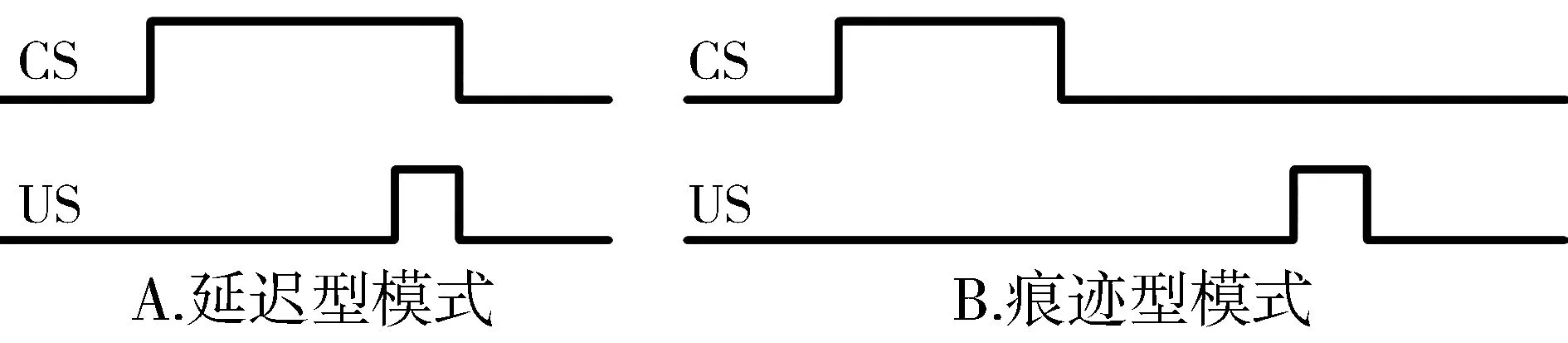
CS:条件刺激;US:非条件刺激图1 两类联合运动学习的训练模式
关于海马和mPFC对联合运动学习的调节作用,长期的基础以及临床研究采用包括药理学失活或毁损[15,16]、细胞电活动记录[1,17,18]、转基因动物[19,20]、PET功能成像[21]、双光子钙成像[22]等方法做了大量工作,实验结果强烈提示海马和mPFC参与对于痕迹型EBC联合运动学习的调节过程,且其作用具有一定的时间依赖性。本实验室早前的行为药理学研究工作发现,海马和mPFC不仅对于痕迹型EBC,对于弱线索引导的延迟型EBC也是必需的[12,13]。
除了最受关注的海马和mPFC参与对痕迹型EBC的调节外,其他许多小脑外的皮层和皮层下结构包括杏仁核、丘脑、感觉皮层甚至运动皮层等等似乎也参与了对痕迹型EBC的调节[23-28],如此简单的EBC行为竟有如此广泛的调节机制,反映了脑调节功能高度复杂的特点。遗憾的是,长期以来,该领域始终存在一个未能回答问题:虽然已经初步证实众多相关脑区参与了对EBC联合运动学习的调控,但是这些区域是如何发挥对EBC的调节作用的?特别是最为关键的EBC调节脑区海马和mPFC通过何种通路和细胞机制实现其对痕迹型联合运动学习的调节,目前了解甚少。
2 海马和mPFC参与联合运动学习调节的可能机制
过去大量的传统研究包括失活与毁损、电活动记录、成像研究等已确定相关脑区或结构是否参与对EBC的调控,但未能明确其调节机制特别是通路和细胞机制。因为传统的干预策略无法解决细胞特异性干预、通路特异性干预等难题。近年来快速发展和成熟的具有高度时空特异性的光遗传学技术能通过瞬时性沉默或激活特定类型的神经元或特定的投射通路,成功解决上述难题。近年来已有大量引领性工作[5,29,30]通过光遗传学技术在相关领域的应用揭示出新的发现并对相关传统结论作出了严谨的修正,有力推动了相关领域的研究进展。例如情景性恐惧的提取机制研究修正了海马不参与远期记忆的认识[29];嗅刺激引导的延迟样本非匹配任务研究则区分了mPFC神经元在记忆保持与注意力控制过程中的不同作用[30],等等。
值得注意的是,依托该技术的应用,关于mPFC对于EBC联合运动学习调节的通路机制研究近期取得重要进展。前期我们首先完成了光遗传学兴奋大鼠mPFC锥体神经元作为条件刺激能支持联合型学习的研究,并发现mPFC锥体神经元在此过程中具有编码特异性[11],随后,在本实验室刚刚发表的基于光遗传学技术的工作中[5],我们发现mPFC通过其对脑桥核的神经投射特异性参与调节弱线索引导的延迟型EBC联合运动学习。实验中我们观察到,通过光遗传学手段抑制mPFC神经元或其投射到脑桥核的轴突末梢,能显著影响弱条件刺激引导的延迟型EBC的建立以及其近期和远期提取,而对强条件刺激引导建立的延迟型EBC无显著的影响。mPFC-脑桥核调节通路的鉴定是EBC神经调节机制研究的重要突破。目前对于mPFC通过何种投射通路参与调节痕迹型EBC联合运动学习尚无证据,但根据现有发现可以推测,mPFC-脑桥投射仍有可能是mPFC发挥调节作用的主要通路。但关于海马通过何种回路机制调节EBC联合运动学习目前缺乏基本的了解甚至缺乏理论推测。
脑桥核是条件刺激信息进入小脑的必经之路,也是最后一站[31]。已经确认,各种外源性条件刺激信息在上传大脑的通路中,可从不同水平包括脑干、丘脑、大脑皮层等发出投射经脑桥核进入小脑,故脑桥核控制着来自中枢及外周进入小脑的大部分信息,可能是EBC联合运动学习重要调节靶点。有足够理由相信,虽然小脑包含必要和充分的神经可塑性机制足以支持简单的联合运动学习,但必须以具有足够的条件刺激输入(包括强度和时长)为前提,否则,需要依赖小脑外结构包括mPFC、海马对其传入进行调节。因此,海马对于EBC的调控机制也应考虑其对于条件刺激传入的调节。但问题是,海马并没有直接到脑桥核的投射纤维,但有到mPFC或是基底外侧杏仁核等其他脑区的投射[32]。海马能否通过其对mPFC的神经投射通路调节EBC联合运动学习值得关注。
3 海马-mPFC投射可能在EBC联合运动学习调节过程中发挥作用
解剖学研究早已证明,啮齿类和灵长类动物的海马(主要是腹海马)具有到mPFC的大量单突触的同侧投射[33,34];而mPFC到海马的投射则有两条途径,一是经扣带回、内嗅皮层到海马的间接投射,已受到广泛关注,二是mPFC到海马(主要是背海马)的直接投射[35,36]。有关研究最近确认了小鼠mPFC到背海马的单突触直接投射。该投射起源于前扣带回而终止于海马CA3区[37,38]。
研究显示,海马-mPFC回路参与了多种认知功能以及认知功能的发育[39],是实现工作记忆和抑制控制的关键[40];海马-mPFC回路功能异常与多种神经、精神疾病的发生存在关联。早期一项工作采用空间记忆模型研究发现mPFC可对海马加工不连续事件的功能提供补充[41];最近的相关研究也表明,正常认知功能的实现依赖于海马和PFC组成的双向回路的完整[37]。来自人体研究的结果表明这两个脑区的神经活动能随任务需求的变化表现出动态的相关性[42,43]。灵长类动物的研究发现,工作记忆及陈述性记忆过程中海马和mPFC活动存在相互关联[44,45];而临床研究注意到,精神分裂症、创伤后应激障碍、抑郁症等精神疾病的发病均与海马-mPFC之间的连接受到破坏有关[46]。
有鉴于海马-mPFC之间的直接投射及其功能联系、mPFC在工作记忆和抑制控制中的作用、以及本室关于mPFC通过脑桥核投射调节延迟型EBC的机制的最新发现,似乎有理由做如下假设:①海马可能通过海马-mPFC投射实现对EBC联合运动学习的调节;②海马和mPFC可能通过相互作用共同完成对EBC联合运动学习的调节。未来应采用具有瞬时干预、选择性干预优势的光遗传学技术等,通过选择性抑制腹海马CA1区兴奋性神经元及其向mPFC不同亚区投射的瞬时活动,探讨海马调节EBC联合运动学习的通路机制;并通过选择性抑制mPFC向背海马的投射活动,探讨mPFC对于海马在调节EBC联合运动学习中的协同作用。
另外,免疫细胞学研究表明[47],海马到mPFC的纤维除了与mPFC锥体细胞形成单突触连接外,还与GABA能中间神经元形成单突触连接,这种连接方式参与mPFC锥体细胞的兴奋状态的调控。相关研究发现,在小鼠进行感觉引导的学习行为过程中,大脑皮层的抑制通路比兴奋性通路更加活跃[48-50];在动物主动触摸行为中,抑制性神经元的激活对松散编码(sparse coding)具有重要的调节作用[48,51]。因此,抑制性神经元在海马-mPFC通路调控联合运动学习中的作用值得关注。最近,人们已经把大脑皮层抑制性神经元分为以下三种类型:Parvalbumin+(PV+),Somatostatin+(SOM+)和5-hydroxytryptamine receptor 3A+(5-HT3aR+)神经元,这三种类型的细胞占皮层全部的抑制性神经元的近100%[52]。采用PV-Cre,SOM-Cre和5-HT3aR-Cre的转基因小鼠,结合在体光遗传学干预技术探讨mPFC不同亚区内特定的GABA能神经元亚群在EBC联合运动学习调节中的作用值得尝试。
4 展望
功能神经回路的异常是许多心理及神经疾病重要的发病基础,但功能回路的研究受技术方法的限制早期止步不前,近年来因光遗传学等新技术的成熟,相关领域的研究受到极大推动,但目前仍有大量的功能神经回路亟待澄清。明确联合运动学习调节的回路机制不仅对于解构特定行为的脑机制、深入理解脑基本工作原理具有重要价值,对于探讨相关心理及神经疾病的发病机制及治疗研究也具有深远的意义。
[1] Gruart A, Sanchez-Campusano R, Fernandez-Guizan A,etal. A differential and timed contribution of identified hippocampal synapses to associative learning in mice[J]. Cereb Cortex, 2015, 25(9): 2542-2555.
[2] Chen H, Yang L, Xu Y,etal. Prefrontal control of cerebellum-dependent associative motor learning[J]. Cerebellum, 2014, 13(1): 64-78.
[3] Gogolla N, Caroni P, Luthi A,etal. Perineuronal nets protect fear memories from erasure[J]. Science, 2009, 325(5945): 1258-1261.
[4] Thompson RF. In search of memory traces[J]. Annu Rev Psychol, 2005, 56: 1-23.
[5] Wu GY, Liu SL, Yao J,etal. Medial prefrontal cortex-pontine nuclei projections modulate suboptimal cue-induced associative motor learning[J]. Cereb Cortex, 2017, Published online, doi: 10.1093/cercor/bhw410.
[6] Keifer J, Tiwari NK, Buse L,etal. Subunit-specific synaptic delivery of AMPA receptors by auxiliary chaperone proteins TARPgamma8 and GSG1L in classical conditioning[J]. Neurosci Lett, 2017, 645:53-59.
[7] Connor DA, Gould TJ. The role of working memory and declarative memory in trace conditioning[J]. Neurobiol Learn Mem, 2016, 134: 193-209.
[8] Freeman JH. Cerebellar learning mechanisms[J]. Brain Res, 2015, 1621: 260-269.
[9] Halverson HE, Khilkevich A, Mauk MD. Relating cerebellar purkinje cell activity to the timing and amplitude of conditioned eyelid responses[J]. J Neurosci, 2015, 35(20): 7813-7832.
[10] Linden DJ.From molecules to memory in the cerebellum[J]. Science, 2003, 301(5640): 1682-1685.
[11] Wu GY, Liu GL, Zhang HM,etal. Optogenetic stimulation of mPFC pyramidal neurons as a conditioned stimulus supports associative learning in rats[J]. Sci Rep, 2015, 5:10065.
[12] Wu GY, Yao J, Hu B,etal. Reevaluating the role of the hippocampus in delay eyeblink conditioning[J]. PLoS One, 2013, 8(8):e71249.
[13] Wu GY, Yao J, Zhang LQ,etal. Reevaluating the role of the medial prefrontal cortex in delay eyeblink conditioning[J]. Neurobiol Learn Mem, 2012, 97(3): 277-288.
[14] Oswald B, Knuckley B, Mahan K,etal. Prefrontal control of trace versus delay eyeblink conditioning: role of the unconditioned stimulus in rabbits (Oryctolagus cuniculus)[J]. Behav Neurosci, 2006, 120(5): 1033-1042.
[15] Oswald BB, Maddox SA, Tisdale N,etal. Encoding and retrieval are differentially processed by the anterior cingulate and prelimbic cortices: a study based on trace eyeblink conditioning in the rabbit[J]. Neurobiol Learn Mem, 2010, 93(1): 37-45.
[16] Shors TJ. Memory traces of trace memories: neurogenesis, synaptogenesis and awareness[J]. Trends Neurosci, 2004, 27(5): 250-256.
[17] Weible AP, O’Reilly JA, Weiss C,etal. Comparisons of dorsal and ventral hippocampus cornu ammonis region 1 pyramidal neuron activity during trace eye-blink conditioning in the rabbit[J]. Neuroscience, 2006, 141(3): 1123-1137.
[18] Gilmartin MR, McEchron MD. Single neurons in the dentate gyrus and CA1 of the hippocampus exhibit inverse patterns of encoding during trace fear conditioning[J]. Behav Neurosci, 2005, 119(1): 164-179.
[19] Kloth AD, Badura A, Li A,etal. Cerebellar associative sensory learning defects in five mouse autism models[J]. Elife, 2015, 4:e06085.
[20] Ortiz O, Delgado-Garcia JM, Espadas I,etal. Associative learning and CA3-CA1 synaptic plasticity are impaired in D1R null, Drd1a-/-mice and in hippocampal siRNA silenced Drd1a mice[J]. J Neurosci, 2010, 30(37): 12288-12300.
[21] Plakke B, Freeman JH, Poremba A. Metabolic mapping of rat forebrain and midbrain during delay and trace eyeblink conditioning[J]. Neurobiol Learn Mem, 2009, 92(3): 335-344.
[22] Modi MN, Dhawale AK, Bhalla US. CA1 cell activity sequences emerge after reorganization of network correlation structure during associative learning[J]. Elife, 2014, 3:e01982.
[23] Diaz-Mataix L, Tallot L, Doyere V. The amygdala: a potential player in timing CS-US intervals[J]. Behav Processes, 2014, 101: 112-122.
[24] Freeman JH, Steinmetz AB. Neural circuitry and plasticity mechanisms underlying delay eyeblink conditioning[J]. Learn Mem, 2011, 18(10): 666-677.
[25] Taub AH, Mintz M. Amygdala conditioning modulates sensory input to the cerebellum[J]. Neurobiol Learn Mem, 2010, 94(4): 521-529.
[26] Halverson HE, Freeman JH. Medial auditory thalamic input to the lateral pontine nuclei is necessary for auditory eyeblink conditioning[J]. Neurobiol Learn Mem, 2010, 93(1): 92-98.
[27] Halverson HE, Freeman JH. Ventral lateral geniculate input to the medial pons is necessary for visual eyeblink conditioning in rats[J]. Learn Mem, 2010, 17(2): 80-85.
[28] Campolattaro MM, Halverson HE, Freeman JH. Medial auditory thalamic stimulation as a conditioned stimulus for eyeblink conditioning in rats[J]. Learn Mem, 2007, 14(3): 152-159.
[29] Goshen I, Brodsky M, Prakash R,etal. Dynamics of retrieval strategies for remote memories[J].Cell,2011,147(3):678-689.
[30] Liu D, Gu X, Zhu J,etal. Medial prefrontal activity during delay period contributes to learning of a working memory task[J]. Science, 2014, 346(6208): 458-463.
[31] Moya MV, Siegel JJ, McCord ED,etal. Species-specific differences in the medial prefrontal projections to the pons between rat and rabbit[J]. J Comp Neurol, 2014, 522(13): 3052-3074.
[32] Ishikawa A, Nakamura S. Ventral hippocampal neurons project axons simultaneously to the medial prefrontal cortex and amygdala in the rat[J]. J Neurophysiol, 2006, 96(4): 2134-2138.
[33] Hoover WB, Vertes RP. Anatomical analysis of afferent projections to the medial prefrontal cortex in the rat[J]. Brain Struct Funct, 2007, 212(2): 149-179.
[34] Laroche S, Davis S, Jay TM. Plasticity at hippocampal to prefrontal cortex synapses: dual roles in working memory and consolidation[J]. Hippocampus, 2000, 10(4): 438-446.
[35] Hurley KM, Herbert H, Moga MM,etal. Efferent projections of the infralimbic cortex of the rat[J]. J Comp Neurol, 1991, 308(2): 249-276.
[36] Sesack SR, Deutch AY, Roth RH,etal. Topographical organization of the efferent projections of the medial prefrontal cortex in the rat: an anterograde tract-tracing study with Phaseolus vulgaris leucoagglutinin[J].J Comp Neurol,1989,290(2):213-242.
[37] Sigurdsson T, Duvarci S. Hippocampal-prefrontal interactions in cognition, behavior and psychiatric disease[J]. Front Syst Neurosci, 2015, 9: 190.
[38] Rajasethupathy P, Sankaran S, Marshel JH,etal. Projections from neocortex mediate top-down control of memory retrieval[J]. Nature, 2015, 526(7575): 653-659.
[39] Zhang M, Cai JX. Neonatal tactile stimulation enhances spatial working memory, prefrontal long-term potentiation, and D1 receptor activation in adult rats[J]. Neurobiol Learn Mem, 2008, 89(4): 397-406.
[40] Wang GW, Cai JX. Disconnection of the hippocampal-prefrontal cortical circuits impairs spatial working memory performance in rats[J]. Behav Brain Res, 2006, 175(2): 329-336.
[41] Lee I, Kesner RP. Time-dependent relationship between the dorsal hippocampus and the prefrontal cortex in spatial memory[J]. J Neurosci, 2003, 23(4): 1517-1523.
[42] Harris AZ, Gordon JA. Long-range neural synchrony in behavior[J]. Annu Rev Neurosci, 2015, 38: 171-194.
[43] Gregoriou GG, Gotts SJ, Zhou H,etal. Long-range neural coupling through synchronization with attention[J]. Prog Brain Res, 2009, 176: 35-45.
[44] Bahner F, Demanuele C, Schweiger J,etal. Hippocampal-dorsolateral prefrontal coupling as a species-conserved cognitive mechanism: a human translational imaging study. Neuropsycho-pharmacology[J], 2015, 40(7): 1674-1681.
[45] Brincat SL, Miller EK. Frequency-specific hippocampal-prefrontal interactions during associative learning[J]. Nat Neurosci, 2015, 18(4): 576-581.
[46] Godsil BP, Kiss JP, Spedding M,etal. The hippocampal-prefrontal pathway: the weak link in psychiatric disorders[J]? Eur Neuropsychopharmacol, 2013, 23(10): 1165-1181.
[47] Gabbott P, Headlam A, Busby S. Morphological evidence that CA1 hippocampal afferents monosynaptically innervate PV-containing neurons and NADPH-diaphorase reactive cells in the medial prefrontal cortex (Areas 25/32) of the rat[J]. Brain Res, 2002, 946(2): 314-322.
[48] Crochet S, Poulet JF, Kremer Y,etal. Synaptic mechanisms underlying sparse coding of active touch[J]. Neuron, 2011, 69(6): 1160-1175.
[49] Gentet LJ, Avermann M, Matyas F,etal. Membrane potential dynamics of GABAergic neurons in the barrel cortex of behaving mice[J]. Neuron, 2010, 65(3): 422-435.
[50] Crochet S, Petersen CC. Correlating whisker behavior with membrane potential in barrel cortex of awake mice[J]. Nat Neurosci, 2006, 9(5): 608-610.
[51] Mateo C, Avermann M, Gentet LJ,etal. In vivo optogenetic stimulation of neocortical excitatory neurons drives brain-state-dependent inhibition[J].Curr Biol,2011,21(19):1593-1602.
[52] Sigurdsson T, Duvarci S. Hippocampal-prefrontal interactions in cognition, behavior and psychiatric disease[J]. Front Syst Neurosci, 2016, 9:190.
陆地,男,1960-06生,学士,主任医师,E-mail:LUDI12345678@126.com
2017-06-27
