Notch3信号通路介导MCT诱导的PAH大鼠肺血管ECM的重塑以及分子机制
2017-12-01张永红李凤娟李少军谢新明李芳伟朱燕亭李满祥
张永红,李凤娟,李少军,谢新明,柯 蕊,李芳伟,朱燕亭,刘 璐,李满祥*
(1西安交通大学第二附属医院呼吸内科,西安 710004;2西安交通大学第一附属医院呼吸与危重症医学科;*通讯作者,E-mail:manxiangli@hotmail.com)
Notch3信号通路介导MCT诱导的PAH大鼠肺血管ECM的重塑以及分子机制
张永红1,李凤娟1,李少军2,谢新明2,柯 蕊1,李芳伟2,朱燕亭2,刘 璐2,李满祥2*
(1西安交通大学第二附属医院呼吸内科,西安 710004;2西安交通大学第一附属医院呼吸与危重症医学科;*通讯作者,E-mail:manxiangli@hotmail.com)
目的 探讨Notch3信号通路介导野百合碱(monocrotaline,MCT)诱导的肺动脉高压(pulmonary arterial hypertension,PAH)大鼠肺血管细胞外基质(extracellular matrix,ECM)重塑以及分子机制。 方法 32只4周龄SD雄性大鼠被随机分为3组,对照组(Con组)10只;MCT诱导的PAH模型组(MCT组)12只,一次性腹腔注射2% MCT 60 mg/kg;3,5-二氟苯乙酰-L-丙氨酰-S-苯基甘氨酸t-丁酯(N-[N-(3,5-difluorophena-cetyl-L-alanyl)]-S-phenylglycine t-butyl ester,DAPT)处理的PAH模型组(MCT+DAPT组)10只,一次性腹腔注射2% MCT 60 mg/kg后立即给予腹腔注射Notch抑制剂DAPT 20 mg/kg,1次/d,连续治疗28 d。第28天麻醉各组大鼠,测量右心室收缩压和右心室肥大指数,Masson染色观察肺血管ECM的分布,明胶酶谱法检测肺组织基质金属蛋白酶-2/9(matrix metalloproteinases-2/9,MMP-2/9)的活性。Western blot方法检测肺组织中Notch3、NICD3,以及TIMP-1蛋白质水平。 结果 在MCT诱导的PAH模型组大鼠的肺组织中,Notch3以及其裂解片段NICD3蛋白水平较对照组明显升高(P<0.05),伴有肺血管ECM过量沉积,MMP-2/9活性较对照组明显增加(P<0.05),TIMP1蛋白水平亦较对照组增加(P<0.05);在MCT+DAPT组大鼠的肺组织中,Notch3和NICD3蛋白水平较MCT组明显下降(P<0.05),MMP-2/9活性亦较MCT组降低(P<0.05),TIMP1蛋白水平亦较MCT组下降(P<0.05),伴有肺血管壁ECM较MCT组明显减少。 结论 Notch3信号通路可能通过上调MMP-2/9活性和TIMP1蛋白的表达,介导野百合碱诱导的大鼠肺血管壁ECM的重塑。
肺动脉高压; 细胞外基质; Notch3信号通路
肺动脉高压(pulmonary arterial hypertension,PAH)是以肺血管阻力增加,肺动脉压力升高,最终导致右心功能不全为主要表现的临床综合征。肺血管重塑是PAH最主要的发病机制,其特征为肺血管细胞增殖和细胞外基质(extracellular matrix,ECM)重塑。在PAH患者的肺血管壁中,ECM过量沉积导致肺血管增厚变硬,肺血管阻力增加,以及血管反射波叠加,增加右心室后负荷[1]。
研究证实,Notch3信号通路在PAH患者以及PAH动物模型的发生发展中均起着重要的作用,PAH患者的Notch3受体表达明显增高,Notch3信号通路活性增强[2]。过度激活Notch3信号通路介导ECM的重塑[3],肺血管ECM的合成和降解处于动态平衡,MMP-2/9是ECM的主要降解酶,参与肺血管ECM的重塑[4]。肿瘤细胞的研究证实,Notch3信号通路通过调节MMP-2/9的活性参与调节细胞的生命活动[5,6]。但目前仍不清楚Notch3信号通路是否通过调控MMP-2/9的活性参与肺血管ECM的重塑。本研究探索Notch3信号通路是否介导MCT诱导的大鼠肺血管ECM以及可能的分子机制。
1 材料与方法
1.1 主要试剂
野百合碱购自美国Sigma公司。DAPT购自美国Santa Cruz公司。Notch3一抗购自英国Abcam公司,TIMP1一抗购自美国Bioworld公司。GAPDH一抗购自美国Sigma公司。HRP标记的二抗购自美国Sigma公司。
1.2 实验动物与分组
32只清洁级SD雄性大鼠购自西安交通大学医学院实验动物中心,饲养于西安交通大学医学院动物中心。分笼分组饲养,室内温度为(20±2)℃、湿度为40%-60%,12 h交替昼夜循环,动物垫料经高压蒸汽灭菌,自主进食饮水,适应性饲养1周后SD大鼠体重为170-180 g进行实验。实验大鼠随机分为三组:对照组(Con组)正常饲养28 d;MCT诱导的PAH模型组(MCT组):给予60 mg/kg MCT一次性腹腔注射后正常饲养28 d;DAPT处理的PAH模型组(MCT+DAPT组):给予60 mg/kg MCT一次性腹腔注射后立即给予DAPT 10 mg/kg腹腔注射,1次/d,持续治疗28 d。
1.3 右心室收缩压测定
野百合碱注射后第28天,10%水合氯醛腹腔注射麻醉各组大鼠,行右颈外静脉插管,经颈总静脉、上腔静脉、右心房进入右心室,测定并记录右心室收缩压(right ventricle systolic pressure,RVSP)。
1.4 右心室肥大指数测定
右心室收缩压检测完毕后,立即分离心脏与肺脏,沿室间沟边缘分离右心室(RV),生理盐水冲洗,滤纸吸除多余水分,分别称取右心室及左心室加室间隔(LV+S)的重量,计算右心室肥大指数(index of right ventricular hypertrophy,RVH),即RV/(LV+S)。
1.5 肺组织Masson染色
取肺组织甲醛固定,石蜡包埋,切片。将石蜡切片脱蜡、水化后,浸入Weigert铁苏木素染液染色5 min,经1%盐酸乙醇分化、Masson蓝化液反蓝后,丽春红品红染色染5 min,苯胺蓝溶液染色2 min,弱酸溶液洗1 min,最后经无水乙醇脱水,二甲苯透明,中性树胶封片。
1.6 明胶酶谱法检测MMP-2、MMP-9活性
将肺组织提取的总蛋白用BCA蛋白定量试剂盒定量。取等量蛋白样品上样到含有0.1%明胶的10% SDS-PAGE凝胶,电泳。电泳结束后,将分离胶切下,置于含2.5% Triton X-100的洗脱液中,室温下于摇床上振荡洗脱2次,每次40 min。随后将凝胶置于孵育液中,37 ℃震荡孵育42 h。孵育结束后,将含有0.1%明胶的凝胶置于考马斯亮蓝染液中染色至少3 h,将凝胶移入脱色液中脱色,在蓝色背景色显示出清晰透亮带为止,置于双蒸水中终止脱色。可见72 kD(MMP-2)和92 kD(MMP-9)处为透亮带,将所得结果于凝胶成像系统照相。
1.7 Western bolt检测Notch3、NICD3、TIMP-1水平
将肺组织提取的总蛋白用BCA蛋白定量试剂盒定量。取等量蛋白样品上样到10% SDS-PAGE凝胶,电泳。将凝胶上的蛋白转移至NC膜,封闭后分别加Notch3、NICD3、TIMP-1及GAPDH一抗溶液,4 ℃孵育过夜。TBST洗膜,滴加二抗溶液,室温孵育2 h,TBST洗膜后加入发光液,曝光,显影,定影,晾干,用Quantity One 4.6.2(美国Bio-Rad公司)凝胶成像分析仪采集底片图像并进行定量分析。
1.8 统计学分析
实验数据应用SPSS13.0软件统计分析,正态分布的计量资料以均数±标准差,非正态分布资料经正态转换后再进行统计学分析,多组间比较应用单因素方差分析Tukey post hoc检验,以P<0.05认为组间差异具有统计学意义。
2 结果
2.1 野百合碱诱导的PAH大鼠肺组织Notch3和NICD3蛋白的水平明显升高
本研究应用Western blot法检测了三组实验大鼠肺组织Notch3、NICD3和内参GAPDH蛋白的水平,在MCT诱导的PAH大鼠肺组织中,Notch3蛋白水平明显增加,是对照组的1.83倍(P<0.05),DAPT可明显降低PAH模型组大鼠肺组织中的Notch3水平,为对照组的0.98倍(P<0.05,见图1)。Notch3细胞内片段NICD3的水平变化趋势与Notch3相似(见图1C),在MCT诱导的PAH大鼠肺组织中,NICD3蛋白水平明显增加,是对照组的1.82倍(P<0.05),DAPT可显著降低PAH模型组NICD3的水平,为对照组的0.83倍(P<0.05),提示在MCT诱导的PAH大鼠肺组织中,Notch3信号通路活性增强。

A.Western blot结果 B.应用GAPDH内参校正后,三组大鼠肺组织Notch3蛋白质相对水平 C.应用GAPDH内参校正后,三组大鼠肺组织NICD3蛋白质相对水平与对照组比较,*P<0.05;与MCT组(野百合碱诱导的PAH模型组)比较,#P<0.05图1 大鼠肺组织Notch3和NICD3蛋白水平的变化(n=3)Figure 1 The protein level of Notch3 and NICD3 in rat lung (n=3)
2.2 抑制Notch3信号通路对野百合碱诱导大鼠的右心室收缩压的影响
在无肺动脉瓣狭窄或右心室流出道梗阻的情况下,肺动脉压相当于右心室收缩压,因此本研究用右心室收缩压评估大鼠肺动脉压的变化。SD雄性大鼠腹腔注射MCT后,第28天右心室收缩压为(39.0±2.6)mmHg,明显高于对照组(21.7±1.5)mmHg(P<0.05,见图2)。MCT诱导大鼠的肺动脉压力符合PAH的生理学特征,提示PAH模型建立成功。给予DAPT处理后PAH模型大鼠的右心室收缩压下降为(26.6±1.3)mmHg,与野百合碱诱导的PAH模型组比较,差异有统计学意义(P<0.05),提示抑制Notch3信号通路可降低MCT诱导大鼠的右心室收缩压。
2.3 抑制Notch3信号通路对野百合碱诱导大鼠的右心室肥大指数的影响
右心肥大指数是右心室重量与左心室加室间隔重量的比值,是衡量右心室肥大的重要指标,大鼠腹腔注射MCT后,第28天SD大鼠右心室肥大指数为(53.4±5.3)%,明显高于对照组(22.2±2.2)%(P
<0.05,见图3),经DAPT治疗后,PAH模型大鼠右心肥大指数下降为(33.5±2.6)%,与野百合碱诱导的PAH模型组比较,差异有统计学意义(P<0.05),提示抑制Notch3信号通路可以抑制MCT诱导大鼠的右心室肥大。

RVSP:right ventricle systolic pressure,右心室收缩压;与对照组比较,*P<0.05;与MCT组(野百合碱诱导的PAH模型组)比较,#P<0.05图2 Notch3信号通路对MCT诱导大鼠右心室收缩压的影响 (n=9-10)Figure 2 Effect of Notch3 signaling pathway on right ventricle systolic pressure in MCT-induced PAH rats (n=9-10)
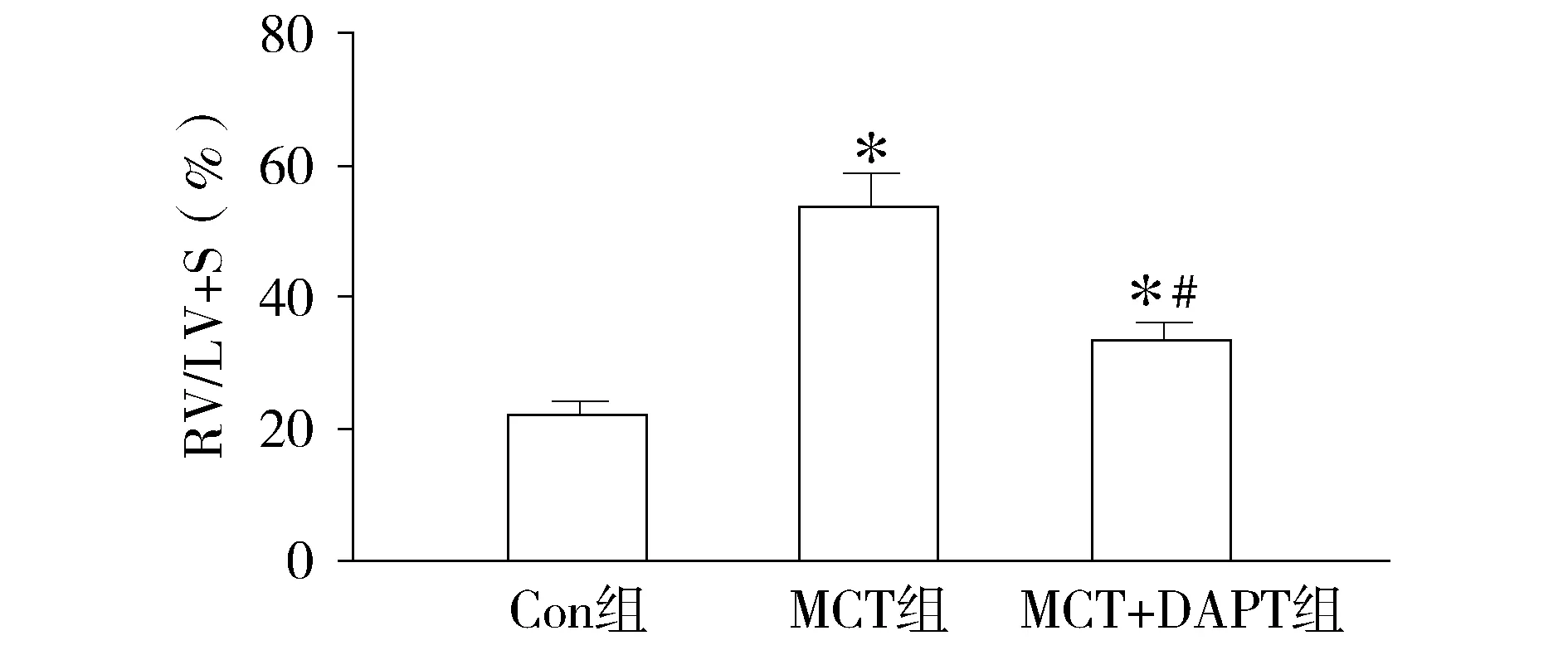
RV/LV+S:右心室重量与左心室加室间隔重量的比值与对照组比较,*P<0.05;与MCT组(野百合碱诱导的PAH模型组)比较,#P<0.05图3 Notch3信号通路对MCT诱导大鼠右心室肥大指数的影响 (n=9-10)Figure 3 Effect of Notch3 signaling pathway on right ventricular hypertrophy index in MCT-induced PAH rats (n=9-10)
2.4 抑制Notch3信号通路对野百合碱诱导的PAH大鼠肺血管ECM重塑的影响
Notch3信号通路参与PAH的发生,肺血管重塑是PAH的重要发病机制,肺血管重塑主要表现为肺血管细胞增加以及肺血管ECM的过量沉积,过量沉积的ECM导致肺血管壁增厚僵硬,管腔狭窄,血管阻力增加。本研究为了探索Notch3信号通路是否介导MCT诱导的PAH大鼠肺血管ECM重塑,大鼠肺组织切片Masson染色观察其胶原分布情况。对照组大鼠肺血管壁、细支气管壁及肺泡间隔可见少量的胶原沉积(见图4A);MCT诱导的PAH大鼠肺血管内弹膜厚薄不均断裂,血管壁有较多的蓝染胶原沉积(见图4B);DAPT处理的PAH模型组大鼠的肺血管壁蓝染胶原较PAH模型组明显减少(见图4C)。
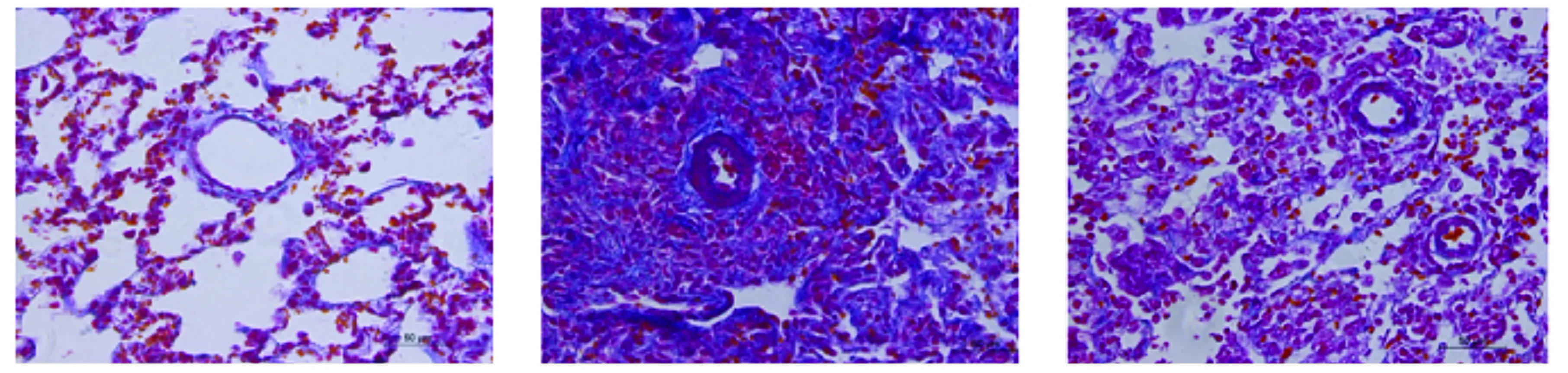
A.对照组大鼠肺血管壁可见少量的胶原沉积 B.MCT诱导的PAH(MCT组)大鼠肺血管壁有大量广泛分布的胶原沉积 C.DAPT处理的PAH模型(MCT+DAPT组)大鼠肺血管胶原沉积较MCT组明显减少图4 Notch3信号通路对MCT诱导的PAH大鼠肺血管胶原沉积的影响 (Masson染色,×400)Figure 4 Effect of Notch3 signaling pathway on pulmonary arterial vascular ECM remodeling in MCT-induced PAH rats (Masson,×400)
2.5 Notch3信号通路对野百合碱诱导的PAH大鼠肺组织MMP-2/9活性的影响
本研究为了探讨Notch3信号通路是否调控MCT诱导的PAH大鼠肺组织MMP-2/9活性,应用明胶酶谱法检测各组实验大鼠肺组织MMP-2/9活性,结果显示,在MCT诱导的PAH大鼠肺组织中,MMP-9活性明显增加(P<0.05,见图5),是对照组的1.86倍,DAPT可明显降低PAH模型组大鼠的MMP-9活性(P<0.05),其活性降为对照组的1.21倍。在MCT诱导的PAH大鼠肺组织中,MMP-2活性明显增加,是对照组的3.38倍(P<0.05,见图5C),DAPT抑制Notch3信号通路可明显降低PAH模型组大鼠的MMP-2活性(P<0.05),其活性降为对照组的1.76倍。
2.6 Notch3信号通路对野百合碱诱导的PAH大鼠肺组织TIMP1蛋白表达的影响
TIMP1是重要的胶原酶抑制剂,调控ECM的重塑。本研究应用Western blot法检测三组大鼠肺组织TIMP1和内参GAPDH蛋白水平结果显示,在MCT诱导的PAH大鼠肺组织中,TIMP1蛋白水平明显增加,是对照组的1.74倍(P<0.05,见图6),DAPT抑制Notch3信号通路可明显降低PAH模型组大鼠肺组织中的TIMP1蛋白水平(P<0.05),降为对照组的1.22倍。
3 讨论
本研究探讨了Notch3信号通路在MCT诱导的PAH大鼠肺血管ECM重塑中的作用及其分子机制。在MCT诱导的PAH大鼠肺组织中,Notch3信号活性增强,伴有肺血管ECM过量沉积,通过DAPT抑制Notch3信号通路,可显著减轻MCT诱导的PAH大鼠肺血管ECM的过量沉积,提示Notch3信号通路介导MCT诱导的PAH大鼠肺血管ECM的重塑。在MCT诱导的PAH大鼠肺组织中,MMP-2/9胶原酶活性增强,TIMP1表达上调,导致MMP/TIMP比例失衡,诱发肺血管ECM的重塑,抑制Notch3信号通路可重建MMP/TIMP失衡,减轻MCT大鼠肺血管ECM的过量沉积,提示Notch3信号通路可能通过上调MMP-2/9活性和TIMP1蛋白的表达,促进肺血管壁ECM的重塑。

A.三组大鼠肺组织MMP2和MMP-9明胶酶谱图 B.应用明胶酶谱法检测大鼠肺组织MMP-2相对明胶酶活性 C.应用明胶酶谱法检测大鼠肺组织MMP-2相对明胶酶活性与对照组比较,*P<0.05;与MCT组(野百合碱诱导的PAH模型组)比较,#P<0.05图5 Notch3信号通路对MCT诱导的PAH大鼠肺组织MMP-2和MMP-9明胶酶活性的影响(n=3) Figure 5 Effect of Notch3 signaling pathway on activity of MMP-2/9 from lung tissue lysates inMCT-induced PAH rats (n=3)

A.三组大鼠肺组织TIMP1和GADPH蛋白的Western blot结果 B.应用GAPDH内参校正后,三组大鼠肺组织TIMP1蛋白相对水平与对照组比较,*P<0.05;与MCT组(野百合碱诱导的PAH模型组)比较,#P<0.05图6 Notch3信号通路对MCT诱导的PAH大鼠肺组织TIMP1蛋白水平的影响 (n=3)Figure 6 Effect of Notch3 signaling pathway on the level of TIMP1 from lung tissue lysates in MCT-induced PAH rats (n=3)
肺血管重塑是PAH最主要的发病机制,其特征为肺血管细胞增殖和ECM重塑。既往的研究表明Notch3信号通路参与ECM的重塑。在高血压肾纤维化患者的肾脏组织中,Notch3表达明显升高[7],此外γ分泌酶抑制剂抑制Notch信号通路可以减轻糖尿病肾病的肾脏纤维化[8],在硬皮病患者中,Notch3信号通路参与调节ECM的合成和分泌,过度激活的Notch3信号通路诱导成纤维细胞转化为肌成纤维细胞,并分泌大量的Ⅰ和Ⅲ型胶原蛋白等ECM,促进硬皮病的进展[9]。腺病毒介导的Notch3-shRNA下调Notch3信号可以抑制上皮-间质转化,抑制四氯化碳诱导的肝纤维化[3]。本研究结果提示在MCT诱导的PAH大鼠肺组织中,Notch3信号通路活性增强,伴有肺血管ECM的过量沉积;抑制Notch3信号通路可以减轻百合碱诱导的PAH大鼠肺血管ECM的过量沉积。提示Notch3信号通路介导MCT诱导的PAH大鼠肺血管ECM的重塑。
生理状态下,ECM的合成与降解处于动态平衡,其主要的降解酶为MMPs,它是一组锌依赖性多功能蛋白酶。TIMP是MMPs内源性抑制剂,是调控MMPs活性的一个关键因素,防止ECM的过度降解。MMPs/TIMP动态调节ECM的平衡,参与广泛生理过程,包括胚胎发育,血管生成/再生,组织修复/重塑[10]。研究证实MMPs/TIMP失衡导致肺血管ECM过量沉积参与PAH的发生和发展[11]。MCT诱导的PAH大鼠MMP-2和MMP-9表达上调,活性增加,抑制MMP-2/9可减轻MCT诱导的PAH大鼠肺血管ECM的重塑[12,13],提示MMPs在PAH肺血管ECM的重塑过程起着不可或缺的作用。本研究结果证实,MCT诱导的PAH大鼠肺血管ECM过量沉积,伴Notch3信号通路活性增高,MMP-2/9酶活性增加,TIMP1的表达上调,DAPT抑制Notch3信号通路可减轻MCT诱导的上述变化,减轻MCT诱导的PAH大鼠肺血管ECM过量沉积。在MCT诱导的PAH大鼠肺组织中,Notch3信号通路的活性增强,伴有MMP2/9活性增高,抑制Notch3信号通路可以降低MMP2/9活性,提示Notch3信号通路介导MCT诱导的PAH大鼠肺组织MMP2/9活性增加,其机制可能为一方面Notch3信号通路依赖CBF1/RBPJ途径正性调节NF-κB的表达[14-16];另一方面Notch3信号通路通过Ras正性调节ERK1/2磷酸化水平[17],激活的ERK1/2可以进一步磷酸化核转录因子NF-κB,二者均促进MMP2/9的表达[18-20]。MMP-2/9是调节ECM降解的重要金属蛋白酶,参与PAH动物模型肺血管ECM的重塑。综上所述,Notch3信号通路可能通过多种信号通路正性调节MMP-2/9的活性介导MCT诱导的PAH大鼠肺血管ECM的重塑。
[1] Wang Z, Chesler NC. Role of collagen content and cross-linking in large pulmonary arterial stiffening after chronic hypoxia[J]. Biomech Model Mechanobiol, 2012, 11(1-2):279-289.
[2] Li X, Zhang X, Leathers R,etal. Notch3 signaling promotes the development of pulmonary arterial hypertension[J]. Nat Med, 2009, 15(11):1289-1297.
[3] Zheng SP, Chen YX, Guo JL,etal. Recombinant adeno-associated virus-mediated transfer of shrna against notch3 ameliorates hepatic fibrosis in rats[J]. Exp Biol Med (Maywood), 2013, 238(6):600-609.
[5] Zhou L, Zhang N, Song W,etal. The significance of notch1 compared with notch3 in high metastasis and poor overall survival in hepatocellular carcinoma[J]. Anatol J Cardiol, 2017, 17(1):8-17
[6] Zhou L,Wang DS,Li QJ,etal.Downregulation of the notch signaling pathway inhibits hepatocellular carcinoma cell invasion by inactivation of matrix metalloproteinase-2 and-9 and vascular endothelial growth factor[J].Oncol Rep,2012,28(3):874-882.
[7] 许辉,张瑾,郑理,etal.Notch3的表达与高血压肾纤维化[J].中南大学学报(医学版),2013,38(11):1130-1134.
[8] Xiao Z, Zhang J, Peng X,etal. The notch gamma-secretase inhibitor ameliorates kidney fibrosis via inhibition of Tgf-Beta/Smad2/3 signaling pathway activation[J]. Int J Biochem Cell Biol, 2014, 55:65-71.
[9] Dees C, Tomcik M, Zerr P,etal. Notch signalling regulates fibroblast activation and collagen release in systemic sclerosis[J]. Ann Rheum Dis, 2011, 70(7):1304-1310.
[10] Liu J1, Khalil RA. Matrix metalloproteinase inhibitors as investigational and therapeutic tools in unrestrained tissue remodeling and pathological disorders[J]. Prog Mol Biol Transl Sci,2017,148:355-420.
[11] Li XQ, Wang HM, Yang CG,etal. Fluoxetine inhibited extracellular matrix of pulmonary artery and inflammation of lungs in monocrotaline-treated rats[J]. Acta Pharmacol Sin, 2011, 32(2):217-222.
[12] Huang TH, Chung SY, Chua S,etal. Effect of early administration of lower dose versus high dose of fresh mitochondria on reducing monocrotaline-induced pulmonary artery hypertension in rat[J]. Am J Transl Res, 2016, 8(12):5151-5168.
[13] Bai Y 1, Wang HM 1, Liu M,etal. 4-Chloro-DL-phenylalanine protects against monocrotaline-induced pulmonary vascular remodeling and lung inflammation[J]. Int J Mol Med, 2014, 33(2):373-382.
[14] Lee SH, Wang X, Dejong J. Functional interactions between an atypical nf-kappab site from the rat cyp2b1 promoter and the transcriptional repressor rbp-Jkappa/Cbf1[J]. Nucleic Acids Res, 2000, 28(10):2091-2098.
[15] He F, Guo FC, Li Z,etal. Myeloid-specific disruption of recombination signal binding protein jkappa ameliorates hepatic fibrosis by attenuating inflammation through cylindromatosis in mice[J]. Hepatology, 2015, 61(1):303-314.
[16] Bellavia D, Campese AF, Alesse E,etal. Constitutive activation of nf-kappab and T-cell leukemia/lymphoma in notch3 transgenic mice[J]. EMBO J, 2000, 19(13):3337-3348.
[17] Fitzgerald K, Harrington A, Leder P. Ras pathway signals are required for notch-mediated oncogenesis[J]. Oncogene, 2000, 19(37):4191-4198.
[18] Poudel B, Lee YM, Kim DK. Ddr2 inhibition reduces migration and invasion of murine metastatic melanoma dells by suppressing Mmp2/9 expression through Erk/Nf-Kappab pathway[J]. Acta Biochim Biophys Sin (Shanghai), 2015, 47(4):292-298.
[19] Yang YN, Wang F, Zhou W,etal. Tnf-alpha stimulates mmp-2 and mmp-9 activities in human corneal epithelial cells via the activation of fak/erk signaling[J]. Ophthalmic Res, 2012, 48(4):165-170.
[20] Wang Y, Li M, Xu Y,etal. Tumor necrosis factor-alpha regulates matrix metalloproteinase-2 expression and cell migration via erk pathway in rat glomerular mesangial cells[J]. Cell Biol Int, 2014, 38(9):1060-1068.
Notch3signalingpathwaymediatedpulmonaryvascularECMremodelinginMCT-inducedpulmonaryarterialhypertensionratsanditsmolecularmechanism
ZHANG Yonghong1,LI Fengjuan1,LI Shaojun2,XIE Xinming2,KE Rui1,LI Fangwei2,ZHU Yanting2,LIU Lu2,LI Manxiang2*
(1DepartmentofRespiratoryMedicine,SecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China:2DepartmentofRespiratoryandCriticalCareMedicine,FirstAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:manxiangli@hotmail.com)
ObjectiveTo investigate the molecular mechanisms of Notch3 signaling pathway-mediated pulmonary vascular extracellular matrix(ECM) remodeling in monocrotaline(MCT)-induced pulmonary arterial hypertension(PAH) rats.MethodsTotally 32 male 4-week-old SD rats were randomly divided into 3 groups: control group(n=10), MCT-induced PAH model group(MCT,n=12), PAH model+DAPT group(MCT+DAPT,n=10). The PAH model was induced by intraperitoneal injection with MCT(60 mg/kg body weight) at day 1. DAPT(10 mg/kg) was administered by intraperitoneal injection once a day after administrated with MCT at day 1 and continuously treated for 28 d. Rats in each group were anesthetized at day 28 to measure the right ventricle systolic pressure(RVSP) and index of right ventricular hypertrophy(RVH), ECM in pulmonary vessel was localized by Masson staining, and the activity of MMP-2/9 from the lung tissue lysates was assessed by gelatin zymography. The contents of Notch3, NICD3, tissue inhibitor of matrix metalloproteinase-1(TIMP-1)protein were detected by Western blot.ResultsThe levels of Notch3 and its cleavage domain NICD3 protein in lung tissue in MCT group were significantly higher than that in control group. Compared with control group, the deposition of pulmonary vascular ECM increased in MCT group, the activity of MMP-2/9 was enhanced in lung tissue, and TIMP1 protein level from lung tissue lysates was increased. The levels of Notch3 and its cleavage domain NICD3 protein in lung tissue in MCT+DAPT group were significantly lower than those in MCT group(P<0.05), and the activity of MMP-2/9 and the level of TIMP1 protein were also lower(P<0.05), accompanied with decreased deposition ECM of pulmonary vascular wall.ConclusionNotch3 signal may promote the pulmonary vascular ECM remodeling through increasing the activity of MMP-2/9 and the expression of TIMP1.
pulmonary arterial hypertension; extracellular matrix; Notch3 signaling pathway
国家自然科学基金面上项目(81170051)
张永红,男,1981-03生,博士,助理研究员,E-mail:zyh420989344@126.com
2017-06-19
R544.1
A
1007-6611(2017)11-1118-06
10.13753/j.issn.1007-6611.2017.11.007
