布地奈德对呼吸道合胞病毒感染的哮喘小鼠肺损伤保护作用
2017-12-01蔡玉香周宁娟徐海军
郭 颖,张 娟,蔡玉香,周宁娟,徐海军,孙 新*
(1第四军医大学西京医院儿科,西安 710032;2西安市儿童医院新生儿科;*通讯作者,E-mail:sunxin6@fmmu.edu.cn)
布地奈德对呼吸道合胞病毒感染的哮喘小鼠肺损伤保护作用
郭 颖1,张 娟1,蔡玉香2,周宁娟1,徐海军1,孙 新1*
(1第四军医大学西京医院儿科,西安 710032;2西安市儿童医院新生儿科;*通讯作者,E-mail:sunxin6@fmmu.edu.cn)
目的 观察布地奈德对呼吸道合胞病毒(RSV)感染的哮喘小鼠模型肺部损伤的保护作用。 方法 6-8周龄雄性BALB/c小鼠36只,随机分为对照组、模型组、布地奈德组,每组12只。模型组和布地奈德组用卵清蛋白腹腔注射致敏和雾化吸入激发,建立小鼠哮喘模型,对照组用生理盐水替代。于28,30,32 d,用RSV病毒液隔日滴鼻,连续3次,建立急性病毒感染哮喘模型。对照组用生理盐水滴鼻。布地奈德组于27-33 d给予布地奈德雾化吸入,每日1次,每次30 min,第34天给予各组小鼠肺泡灌洗,收集支气管肺泡灌洗液(BALF),计数BALF中的白细胞数目;制作肺组织的病理切片,HE染色光镜观察肺组织病理变化;免疫组化法观察HMGB1、TLR4在肺组织中的表达;ELISA检测BALF与血清中细胞因子IFN-γ、IL-2、IL-13及嗜酸性粒细胞趋化因子。 结果 与对照组相比,模型组与布地奈德组小鼠BALF中嗜酸性粒细胞、中性粒细胞及巨噬细胞升高(P<0.01)。与模型组相比,布地奈德组小鼠BALF中白细胞总数明显降低(P<0.01),BALF及血清中细胞因子,嗜酸性粒细胞趋化因子、IL-13水平降低(P<0.01);IFN-γ、IL-2水平明显增高(P<0.01)。肺组织病理结果显示吸入布地奈德可减少小鼠肺组织炎症细胞浸润,抑制HMGB1、TLR4在肺组织中的表达。 结论 布地奈德可减轻RSV感染的哮喘小鼠气道炎症,吸入布地奈德对于RSV感染的哮喘小鼠具有一定的治疗作用。
布地奈德; 支气管哮喘; 卵清蛋白; 肺损伤; 小鼠
支气管哮喘是由多种细胞和细胞组分共同参与的气道慢性炎症性疾病[1]。研究证明,无论是发达国家还是发展中国家,呼吸道合胞病毒(RSV)是婴幼儿下呼吸道感染最重要的病毒病原[2,3]。吸入糖皮质激素被认为是哮喘最有效安全的治疗。布地奈德是一种抗炎作用较强的吸入用糖皮质激素,其脂溶性差,但对糖皮质激素受体的亲和力较强,同时具有较高的肝脏首过代谢效应,使进入体循环的药量明显减少,上述特点决定了布地奈德具有较强的局部抗炎作用[4]。在哮喘的治疗中,布地奈德临床应用已经非常广泛,但是布地奈德基础研究较少。本实验研究观察吸入布地奈德对于RSV感染的哮喘小鼠模型肺组织炎性因子的影响。
1 材料与方法
1.1 细胞株、主要试剂及仪器
卵清蛋白OVA购自美国Sigma公司,布地奈德购自澳大利亚AstraZeneca公司,呼吸道合胞病毒A亚型来源于(首都儿科研究所),空压雾化器购自欧姆龙大连有限公司。
1.2 病毒的细胞培养

1.3 实验动物与分组
8周龄SPF级BALB/c雄性小鼠(生产许可证号:SCXK(军)2012-0007)36只,体质量(20±2)g,购自第四军医大学实验动物中心,饲养于第四军医大学基础部动物房,随机分为3组,每组12只,分别为对照组、模型组、布地奈德组,用不含OVA的颗粒饲料喂养,自由饮水。整个过程遵守《实验动物管理条例》。
1.4 模型的建立
实验第0,7,14天给予模型组、布地奈德组小鼠腹腔注射致敏液0.2 ml进行致敏。对照组小鼠采用仅含有Al(OH)3粉末的生理盐水溶液,注射部位及剂量与实验组相同。实验第21-28天给予模型组、布地奈德组雾化液激发。方法是将模型组和布地奈德组小鼠放在5 L自制的密闭容器中,使小鼠暴露在1% OVA气雾中,每日1次,每次30 min。第29,31天每日给予上述1%OVA雾化;第28,30,32天给予体积100 μl RSV上清液鼻腔滴入,共3次。待滴鼻第4天小鼠出现毛发竖立、无光泽,烦躁不安或精神萎靡,颤动或点头、咳嗽及呼吸加深、节律性收腹样喘促等阳性反应,表明RSV感染小鼠模型建立成功。对照组以生理盐水代替OVA雾化激发和鼻腔滴入,频次及时间同上。布地奈德组于实验第27-33天采用布地奈德雾化吸入(布地奈德1 mg溶于注射用水中雾化,每次吸入30 min,每天1次),其他二组均采用等量生理盐水代替布地奈德雾化。
1.5 血清中细胞因子检测
在末次激发后处死小鼠,立即摘眼球取血,4 ℃、5 000 r/min,离心10 min获取血清。用自制穿刺针进行气管插管并固定,用0.8 ml PBS溶液进行支气管肺泡灌洗,将回抽的BALF于4 ℃,2 500 r/min,离心5 min,收集上清液[6]。ELISA试剂盒检测小鼠血清和BALF中各种因子(IFN-γ、IL-2、嗜酸性粒细胞趋化因子、IL-13)。具体步骤按照试剂盒说明书进行。
1.6 肺组织标本制备
取新鲜左肺,将小鼠肺组织制成4 μm厚的切片,分别给予苏木精-伊红染色和免疫组化分析,观察支气管壁的形态学改变及肺组织中高迁移率族蛋白B1(HMGB1)、Toll样受体4(TLR4)的表达。
1.7 统计学分析
实验采用SPSS 17.0统计软件,数据用均数±标准差表示,符合正态分布且方差齐者,多组间比较采用One-Way ANOVA法,组间两两比较采用LSD法;数据不符合正态分布者,多组间比较采用Kruskal-WallisH检验,组间两两比较采用Mann-WhitneyU检验,P<0.05为差异具有统计学意义。
2 结果
2.1 RSV与Hep-2细胞孵育后的变化
RSV感染细胞后,24 h后出现细胞变圆、拉长及融合现象,48-96 h后细胞病变明显,镜下可见细胞边界不清,病变细胞相互融合呈“多核巨细胞”的合胞体(见图1)。
2.2 肺组织病理变化
肺组织HE染色显示,对照组小鼠气道周围炎性细胞浸润较少,肺泡壁完整,模型组小鼠肺组织炎性细胞浸润明显增多,肺泡腔明显狭窄,肺泡壁断裂,布地奈德组小鼠肺组织炎症较模型组明显减轻,炎症细胞浸润显著减少,偶见肺泡壁断裂及管腔狭窄(见图2)。

A.正常Hep-2细胞 B.接种RSV第5天的Hep-2细胞图1 Hep-2细胞感染RSV病毒前后变化Figure 1 Changes of Hep-2 cells before and after infected with RSV virus

A.对照组 B.模型组 C.布地奈德组图2 不同组肺组织HE染色结果 (×200)Figure 2 HE staining of lung tissue in three groups (×200)
2.3 肺组织免疫组化法检测小鼠肺组织HMGB1表达
免疫组化法检测各组小鼠肺组织HMGB1、TLR4的表达,结果显示,对照组HMGB1、TLR4表达较弱;模型组HMGB1、TLR4表达较强;布地奈德组HMGB1、TLR4表达较哮喘组减弱;深棕黄色为HMGB1、TLR4表达阳性细胞(见图3,4)。

A. 对照组 B.模型组 C.布地奈德组图3 肺组织免疫组化法检测HMGB1表达 (×400)Figure 3 Expression of HMGB1 in lung tissues by immunohistochemical staining (×400)
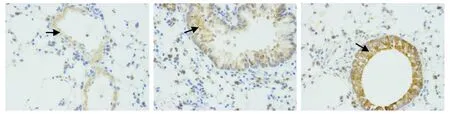
A.对照组 B.模型组 C.布地奈德组图4 肺组织免疫组化法检测TLR4的表达 (×400)Figure 4 Expression of TLR4 in lung tissues by immunohistochemical staining (×400)
2.4 BALF的炎症细胞变化
与对照组小鼠相比,模型组小鼠BALF中白细胞总数明显升高(P<0.01),主要表现为嗜酸性粒细胞、中性粒细胞及巨噬细胞的升高;布地奈德组小鼠BALF中嗜酸性粒细胞、中性粒细胞及巨噬细胞明显降低(P<0.01,见图5)。

与对照组相比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图5 小鼠肺泡灌洗液中白细胞及其分类计数比较 (n=12)Figure 5 Comparison of leukocyte in bronchoalveolar lavage fluid of mice between three groups (n=12)
2.5 各组小鼠血清与BALF中IFN-γ、IL-2的检测结果
与对照组相比,模型组小鼠血清和BALF中IFN-γ、IL-2水平明显降低(P<0.01),与模型组比较,布地奈德组IFN-γ、IL-2明显升高(P<0.01)。(见图6、图7)。

与对照组比较,***P<0.001;与模型组比较,##P<0.01图6 各组小鼠血清和肺泡灌洗液中IFN-γ含量 (n=12)Figure 6 Comparison of levels of IFN-γ content in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)
2.6 各组小鼠血清中嗜酸性粒细胞趋化因子、IL-13含量
与对照组相比,模型组小鼠血清和BALF中嗜酸性粒细胞趋化因子、IL-13水平明显升高(P<0.01),雾化吸入布地奈德可以降低哮喘小鼠嗜酸性粒细胞趋化因子与IL-13水平(P<0.01,见图8,9)。
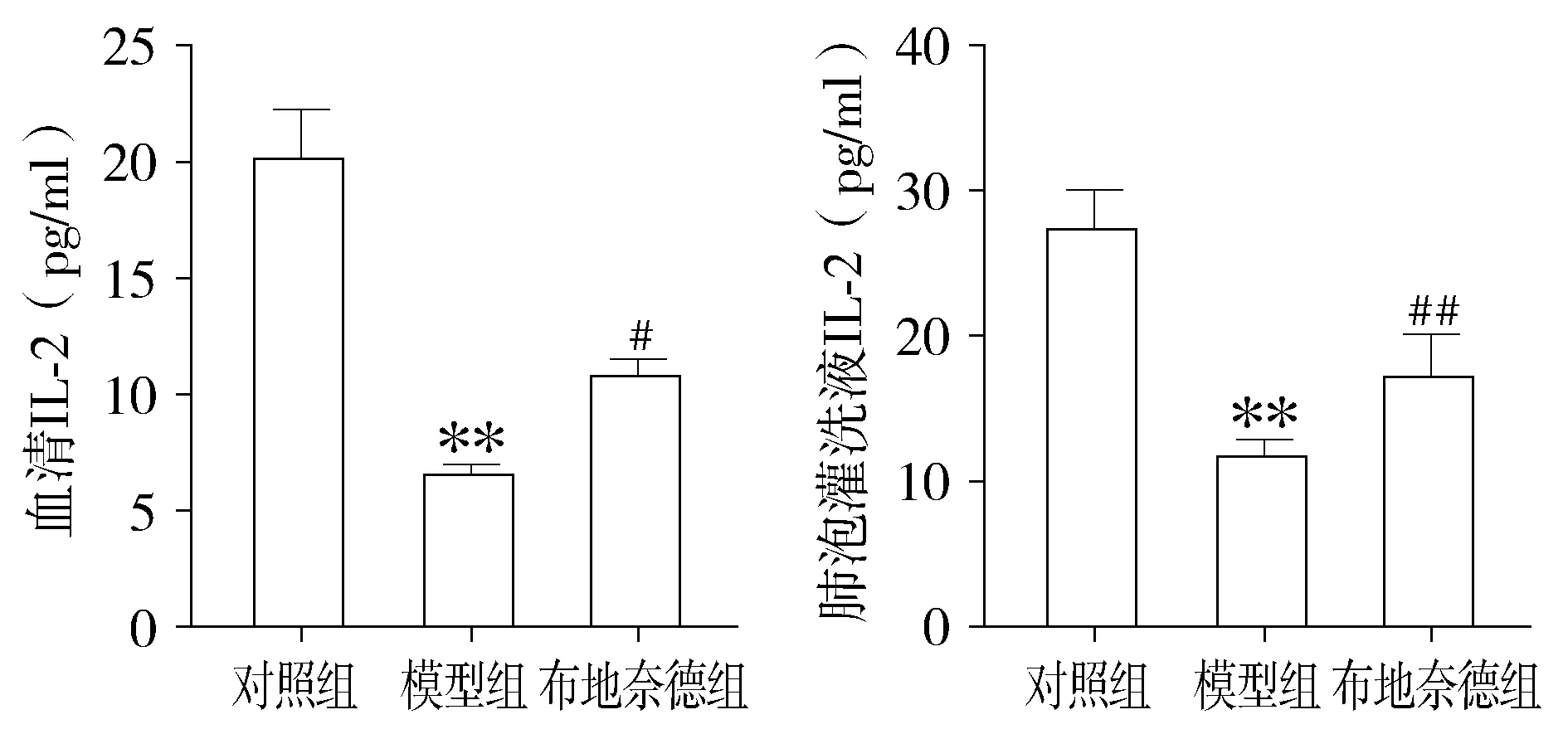
与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01图7 各组小鼠血清和肺泡灌洗液中IL-2含量 (n=12)Figure 7 Comparison of IL-2 level in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)

与对照组比较,***P<0.001;与模型组比较,##P<0.01,###P<0.001图8 各组小鼠血清和肺泡灌洗液中嗜酸性粒细胞趋化因子含量 (n=12)Figure 8 Comparison of eosinophil chemokines contents in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)

与对照组比较,***P<0.001;与模型组比较,#P<0.05,###P<0.001图9 各组小鼠血清和肺泡灌洗液中IL-13含量 (n=12)Figure 9 Comparison of IL-13 contents in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)
3 讨论
支气管哮喘(bronchial asthma)是由多种细胞和细胞组分参与的气道慢性炎症性疾病[7]。近年来,越来越多的证据表明Th1和Th2在过敏性哮喘发生中扮演者不同的角色[8,9]。当哮喘发作时,Th1细胞主要分泌IFN-γ、IL-2、IL-12等,Th2细胞主要分泌IL-4、IL-5、IL-13、嗜酸性粒细胞趋化因子等,Th1细胞可引发吞噬细胞介导的宿主防御应答,减少炎症反应,而Th2细胞可促进炎症反应。因此许多学者认为通过提高Th1细胞功能可达到抑制亢进的Th2反应,从而达到预防和治疗哮喘的目的。IFN-γ通过调节血管内皮细胞上的黏附分子表达,激活单核细胞以及增强嗜酸性粒细胞活性等而参与哮喘反应。IL-2刺激T淋巴细胞增值,促进嗜酸性粒细胞趋化,参与哮喘反应。并且哮喘是一种以嗜酸粒细胞浸润为特征的气道炎症性疾病[10],嗜酸性粒细胞趋化因子是组织嗜酸性粒细胞增多的主要调解者,促炎细胞因子TNF-γ和Th2型细胞因子IL-4各自诱导嗜酸性粒细胞趋化因子产生,并且它们的组合具有显著协同作用[11]。IL-13促进IgE合成,增强巨噬细胞和树突状细胞活性,活化嗜酸性粒细胞。本实验证明给予RSV感染哮喘小鼠雾化吸入布地奈德倾向于抑制Th2型细胞反应和增强Th1型细胞反应,最终促进Th1/Th2比例趋向正常水平[12,13]。
HMGB1(high mobility group box 1)是一种肺组织高迁移率族蛋白,具有高度保守性,在气道炎症反应中,作为一种免疫调节因子和炎性因子;Toll4(toll like receptors 4,TLR4)是一种重要的免疫识别受体,是连接获得性免疫和天然免疫的媒介,参与启动和调节气道炎症过程[14]。本实验中证明吸入布地奈德可减少RSV感染的哮喘小鼠肺组织中HMGB1与TLR4,从而减少炎症反应的进一步发生。
吸入性皮质类固醇(ICS)是控制哮喘症状的首选治疗方法[15]。低剂量ICS治疗可减少哮喘症状,增加肺功能,降低哮喘死亡的风险[16-19]。在治疗哮喘的过程中,吸入布地奈德有效地改善了大量患者(包括儿童和成人)的气道高反应性,控制了咳嗽、喘息症状,明显提高了患者的生活质量[20,21]。布地奈德混悬液具有比其他同类药物更强的局部抗炎作用。吸入后穿过细胞膜,与细胞质内的激素受体结合,进入细胞核起到抗炎作用,未与激素受体结合的布地奈德形成免疫复合物,可再次进入细胞核发挥抗炎作用,从而加强了局部抗炎效果[16]。本实验结果显示,雾化吸入布地奈德使RSV感染的哮喘小鼠肺组织中HMGB1与TLR4降低,可降低RSV感染的哮喘小鼠血清和BALF中炎细胞总数、在一定程度上诱导RSV感染的哮喘小鼠分泌Th1细胞因子IFN-γ、IL-2上调,降低嗜酸性粒细胞趋化因子及IL-13,减轻哮喘小鼠气道炎症,通过本次试验更加深入和具体地证明吸入布地奈德对RSV感染的哮喘疾病的抗炎作用及对恢复Th1/Th2细胞平衡中的调节作用,为临床应用布地奈德控制RSV感染加重的哮喘疾病提供更加深入的依据。
[1] 中华医学会儿科学分会呼吸学组.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,46(6):745-753.
[2] McIntosh K. Respiratory Syncytial Virus[M]//Evans AS, Kaslow RA.Viral Infections of Humans. 4th ed.New York and London: Plenum Medical Book Company, 1997:691-711.
[3] 王之梁,朱宗涵,张梓荆,等.1976年冬至1981年春北京地区小儿下呼吸道感染的病原学研究[J].中华儿科杂志,1985,23(2):99.
[4] 李明华,殷凯生,蔡映云,等.哮喘病学[M].北京:人民卫生出版社,2005:475-476.
[5] 刘瑞清,张国成,黄可飞,等.重组人干扰素α1b对呼吸道合胞病毒感染小鼠外周T淋巴细胞亚群及肺组织病理学的影响[J].2013,13(9):1639-1644.
[6] 张娟,魏春,孙新,等.口服酪酸梭菌减轻哮喘小鼠气道炎症的研究[J].山西医科大学学报,2015,46(11):1083-1087.
[7] 胡亚美,江载芳,申昆玲,等.诸福棠实用儿科学[M].北京:人民卫生出版社,2016:706-722.
[8] Neurath MF, Finotto S, Glimcher LH. The role of Th1/Th2 polarization in mucosal immunity[J]. Nat Med,2002,8(6):567-573.
[9] Yang YL, Pan YQ, He BS,etal. Reulatory T cells and Th1/Th2 in peripheral blood and their roles in asthmatic children[J]. Transl Pediatr, 2013, 2(1):27-33.
[10] Aeffner F, Davis IC. Respiratory syncytial virus reverses airway hyperresponsiveness tomethacholine inovalbumin-sensitized mice[J]. PLoS One, 2012, 7(10):e46660.
[11] Zhu W, Bi M, Liu Y,etal. Thrombin promotes airway remodeling via protease-activated recepror-1 and transforming growth factor-β1 in ovalbumin-allergic rats[J]. Inhaltion, 2013, 25(10):577-586.
[12] 薛涛.Th1/Th2型细胞因子及免疫状态在支气管哮喘患儿治疗前后的变化[J].中国医药导报,2013,10(33):81-83.
[13] 李付广,王芳,李玉琴,等.儿童过敏性哮喘特异性免疫治疗过程中IL-10、TGF-β1和CD4+CD25+T细胞变化[J].现代免疫学,2009,29(1):59-62.
[14] 乔俊英,宋丽,张艳丽,等.哮喘小鼠HMGB1/TLR4/NF-κB信号通路及维生素D的作用[J].中国当代儿科杂志,2017,19(1):95-96.
[15] Peebles RS Jr, Shrller JR, Collins RD,etal. Inhaled corticosteroids (ICS) is the preferred method of treatment to control asthma symptoms[J]. J Med Virol, 2001, 63(2):178-188.
[16] Adams N, Lasserson TJ, Cates CJ,etal. Fluticasone versus beclomethasone or budesonide for chronic asthma in adults and children[J]. Cochrane Database Syst Rev,2007,(4):CD002310.
[17] Suissa S, Ernst P, Benayoun S,etal. Low-dose inhaled corticosteroids and the prevention of death from asthma[J]. N Engl J Med,2000,343:332-336.
[18] Barnes NC, Hallett C, Harris TA. Clinical experience with fluticasone propionate in asthma: a meta-analysis of efficacy and systemic activity compared with budesonide and beclomethasone dipropionate at half the microgram dose or less[J]. Respir Med, 1998,92:95-104.
[19] 王旭,左志通,凌春华,等.普米克令舒、博利康尼雾化吸入治疗轻中度支气管哮喘的临床研究[J].临床肺科杂志,2008,13(3):276-277.
[20] Rubin BK, Fink JB. Novel medications for asthma: a look at the future[J]. Expert Opin Investig Drugs,2007,16:889-897.
[21] The Childhood Asthma Management Program Research Group. Long-term effects of budesonide or nedocromial in children with asthma[J]. New England J Med,2000,343:1054-1063.
Protectiveeffectofbudesonideonlunginjuryinducedbyrespiratorysyncytialvirusinasthmaticmice
GUOYing1,ZHANG Juan1,CAI Yuxiang2,ZHOU Ningjuan1,XU Haijun1,SUN Xin1*
(1DepartmentofPediatrics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofNeonatology,Children’sHospitalofXi’an;*Correspondingauthor,E-mail:sunxin6@fmmu.edu.cn)
ObjectiveTo explore the protective effect of budesonide on lung injury induced by respiratory syncytial virus(RSV) in asthmatic mice.MethodsThirty-six male BALB/c mice aged 6-8 weeks were randomly divided into control group, model group, and budesonide group(n=12 in each group). The mice in model group and budesonide group were intraperitoneally injected with OVA for sensitization and atomization inhalation to establish the model of asthma. The mice in control group were given normal saline. At day 28, 30,32, RSV virus was given intranasally every other day to establish an acute viral infection model. The mice in control group were treated with saline. The mice in budesonide group were given budesonide inhalation for 30 min once a day at day 27-33, and the bronchoalveolar lavage fluid(BALF) was collected to count the white blood cells in BALF at day 34. The pathological changes of lung tissues were observed by HE. The expression of HMGB1 and TLR4 in lung tissue was observed by immunohistochemical method. The expression of cytokine IFN-γ, IL-2, IL-13 and eosinophil chemokines in BALF and serum was detected by ELISA.ResultsCompared with control group, the number of eosinophils, neutrophils and macrophages in the BALF increased in model group and budesonide group(P<0.01). Compared with model group, the total number of leukocytes in BALF was significantly decreased in budesonide group(P<0.01), the levels of cytokines, eosinophil chemokines and IL-13 in BALF and serum were decreased(P<0.01), while IFN-γ and IL-2 levels were significantly increased(P<0.01). Pathological results of lung tissue showed that the inflammatory cell infiltration decreased in budesonide group and the expression of HMGB1 and TLR4 in lung tissue was inhibited.ConclusionBudesonide can reduce the airway inflammation in children with RSV infection and inhaled budesonide has a certain therapeutic effect in RSV-infected asthmatic mice.
budesonide; bronchial asthma; ovalbumin; lung injury; mice
郭颖,女,1979-05生,硕士,住院医师
2017-06-25
R562.25
A
1007-6611(2017)11-1135-06
10.13753/j.issn.1007-6611.2017.11.010
