FTO基因多态性及其与2个绵羊群体生长性状的相关性
2017-12-01康晓龙张莉莉王昊升冯登侦
康晓龙,张莉莉,王昊升,毛 浩,杨 润,冯登侦
(宁夏大学农学院 动物科学系,宁夏 银川 750021)
FTO基因多态性及其与2个绵羊群体生长性状的相关性
康晓龙,张莉莉,王昊升,毛 浩,杨 润,冯登侦
(宁夏大学农学院 动物科学系,宁夏 银川 750021)
【目的】本文探讨了FTO基因多态性与不同绵羊群体生长性状的相关性。【方法】采用飞行质谱技术检测了FTO基因在杜泊羊和滩寒杂交群体中的多态性及其与生长性状的相关性。【结果】FTO基因的rs160915957位点的AA基因型个体体重在杜泊和滩寒绵羊群体中分别为极显著(Plt;0.01)和显著(Plt;0.05)低于GG型个体。GG型绵羊胸围最大,且GG型杜泊羊胸围显著大于滩寒羊GG型个体(Plt;0.05)。GG型个体在2个群体中的体斜长最大,同一群体不同基因型间差异不显著(Pgt;0.05);不同基因型间,滩寒群体绵羊体高大于杜泊羊,但只有AA型个体在2个群体间显著差异(Plt;0.05)。此外,GG型个体的杜泊羊胸宽最大,AA型的最小,这与滩寒群体相反,但均没有显著性差异(Pgt;0.05)。FTO基因的rs160915957位点不同基因型对绵羊其他性状的影响差异不显著。【结论】FTO基因的rs160915957位点对杜泊及滩寒绵羊群体的体重、体斜长及胸围等具有显著影响。FTO基因是否是影响绵羊生长性状的主效基因尚待进一步探讨,但FTO基因的rs160915957位点多态性将为不同绵羊群体后代的体重、胸围等性状的选择提供参考依据。
脂肪和肥胖相关基因;FTO基因;生长性状;杜泊羊;滩寒杂交群体
【研究意义】脂肪和肥胖相关基因(fat mass and obesity associated gene,FTO)是首次利用全基因组关联研究(genome wide association study,GWAS)被证实与肥胖相关的可靠候选基因。FTO普遍表达于动物机体的各个组织[1]。FTO基因的遗传多态是否与绵羊群体的生长发育性状具有相关性,值得探讨。【前人研究进展】相关研究证实FTO基因的变异位点可影响人类的体质指数,与体重及脂肪含量的增加以及摄食行为的改变有关[2-4]。FTO基因的单核苷酸多态性不仅参与人类肥胖调控,与人糖尿病及胰岛素抵抗密切相关[5];FTO同样介导家养动物,如家猪的肌内脂肪含量、背膘厚及瘦肉率的变化[6-7]。FTO基因可作为C/EBP家族的转录辅助活化因子促进未甲基化和受甲基化抑制的基因启动子转录[8-9],参与动物机体脂肪细胞的分化及脂质代谢。此外,FTO基因还在动物β细胞功能调节[10]及氧化应激[11]等生物学过程中发挥调控功能。由于不能作为理想的肥胖动物模型,有关绵羊FTO基因的分子结构与生物学调控功能报道不多,NCBI上仅见绵羊FTO的预测序列。【本研究切入点】依据FTO基因在人类个体肥胖及家猪体重差异中的研究结果,本研究主要针对FTO基因多态性与不同群体绵羊生长性状进行相关性分析。【拟解决的关键问题】为后期绵羊杂交选育及生产养殖提供参考依据。
1 材料与方法
1.1 供试材料
本试验选用宁夏宇泊科技有限公司186只,3~4岁的绵羊作为研究对象,其中杜泊羊(DB)26只,滩寒杂交羊(TH ,F1代)160只。所选绵羊群体均健康无病且饲养管理条件一致。颈静脉采血5 mL,轻微振荡后于-20 ℃保存。绵羊体尺性状测定方法如下:体高:绵羊鬐胛最高点至地面垂直距离;体斜长:肩胛骨前缘至坐骨结节后缘的直线距离;管围:左前肢管部上三分之一处的周长;腰角宽:两侧腰角外缘间的直线距离;胸围:肩胛后端绕胸一周的长度;胸宽:两侧肩胛骨后缘最宽点的直线距离;胸深:鬐胛最高点到胸骨底面的距离。
1.2 试验方法
1.2.1 基因组DNA提取 采用哺乳动物血液DNA提取试剂盒(天根)提取绵羊基因组DNA,试验步骤和方法参考其说明书,经浓度测定后,利用1 %的琼脂糖凝胶电泳对分离DNA进行质量检测。
1.2.2 群体基因型的Sequenom SNPs分析 飞行质谱分型检测技术是一种可同时对多个位点进行检测的新型SNP分型方法。该方法在引物延伸的基础上,通过在待检SNP位点上延伸若干碱基,根据延伸产物分子质量的不同,将仅含单个不同碱基的两段序列区别开来,从而鉴定出不同基因型。
1.2.3 引物设计及PCR扩增 依据SNP位点序列,使用Sequenom公司的引物软件(Assay design 3.1)设计反应所需引物并合成,引物序列见表1。PCR扩增反应体系如表2所示;PCR产物纯化:10×SAP缓冲液0.23 μl,SAP酶0.4 μl,水2.1 μl;反应条件见表2。
1.2.4 延伸反应 反应体系:10× iPLEX buffer plus 1 μl;iPLEX terminator 0.27 μl;Primer Mix 1.1 μl;iPlex酶0.06 μl;水1.05 μl。扩增条件如表2所示。反应样品经树脂纯化后,转入Sequenom芯片上进行电离飞行时间质谱分析,收集数据,完成分型。
1.2.5 数据处理与统计分析 使用Excel统计各位点的基因频率、基因型频率;利用SPSS 22.0软件对个体基因型与体尺表型进行相关性分析,以最小二乘均值±标准差表示。
基因效应方差分析模型:Y=μ+G+m+e
其中,Y为性状测定值,μ为群体均值,G为基因型效应,m为性别效应,e为随机残差。
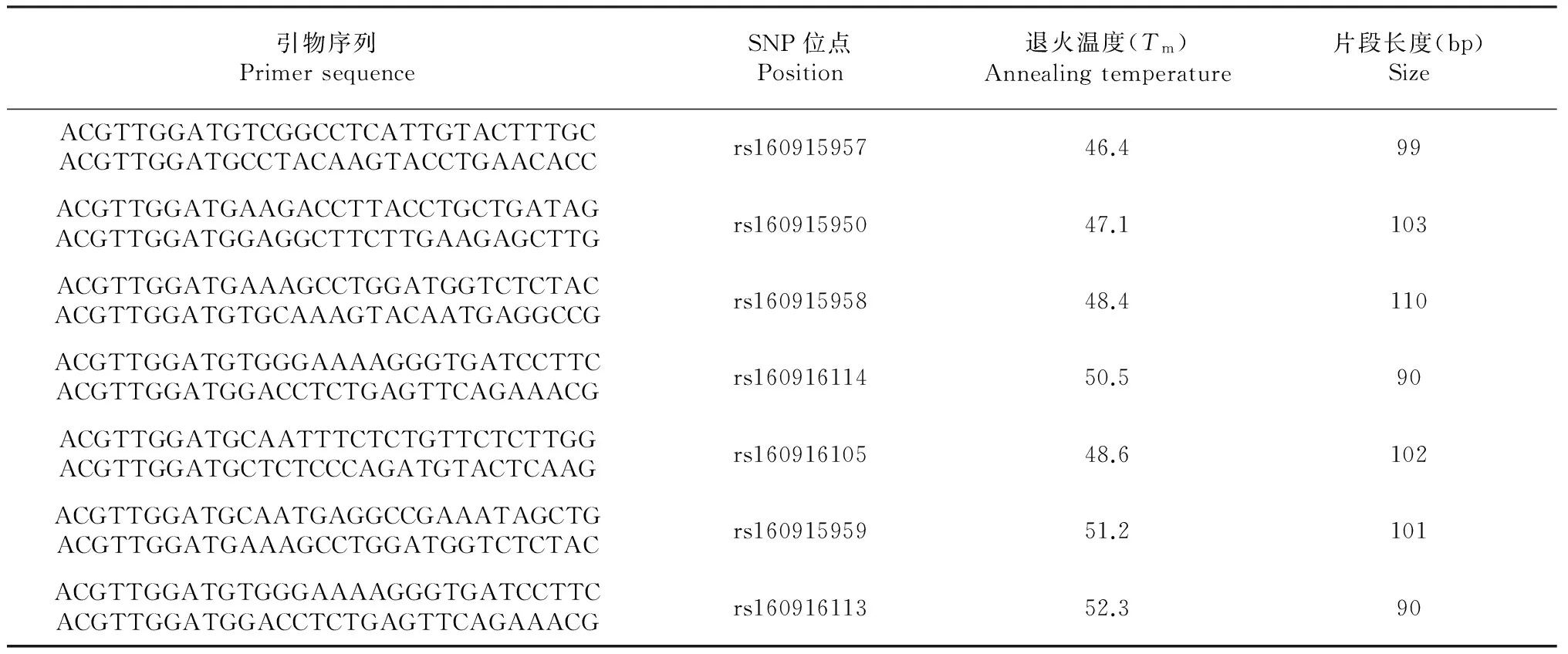
表1 Sequenom SNP FTO基因测序引物信息

表2 PCR反应条件

图1 绵羊血液DNA凝胶电泳分析Fig.1 Gel electrophoresis analysis of DNA for sheep blood
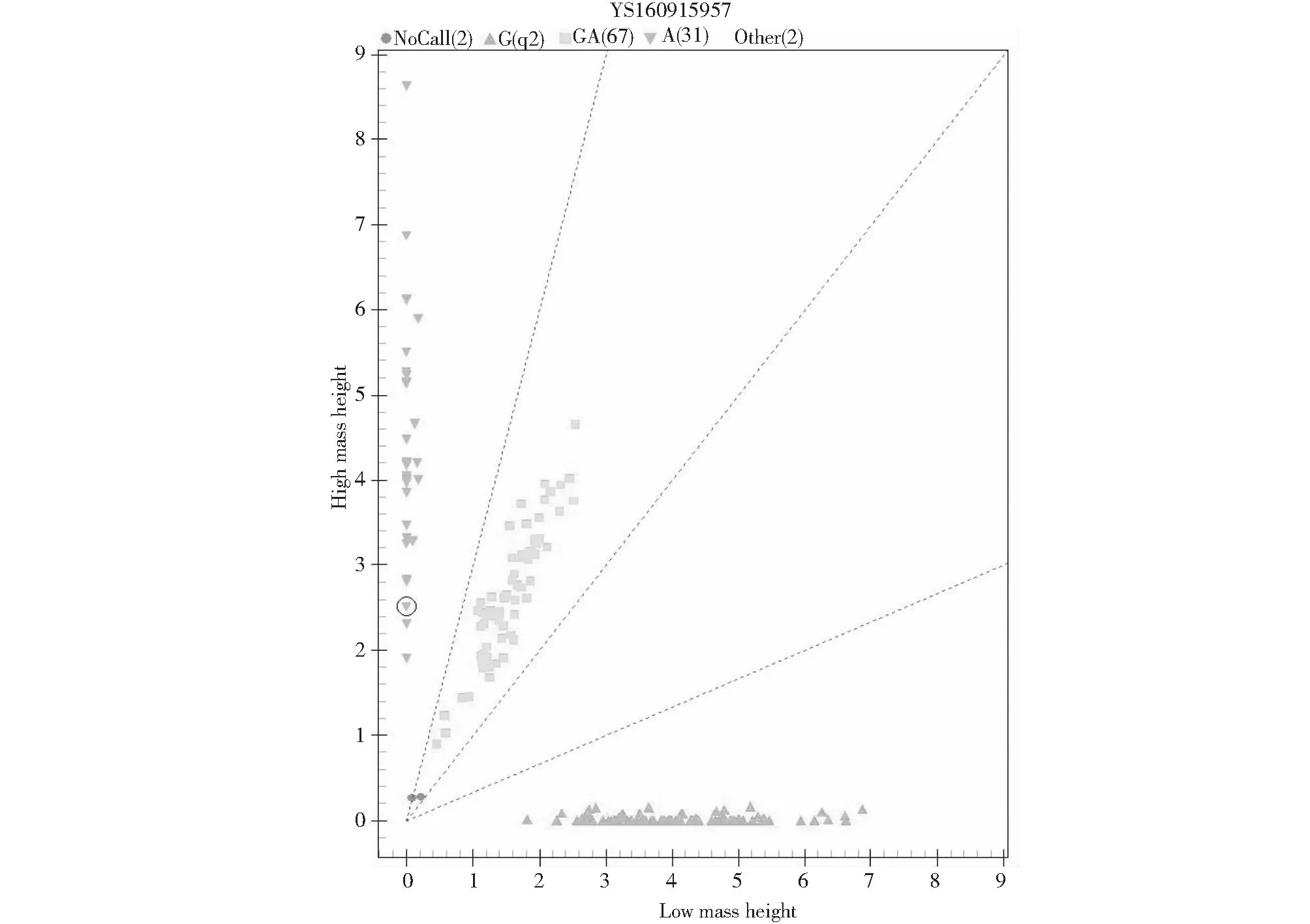
A (橙色): AA型个体,GA(绿色): GA型个体,G (蓝色): GG型个体A: The genotype of individuals in the orange region was AA; GA: The genotype of individuals in green region was GA; G: The genotype of individuals in blue region was GG图2 绵羊FTO基因飞行质谱检测Fig.2 Mass spectrometry results for FTO gene

位点Loci基因型Genotype基因型频率Genotypefrequency等位基因Allele等位基因频率AllelicfrequencyDBTHDBTHDBTHDBTHrs160915957AA(9)AA(21)0.3460.130AA0.550.36GA(10)GA(56)0.3850.350GG0.450.64GG(7)GG(81)0.2690.510rs160915959CC(26)CC(158)11rs160916105TT(26)TT(158)11rs160916113CC(26)CC(158)11rs160915950AA(26)AA(158)11rs160915958TT(26)TT(157)10.981TC(1)0.006rs160916114CC(26)CC(157)10.994CT(1)0.006
2 结果与分析
2.1 血液DNA提取
通过对绵羊186个个体血液DNA提取及质量检测,所有样品质量均合格(图1)。实验测定的DNA浓度在1.8~2.1,单个样品浓度gt;20 ng/μl,单个样品实验总量gt;1 μg,样品无大分子污染,样品保持完整,无降解;可用于后续实验。
2.2 试验群体FTO基因质谱分型
经Sequenom SNP测序分析,FTO基因不同位点均能检出相关基因型,检出率为98.92 %,未检出个体占1.08 %。除rs160915957位点外,其余位点均检测到1中基因型(图2),其中rs160915958与rs160916114位点无统计学意义,不作进一步分析。
2.3 FTO基因检测位点的遗传多态性分析
由表3分析显示,在DB群体中,AA基因型占34.6 %,GA基因型为38.5 %,GG基因型为26.9 %,A为优势等位基因;而在TH群体中,GG基因占51.3 %,GA基因型为35.4 %,AA基因型为13.3 %,G为优势等位基因。
FTO基因是一个在不同物种间早已报道的基因,其在NCBI数据库rs160915957位点,即绵羊14号染色体21594213碱基处(第一外显子7795bp),有一A→G的错义突变,并导致相应的氨基酸由蛋氨酸Met突变为缬氨酸Val(图3)。本实验测序结果显示,FTO基因rs160915957位点在2个绵羊群体中分别有3种基因型,AA,GA,GG型。其中,在DB群体中,A和G等位基因频率分别为0.55和0.45;在TH群体中,A和G等位基因频率分别为0.36和0.64。
2.4 FTO基因测定位点与生产性状的相关性分析
针对FTO基因rs160915957位点与DB和TH绵羊群体主要生长性状的相关性分析表明,AA基因型个体在两个绵羊群体中的体重最小,而GG型个体的体重最大(表4);DB群体中,不同基因型间的个体体重差异极显著(Plt;0.01),而TH群体中,除AA型个体体重显著小于GG型个体外,其余无显著差异。不同基因型间,TH群体绵羊体高大于DB群体,但只有AA型个体在两个群体间显著差异(Plt;0.05)。2个群体中,GG型绵羊胸围最大,其中DB群体GG型个体显著高于杂合子个体,且DB个体胸围显著大于TH绵羊个体;对于该位点与绵羊胸宽性状的相关性分析,两个群体具有差异,在DB群体中GG型个体胸宽最大,而AA型最小;而在TH群体中,则为AA型个体胸宽最大,GG型个体最小,但在统计学上没有显著性差异。同时,GG型个体在2个群体中的体斜长表型中最大,2个群体中不同基因型间无显著差异,但TH群体AA型个体的体斜长显著低于DB各基因型个体。此外,在2个群体绵羊的腰角宽表型中,杂合子个体低于其他基因型,但不具有统计学意义(Pgt;0.05)。

图3 绵羊FTO基因rs160915957位点信息Fig.3 Location information for rs160915957 loci of sheep FTO

品种Breeds基因型Genotype生长性状(Mean±S.D.)Growthtraits体重(kg)Bodyweight体高(cm)Bodyheight体斜长(cm)Bodylength胸围(cm)Chestgirth胸深(cm)Chestdepth胸宽(cm)Chestwidth管围(cm)Shincircumference腰角宽(cm)HipwidthDBAA51.92±4.45A64.50±4.06a67.19±4.37b91.36±3.90a33.45±3.2621.93±3.629.18±1.7321.09±2.08GA62.23±3.73B65.15±3.37ac66.28±3.39b91.99±2.43a33.90±3.6424.39±3.158.56±1.3417.64±3.87GG75.50±4.45C65.58±5.32ac68.68±3.76b97.43±2.13b33.80±3.9126.08±2.9710.38±1.7418.48±2.64THAA37.98±3.31Da70.75±3.71b61.03±2.86a86.68±3.55ad35.27±3.5523.32±2.298.17±1.4018.10±3.41GA40.44±3.32Dab68.96±4.59ab64.46±4.14ab84.80±4.41dc33.99±3.6921.80±3.159.28±2.1317.68±1.95GG42.83±4.37Db69.82±4.04bc65.38±3.17ab87.11±3.32ad33.68±4.3821.63±4.388.61±1.5418.26±2.37
注:同列标有不同大写字母表示差异极显著(Plt;0.01),不同小写字母表示差异显著(Plt;0.05)。
Note: Data with a different superscript capital letters in one column was significant at 0.01 level, and small letters at 0.05 level.
3 讨 论
FTO基因是最早报道与哺乳动物肥胖相关的等位基因。人及模式生物小鼠方面的FTO研究主要集中于位点多态与食物摄入及肥胖疾病之间的相关性,从而为预防人类肥胖提供参考。如FTO基因rs9939609位点突变与我国成年人肥胖之间具有显著的相关性[12]。随着对FTO基因研究的不断深入,关于FTO基因与畜禽生长发育、脂肪沉积及肉品质相关的报道也逐渐增多。以牛为试验动物的研究结果表明,FTO基因核苷酸多态性影响杂交牛的生长体重和平均日增重[13]。同时FTO基因单核苷酸多态性不仅影响猪的平均日增重[14],猪FTO基因g.276Tgt;G位点多态与其脂肪特征、大理石纹、背部脂肪厚度和肌内脂肪含量密切相关[15]。家兔FTO基因的c. 499Ggt;A位点显著影响35、70和84日龄新西兰兔的体重;其中c.660Tgt;C位点的CC基因型显著影响84日龄新西兰兔的体重、平均日增重及肌内脂肪含量[16]。
在绵羊研究中,已有的报道主要集中于FTO基因的组织时空表达差异及其多态性与绵羊脂肪沉积的相关性分析[17-18]。针对杜泊羊(DB)及与滩寒(TH)杂交羊的生长体尺差异,本试验选择FTO基因多个位点与两个群体绵羊的生长性状进行遗传相关性检测。通过飞行质谱分型技术对FTO基因7个位点的遗传分析,除rs160915957位点外,其余6个位点只检测出一种或无统计学意义的基因型,提示rs160915957位点与试验绵羊群体的生长发育具有一定的相关性。本研究中,不论是杜泊群体(DB)或滩寒杂交群体(TH),rs160915957位点的GG基因型个体在体重方面显著高于其他基因型个体。研究表明,杜泊羊在1、2、3及4月龄的平均日增重均显著高于我国本土绵羊[19]。结合本试验结果,FTO基因可能与杜泊羊及滩寒杂交羊的体重具有显著的相关性。由于TH群体具有小尾寒羊血统,TH羊AA基因型个体体高显著高于DB羊。2个群体中,GG型个体胸围最大,同一群体不同基因型间无显著差异,但DB群体不同基因型个体胸围均高于TH群体各基因型,可能是由于品种间本身的遗传差异所致。此外,无论同一群体不同基因型间或同一基因型中的不同群体,胸深、胸宽、管围及腰角宽均无显著差异,提示FTO基因的rs160915957位点与上述表型性状相关性较小。
除了单核苷酸变异外,基因的表达差异也可能会导致动物个体的体重及体尺差异。FTO基因在绵羊多个部位均有表达,但脂肪与下丘脑之间FTO基因表达存在显著差异[17],这与在人类方面的报道吻合[20]。下丘脑是能量调节的中枢,禁食48 h大鼠的FTO基因的表达与下丘脑正向调节存在正相关;FTO表达水平与弓状核中促进食欲的促生长激素神经肽类似肽的表达存在显著负相关[21]。FTO基因表达位点不仅存在促食欲肽类,如β-内啡肽和NPY等,也存在抑制食欲的肽类,如α-MSH。因此,FTO基因对机体体重、生长发育的调节可能通过介导动物采食中枢过程发挥作用。通过对妊娠绵羊分别给予充足食物或者从妊娠早期至中期只给予半量食物供给的研究表明,在妊娠110 d时,绵羊胎盘中FTO基因表达量与胎羊的体重存在显著正相关[22]。因此,FTO基因可能通过对采食中枢—下丘脑的调节,参与绵羊采食行为调控,引起生长体尺性状差异。
早期的FTO研究主要针对位点多态与动物体重增加、能量平衡调控、脂肪沉积及肥胖相关性开展研究。FTO基因位点变异是否参与绵羊群体生长差异的主要基因,报道较少。本研究结果中,FTO基因rs160915957位点与2个绵羊群体的体重、体高、体斜长及胸围方面具有相关性,提示除了与肉质性状及脂肪沉积与肥胖相关外,FTO基因与绵羊的体格大小及生长发育亦具有相关性。杜滩寒三元杂交羔羊在日增重和屠宰性能方面均极显著高于滩寒杂交羔羊(Plt;0.01)[23]。因此,以杜泊羊做终端父本与滩寒杂交羊群体进行三元经济杂交可能具有较高的生长潜力与屠宰性能。
4 结 论
由本研究结果可知,FTO基因的rs160915957位点可作为杜泊羊及滩寒杂交羊标记辅助育种的候选位点,可对后续杂交育种中绵羊的体重、体高、体斜长及胸围性状的选择提供依据。然而由于样本量及基因位点数量的限制,后续研究可在扩大样本量及分析FTO基因其他SNPs位点的基础上,明确FTO基因与绵羊主要生长性状的相关性;而从表达水平研究FTO基因的表达差异及其对绵羊生长性状的分子调控也将为绵羊FTO基因的生物学功能研究奠定基础。
[1]Madsen M B,Birck M M,Fredholm M,et al. Expression studies of the obesity candidated gene FTO in pig[J]. Animal Biotechnology, 2010, 21(1): 51-63.
[2]Dina C, Meyre D, Gallina S, et al. Variation inFTOcontributes to childhood obesity and severe adult obesity[J]. Nature Genetics, 2007, 39(6): 724-726.
[3]Hotta K, Nakata Y, Matsuo T, et al. Variations in theFTOgene are associated with severe obesity in the Japanese[J]. Journal of Human Genetics, 2008, 53(6): 546-553.
[4]Thorleifsson G, Walters G B, Gudbjartsson D F, et al. Genome-wide association yields new sequence variants at seven loci that associate with measures of obesity[J]. Nature Genetics, 2009, 41(1): 18-24.
[5]Keller L, Xu W, Wang H X, et al. The obesity related gene, FTO, interacts with APOE, and is associated with Alzheimer's disease risk: a prospective cohort study[J]. Journal of Alzheimer's Disease, 2011, 23(3): 461-469.
[6]Huang J M, Yang Y Z, Liu G, et al. Molecular cloning and characterization of the porcine FTO promoter and coding regions[J]. Molecular Biology Reports, 2011, 38(4): 2855-2862.
[7]Fontanesi L, Scotti E, Buttazzoni L, et al. Confirmed association between a single nucleotide polymorphism in theFTOgene and obesity-related traits in heavy pigs[J]. Molecular Biology Reports, 2010, 37(1): 461-466.
[8]Wu Q, Saunders R A, Szkudlarek-Mikho M, et al. The obesity-associatedFT0 gene is a transcriptional coactivator[J]. Biochemical and Biophysical Research Communications, 2010, 401(3): 390-395.
[9]Pelorossof G, Balmain A. C/EBPδ: friend or foe? A novel role for C/EBPδ in metastasis[J]. The EMBO Journal, 2010, 29(24): 4063-4065.
[10]Russell M A, Morgan N G. Conditional expression of theFTOgene product in rat INS-1 cells reveals its rapid turnover and a role in the profile of glucose-induced insulin secretion[J]. Clinical Science, 2011, 120(9): 403-413.
[11]Bravard A, Lefai E, Meugnier E, et al. FTO is increased in muscle during type 2 diabetes, and its overexpression in myotubes alters insulin signaling, enhances lipogenesis and ROS production, and induces mitochondrial dysfunction[J]. Diabetes, 2011, 60(1): 258-268.
[12]Li X Y,Song F F, Jiang H, et al. A genetic variation in the fat mass- and obesity-associated gene is associated with obesity and newly diagnosed type 2 diabetes in a Chinese population[J]. Diabetes/Metabolism Research Reviews, 2010, 26(2): 128-132.
[13]Rempel L A, Casas E, Shackeford S D, et al. Relationship of polymorphisms within metabolic genes and carcass traits in crossbred beef cattle[J]. Journal of Animal Science, 2012, 90(4):1311-1316.
[14]Fan B, Du Z Q, Rothschild M F. The fat mass and obesity-associated (FTO) gene is associated with intramuscular fat content and growth rate in the pig[J]. Animal Biotechnology, 2009, 20(2): 58-70.
[15]Fontanesi L, Scotti E, Buttazzoni L, et al. The porcine fat mass and obesity associated (FTO) gene is associated with fat deposition in Italian Duroc pigs[J]. Animal Genetics, 2009, 40(1): 90-93.
[16]Zhang G W, Lian G, Chen S Y, et al. Singe nucleotide polymorphisms in theFTOgene and their association with growth and meat quality traits in rabbits[J]. Gene, 2013, 527(2): 553-557.
[17]王金泉,王肖燕,叶 青,等. 阿勒泰大尾羊与小尾寒羊不同组织FTO基因的检测[J]. 动物医学进展, 2013, 34(12): 84-88.
[18]王肖燕. 阿勒泰大尾羊FTO基因表达的时空特异性及其与脂肪沉积的相关性研究[D]. 乌鲁木齐:新疆农业大学,2014.
[19]贝丽琴,徐尚荣,杜泊羊. 藏羊及其杂种一代生长发育对比研究[J]. 青海畜牧兽医杂志,2015(5):15-18.
[20]Zabena C, Gonzalez-sanchez J L, Martinez-Larrad M T, et al. The FTO obesity gene. Genotyping and gene expression analysis in morbidly obese patients[J]. Obesity Surgery, 2009, 19(1): 87-95.
[21]Fredriksson R, Hagglund M, Olszewski P K, et al. The obesity gene, FTO, is of ancient origin, up-regulated during food deprivation and expressed in neurons of feeding-related nuclei of the brain[J]. Endocrinology, 2008, 149(5): 2062-2071.
[22]Sebert S P, Hyatt M A, Chan L L Y, et al. Influence of prenatal nutrition and obesity on tissue specific fat mass and obesity-associated (FTO) gene expression[J]. Reproduction, 2010, 139(1): 265-274.
[23]杜文国,李新春,吴 鑫,等. 杜泊羊与 “寒滩” 三元杂交羔羊育肥效果研究[J]. 中国草食动物科学,2016,36(5): 67-68.
(责任编辑 陈 虹)
AssociationofFTOGeneGeneticVariationwithGrowthTraitsofTwoSheepPopulation
KANG Xiao-long, ZHANG Li-li, WANG Hao-sheng, MAO Hao, YANG Run, FENG Deng-zhen
(School of Agriculture, Ningxia University, Ningxia Yinchuan 750021, China)
【Objective】In this paper, the association betweenFTOgene polymorphism and the growth traits of two sheep populations were investigated.【Method】The polymorphisms ofFTOgene in Dorper and Tan×Han hybrid sheep and their correlation with growth traits by sequenom SNP technology were investigated. 【Result】The body weight of AA genotype at the rs160915957 locus of theFTOgene was significantly different (Plt;0.01) and significantly lower (Plt;0.05) than that of the GG type in two sheep. GG type sheep had the largest bust value, and the chest girth of GG individuals in Doper sheep was larger than that of Tan×Han sheep. The body length of GG individuals was the largest in both sheep groups, but there was no significant difference among genotypes in same group (Pgt;0.05); The body height of TH sheep was higher than that of DB sheep among three genotypes, but only AA group had significant difference between the two groups (Plt;0.05). In addition, GG individuals had the largest breast width while AA type were the lowest one, which was contrary to Tan×Han group (Pgt;0.05). There were no significant differences of rs160915957 locus ofFTOgene in other growth traits of sheep. 【Conclusion】The above results demonstrated that the rs160915957 locus ofFTOgene had a significant effect on the body weight, length, height and chest girth of two sheep population,whether theFTOgene was the major gene affecting the growth traits of sheep remained to be further explored, but the rs160915957 polymorphism ofFTOgene would provide a reference for traits selection in different sheep offsprings.
Fat mass and obesity associated gene;FTOgene; Growth traits; Dorper sheep; Tan×Han hybrid sheep
S826
A
1001-4829(2017)11-2603-06
10.16213/j.cnki.scjas.2017.11.036
2017-05-20
宁夏自然科学基金(NZ15030)
康晓龙(1982-),男,回族,副教授,博士,主要从事动物分子遗传育种研究,E-mail:kangxl@nxu.edu.cn。
