黄花马铃苣苔不定芽高频再生研究
2017-12-01,,,,,
, , , , ,
(海南省农业科学院园林花卉研究所, 海口 571100)
黄花马铃苣苔不定芽高频再生研究
潘梅,符瑞侃,戚华莎,吕德任,王景飞,黄赛
(海南省农业科学院园林花卉研究所, 海口 571100)
以无菌植株叶片作为外植体,从接入方式、培养基pH值、MS无机盐浓度、糖浓度、植物激素种类及配比等方面研究了黄花马铃苣苔叶片不定芽再生的影响因素。结果表明,黄花马铃苣苔叶片再生芽的最佳诱导培养基为MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+蔗糖30 g/L,灭菌前pH值为6.5,在此培养基上,叶面朝上接种的叶片经过50 d的培养,可获得100%的再生率和平均32.33个不定芽,黄花马铃苣苔(OreocharisflavidaMerr.)是苦苣苔科马铃苣苔属多年生草本植物,生于海拔1 600~1 800 m山坡林下,是海南特有的野生花卉,分布于保亭、乐东、定安、白沙、陵水、东方、琼海7县市[1]。其株型紧凑,叶全部基生,具长柄,叶片卵形至宽卵形,聚伞花序伞状,每花序具3~4花,花冠斜钟状,淡黄色,花期约10月,果期11月[2]。是盆栽观赏、阴生地被的优秀植物材料。苦苣苔科野生植物的组织培养与快速繁殖已有报道[3-14],多以叶片作为诱导外植体,但对不定芽的再生均无详细的研究,而叶片不定芽的高效再生是苦苣苔科植物组培快繁的最为关键的步骤之一。目前,对黄花马铃苣苔的研究只有资源分布及观赏性等方面的报道,尚无组织培养的研究,本属植物的组培快繁研究也未见有报道。该试验以黄花马铃苣苔无菌植株叶片作为试验材料,对其离体培养诱导不定芽的相关因子进行研究,以期建立黄花马铃苣苔的离体快速繁殖技术,为该植物的种质保存、繁育和开发利用等提供技术基础。
黄花马铃苣苔; 叶片; 不定芽; 培养基
1 材料与方法
1.1 供试材料
植物材料采用从野外引种种植于海南省农业科学院热带园艺研究所种质圃的黄花马铃苣苔叶片,取健康幼嫩叶片进行表面灭菌培养所得的无菌植株叶片作为试验材料。
培养基及培养条件,无特殊说明情况下,以MS为基本培养基,添加30.0 g/L的食用白糖,9.0 g/L的卡拉胶,灭菌前pH=6.5,培养温度为(26±2)℃,光照强度为1 500 lx,光照时间9 h/d。
1.2 试验方法
1.2.1 接入方式对不定芽再生的影响
在MS培养基中添加6-BA和NAA各0.1 mg/L,以叶面朝上或叶背朝上2种方式将叶片接入培养基上。
1.2.2 pH值对不定芽再生的影响
在MS培养基中添加6-BA和NAA各0.1 mg/L,pH值设置分别为5.0、5.5、6.0、6.5、7.0。
1.2.3 无机盐浓度对不定芽再生的影响
设置4种MS无机盐浓度:1/4、2/4、3/4 MS和MS,分别添加6-BA和NAA各0.1 mg/L。
1.2.4 细胞分裂素种类对不定芽再生的影响
在MS+NAA 0.1 mg/L的基本培养基中分别添加6-BA、KT和TDZ各0.1 mg/L。
1.2.5 蔗糖浓度对不定芽再生的影响
在MS培养基中添加6-BA和NAA各0.1 mg/L,设置5个蔗糖浓度:10、20、30、40、50 g/L。
1.2.6 温度对叶片不定芽再生的影响
在MS培养基中添加6-BA和NAA各0.1 mg/L,设置3个培养温度:25、28、31 ℃。
1.2.7 光照强度对叶片不定芽再生的影响
在MS培养基中添加6-BA和NAA各0.1 mg/L,设置3种光照强度:1 000,1 500,2 000 lx。
1.2.8 植物激素配比对不定芽再生的影响
基本培养基为MS,6-BA与NAA浓度配比设置6个处理:0.1∶0.1、0.1∶0.5、0.5∶0.1、.05∶0.5、1.0∶0.1、1.0∶0.5。
1.3 数据分析
无菌植株叶片约0.5 cm×0.5 cm,无特殊说明,均是以叶面朝上接入培养基中(见图1),每种处理设3次重复,每次8袋,每袋接入3片叶,50 d后调查不定芽再生率和平均不定芽数。不定芽再生率(%)=出芽叶片数/接种叶片数×100%,平均不定芽数=不定芽总数/出芽叶片数。用Excel 2007和Duncan进行数据分析。
2 结果与分析
2.1 接入方式对不定芽再生的影响
接入15 d左右叶片外植体逐渐膨大,20 d开始出现愈伤组织,呈绿色透明状,35 d左右长出翠绿色不定芽(图2),50 d后在叶片周边和叶片上下面均分化出大量的不定芽。2种接入方式的不定芽再生率差值较小(见表1),叶背接触培养基的再生率为97.22%,叶面接触培养基的再生率则为93.83%,平均每叶不定芽数分别为26.70个和21.62个,2种接种方式不定芽的长势均表现良好,芽粗大。方差检测结果表明,接入方式对不定芽的再生率和平均不定芽数的影响极为显著,因此,宜以叶面朝上的接种方式进行黄花马铃苣苔的不定芽再生诱导。
表1 接入方式对黄花马铃苣苔不定芽再生的影响
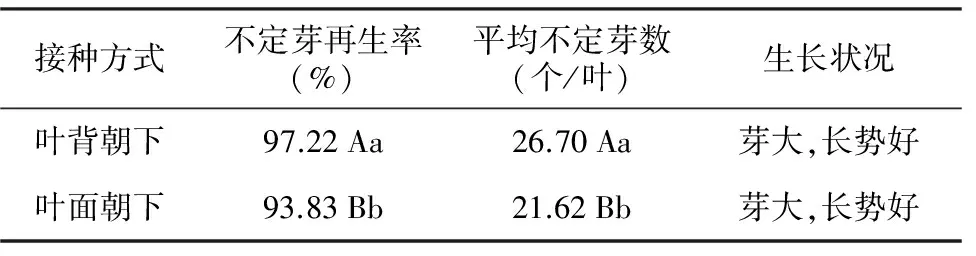
接种方式不定芽再生率(%)平均不定芽数(个/叶)生长状况叶背朝下97.22Aa26.70Aa芽大,长势好叶面朝下93.83Bb21.62Bb芽大,长势好
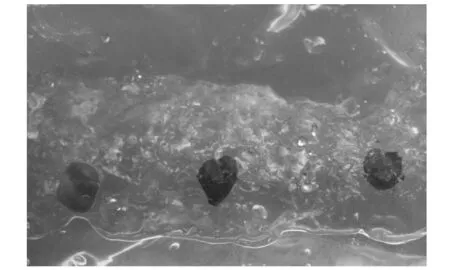
图1 黄花马铃苣苔接种叶片

图2 培养35 d分化的不定芽
2.2 pH值对不定芽再生的影响
由表2可知,黄花马铃苣苔的不定芽诱导所需的pH值较高,pH=5.0时,不定芽再生率最低,只有83.330%,诱导的不定芽数小而少,平均每叶仅有11.62个,愈伤组织多;pH=5.5时,不定芽再生率偏低,为86.11%,诱导的不定芽数有较大的提高,达到20.26个,但芽也较为细小,愈伤组织较多;pH=6.0时,不定芽再生率提高到95.46%,不定芽数与pH=5.5时差异不大,但芽较大,可见2~4张小叶,高0.2~0.5 cm,仍有较多的愈伤组织;pH=6.5时,不定芽再生率最高,达到97.10%;叶片发生不定芽的时间早,培养35 d时已有少量的不定芽长出,50 d每叶分化的不定芽数平均达到26.22个,且分化整齐无愈伤组织,芽较大,多为0.5~0.8 cm,有2~4张小叶;pH=7.0时,不定芽再生率下降,不定芽数减少,芽致密较小,芽长0.2~0.4 cm。经方差分析,pH=6.5与其它各处理间不定芽再生率的差异达到极显著或显著性水平;平均不定芽数与其它各处理间的差异则达到极显著性水平。因此,pH=6.5最适合黄花马铃苣苔的叶片培养。
表2 pH值对黄花马铃苣苔不定芽再生的影响
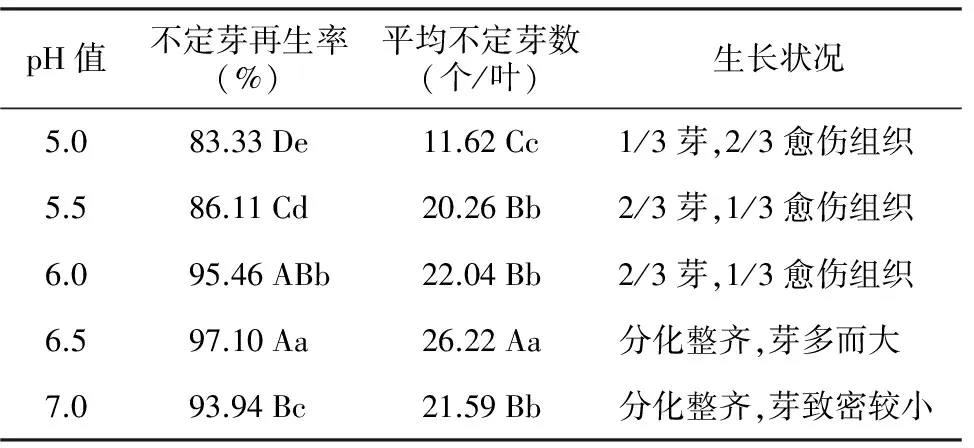
pH值不定芽再生率(%)平均不定芽数(个/叶)生长状况5.083.33De11.62Cc1/3芽,2/3愈伤组织5.586.11Cd20.26Bb2/3芽,1/3愈伤组织6.095.46ABb22.04Bb2/3芽,1/3愈伤组织6.597.10Aa26.22Aa分化整齐,芽多而大7.093.94Bc21.59Bb分化整齐,芽致密较小
2.3 无机盐浓度对不定芽再生的影响
从表3可知,各处理不定芽再生率介于95.0%~96.97%之间,其中MS、3/4 MS、2/4 MS间差异不显著,但三者与1/4 MS间的差异达到显著性水平;不同的无机盐浓度对不定芽数的影响则达到极显著性水平,对芽的生长影响也极大,1/4 MS诱导的不定芽生长势差,芽少而小,多呈芽点状,有较多的愈伤组织;2/4 MS诱导的不定芽小而密,发根多;3/4 MS诱导的芽长势好,但芽小;MS诱导的不定芽生长势好,芽体大而整齐。因此,黄花马铃苣苔叶片诱导培养宜选择全量的MS。
表3 MS无机盐浓度对黄花马铃苣苔不定芽再生的影响

无机盐浓度不定芽再生率(%)平均不定芽数(个/叶)不定芽生长状况1/4MS95.0Ab9.63Dd愈伤多,芽少而小,高0.1~0.2cm2/4MS95.65Aa13.56Cc芽小而密,高0.2~0.4cm,长根3/4MS96.97Aa19.46Bb芽小,多为0.3cmMS96.97Aa25.11Aa长势好,芽整齐,高多为0.5cm
2.4 细胞分裂素对不定芽再生的影响
从表4可看出,6-BA对黄花马铃苣苔叶片不定芽的诱导效果最好,不定芽的再生率和不定芽数最高,分别达到98.59%和25.32个,其不定芽的再生率极显著优于TDZ,与KT的差异也达到显著性水平;不定芽数则极显著优于KT和TDZ,KT与TDZ的差异也极显著。从生长状况看,不同细胞分裂素诱导的芽均生长正常,没有玻璃化苗出现。含6-BA的培养基,愈伤组织分化整齐,不定芽长势好,芽长;KT诱导的不定芽长势也好,但仍有少量的愈伤组织,芽较为短小;而TDZ诱导的芽长势差,芽小,且愈伤组织多,因此,黄花马铃苣苔不定芽再生的最佳细胞分裂素为6-BA。
表4 细胞分裂素对黄花马铃苣苔不定芽再生的影响

细胞分裂素不定芽再生率(%)平均不定芽数(个/叶)生长状况6⁃BA98.59Aa25.32Aa无愈伤,芽长0.4~0.7cm,长势好KT95.83Ab21.81Bb极少愈伤,芽长0.2~0.5cm,长势好TDZ91.67Bc15.93Cc愈伤多,芽小,多为0.2cm,长势差
2.5 蔗糖浓度对不定芽再生的影响
蔗糖浓度对黄花马铃苣苔不定芽的再生有较大的影响,过高或过低的蔗糖均不利于不定芽的诱导和生长(见表5)。就不定芽再生率而言,适宜的蔗糖浓度为20~40 g/L,再生率达到95%以上,20 g/L、30 g/L、40 g/L蔗糖间的差异不显著,而三者与10 g/L和50 g/L蔗糖间的差异达到极显著性水平。从不定芽数看,以30 g/L蔗糖浓度为佳,平均每叶不定芽数最多,达到24.56个,与其它各处理间的差异则达到显著性水平。从生长状况看,10~20 g/L的蔗糖培养50 d仍有愈伤组织未分化,其芽较小,长势较差;40 g/L蔗糖诱导的芽小而密,长势差;50 g/L蔗糖有较多的愈伤组织,芽发生晚、且小而密,长势差,接种叶片出现褐化死亡;30 g/L的蔗糖诱导的芽整齐,高多为0.5 cm,长势好。综合考虑,30 g/L的蔗糖浓度最适合黄花马铃苣苔叶片不定芽的发生。
表5 蔗糖浓度对黄花马铃苣苔不定芽再生的影响
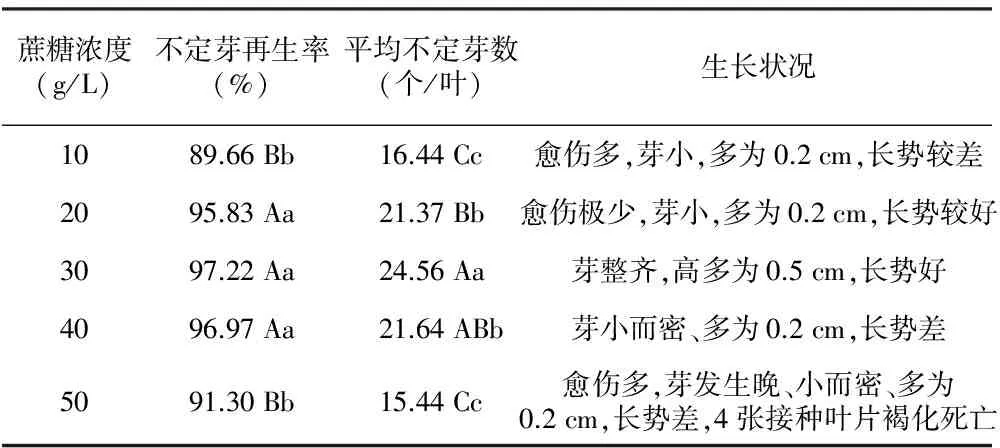
蔗糖浓度(g/L)不定芽再生率(%)平均不定芽数(个/叶)生长状况1089.66Bb16.44Cc愈伤多,芽小,多为0.2cm,长势较差2095.83Aa21.37Bb愈伤极少,芽小,多为0.2cm,长势较好3097.22Aa24.56Aa芽整齐,高多为0.5cm,长势好4096.97Aa21.64ABb芽小而密、多为0.2cm,长势差5091.30Bb15.44Cc愈伤多,芽发生晚、小而密、多为0.2cm,长势差,4张接种叶片褐化死亡
2.6 温度对叶片不定芽再生的影响
从表6可看出,黄花马铃苣苔叶片不定芽再生率和不定芽数由高至低依次为28 ℃gt;25 ℃gt;31 ℃,25 ℃和28 ℃的不定芽再生率不定芽数接近,31 ℃培养条件下,不定芽再生率大幅下降至66.67%,不定芽数减少1/2以上。差异显著性检验结果表明,25 ℃和28 ℃间不定芽再生率和平均不定芽数的差异不显著,而与31 ℃间的差异极显著。25~28 ℃时,不定芽生长良好,叶色绿;31 ℃时,芽生长势差,芽细小,部分叶片黄化,有少量芽死亡。因此适合黄花马铃苣苔叶片不定芽诱导的培养温度为25~28 ℃。
表6 培养温度对黄花马铃苣苔不定芽再生的影响

温度(℃)不定芽再生率(%)平均不定芽数(个/叶)生长状况2597.22Aa24.15Aa芽长0.3~0.6cm,长势好2898.61Aa24.41Aa芽长0.3~0.60cm,长势好3166.67Bb11.52Bb芽细小,芽长多为0.2cm,出现死芽
2.7 光照强度对叶片不定芽再生的影响
随着光照强度的增加,黄花马铃苣苔不定芽再生率和平均不定芽数也随之增高,2 000 lx的培养效果最好,不定芽再生率达到100%,平均每叶不定芽数最高,为28.52个(见表7),且芽体较大,生长势好。1 500 lx的诱导效果次之,不定芽再生率98.60%,平均不定芽数23.20个,芽较小,芽长0.2~0.4 cm,有少量愈伤组织;1 000 lx光照强度下,不定芽再生率低,只有88.89%,平均不定芽数13.41个,芽细小,长0.1~0.2 cm,少量接种叶片褐化死亡。从差异显著性测验结果看,1 500 lx和2 000 lx的不定芽再生的差异不显著,而二者与1 000 lx的差异则极为显著;3种光照强度对不定芽数的影响则达到极显著水平。可见,黄花马铃苣苔的不定芽诱导需要较强的光照强度,以2 000 lx为最佳。
2.8 植物激素配比对不定芽再生的影响
黄花马铃苣苔在6种培养基中培养20 d均有愈伤组织长出,35 d有少量芽分化,随后芽分化增多和长大。6个组合不定芽再生率均在91%以上,其值差较小;而平均不定芽数的差值较大,介于14.15~32.33之间(见表8)。其中组合6-BA 0.5 mg/L+NAA 0.1 mg/L的诱导效果最优,不定芽再生率达到100%,平均不定芽数分别为32.33个,芽苗生长势好,芽体大而整齐,有2~4张小叶且健壮(见图3)。其次为6-BA 0.1 mg/L+NAA 0.1 mg/L组合,不定芽再生率98.33%,平均不定芽数25个,分化整齐,芽大,长势好,叶绿色。其它各组合均有不同程度的愈伤组织,分化出的芽都较为细小,其中组合6-BA 0.1 mg/L+NAA 0.5 mg/L有少量芽微黄。方差分析结果表明,组合6-BA 0.5 mg/L+NAA 0.1 mg/L不定芽再生率与其它组合间的差异达到极显著或显著性水平,而平均不定芽数与其它组合间的差异则达到极显著性水平,因此,黄花马铃苣苔不定芽诱导培养的最佳植物激素配比为6-BA 0.5 mg/L,NAA 0.1 mg/L。
表7 光照强度对黄花马铃苣苔不定芽再生的影响

光照强度(lx)不定芽再生率(%)平均不定芽数(个/叶)生长状况100088.89Bb13.41Cc芽细小,多为0.2cm,6张接种叶片褐化死亡150098.60Aa23.20Bb少量愈伤,芽较小,芽长0.2~0.4cm2000100Aa28.52Aa极少愈伤,芽大,长0.3~0.6cm

图3 培养50 d分化的不定芽
表8 植物激素配比对黄花马铃苣苔不定芽再生的影响
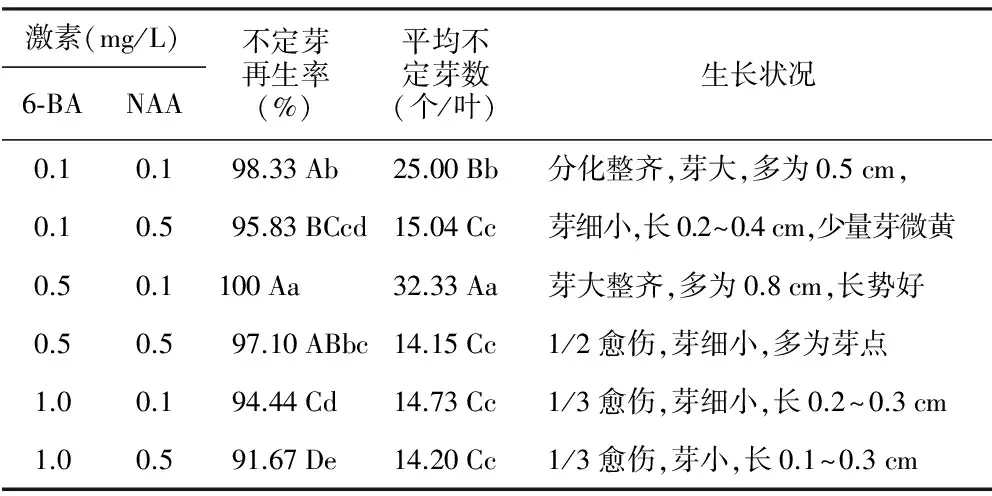
激素(mg/L)6⁃BANAA不定芽再生率(%)平均不定芽数(个/叶)生长状况0.10.198.33Ab25.00Bb分化整齐,芽大,多为0.5cm,0.10.595.83BCcd15.04Cc芽细小,长0.2~0.4cm,少量芽微黄0.50.1100Aa32.33Aa芽大整齐,多为0.8cm,长势好0.50.597.10ABbc14.15Cc1/2愈伤,芽细小,多为芽点1.00.194.44Cd14.73Cc1/3愈伤,芽细小,长0.2~0.3cm1.00.591.67De14.20Cc1/3愈伤,芽小,长0.1~0.3cm
3 结论与讨论
初代培养是建立组培快繁最为重要和关键的步骤之一,叶片外植体不定芽再生是一个复杂的过程,受到基因型、激素以及其它营养、环境条件等内外因素影响。
叶片的植入方式对芽的再生有影响。基因型不同物种的叶片再生培养所需的放置方式不一样[15]。王艳等研究苹果砧木叶片再生时发现,叶片正放的再生效果远好于叶片的反置[16],肖蓉等[17]对辣椒枣的研究也得出相同的结论。王树曜等[18]对84 K杨树叶片的再生研究所得结论则相反。在苦苣苔科植物叶片的再生芽诱导培养,多采用叶背接触培养基的放置方式。本研究结果表明,叶片以叶背朝下放置的不定芽再生率和平均不定芽数均极显著高于叶面朝下放置。这可能与叶片的构成有关,不定芽一般是从叶片的近轴面向上生长,而叶片远轴面的气孔多,组织较疏松,与培养基易充分接触吸收养分[19]。
苦苣苔科植物组培培养基pH值多为5.8~6.0,蔗糖浓度为20~30 mg/L,而桂林小花苣苔的诱导培养pH值达到了8.0[9]。本研究结果表明,灭菌前pH值6.5,蔗糖30 mg/L更适合于黄花马铃苣苔的不定芽再生,极显著优于其它处理。
MS培养基是植物组织培养中最为广泛应用的基础培养基,现有苦苣苔科植物的组培快繁研究结果显示,MS培养基适合于叶片的诱导培养。在全量的MS培养基中,黄花马铃苣苔的不定芽再生率和平均不定芽数均优于无机盐减量的培养基,说明黄花马铃苣苔的叶片再生需要的矿质元素含量较高。
适宜的培养温度和光照强度是培养中的细胞所必需的,不同植物试管芽苗对光照强度有不同的反应[20]。已有研究表明,苦苣苔科植物组培最适温度多为是25~28 ℃,对光的需求则差异较大,介于1 500~3 000 lx之间。黄花马铃苣苔不定芽诱导适宜的培养温度为25~28 ℃;最适光照强度为2 000 lx。因此不同的物种所需的光温培养条件必须经过试验确定,以达到最好的培养效果。
调节植物激素种类和组合是获得高效再生芽的重要手段。苦苣苔科植物的组培研究表明,细胞分裂素在不定芽的再生中起着关键的作用,其中6-BA对外植体的生长和再生分化的促进效果最好,生长素则起辅助作用,多使用IBA或NAA,二者浓度均不宜过高,适宜浓度6-BA为0.1~1.0 mg/L,IBA或NAA为0.01~0.1 mg/L[3-4,6-14]。但在异裂苣苔和吊石苣苔的不定芽再生中6-BA的使用浓度达到3.0 mg/L[5,10]。本研究结果表明,6-BA与NAA组合使用,黄花马铃苣苔再生芽的发生频率极显著高于其它几种植物生长物质组合,最适浓度为6-BA 0.5 mg/L与NAA 0.1 mg/L,不定芽再生率达到100%,平均每叶不定芽数32.33个,芽体均匀,生长正常无畸形;6-BA浓度达到1.0 mg/L时不利于芽的诱导和生长,愈伤组织分化不整齐芽体细小。在不同的6-BA浓度下,NAA 0.1 mg/L均较NAA 0.5 mg/L表现出较好的诱导效果,其不定芽再生率高,平均不定芽数多,所诱导的芽体较大,说明较高的NAA浓度会抑制不定芽的形成和生长。因此在黄花马铃苣苔叶片诱导不定芽过程中6-BA和NAA浓度应分别控制在0.5 mg/L和0.1 mg/L。
综合试验结果得出,叶片外植体以叶面朝上接入培养基MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+蔗糖30 g/L,在温度25~28 ℃,光照强度2 000 lx的培养条件下,黄花马铃苣苔不定芽的再生效果最好。
[1]史佑海,徐世松,黄觉武.海南苦苣苔科野生资源及其观赏特性评价[J].北方园艺,2011(11):79-82.
[2]李桭宇,王印波.中国苣苔科植物[M].郑州:河南科学技术出版社,2005:4-5.
[3]付传明,黄宁珍,唐凤鵉,等.桂林唇柱苣苔的组织培养和快速繁殖[J].植物生理学通讯,2003,46(3):253-254.
[4]汤正辉,石雷,陈维伦,等.台闽苣苔的组织培养与快速繁殖[J].植物生理学通讯,2005,41(4):497.
[5]汤正辉,石雷,陈维伦,等.异裂苣苔的组织培养和快速繁殖[J].植物生理学通讯,2005,41(5):643.
[6]温放,李湛东,张启翔.牛耳朵的离体培养和快速繁殖[J].植物生理学通讯,2006,42(5):906.
[7]梁桂友,温放,李湛东.尖萼唇柱苣苔的组织培养和快速繁殖[J].植物生理学通讯,2007,43(2):321.
[8]余海霞,张占江,吕惠珍,等.钟冠唇柱苣苔组织培养研究[J].湖北农业科学,2012,51(6):2 606-2 608,2 615.
[9]黄宁珍,付传明,赵志国,等.桂林小花苣苔的离体快速繁殖技术[J].植物学报,2010,45(6):744-750.
[10]刘伟,黄勇.吊石苣苔的组织培养和快速繁殖[J].植物生理学通讯,2010,46(2):159.
[11]付传明,黄宁珍,唐凤鸾,等.桂林唇柱苣苔的组织培养和快速繁殖[J].植物生理学通讯,2010,46(3):253.
[12]韦啸,唐赛春,黄素梅.三苞苣苔花梗的离体培养[J].北方园艺,2011(6):144-147.
[13]冼康华,付传明,唐凤鵉,等.文采唇柱苣苔的组织培养与快速繁殖[J].植物生理学报,2014,50(7):1 065-1 069.
[14]潘梅,戚华莎,黄赛,等.烟叶唇柱苣苔叶片分化与植株再生研究[J].北方园艺,2014,(12):83-84.
[15]谢启鑫,黄美连,吴晓萍,等.君迁子叶片培养再生植株的研究[J].中国农业科学,2008,41(2):607-612.
[16]王艳,孙仲序,夏阳.苹果砧木试管苗叶片再生体系的建立[J].山东农业大学学报(自然科学版),2004,35(2):196,200.
[17]肖蓉,王国,李春燕,等.辣椒枣试管苗叶片再生植株研究[J].山西农业科学,2012,40(3):193-196,216.
[18]王树曜,田宗斌,黄白红,等.84 K杨叶片再生系统的建立[J].湖南文理学院学报,2004,16(4):50-51.
[19]师效欣,杜国强,高仪,等.苹果离体叶片高效再生不定芽技术研究[J].果树科学,1999,16(4):255-258.
[20]王玉英,高新一.植物组织培养技术手册[M].北京:金盾出版社,2006:37,89-90.
Research on the Adventitious Buds High-frepuency Regeneration ofOreocharisflavidaMerr
PANMei,FURuikan,QIHuasha,LÜDeren,WANGJingfei,HUANGSai
2016-08-28
海南省科学事业费项目(kyys-2013-12)。
潘 梅(1962—),女(壮族),广西隆安县人;高级园艺师,主要从事植物组织培养研究与开发利用;E-mail:panmei200@sina.com。
10.16590/j.cnki.1001-4705.2017.01.085
Q 943.1
A
1001-4705(2017)01-0085-05
