自噬相关基因Atg7 rs11706903单核苷酸多态性与帕金森病的相关性
2017-12-01贺鹏赵西耀陈煜森陈霄仪郑伟明
贺鹏,赵西耀,陈煜森,陈霄仪,郑伟明
自噬相关基因Atg7 rs11706903单核苷酸多态性与帕金森病的相关性
贺鹏1,赵西耀2,陈煜森3,陈霄仪3,郑伟明1
目的 研究Atg7内含子区rs11706903单核苷酸多态性与帕金森病的关系。方法 2013年1月至2017年3月,收集130例帕金森病患者(病例组)和同期109例健康体检者(对照组)血样,采用聚合酶链反应-限制性片段长度多态性分析方法检测Atg7 rs11706903基因多态性。结果 rs11706903位点各基因型病例组基因型频率AA 10.00%、AC 52.31%、CC 37.69%,等位基因频率A 36.15%、C 63.85%;对照组基因型频率AA 7.34%、AC 49.54%、CC 43.12%,等位基因频率A 32.11%、C 67.89%。两组间无显著性差异(χ2<1.001,P>0.05)。结论 Atg7内含子区rs11706903单核苷酸多态性与帕金森病可能无关。
帕金森病;自噬相关基因;内含子;单核苷酸多态性;rs11706903
帕金森病是常见于中老年人的进行性神经系统变性疾病,以黑质多巴胺能神经元变性缺失和路易小体形成为特征,在65岁以上人群中患病率达1.7%。随着社会人口的老龄化,帕金森病患病率和致残率有升高趋势,给家庭和社会带来沉重负担。帕金森病病因迄今不明,目前普遍认为帕金森病并非单一因素所致,多种因素可能参与其中。遗传因素可使患病易感性增加,在环境因素及衰老的相互作用下,通过氧化应激、线粒体功能衰竭、细胞凋亡、自噬等机制,导致黑质多巴胺神经元大量变性丢失而发病。许多研究显示,基因因素在帕金森病发病中至少占27%的作用,而在一些人口中,至少占33%[1]。已经确定PARK1~PARK13等单基因与帕金森病有关。单基因遗传性帕金森病很少见,仅占帕金森病总数5%左右,绝大多数帕金森病为散发性。对其致病基因及蛋白产物功能进行深入研究,有助于阐明帕金森病的遗传机制,为寻找帕金森病治疗靶点提供依据。
近来报道提示,自噬与帕金森密切相关[2]。自噬相关基因(autophagy-related genes,ATG)是自噬通路的关键基因,本研究探讨Atg7内含子rs11706903位点多态性与散发性帕金森病发病的关系。
1 对象与方法
1.1 对象
选择2013年1月至2017年3月,在浙江大学医学院附属二院建德分院、广东省人民医院南海医院(佛山市南海区第二人民医院)和广东医科大学附属医院神经内科门诊及住院诊治的帕金森病患者130例(病例组),所有患者均符合英国帕金森病协会脑库的帕金森病临床诊断标准,并经1年随访证实[3]。
排除标准:①帕金森病症状和体征是由于脑外伤、脑肿瘤、病毒感染、脑血管病或其他已知的神经系统疾病,以及已知的药物和/或化学毒物引起;②患者有眼外肌麻痹、小脑体征、体位性低血压、锥体系损害、肌萎缩等。
对照组为同期同院健康体检者109例。经临床检查和/或影像学检查,排除心、脑、肝、肾疾病,糖尿病、炎症等疾病。
所有标本的收集均经患者本人或其家属同意,签署知情同意书,并经各自就医的医院医学研究伦理委员会同意。
病例组平均年龄(71.47±8.84)岁,对照组(70.79±11.02)岁(t=0.529,P=0.597);病例组男/女性别比为72/58,对照组为64/45(χ2=0.268,P=0.604)。两组间年龄及性别构成均无显著性差异。
1.2 方法
1.2.1 样本的收集及提取
取早晨空腹静脉血5 ml,3.8%柠檬酸钠抗凝。碘化钾法提取外周血白细胞的基因组DNA,-20℃冰箱中保存备用。
1.2.2 引物设计及基因目的片段扩增
选择Atg7基因内含子区rs11706903位点,应用引物设计软件PRIMER 5.0设计引物。

1.2.3 主要仪器
聚合酶链反应(polymerase chain reaction,PCR)扩增仪、移液器(100~1000 μl、20~200 μl、0.5~10 μl):BBI公司。SW-CJ-1D洁净工作台:江苏苏洁净化设备厂。DK-8D型电热恒温水槽:上海森信实验仪器有限公司。DYY-8型稳压稳流电泳仪:上海琪特分析仪器有限公司。YXJ-2离心机:湘仪离心机仪器有限公司。H6-1微型电泳槽:上海精益有机玻璃制品仪器厂。凝胶成像系统:GENE GENIUS公司。U-3010紫外-可见分光光度计:HITACHI公司。
1.2.4 主要试剂
TaqDNA聚合酶、10×PCR Buffer(without Mg2+:100 mmol/L Tris-HCl、 500 mmol/L KCl、 0.8%Nonidet)、25 mmol/L MgCl2、10 mmol/L dNTP、Marker:BBI公司。6×DNA Loading Dye、SK1141 PCR产物纯化回收试剂盒:生工公司。限制性内切酶:MBI Fermentas公司。
1.2.5 反应过程
取0.5 ml PCR反应管,加入10×Taq Buffer 1.5 μl、2.5 mmol/L dNTP(each)0.3 μl、50 pmol/μl F 引物0.2 μl、50 pmol/μl R 引物 0.2 μl、基因组 DNA 1.0 μl、5 U/μl TaqDNA 聚合酶 0.1 μl、MgCl21.2 μl、蒸馏水11 μl,总反应体积 15 μl。置 PCR 反应扩增仪中扩增:95℃预变性5 min,95℃变性30 s,(68±0.5)℃退火45 s,72℃延伸60 s,20个循环;再次95℃变性30 s,58℃退火30 s,72℃延伸40 s,再重复20个循环,72℃延伸6 min。
1.2.6 基因型鉴别及分析
PCR产物用MBI限制性内切酶酶切,参照内切酶说明书操作。酶切体系 15 μl,包括PCR 产物 10 μl、10×Buffer R 1.5 μl、10 U/μl内切酶酶 0.1 μl、蒸馏水3.4 μl,37℃水浴8 h以上。酶切产物用3%琼脂糖凝胶(Agarose LE,Sangon),电压150 V,在TBE缓冲液中电泳30 min。凝胶成像系统对电泳带型照相、分析。
1.3 统计学分析
应用SPSS 22.0统计软件进行数据处理。Har-dy-Weinburg平衡吻合度和各组基因型和等位基因频率比较采用χ2检验。显著性水平α=0.05。
2 结果
扩增片段长152 bp。野生型(AA基因型)无酶切位点,酶切后可见长度为152 bp条带,突变杂合子(AC基因型)酶切后可见152 bp、114 bp和38 bp三条条带,突变纯合子(CC基因型)酶切后可见114 bp和38 bp两条条带。
为验证聚合酶链反应-限制性片段长度多态性分析(polymerase chain reaction restriction fragment length polymorphism,PCR-RFLP)方法的可靠性,选取对照组14和88号标本送上海生工公司进行测序,测序结果与PCR-RFLP结果吻合。
病例组和对照组各基因型分布见表1。经χ2检验均符合Hardy-Weinburg平衡定律,表明在所调查人群中已达到遗传平衡,数据来自同一个孟德尔群体。见表1。
两组rs11706903位点基因型频率及等位基因频率均无显著性差异(P>0.05)。见表1、表2。
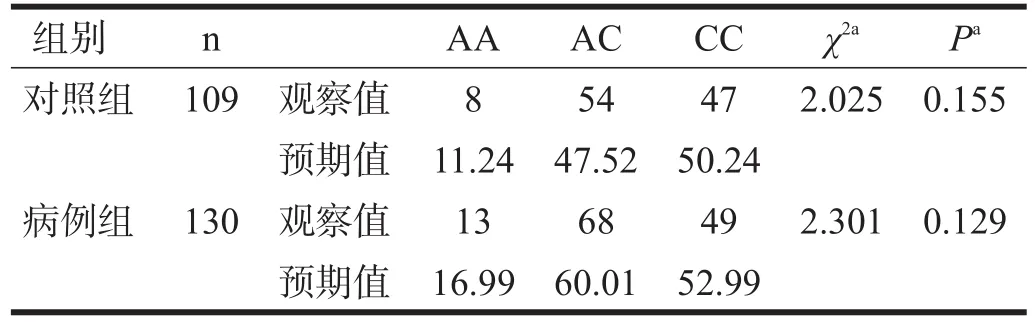
表1 两组rs11706903位点基因型分布比较(n)
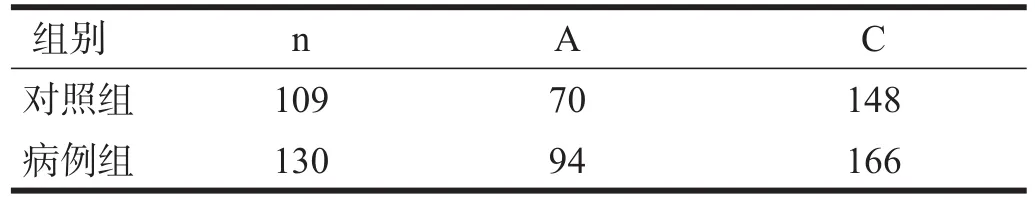
表2 两组rs11706903等位基因频率比较(n)
3 讨论
自噬是广泛存在于真核细胞的一种蛋白质降解方式。研究发现,自噬可以利用泛素标签进行底物识别和加工,批量降解细胞内大分子、聚集的蛋白质和受损的细胞器[4]。通过对不同时间小鼠进行解剖,发现自噬缺陷的神经元内存在异常蛋白质及细胞器,如异常线粒体、过氧化物酶体等的积累,并与多聚泛素蛋白发生累积,形成包涵体[5]。随着时间延长,包涵体大小和数量都在增加。提示中枢神经系统自噬缺乏导致神经元退变[6-7]。
Crews等[8]通过对含有路易体的患者尸检、运用转基因鼠、Western blotting、显微镜观察等方法发现,存在路易体的患者和具有α-突触核蛋白(alpha-synuclein,α-Syn)的小鼠存在Atg7水平降低;在含路易体的神经元发现自噬标记物异常表达;超微结构分析显示众多异常自噬体存在。提示自噬与帕金森病发病相关[9-10]。
Atg7是自噬过程中的必需成分[11-12]。它在催化过程中起泛素样激酶E1酶的作用,可以识别Atg3和Atg10,并把它们分别转运到Atg8和Atg12上,使之连接。在哺乳动物细胞自噬泡形成过程中,Atg3、Atg5、Atg7、Atgl0、Atg8和Atg12参与两条泛素样蛋白加工修饰系统:Atg12-Atg5结合系统和微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)-Atg8脂化系统[13]。两个途径均与Atg7催化作用密切相关,Atg7缺陷将不能发生自噬[14]。特异性自噬损害导致小鼠中枢神经系统纹状体多巴胺能神经元丢失、低分子量α-Syn积累和泛素化蛋白质聚集体存在[15]。这包括帕金森病许多病理特征。
Atg7基因进化保守,由282,455 bp组成,编码基因位于染色体3q25.3,含有18个外显子,转录生成含676个氨基酸残基的蛋白酶。研究发现,Atg7基因在自噬通路中起重要作用[16-17]。Ahmed等[18]使用表达Cre重组酶的转基因小鼠,产生了在黑质致密部、中脑其他区域及后脑多巴胺能神经元中特异删除Atg7基因的小鼠。Pattison等[19]利用此小鼠模型,运用Western blotting、高效液相色谱分析、电子显微镜观察、行为测试等方法,发现小鼠全脑突触前α-Syn和富含亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2)蛋白累积;运用抗体检测的方法,发现泛素阳性包涵体存在于中枢系统广泛区域中;小鼠也显示自噬功能完全丧失导致的行为缺陷,包括异常的抓握反射、震颤、协调运动降低。LRRK2基因常染色体显性突变是导致家族性帕金森病最常见的基因原因,亦与其散发性病例相关[20-22]。Chen等[23]在散发性帕金森病患者和种族匹配的健康对照者中,对Atg7基因启动子进行双向测序,在5例帕金森病患者中,发现4个新的杂合子突变体,降低Atg7基因启动子的转录活性。提示Atg7基因启动子序列突变可能是帕金森病的危险因素。但Atg7基因内含子与帕金森病的关系迄今未见报道。
本研究证实,汉族人群Atg7基因内含子区rs11706903存在多态性,但病例组的各基因型频率与对照组无显著性差异。提示rs11706903多态性与散发型帕金森病发病无明显联系。
由于目前尚未发现与该位点有关的其他研究结果,基于以下原因对于本研究阴性结果的解读尚需谨慎:①因种族差异,基因型及等位基因频率分布往往明显不同;②由于环境因素、研究对象选择标准等的差异,或基因多态性间连锁不平衡,可能影响实验结果;③由于研究的样本量不够大,导致统计学效能不足;④可能存在样本偏倚[24-25]。需在其他人群、更大样本、更严格入组标准背景下进行进一步研究,评估该基因变异对帕金森病发病的作用。
[1]Gan-Or Z,Dion PA,Rouleau GA.Genetic perspective on the role of the Autophagy-Lysosome Pathway in Parkinson disease[J].Autophagy,2015,11(9):1443-1457.
[2]Schulz JB.Mechanisms of neurodegeneration in idiopathic Parkinson's disease[J].Parkinsonism Relat Disord,2007,13(Suppl 3):S306-S308.
[3]Reichmann H.Clinical criteria for the diagnosis of Parkinson's disease[J].Neurodegener Dis,2010,7(5):284-290.
[4]Koch JC,Bitow F,Haack J,et al.Alpha-Synuclein affects neurite morphology,autophagy,vesicle transport and axonal degeneration in CNS neurons[J].Cell Death Dis,2015,6(7):e1811.
[5]Lynch-Day MA,Mao K,Wang K,et al.The role of autophagy in Parkinson's disease[J].Cold Spring Harb Perspect Med,2012,2(4):a009357.
[6]Vuppalapati KK,Bouderlique T,Newton PT,et al.Targeted deletion of autophagy genes Atg5 or Atg7 in the chondrocytes promotes caspase-dependent cell death and leads to mild growth retardation[J].J Bone Miner Res,2015,30(12):2249-2261.
[7]Komatsu M,Waguri S,Chiba T,et al.Loss of autophagy in the central nervous system causes neurodegeneration in mice[J].Nature,2006,441(7095):880-884.
[8]Crews L,Spencer B,Desplats P,et al.Selective molecular alterations in the autophagy pathway in patients with Lewy body disease and in models of α-synucleinopathy[J].PLoS One,2010,5(2):e9313.
[9]Yao TP.The role of ubiquitin in autophagy-dependent protein aggregate processing[J].Genes Cancer,2010,1(7):779-786.
[10]Stefanis L.α-synuclein in Parkinson's disease[J].Cold Spring Harb Perspect Med,2012,2(2):a009399.
[11]Cao Y,Cai J,Li X,et al.Autophagy governs erythroid differentiation both in vitro and in vivo[J].Hematology,2016,21(4):225-233.
[12]Kaiser SE,Mao K,Taherbhoy AM,et al.Noncanonical E2 recruitment by the autophagy E1 revealed by Atg7-Atg3 and Atg7-Atg10 structures[J].Nat Struct Mol Biol,2012,19(12):1242-1249.
[13]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[14]Molaei S,Roudkenar MH,Amiri F,et al.Down-regulation of the autophagy gene,ATG7,protects bone marrow-derived mesenchymal stem cells from stressful conditions[J].Blood Res,2015,50(2):80-86.
[15]Cai Z,Zeng W,Tao K,et al.Chaperone-mediated autophagy:roles in neuroprotection[J].Neurosci Bull,2015,31(4):452-458.
[16]Friedman LG,Lachenmayer ML,Wang J,et al.Disrupted autophagy leads to dopaminergic axon and dendrite degeneration and promotespresynaptic accumulation of α-synuclein and LRRK2 in the brain[J].J Neurosci,2012,32(22):7585-7593.
[17]Juhász G,Erdi B,Sass M,et al.Atg7-dependent autophagy promotes neuronal health,stress tolerance,and longevity but is dispensable for metamorphosis in drosophila[J].Genes Dev,2007,21(23):3061-3066.
[18]Ahmed I,Liang Y,Schools S,et al.Development and characterization of a new Parkinson's disease model resulting from impaired autophagy[J].J Neurosci,2012,32(46):16503-16509.
[19]Pattison JS,Osinska H,Robbins J,et al.Atg7 induces basal autophagy and rescues autophagic deficiency in CryABR120G cardiomyocytes[J].Circ Res,2011,109(2):151-160.
[20]Cookson MR.Cellular functions of LRRK2 implicate vesicular trafficking pathways in Parkinson's disease[J].Biochem Soc Trans,2016,44(6):1603-1610.
[21]Manzoni C.The LRRK2-macroautophagy axis and its relevance to Parkinson's disease[J].Biochem Soc Trans,2017,45(1):155-162.
[22]Guerreiro PS,Huang Y,Gysbers A,et al.LRRK2 interactions with α-synuclein in Parkinson's disease brains and in cell models[J].J Mol Med(Berl),2013,91(4):513-522.
[23]Chen D,Pang S,Feng X,et al.Genetic analysis of the ATG7 gene promoter in sporadic Parkinson's disease[J].Neurosci Lett,2013,534:193-198.
[24]赵西耀,何芳梅.PSMA6基因rs17458312位点多态性与脑梗死的相关性研究[J].中国康复理论与实践,2015,21(9):1091-1094.
[25]赵西耀,何芳梅.PSMA6基因rs1048990位点多态性与动脉粥样硬化性脑梗死的相关性分析[J].温州医科大学学报,2016,46(2):97-101.
Association of Single Nucleotide Polymorphisms of Autophagy-related Genes Atg7 Site rs11706903 and Parkinson's Disease
HE Peng1,ZHAO Xi-yao2,CHEN Yu-sen3,CHEN Xiao-yi3,ZHENG Wei-ming1
1.Department of Neurology,Guangdong General Hospital's Nanhai Hospital(the Second People's Hospital of Nanhai District Foshan City),Foshan,Guangdong 528251,China;2.Department of Neurology,the Second Affiliated Hospital(Jiande Branch),School of Medicine,Zhejiang University,Hangzhou,Zhejiang 311600,China;3.Department of Neurology,Affiliated Hospital of Guangdong Medical University,Zhanjiang,Guangdong 52400l,China
ZHAO Xi-yao.E-mail:13588181243@163.com
Objective To investigate the relationship between the single nucleotide polymorphisms(SNP)of rs11706903,intron region of Atg7,and Parkinson's disease(PD).Methods From January,2013 to March,2017,130 PD patients and 109 healthy subjects were recruited and collected the blood samples.SNPs of rs11706903 were detected with polymerase chain reaction restriction fragment length polymorphism.Results For the patients,the genotype frequencies of rs11706903 were AA 10.00%,AC 52.31%and CC 37.69%;and allele frequencies were A 36.15%and C 63.85%.For the healthy controls,the genotype frequencies of rs11706903 were AA 7.34%,AC 49.54%and CC 43.12%;and allele frequencies were A 32.11%and C 67.89%.There was no significant difference in frequencies of genetypes and alleles beteen two groups(χ2<1.001,P>0.05).Conclusion There might be no relationship between SNPs ofAtg7 intron region rs11706903 and PD.
Parkinson's disease;autophagy-related genes;intron;single nucleotide polymorphisms;rs11706903
10.3969/j.issn.1006-9771.2017.11.015
R742.5
A
1006-9771(2017)11-1313-04
[本文著录格式] 贺鹏,赵西耀,陈煜森,等.自噬相关基因Atg7 rs11706903单核苷酸多态性与帕金森病的相关性[J].中国康复理论与实践,2017,23(11):1313-1316.
CITED AS:He P,Zhao XY,Chen YS,et al.Association of single nucleotide polymorphisms of autophagy-related genes Atg7 site rs11706903 and Parkinson's disease[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(11):1313-1316.
杭州市医疗卫生科研项目(No.20150633B82)。
1.广东省人民医院南海医院(佛山市南海区第二人民医院)神经内科,广东佛山市528251;2.浙江大学医学院附属第二医院建德分院神经内科,浙江建德市311600;3.广东医科大学附属医院神经内科,广东湛江市524001。作者简介:贺鹏(1972-),男,汉族,湖北丹江口市人,硕士,副主任医师,主要研究方向:神经疾病遗传学。通讯作者:赵西耀(1980-),男,汉族,河南开封市人,硕士,主治医师,主要研究方向:神经疾病遗传学。E-mail:13588181243@163.com。
2017-03-29
2017-08-30)
