生物法合成3-羟基丙酸的研究进展
2017-11-30冯新军咸漠刘会洲赵广
冯新军,咸漠,刘会洲,赵广
中国科学院生物基材料重点实验室,中国科学院青岛生物能源与过程研究所,青岛 266101
生物法合成3-羟基丙酸的研究进展
冯新军,咸漠,刘会洲,赵广
中国科学院生物基材料重点实验室,中国科学院青岛生物能源与过程研究所,青岛 266101
3-羟基丙酸是一种重要的平台化合物,应用广泛。生物法是实现高效合成3-羟基丙酸的重要手段,近年来发展迅速。针对3-羟基丙酸的天然合成途径、工程合成途径,特别是利用葡萄糖、甘油等廉价底物合成3-羟基丙酸的代谢工程进展进行了综述和比较。同时,对生物法合成3-羟基丙酸的主要问题进行了讨论,并提出了解决相关问题的建议。另外,根据现阶段的研究进展,对3-羟基丙酸的产业化发展进行了展望。
3-羟基丙酸;微生物发酵;葡萄糖;甘油;丙二酸单酰辅酶A
3-羟基丙酸(3-HP)是一种三碳非手性有机酸,分子式C3H6O3,拥有一个羧基和一个β位的羟基,呈糖浆状,易溶于水、乙醇和乙醚[1]。3-HP与乳酸是同分异构体,由于羟基位置的不同,与乳酸相比,其化学性质更加活泼,易于通过不同的化学反应来合成多种化工产品。例如,通过氧化、还原、脱水、环化等反应分别可以得到丙二酸、1,3-丙二醇、丙烯酸、丙内酯等产物,所得到的产物可以进一步用于合成附加值更高的产品(图1)。其中,1,3-丙二醇可以用做抗冻剂或者保护剂以及新型聚酯-聚对苯二甲酸丙二醇酯(PTT)的单体[2],丙烯酸可以作为单体用于合成树脂、合成纤维等的制造[3]。另外,3-HP及其酯化衍生物可以用于生物可降解塑料聚3-羟基丙酸[4]、聚3-羟基丙酸-co-3-羟基丁酸[5]等的合成,在替代传统石油基塑料方面前景广阔。由于3-HP显著的市场价值和应用前景,美国能源部在2004年将3-HP列为12种最具开发潜力的平台化合物之一[6]。
3-HP可以通过化学合成法和生物合成法获得。传统的化学合成法主要是以β-丙内酯、丙烯酸、β-羟基丙腈等为原料[7-8],普遍存在原材料价格昂贵、毒性较大等缺陷。1,3-丙二醇、3 -羟基丙醛、丙烯醇等也可以被氧化得到3-HP,但是催化效率和选择性较低[9],仍然不能满足工业化应用的要求。在资源与环境的双重压力下,新型可持续的3-HP合成工艺亟待开发。生物合成法可以利用廉价的生物质资源进行生产,具有反应条件温和、操作简单、副产物较少、绿色环保、生产成本较低等优点。生物法合成3-HP已经引起越来越多的兴趣,近年来发展迅速,取得了一系列进展。本文将针对生物法合成3-HP的研究进展进行综述,并对生物法合成过程中的主要问题及建议进行讨论。
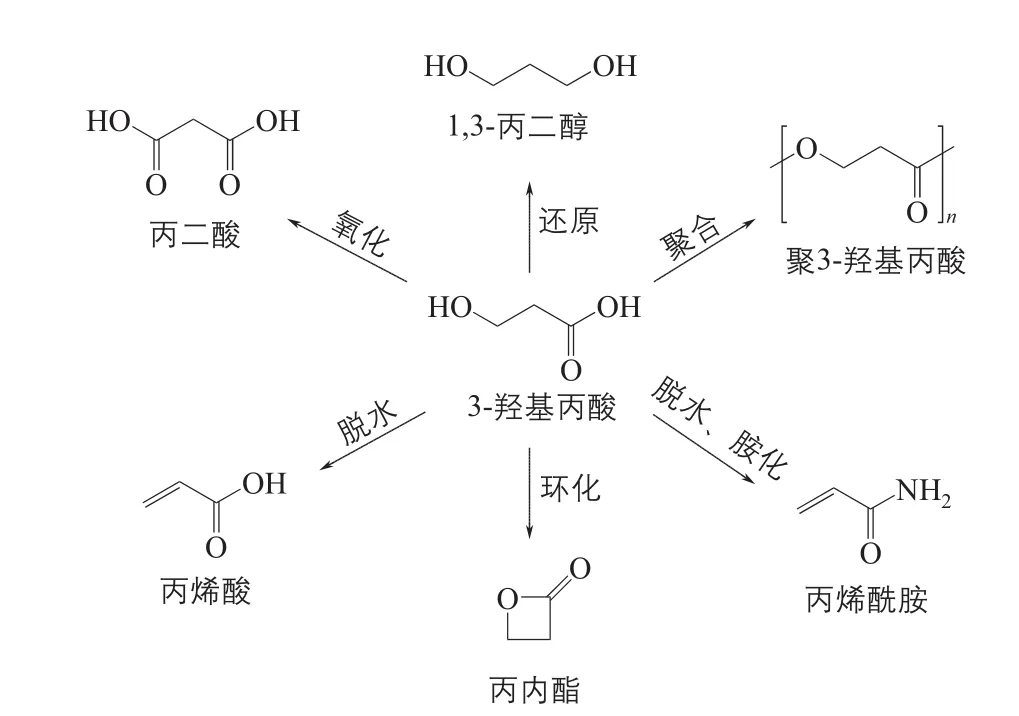
图1 3-羟基丙酸的工业化应用
1 3-羟基丙酸的天然合成途径
早在20世纪60年代,人们就发现了能够产3-HP的野生菌株。1968年,Harada课题组首次发现汉逊氏酵母Hansenula miso可以1,3-丙二醇为底物,氧化得到3-HP[10];随后又发现镰刀霉菌Fusarium merismoides可 将 丙 酸 转 化 为3-HP[11]。1982年,Hasegawa发现了同样利用丙酸合成3-HP的褶皱假丝酵母Candida rugosa,产率可以达到89%[12]。1994年,Takamizaw等[13]从空气中分离到能够利用丙烯酸合成3-HP的丝衣霉Byssochlamys sp.菌株。以上研究只是发现了3-HP合成现象,并没有深入地研究和解析相关微生物中的3-HP代谢途径。
1986年,Holo等[14]发现橙色绿屈挠菌Chloro fl exus aurantiacus OK-70 fl 能够以CO2为唯一碳源进行自养生长,但是这个菌中没有已知的卡尔文固碳途径的关键酶。通过进一步研究,发现3-羟基丙酸是Chloro fl exus aurantiacus固碳途径的中间代谢物质,并首次提出了固定CO2的3-羟基丙酸循环途径[15]。在此之后,科研工作者通过持续深入的研究,逐步阐明了3-羟基循环途径的各个关键酶和反应机制[16-19],并最终证明3-羟基丙酸固碳途径是一个双循环偶联途径[20]。
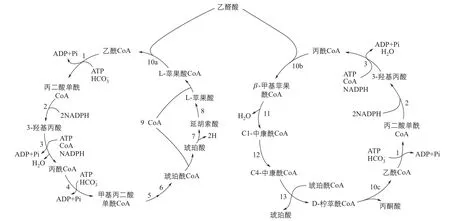
图2 C. aurantiacus的3-羟基丙酸双循环固碳途径
3-羟基丙酸双循环固碳途径(图2)的起始物质是乙酰辅酶A。在第一个循环中,乙酰辅酶A首先与碳酸氢根反应生成丙二酸单酰辅酶A,丙二酸单酰辅酶A在还原酶的作用下生成3-HP,3-HP经过一系列酶的催化反应,最终转化为L-苹果酰辅酶A,苹果酰辅酶A进一步裂解为乙醛酸和乙酰辅酶A,完成第一个循环。第一个循环所产生的乙醛酸与丙酰辅酶A反应生成β- 甲基苹果酰辅酶A,从而进入第二个循环。β-甲基苹果酰辅酶A经过四步催化反应转化为丙酮酸和乙酰辅酶A,乙酰辅酶A再次进入第一个循环中,实现两个循环的偶联。作为一种新类型的自养固碳途径,3-羟基循环途径具有与其他固碳途径不同的鲜明特点和优势[20-24]。①途径中涉及19步反应,但只需13种酶,其中包括几个多功能酶,例如双功能酶丙二酸单酰辅酶A还原酶(malonyl-coenzyme A reductase,MCR)和三功能酶丙酰辅酶A合酶(propionyl-CoA synthase,PCS),这在其他的自养途径中并不常见。多功能酶的存在,可以减少代谢压力,提高代谢效率。②途径中的酶反应对O2不敏感,可以在好氧条件下进行,与其他固碳途径需要在厌氧环境中进行相比,更易于实际操作,更利于工业化生产。③途径中乙酰辅酶A羧化酶和丙酰辅酶A羧化酶是以HCO3-为底物,一个循环可以固定两分子CO2,固碳效率更高。与直接以CO2为底物的固碳途径相比,以HCO3-为底物更利于在发酵体系中进行,更利于细胞的利用。④整个代谢途径可以合成3-HP和丁二酸两种中间物质,这两种物质都是高附加值平台化学品,应用潜力和市场价值巨大。
除了在C. aurantiacus中发现3-羟基丙酸循环途径外,在嗜酸热菌Acidianus brierleyi、硫化叶菌Metallosphaera sedula等古生菌中也发现了类似的途径[25-26]。除了个别关键酶的不同,古生菌的3-羟基丙酸合成途径与C. aurantiacus基本一致,可以称为经过修饰的3-羟基丙酸循环途径。最新研究结果发现,在一些营养缺乏的水环境中生长的微生物,如绿爬菌Chloroherpeton thalassium、赤杆菌Erythrobacter sp. NAP-1、硝化球菌Nitrococcus mobilis、海洋变形菌Congregibacter litoralis等都是通过类似于3-羟基丙酸循环的生物途径来利用溶解于水中的微量有机物和CO2获得营养[27]。
2 3-羟基丙酸的代谢工程途径
利用野生菌株中存在的天然途径合成3-HP,由于效率低下,很难实现工业化规模的生产。通过构建代谢工程途径,实现以廉价碳源为原料高效合成3-HP成为主要趋势。近年来,利用代谢工程途径合成3-HP的研究取得了重要进展,使用的起始碳源主要是葡萄糖、甘油等。
2.1 以葡萄糖为底物的途径
美国嘉吉公司(Cargill)在2002年申请的专利中首次提出了以葡萄糖为底物合成3-HP的微生物途径[28]。在前期的基础上,嘉吉公司继续深入研究,并提出了7条以葡萄糖为碳源合成3-HP的路线,根据主要中间产物的不同,可以分为四种:乳酸途径、丙酸途径、β-丙氨酸途径和丙二酸单酰辅酶A途径。随后,吉诺玛蒂卡公司(Genomatica)和OPX生物技术公司(OPX Biotechnologies)又提出了以草酰乙酸为主要中间产物的3-HP合成路线(图3)。
2.1.1 丙酸途径
丙酸途径是由存在于Actinobacillus sp.的琥珀酸途径衍生而来[29]。1分子的葡萄糖理论上可以生成2分子的丙酸,丙酸在一个多功能酶丙酰辅酶A合成酶的作用下逐步转化为丙酰辅酶A、丙烯酰辅酶A和3-羟基丙酰辅酶A,3-羟基丙酰辅酶A再通过3-羟基丙酰辅酶A水解酶的作用转化为3-HP。该途径使用的丙酰辅酶A合成酶来源于橙色绿屈挠菌Chloro fl exus aurantiacus,该酶将丙酰辅酶A转化为丙烯酰辅酶A时效率较低,甚至有学者推测该反应的逆反应更加趋于不可逆。整个以丙酸为中间物质合成3-HP的途径,在热力学上是不可行的,该途径的吉布斯自由能高达79.6kJ/mol。同时,需要消耗额外的ATP,容易造成氧化还原失衡,不利于在细胞内进行。
2.1.2 乳酸途径
由丙酮酸转化为乳酸后,乳酸可以经过四步反应,最终得到3-羟基丙酸[29]。乳酸可以在辅酶A转移酶和乳酰辅酶A脱水酶的作用下转化为丙烯酰辅酶A,后者经3-羟基丙酰辅酶A脱水酶和3-羟基丙酰辅酶A水解酶的作用生成3-羟基丙酸。在这个合成途径中,乳酸到乳酰辅酶A的转化需要消耗大量的辅酶A,容易造成微生物代谢失调。而乳酰辅酶A脱水酶属于严格厌氧酶类,对氧气十分敏感,严重制约了后期发酵条件的选择。另外,乳酸和3-HP的平衡常数Keq为0.4,整个反应的吉布斯自由能较大,理论上难以转化。同时,作为同分异构体,乳酸和3-HP在下游的分离回收过程中也会出现较大困难。
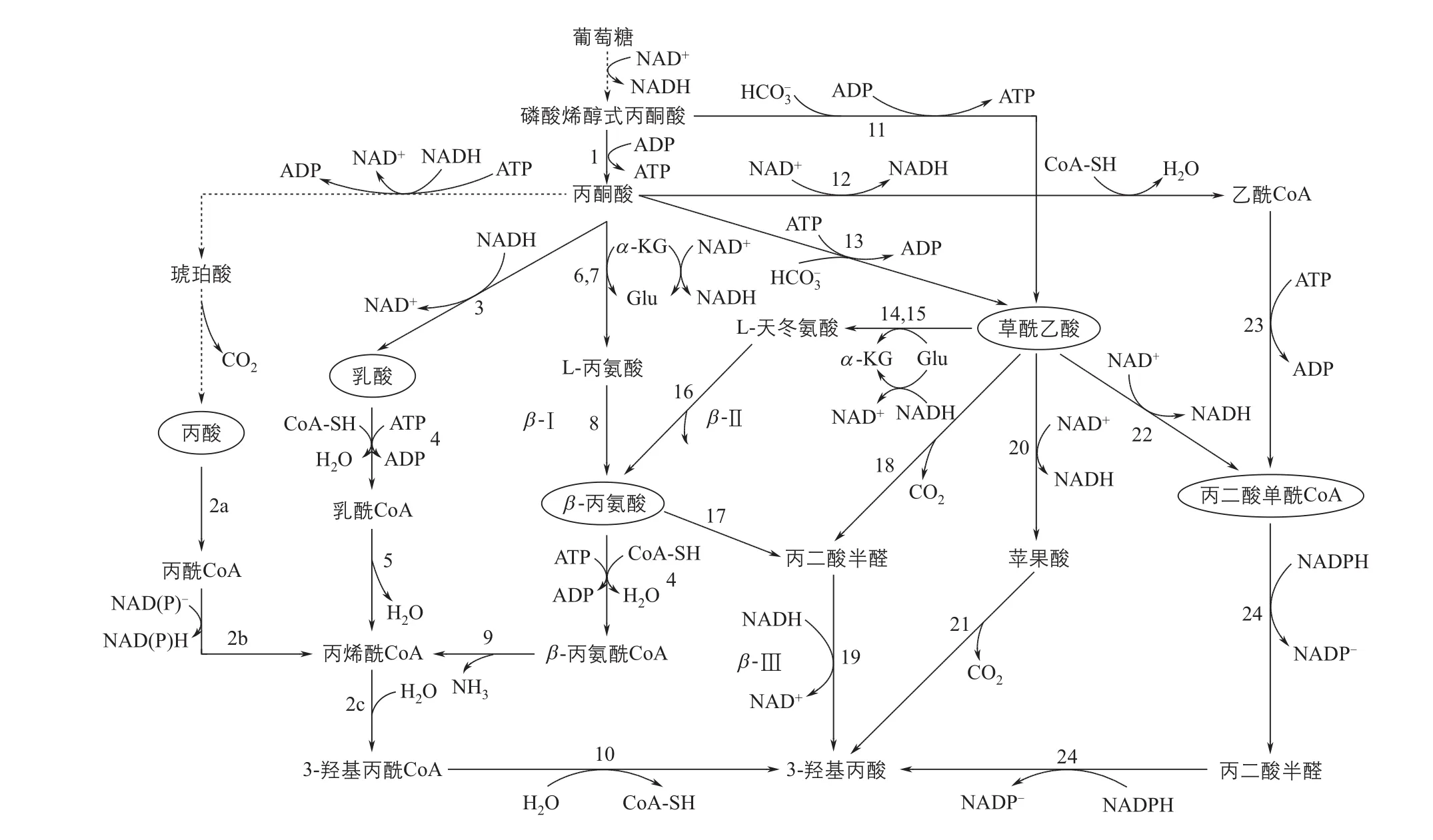
图3 以葡萄糖为碳源合成3-HP的代谢途径
2.1.3 β-丙氨酸途径
嘉吉公司开发了多条以β-丙氨酸为中间物质的3-HP合成路线[29-30]。其中两条途径(β-Ⅰ和β-Ⅱ)在热力学上不可行的,而另外一条途径则是可行的(途径β-Ⅲ的吉布斯自由能为-32.2kJ/mol)。后一条途径比前两条途径的催化步骤更短,而且在整个反应过程中会产生1mol的ATP。β-丙氨酸是微生物体内广泛存在的代谢产物,以其为中间体合成3-HP,可以拓宽原料来源。但是,β-丙氨酸本身的合成路线比较复杂,容易造成代谢负担,依赖该途径合成3-HP的效率在很长时间内处于较低水平。直到近几年,Borodina等[31]在针对β-Ⅲ途径进行了一系列优化,并在酿酒酵母中进行重构,使3-HP的产量达到了13.7g/L。
2.1.4 草酰乙酸途径
由丙酮酸或磷酸烯醇式丙酮酸(PEP)可以得到草酰乙酸,草酰乙酸在脱羧酶或脱氢酶的作用下可以转化为丙二酸半醛、苹果酸或者丙二酰辅酶A,进一步转化为3-HP[32-33]。以上3条以草酰乙酸为中间体的途径,在热力学上都是可行的,同时会产生1mol的ATP,具有一定优势。但是,转化草酰乙酸需要的脱羧酶和脱氢酶都是新型生物酶,在自然界不存在。想要实现以上途径的高效合成,需要结合酶工程等手段,提高关键酶的选择性和转化效率。
2.1.5 丙二酸单酰辅酶A途径
丙二酸单 酰辅酶A途径[29],是已知的以葡萄糖为碳源合成3-羟基丙酸的最短途径:来源于葡萄糖的乙酰辅酶A在乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)的作用下生成丙二酸单酰辅酶A,丙二酸单 酰辅酶A在丙二酸单 酰辅酶A还原酶(malonyl-CoA reductase,MCR)作用下转化为3-HP(图4)。由乙酰辅酶A到3-HP,只需要两个酶的催化作用即可实现。同时,整个过程在热力学上是可行的,且合成1mol的3-HP会生成1mol的ATP。鉴于丙二酸单酰辅酶A途径拥有多种优势,针对该途径的研究成为3-HP合成领域的研究热点(表1),主要开展的内容包括加强3-HP代谢流、增强辅因子和能量供应以及提高关键酶性能等方面。
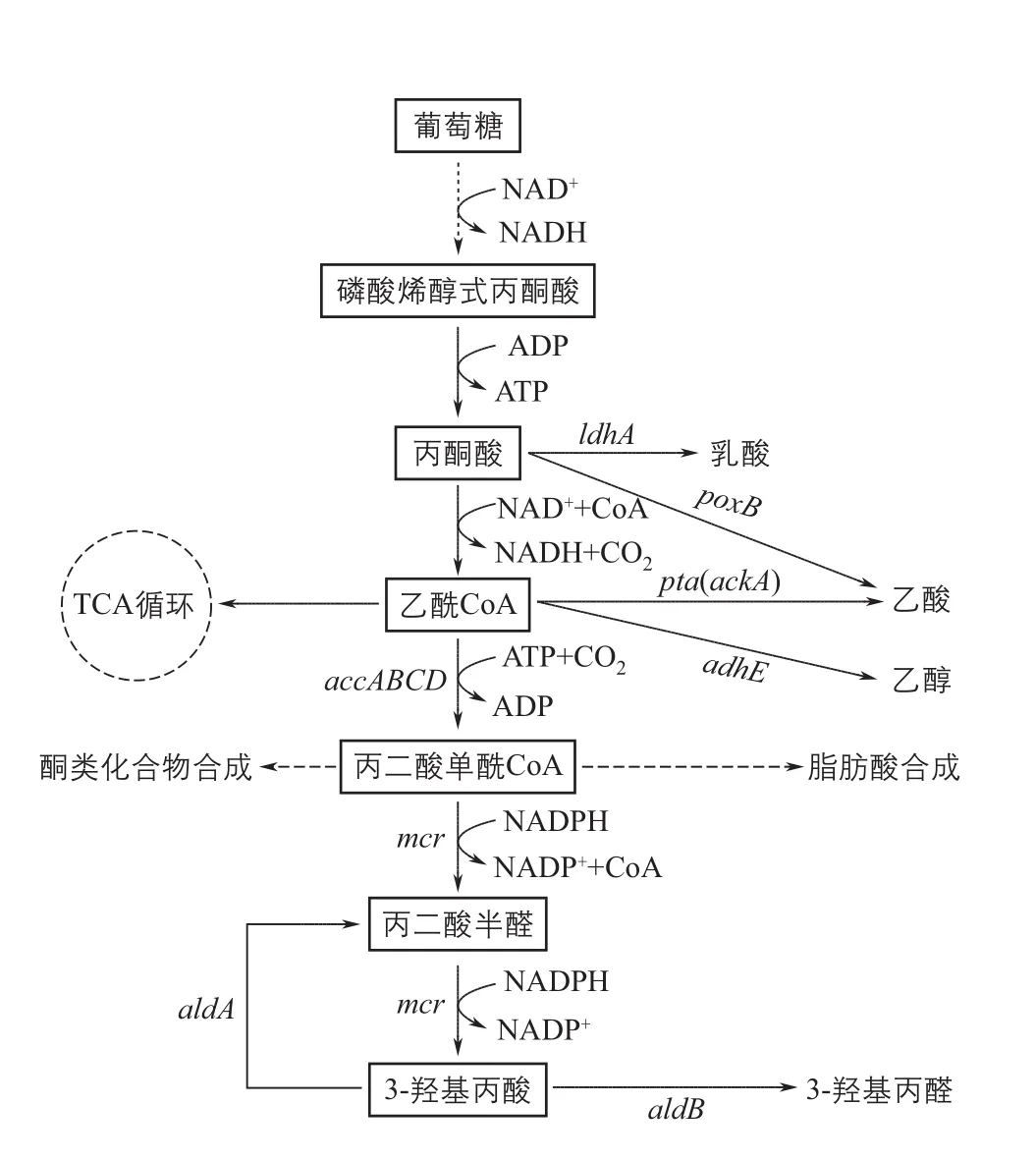
图4 丙二酸单酰辅酶A途径合成3-HP及其主要代谢支路
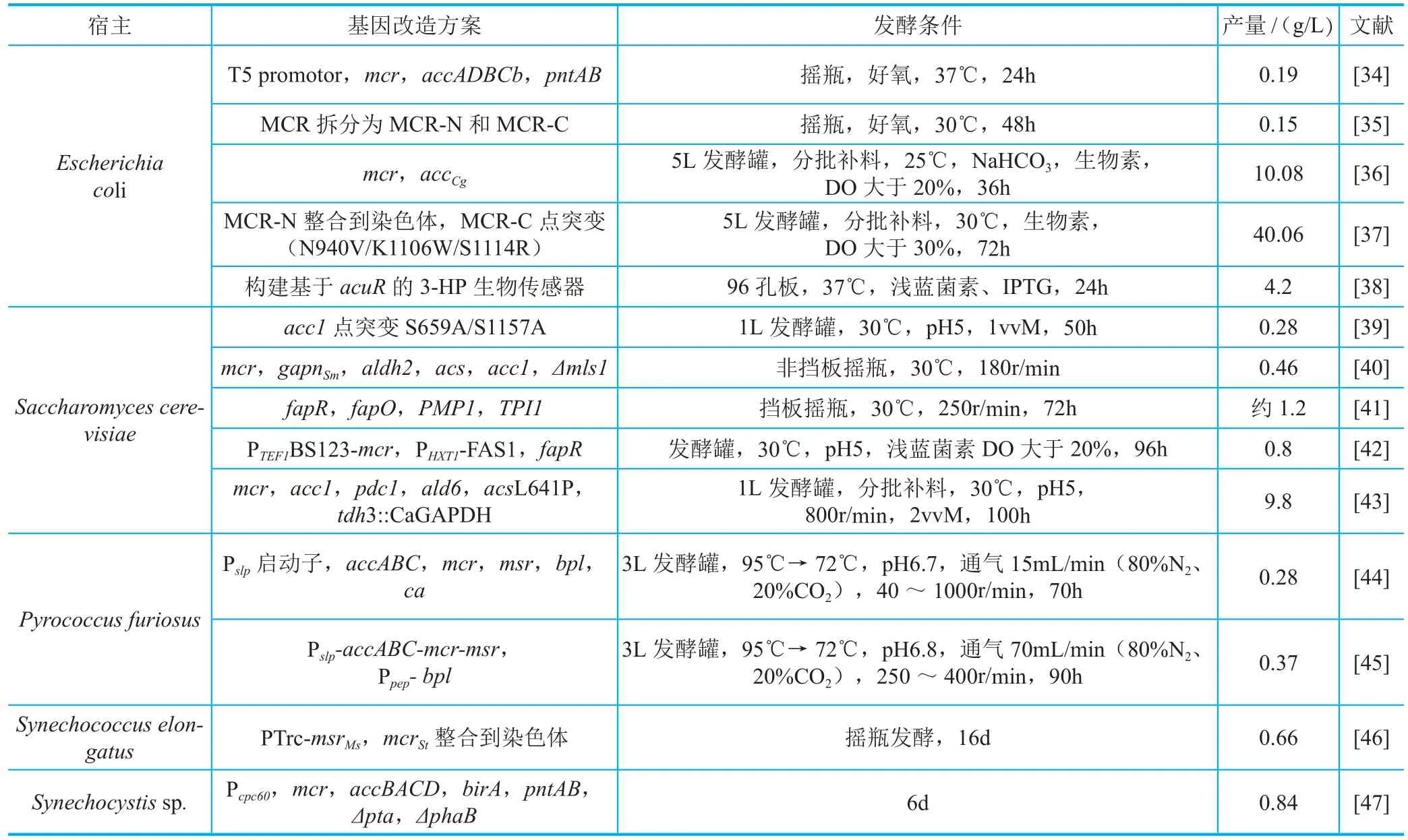
表1 利用丙二酸单酰辅酶A途径合成3-HP情况
丙二酸单酰辅酶A途径是以 乙酰辅酶A为主要中间体逐步转化而来,乙酰辅酶A作为微生物体内的主要代谢中间体,可以转化为乙酸、乙醇等各种代谢物质。原则上,抑制乙酰辅酶A到其他产物的合成途径,可以提高3-HP产量。Rathnasingh等[34]敲除了磷酸乙酰转移酶PTA和乙酸激酶ACK,没能实现3-HP产量的明显提高。相反, Kildegaard等[43]通过过表达丙酮酸脱羧酶PDC、醛脱氢酶ALDH和乙酰辅酶A合成酶 ACS来加强乙酰辅酶A合成,使得3-HP的产量提高了80%。Chen等[40]将以上两种策略进行了结合,在抑制乙醛酸循环的基础上,过表达了ALDH和ACS,3-HP的产量提高到原来的3倍。笔者所在研究团队通过敲除全局调控因子基因arcA来调控细胞代谢,在抑制乙酸合成的同时使3-HP的产量提高到原来的2倍[48]。
辅因子和能量供应是影响酶反应的重要因素。在该途径中,ACC需要生物素和ATP维持酶活性,而MCR需要NADPH提供电子。ACC的羧化能力依赖于自身的生物素酰化,可以通过在发酵过程中添加外源的生物素,或者通过引入外源的生物素酰化酶来增强ACC的酶活,从而达到提高3-HP的目的[45]。Li等[41]从酿酒酵母中筛选到与ATP合成有关的酶TPI1和编码质子-ATP酶亚基的酶PMP1,单独表达后都能引起3-HP产量的提升,升高幅度可以高达120%。从丙二酸单酰辅酶A出发,每生成1mol的3-HP就需要2mol的NADPH,需要大量的还原力。通过过表达与NADPH合成有关的酶,如吡啶核苷酸转氢酶PNT、甘油醛3-磷酸脱氢酶GAPDH等来加强NADPH的合成,可以使 3-HP 的产量得到提高[34,43]。
关键酶的催化作用对于生物合成途径的效率起到至关重要的作用。丙二酸单酰辅酶A途径中起主要作用的酶是乙酰辅酶A羧化酶ACC和丙二酸单酰辅酶A还原酶MCR。为了加强酶的催化作用,最常用的手段是在胞内进行过表达。然而,有关研究证明,在E. coli体内过表达自身的ACC后,细胞活性会受到抑制,相关机制尚不清晰[49]。Cheng等[36]尝试将来源于Corynebacterium glutamicum的ACC在E. coli中进行表达,发酵36h后3-HP的产量达到了10.08g/L。Shi等[39]以Saccharomyces cerevisiae为研究对象,通过对自身的ACC1进行点突变,使其活性得到增强,从而促进了3-HP的合成。
丙二酸单酰辅酶A途径使用的丙二酸单酰辅酶A还原酶MCR来源于C. aurantiacus,后者属于嗜热自养型细菌,导致MCR在57℃时才能发挥最佳酶活。当MCR在工程菌株中表达时,受培养温度和环境条件变化的影响,其活性被严重抑制,成为3-HP合成的限速酶。笔者所在研究团队通过对MCR的功能区域进行深入分析,发现MCR的N端(MCR-N)和C端(MCR-C)是两个不同的功能区域,分别发挥不同的催化作用。MCR-C先将丙二酸单酰辅酶A转化为丙二酸半醛,丙二酸半醛再被MCR-N还原而得到3-HP。将MCR的两个功能区域拆分后,其酶活得到提高;在工程菌株中表达后,3-HP的产量也得到大幅度提高[35]。进一步发现MCR-C端表达量及酶活均低于MCR-N,推测两个结构域的不平衡是导致MCR整体酶活较低的原因。通过定向进化提高MCR-C的酶活、通过染色体整合控制MCR-N的酶活,结合发酵条件的优化,在分批补料水平,得到了40.6g/L的3-HP,是已知利用该途径合成3-HP的最高水平[37]。一些科研工作者也尝试使用其他来源的酶来合成3-HP。例如将来源于Sulfolobus tokodaii的丙二酸单酰辅酶还原酶和来源于Metallosphaera sedula的丙二酸半醛还原酶在蓝藻Synechococcus elongatus内表达,3-HP的产量高于直接利用全长的MCR,但是仍然处于毫克水平[46]。
2.2 以甘油为底物的途径
近年来,生物柴油产业快速发展,炼制过程中会产生大量的甘油副产物,导致甘油成为价格低廉的碳源。甘油是一种还原性物质,与葡萄糖等碳源相比,在转化为丙酮酸时可以产生更多的还原力。同时,甘油和3-HP同为三碳化合物,到3-HP的转化途径也更短。已经发现很多种微生物,如Klebsiella、Lactobacillus、Citrobacter、Clostridium等都可以在厌氧环境下利用甘油生产3-HP。
2.2.1 甘油到3-HP的两种途径
甘油到3-HP的转化途径主要有两条(图5):辅酶A依赖型途径和非辅酶A依赖型途径。两个途径都需要先利用依赖维生素B12(VB12)的甘油脱水酶辅酶A将甘油转化为3-羟基丙醛(3-HPA),不同之处在于3-HPA后面的转化。辅酶A依赖型途径主要存 在 于Salmonella enterica、Lactobacillus reuteri和Klebsiella pneumoniae中,甘油被甘油脱水酶转化为3-羟基丙醛后,在1,3-丙二醇氧化还原酶、丙醛脱氢酶、磷酸转酰酶、丙酸激酶的逐步催化下,最终生成3-HP,途径复杂。辅酶A依赖型途径被发现以来,研究较少。与辅酶A依赖型途径相比,非辅酶A依赖型途径可以利用不同来源的醛脱氢酶,只需要一步催化就可以实现3-HPA到3-HP的转化,整个代谢过程不需要额外提供辅酶A。正是因为非辅酶A依赖型途径的简单高效,科研工作者们在E. coli、K. pneumoniae和其他一些菌株中利用该途径进行了一系列研究。
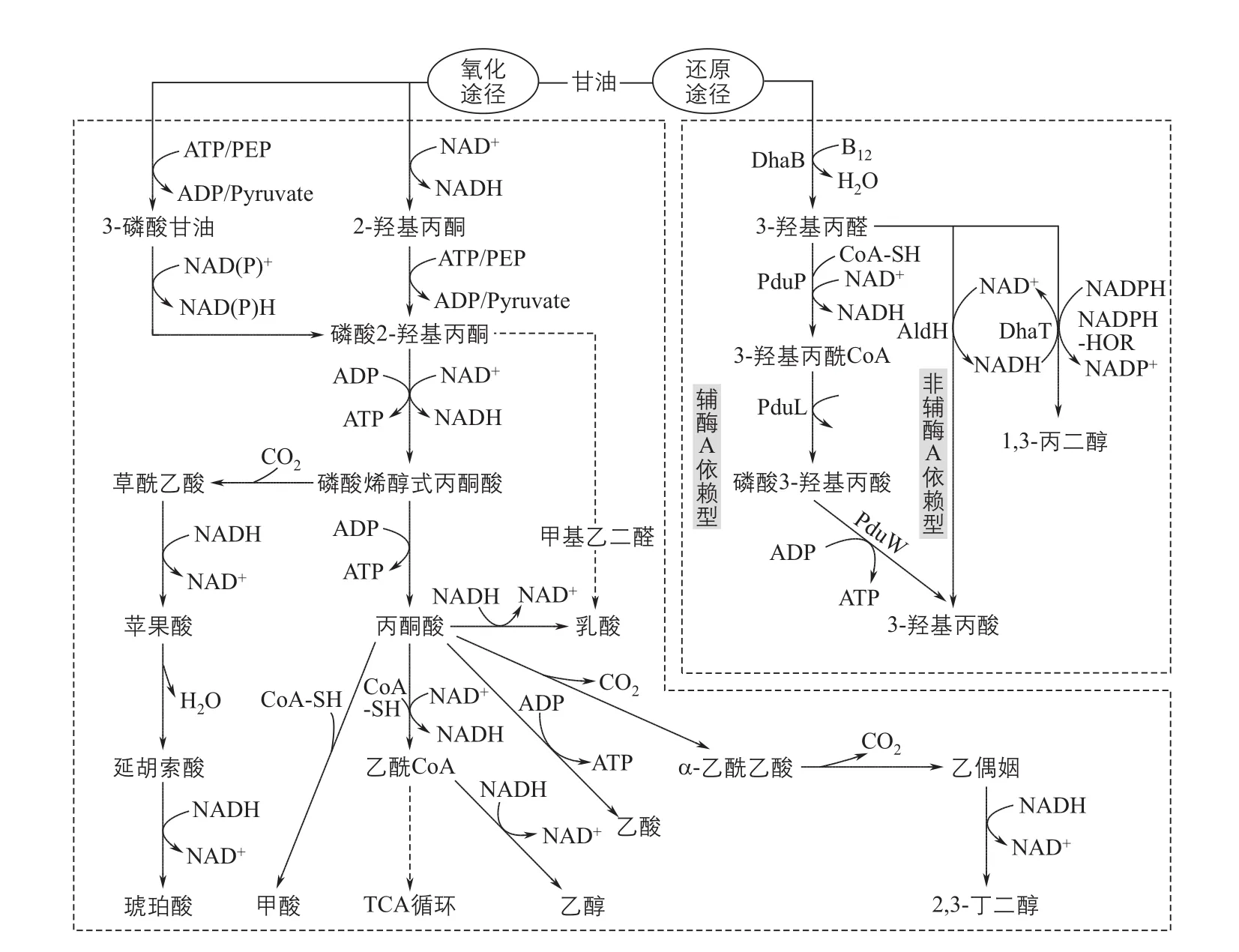
图5 甘油到3-羟基丙酸的代谢途径及主要支路
2.2.2 不同菌株利用甘油合成3-HP
(1)以E. coli为宿主合成3-HP
E. coli具有清楚的遗传背景,所需营养条件简单,已经被广泛用于各种高附加值化学品的合成。在合成3-羟基丙酸的问题上,E. coli存在一些劣势,其本身没有转化甘油合成3-羟基丙醛的途径,且不能合成甘油脱水酶的辅酶维生素B12(VB12)。所以,以E. coli为宿主利用甘油合成3-HP的研究(表2)主要集中在甘油脱水酶以及其激活因子的筛选方面,要实现3-HP合成的高产高效,同时需要抑制副产物的合成、对发酵条件进行优化等。
以E. coli为宿主利用甘油合成3-HP的研究,主要来自于韩国釜山大学、首尔大学等机构,已经取得比较好的进展。釜山大学Park课题组将来源于K. pneumoniae的甘油脱水酶D haB和E. coli的醛脱氢酶AldH在E. coli BL21中进行表达,通过对pH、基质浓度、诱导剂浓度、溶氧等条件的优化,使3-HP的浓度达到31g/L[50]。将宿主更换为E . coli BL21(DE3),同时过表达K. pneumoniae的甘油脱水酶DhaB123及其激活因子GdrAB以及Azospirillum brasilense的醛脱氢酶KGSADH,3-HP的产量提高到38.7g/L[51]。通过比较9种不同的E. coli宿主细胞对3-HP的耐受性,筛选出E. coli W具有最佳性能并用于3-HP的生产,好氧条件下的产量可以达到41.5g/L[52]。首尔大学以E. coli star(DE3)为宿主,同时过表达L. brevis的甘油脱水酶DhaB、DhaR和Pseudomonas aeruginosa的醛脱氢酶AldH,并敲除副产物途径基因glpK和yqhD,好氧分批补料发酵可以得到57.3g/L的3-HP,转化率达到0.88g/g[53]。三星高等研究院对来源于C. necator的醛脱氢酶GabD4进行了点突变,将突变后的GabD4 _E209Q/E269Q与甘油脱水酶DhaB同时引入E. coli W3110,并对乙酸、乙醇合成关键酶基因ackA、pta、yqhD进行敲除,在通气为1vvM条件下,3-HP产量达到71.9g/L[54],这是以E. coli为宿主利用甘油合成3-HP的最高产量。
(2)以K. pneumoniae为宿主合成3-HP
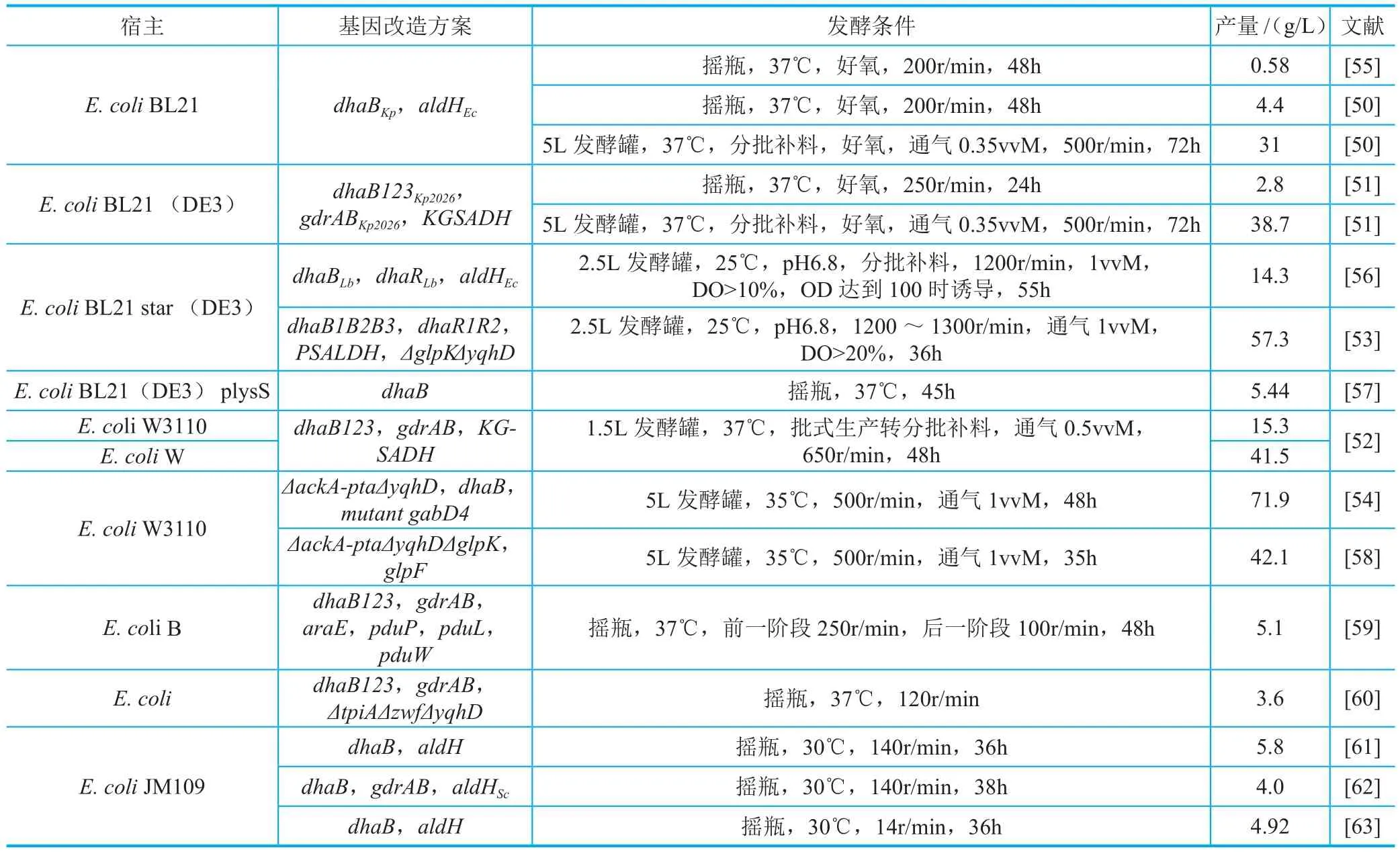
表2 以E. coli为宿主利用甘油合成3-HP主要情况
K. pneumoniae能够以甘油为唯一碳源进行生长代谢,与E. coli相比,具有更强的甘油同化能力,且其自身可以在厌氧或微氧条件下合成VB12,降低了生产成本(表3)。K. pneumoniae对甘油的代谢(图5),主要分为氧化途径和还原途径。在还原途径中,甘油先是被甘油脱水酶作用生成3-HPA,一部分3-HPA继续被还原转化为1,3-PDO,伴随NAD+生成;还有一部分3-HPA则被氧化为3-HP,氧化3-HPA生成3-HP的酶是醛脱氢酶,这一过程伴随NAD+的消耗。NAD+转化的NADH可以被重新氧化为NAD+用于3-HP的合成,但是,氧气存在时会影响VB12的合成,甘油脱水酶的活性也会被抑制,这种竞争关系成为3-HP合成的一个重要限制因素。

表3 K. pneumoniae与E. coli利用甘油合成3-HP的比较分析
以K. pneumoniae为宿主利用甘油合成3-HP的研究(表4),主要集中在不同关键酶的筛选、副产物合成基因的敲除、溶氧等条件对产物合成的影响等方面,且通常是对这几个关键因素进行组合优化。韩国釜山大学的Sunghoon Park课题组通过在K. pneumoniae内过表达自身的醛脱氢酶基因puuC、甘油脱水酶基因dhaB123及其激活因子gdrAB,同时敲除1,3-PDO氧化还原酶dhaT和yqhD,在5L发酵罐中维持溶氧在5%,通过分批补料发酵48h,最终得到了28g/L的3-HP[64]。华东理工大学的叶勤课题组对来源于Lactobacillus collinoides、Zymomonas mobilis、E. coli 和K. penumoniae的14种醛脱氢酶进行比较,最终确定在K. pneumoniae内过表达E.coli的脱氢酶AldH后3-HP的产量最高。经过对溶氧的进一步优化,利用5L发酵罐,在通气为1.5vvM的微氧条件下,3-HP的产量显著提升,可以达到48.9g/L[65]。北京化工大学的田平芳课题组针对K.pneumoniae利用甘油合成3-HP进行了大量研究,该课题组考察了来源于Bacillus subtilis、Pseudomonas sp. AIU 362和K. pneumoniae的醛脱氢酶对3-HP合成的影响,过表达Pseudomonas sp.的醛脱氢酶DhaS后,发酵24h可以得到18.5g/L的3-HP[66]。田平芳课题组还研究了不同启动子对醛脱氢酶效率的影响,在使用IPTG诱导的tac启动子的基础上,进一步敲除了乳酸合成关键基因ldh1、ldh2和乙酸合成关键基因pta,结合发酵条件的优化,发酵72h可以得到83.8 g/L的3-HP[67]。该产量是迄今公开报道的最高产量,对于3-HP的工业化发展具有重要意义。
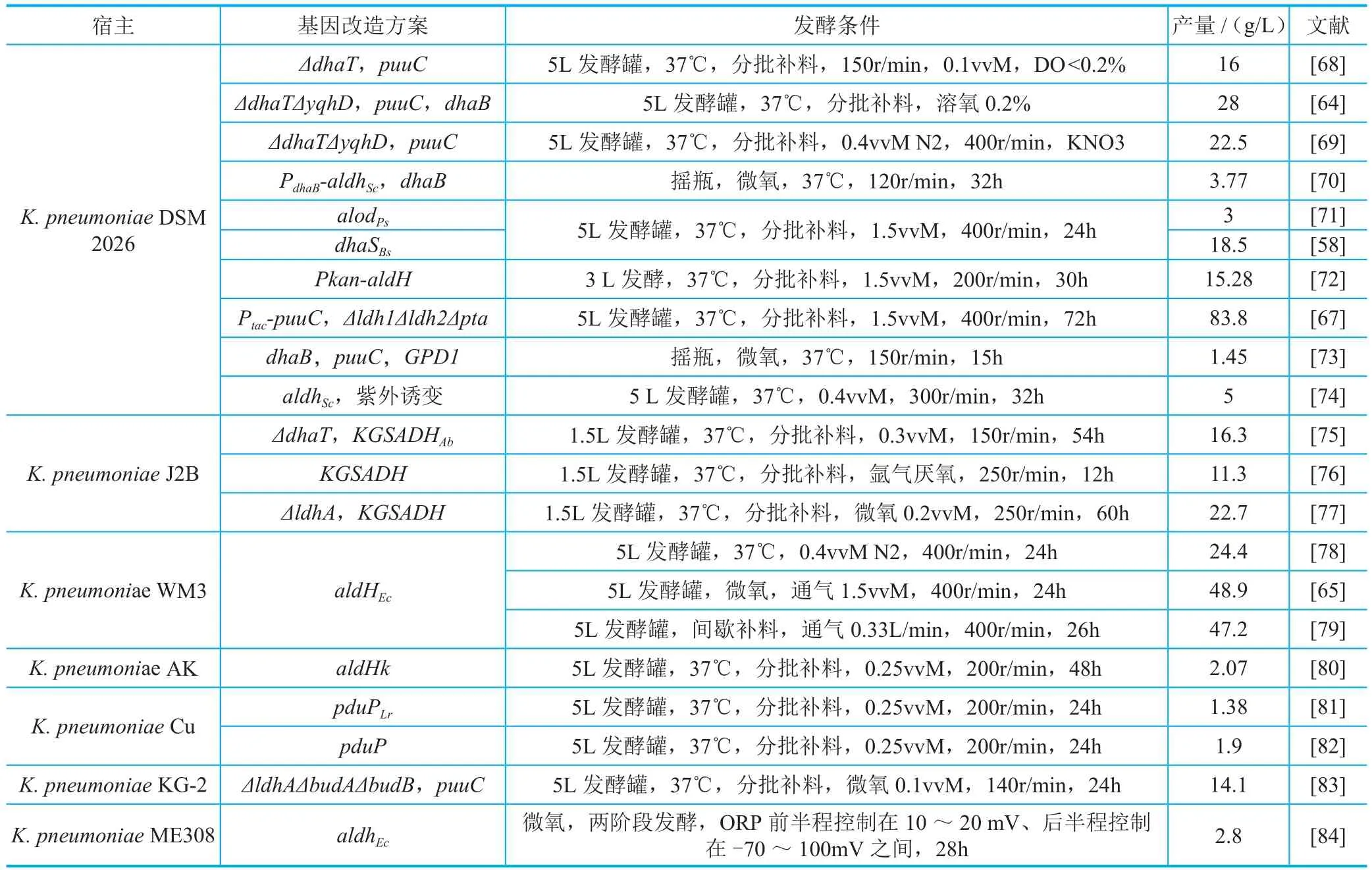
表4 以K. pneumoniae为宿主利用甘油合成3-HP主要情况
(3)以其他菌株为宿主
除了K. pneumoniae和E.coli,其他一些微生物也被证明可以用来合成3-HP。如L. reuteri可以将甘油转化为1,3-丙二醇,并通过CoA依赖型途径合成3-HP,且可以合成VB12[85]。而S. blattae能够将甘油转化为3-HPA,不需要额外添加VB12,但缺少醛脱氢酶,工程S. blattae菌株已经被用于合成3-HP的聚合物[86]。Clostridium既可以利用纯甘油,也可以利用粗甘油,含有依赖VB12的甘油脱水酶GDHt,而且GDHt对氧气高度敏感,只有在完全厌氧条件下才能发挥作用。Paracoccus denitri fi cans可以在好氧条件下合成VB12,具有高效的NAD+再生途径,引入K.pneumoniae的dhaB、gdrAB基因后可以得到3.4g/L的3-HP;加入CoCl2后,3-HP产量提高到4.3g/L;进一步表达K. pneumoniae的puuC后,3-HP产量可以达到4.93g/L[87]。这些微生物都被证明可以利用甘油,其中一些甚至可以在好氧条件下合成VB12,具有一定优势。但是,遗传背景尚不清晰,遗传操作工具缺乏,现有3-HP的合成产量较低。
3 主要问题及建议
3.1 3-HPA及3-HP的毒性
以甘油为碳源能合成3-HP,首先要转化为3-HPA,如果转化不及时,会很容易导致3-HPA的积累。醛基基团抑制DNA的复制,对细胞具有较大毒性,胞外的3-HPA浓度达到480mmol/L时,就会抑制细胞的生长[88]。有机酸可以通过细胞膜进入细胞,积累到一定程度后会引起细胞质酸化,影响嘌呤碱基的合成、引起关键酶的变性,从而影响细胞活性[89]。3-HP和其它有机酸一样,也会对细胞生长和代谢造成抑制。
可以从以下几个方面消除或缓解产物的毒性。首先,可以从细胞的耐受性出发。通过两阶段培养方法,使用L. reuteri静息细胞进行发酵,发现可以耐受更高浓度的3-HPA[90]。已经有很多关于酸的耐受性方面的研究。例如,有研究发现在E. coli内存在一个21个氨基酸的短肽sORF可以使细胞对3-HP的耐受性提高133%[91]。笔者所在团队通过差异蛋白组学分析,发现了46个与3-HP耐受性相关的蛋白,将其中一些蛋白进行过表达后,可以使3-HP的产量提高1倍以上[92]。其次,可以从代谢途径的平衡出发。3-HPA的积累很大程度上是由于甘油脱水酶和醛脱氢酶的活性不平衡引起的,在一定程度上降低甘油脱水酶的活性,同时提高醛脱氢酶的活性,提高3-HPA到3-HP的转化效率,也许会有助于缓解3-HPA的积累。另外,有学者提出可以利用氨基脲包埋3 -HPA的方法来缓解对细胞的毒性[93]。
3.2 氧化还原平衡
氧化还原平衡关系到细胞代谢的各个方面。在甘油合成3-HP的代谢途径中,NAD+的再生系统需要氧气供应,而氧气会抑制VB12的合成,如何调节氧气供应是一大难题。有学者从还原性物质的添加出发,利用硝酸盐和亚硝酸盐的转化来激活NAD+再生,从而提高了3-HP的产量[69]。另外,通过过表达NADH氧化酶/脱氢酶来加强NADH到NAD+的转化,也是一种潜在的方法。但是,需要注意的是,NADH氧化酶/脱氢酶会受到胞内ATP水平的影响。所以,在利用NADH氧化酶/脱氢酶来调控胞内氧化还原平衡时,要同时调控胞内ATP合成酶的活性。
3.3 VB12的供应
VB12对于维持甘油脱水酶的活性至关重要,需要持续供应。K. pneumoniae等细胞内存在VB12的合成途径,但对氧气十分敏感,而氧气是NAD+再生系统的必要元素。在具体发酵过程中,需要对发酵条件特别是溶氧进行优化,但是,单纯的优化需要耗费大量的人力和时间,获得的效果也不尽如人意。P. denitri fi cans被发现可以在好氧条件下合成VB12,但该菌不存在3-HP合成途径且遗传背景不清晰,难以通过基因工程的方法实现3-HP的高效合成。有学者尝试将P. denitrificans的VB12合成途径在E. coli中进行表达,但整个途径需要25个酶,步骤繁琐,难以调控,代谢压力较大,产量较低[94]。
4 总结与展望
近几年来,3-HP的生物合成研究发展迅速。在原料上,主要是以廉价的葡萄糖和甘油为碳源进行发酵,甘油的价格随着生物柴油产业的发展有望进一步降低。随着高效的生物质预处理技术的发展,生物质资源有望用于包括3-HP在内的化学品的合成,可以进一步降低生产成本。3-HP的生物合成途径中,以葡萄糖为碳源的丙二酸单酰辅酶A途径和以甘油为碳源的非CoA依赖型途径最具前景。在具体的生产过程中,需要针对产物的耐受性、VB12的生物合成、氧化还原平衡、发酵条件以及副产物合成调控等方面展开深入研究,进一步提高3-HP合成效率。同时,3-HP的高效分离技术也有待开发。大宗化学品的产业化生产对产量的要求是100g/L[95],利用非CoA依赖型途径合成3-HP的产量已经达到了83.8g/L,其产业化的实现已经近在眼前。
[1] 温丽瑗,陈小平,郎春燕. 3-羟基丙酸合成途径研究进展[J]. 天然气化工,2012,37(4):62-67.
[2] 吴从意,陈静. 1,3-丙二醇制备研究进展 [J]. 分子催化,2012,26(3):276-283.
[3] 孟青青,杨建国,王凤寰. 生物法合成丙烯酸的研究进展[J]. 中国生物工程学报,2012,32(10) :119-127.
[4] WANG Q,YANG P,LIU C,et al. Biosynthesis of poly(3-hydroxypropionate)from glycerol by recombinant Escherichia coli[J]. Bioresource Technology,2013,131:548-551.
[5] WANG Q,YANG P,XIAN M,et al. Production of block copolymer poly(3-hydroxybutyrate)-block-poly(3-hydroxypropionate)with adjustable structure from an inexpensive carbon source[J]. ACS Macro Letters,2013,2(11):996-1000.
[6] WERPY T,PETERSEN G. Top value added chemicals from biomass,vol 1- results of screening for potential candidates from sugars and synthesis gas:US Department of Energy Technical Report [EB/OL].2004-08-01 [2004-08-01]. https://www.nrel.gov/docs/fy04osti/35523.pdf.
[7] 沈长洲,游丝慧. 丙烯酸及甲基丙烯酸高温水合反应的研究[J].化学试剂,1997,9(2):77-79.
[8] UITTENBOGAARD J,ZOMER B,HOOGERHOUT P,et al.Reactions of β-propiolactone with nucleobase analogues,nucleosides,and peptides[J]. The Journal of Biological Chemietry,2011,286(42):36198-36214.
[9] 温丽瑗,陈成刚,张战军,等. 3-羟基丙酸的绿色合成法[J]. 工业催化,2016,24(8):7-11.
[10] HARADA T,HIRABAYASHI T. Utilization of aleohols by Hansemila miso[J]. Agricultural and Biological Chemistry,1968,32:1175-1180.
[11] MIYOSHI T,HARADA T. Utilization of 2-butane-1,4-diol by a strain of Fusarium merismoides[J]. Journal of Fermentation Technology,1974,52:196-199.
[12] HASEGAWA J,OGURA M,KANEMA H,et al. Production of β-hydroxypropionic acid from propionic acid by a Candida rugosa mutant unable to assimilate propionic acid[J]. Journal of Fermentation Technology,1982,60:591-594.
[13] TAKAMIZAWA K,HORISTU H,IEHIKAWA T,et al. Betahydroxypropionic acid production by Byssochlamys sp. grown on acrylic acid[J]. Applied Microbiology and Biotechnology,1993,40:196-200.
[14] HOLO H,SIREVAG R. Autotrophic growth and CO2fixation of Chloro fl exus aurantiacus[J]. Archives of Microbiology,1986,145(2):173-180.
[15] HOLO H. Chloro fl exus aurantiacus secretes 3-hydroxypropionate,a possible intermediate in the assimilation of CO2and acetate[J].Archives of Microbiology,1989,151(3):252-256.
[16] ALBER B E,FUCHS G. Propionyl-coenzyme A synthase from Chloro fl exus aurantiacus,a key enzyme of the 3-hydroxypropionate cycle for autotrophi CO2fi xation[J]. Journal of Biological Chemistry,2002,277(14):12137-12143.
[17] HUGER M,MENENDEZ C,SCHAGGER H,et al. Malonylcoenzyme A reductase from Chloro fl exus aurantiacus,a key enzyme of the 3-hydroxypropionate cycle for autotrophic CO2fixation[J].Journal of Bacteriology,2002,184(9):2404-2410.
[18] HERTER S,BUSCH A,FUCHS G. L-malyl-coenzyme A lyase/β-methylmalyl-coenzyme A lyase from Chloro fl exus aurantiacus,a bifunctional enzyme involved in autotrophic CO2fi xation[J]. Journal of Bacteriology,2002,184(21):5999-6006.
[19] FRIEDMANN S,STEINDORF A,ALBER BE,et al. Properties of succinyl-coenzyme A:L-malate coenzyme A transferase and its role in the autotrophic 3-hydroxypropionate cycle of Chloroflexus aurantiacus[J]. Journal of Bacteriology,2006,188(7):2646-2655.
[20] ZARZYCKI J,BRECHT V,MULLER M,et al. Identifying the missing steps of the autotrophic 3-hydroxypropionate CO2fixation cycle in Chloroflexus aurantiacus[J]. Proceeding of the National Academy of Sciences,2009,106(50):21317-21322.
[21] JIANG XL,MENG X,XIAN M. Biosynthetic pathways for 3-hydroxypropionic acid production[J]. Applied Microbiology and Biotechnology,2009,82(6):995-1003.
[22] 王洪杰,倪俊,张怡,等. 新型固碳途径-3-羟基丙酸循环的研究进展 [J].微生物学通报,2013,40(2):304-315.
[23] BERG I A. Ecological aspects of the distribution of different autotrophic CO2fi xation pathways[J]. Applied and Environmental Microbiology,2011,77:1925-1936.
[24] BOYLE N R,MOORGAN J A. Computation of metabolic fl uxes and ef fi ciencies for biological carbon dioxide fi xation[J]. Metabolic Engineering,2011,13:150-158.
[25] HUGLER M,HUBER H,STETTER K O,et al. Autotrophic CO2fi xation pathways in archaea( Crenarchaeota)[J]. Archives of Microbiology,2003,179(3):160-173.
[26] CHUAKRUT S,ARAI H,ISHII M,et al. Characterization of a bifunctional Archaeal acyl coenzyme A carboxylase[J]. Journal of Bacteriology,2003,185(3):938-947.
[27] ZARZYCKI J,FUCHS G. Coassimilation of organic substrates via the autotrophic 3-hydroxypropionate bi-Cycle in Chloro fl exus aurantiacus[J]. Applied and Environmental Microbiology,2011,77(17):6181-6188.
[28] GOKARN R R,SELIFONOVA O V,JESSEN H,et al. 3-Hydroxypropionic acid and other organic compounds:US20120160686 [P/OL]. 2012-03-13 [2012-06-28]. http://www. free patentsonline. com/20120160686.pdf.
[29] GOKARN R R,SELIFONOVA O V,JESSEN H,et al. 3-hydroxypropionic acid and other organic compounds:US7186541 B2[P/OL]. 2001-11-20 [2007-03-06]. http://www.freepatentsonline.com/7186541.pdf.
[30] LIAO H H,GOKARN R R,GORT S J,et al. Alanine 2,3-Aminomutase:US7309597B2 [P/OL]. 2003-01-17 [2007-12-18]. http://www. freepatentsonline. com/7309597.pdf.
[31] BORODINA I,KILDEGAARD K R,FORSTER J,et al. Genetically engineered yeast:US20150267228A1[P/OL]. 2013-10-10 [2015-09-24]. http://www.freepatentsonline.com/20150267228.pdf.
[32] BURK M J,OSTERHOUT R E. Methods and organisms for production of 3-hydroxypropionic acid:US20100021978A1[P/OL]. 2009-07-23 [2010-01-28]. http://www.freepatentsonline.com/20100021978.pdf.
[33] LYNCH M D. Compositions and methods for 3-hydroxypropionate bio-production from biomass:US8048624B1[P/OL]. 2008-12-04[2011-11-01]. http://www.freepatentsonline.com/8048624.pdf.
[34] RATHNASINGH C,RAJ S M,LEE Y,et al. Production of 3-hydroxypropionic acid via malonyl-CoA pathway using recombinant Escherichia coli strains[J]. Journal of Biotechnology,2012,157(4):633-640.
[35] LIU C,WANG Q,XIAN M,et al. Dissection of malonyl-coenzyme A reductase of Chloro fl exus aurantiacus results in enzyme activity improvement[J]. PLoS One,2013,8(9):e75554.
[36] CHENG Z,JIANG J,WU H,et al. Enhanced production of 3-hydroxypropionic acid from glucose via malonyl-CoA pathway by engineered Escherichia coli[J].Bioresource Technology,2016,200:897-904.
[37] LIU C,DING Y,ZHANG R,et al. Functional balance between enzymes in malonyl-CoA pathway for 3-hydroxypropionate biosynthesis[J]. Metabolic Engineering,2016,34:104-111.
[38] ROGERS J,CHURCH G M. Genetically encoded sensors enable real-time observation of metabolite production[J]. Proceeding of the National Academy of Sciences, 2016,113(9):2388-2393.
[39] SHI S,CHEN Y,SIEWERS V,et al. Improving production of malonyl coenzyme A-derived metabolites by abolishing Snf1-dependent regulation of Acc1[J]. mBio,2014,5(3):e01130-e01114.
[40] CHEN Y,BAO J,KIM I K,et al. Coupled incremental precursor and co-factor supply improves 3-hydroxypropionic acid production in Saccharomyces cerevisiae[J]. Metabolic Engineering,2014,22:104-109.
[41] LI S,SI T,WANG M,et al. Development of a synthetic malonyl-CoA sensor in Saccharomyces cerevisiae for intracellular metabolite monitoring and genetic screening[J]. ACS Synthetic Biology,2015,4:1308-1315.
[42] DAVID F,NIELSEN J,SIEWERS V. Flux control at the malonyl-CoA node through hierarchical dynamic pathway regulation in Saccharomyces cerevisiae[J]. ACS Synthetic Biology,2016,5:224-233.
[43] KILDEGAARD K R,JENSEN N B,SCHNEIDER K,et al.Engineering and systems-level analysis of Saccharomyces cerevisiae for production of 3-hydroxypropionic acid via malonyl-CoA reductasedependent pathway[J]. Microbial Cell Factories,2016,15:53.
[44] HAWKINS A B,LIAN H,ZELDES A M,et al. Bioprocessing analysis of pyrococcus furiosusb strains engineered for CO2-based 3-hydroxypropionate production[J]. Biotechnology and Bioengineering,2015,112(8):1533-1543.
[45] LIAN H,ZELDES B M,LIPSCOMB G L,et al. Ancillary contributions of heterologous biotin protein ligase and carbonic anhydrase for CO2incorporation into 3-hydroxypropionate by metabolically engineered Pyrococcus furiosus[J]. Biotechnololgy and Bioengineering,2016,113(12):2652-2660.
[46] LAN E I,CHUANG D S,SHEN C R,et al. Metabolic engineering of cyanobacteria for photosynthetic 3-hydroxypropionic acid production from CO2using Synechococcus elongatus PCC 7942[J]. Metabolic Engineering,2015,31:163-170.
[47] WANG Y,SUN T,GAO X,et al. Biosynthesis of platform chemical 3-hydroxypropionic acid(3-HP)directly from CO2in cyanobacterium Synechocystis sp. PCC 6803[J]. Metabolic Engineering,2016,34:60-70.
[48] LIU M,YAO L,XIAN M,et al. Deletion of arcA increased the production of acetyl-CoA-derived chemicals in recombinant Escherichia coli[J]. Biotechnology letters,2016,38(1):97-101.
[49] DAVIS M S,SOLBIATI J,JR J E C. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis in Escherichia coli[J]. The Journal of Biological Chemistry,2000,275(37):28593-28598.
[50] RAJ S M,RATHNASINGH C,JUNG W C,et al. E ff ect of process parameters on 3-hydroxypropionic acid production from glycerol using a recombinant Escherichia coli[J]. Applied Microbiology and Biotechnology,2009,84(4):649-657.
[51] RATHNASINGH C,RAJ S M,Jo J E,et al. Development and evaluation of efficient recombinant Escherichia coli strains for the production of 3-hydroxypropionic acid from glycerol[J].Biotechnology and Bioengineering,2009,104 (4):729-739.
[52] S ANKARANARAYANAN M,ASHOK S,PARK S. Production of 3-hydroxypropionic acid from glycerol by acid tolerant Escherichia coli[J]. Journal of Industrial Microbiology and Biotechnology,2014,41 (7):1039-1050.
[53]K IM K,KIM S K,PARK Y C,et al. Enhanced production of 3-hydroxypropionic acid from glycerol by modulation of glycerol metabolism in recombinant Escherichia coli[J]. Bioresource Technology,2014,156:170-175.
[54] CHU H S,KIM Y S,LEE C M,et al. Metabolic engineering of 3-hydroxypropionic acid biosynthesis in Escherichia coli[J].Biotechnology and Bioengineering,2015,112 (2):356-364.
[55]R AJ S M,RATHNASINGH C,JO J E,et al. Production of 3-hydroxypropionic acid from glycerol by a novel recombinant Escherichia coli BL21 strain[J]. Process Biochemistry,2008,43(12):1440-1446.
[56]K WAK S,PARK Y C,SEO J H. Biosynthesis of 3-hydroxypropionic acid from glycerol in recombinant Escherichia coli expressing Lactobacillus brevis dhaB and dhaR gene cluster and E. coli K-12 aldH[J]. Bioresource Technology,2013,135:432-439.
[57] 胡南,缪鑫昕,谈曙明,等. 重组大肠杆菌生物转化甘油生产 3-羟基丙酸 [J]. 生物技术,2012,22(1):72-75.
[58]J UNG W S,KANG J H,CHU H S,et al. Elevated production of 3-hydroxypropionic acid by metabolic engineering of the glycerol metabolism in Escherichia coli[J]. Metabolic Engineering,2014,23:116-122.
[59] HONJO H,TSURUNO K,TATSUKE T,et al. Dual synthetic pathway for 3-hydroxypropionic acid production in engineered Escherichia coli[J]. Journal of Bioscience and Bioengineering,2015,120(2):199-204.
[60]T OKUYAMA K,OHNO S,YOSHIKAWA K,et al. Increased 3-hydroxypropinic acid production from glycerol,by modi fi cation of central metabolism in Escherichia coli[J]. Microbial cell factories,2014,13:64.
[61] 张晓梅,李新生,许正宏. 产3-羟基丙酸重组大肠杆菌JM109的构建及发酵条件优化[J]. 生物技术通报,2013,6:200-208.
[62] 权国燕,方慧英,诸葛斌,等. 甘油脱水酶再激活因子提高重组大肠杆菌3-羟基丙酸合成能力[J]. 中国生物工程杂志,2011,31(6):75-80.
[63] 张晓梅,诸葛斌,许正宏,等. 产3-羟基丙酸重组菌的构建及其转化甘油的研究[J]. 生物技术通报,2009,8:104-108.
[64] ASHOK S,SANKARANARAYANAN M,KO Y,et al. Production of 3-hydroxypropionic acid from glycerol by recombinant Klebsiella pneumoniae ΔdhaTΔyqhD which can produce vitamin B12 naturally[J]. Biotechnology and Bioengineering,2013,110(2):511-524.
[65] HUANG Y,LI Z,SHIMIZU K,et al. Co-production of 3-hydroxypropionic acid and 1,3-propanediol by Klebsiella pneumoniae expressing aldH under microaerobic conditions[J].Bioresource Technology,2013,128:505-512.
[66] SU M,LI Y,GE X,et al. 3-Hydroxypropionaldehyde-speci fi c aldehyde dehydrogenase from Bacillus subtilis catalyzes 3-hydroxypropionic acid production in Klebsiella pneumoniae[J].Biotechnology Letters,2015,37(3):717-724.
[67] LI Y,WANG X,GE X,et al. High production of 3-hydroxypropionic acid in Klebsiella pneumoniae by systematic optimization of glycerol metabolism[J]. Scienti fi c reports,2016,6:26932.
[68] AS HOK S,RAJ S M,RATHNASINGH C,et al. Development of recombinant Klebsiella pneumoniae ΔdhaT strain for the coproduction of 3-hydroxypropionic acid and 1,3-propanediol from glycerol[J]. Applied Microbiology and Biotechnology,2011,90(4):1253-1265.
[69] ASHOK S,RAJ S M,KO Y,et al. Effect of puuC overexpression and nitrate addition on glycerol metabolism and anaerobic 3-hydroxypropionic acid production in recombinant Klebsiella pneumoniae ΔglpKΔdha[J]. Metabolic Engineering,2013,15:10-24.
[70] WANG X,SA N,WANG F H,et al. Engineered constitutive pathway in Klebsiella pneumoniae for 3-hydroxypropionic acid production and implications for decoupling glycerol dissimilation pathways[J].Current Microbiology,2013,66(3):293-299.
[71] LI Y,LIU L,TIAN P. NAD+-independent aldehyde oxidase catalyzes cofactor balanced 3-hydroxypropionic acid production in Klebsiella pneumoniae[J]. Biotechnology Letters,2014,36(11):2215-2221.
[72] 马春路,苏明月,赵鹏,等. 构建组成型肺炎克雷伯氏菌表达系统生产3-羟基丙酸[J]. 北京化工大学学报(自然科学版),2016,43(1):68-72.
[73] 曹宁,李莎,葛喜珍,等. 肺炎克雷伯氏菌3-羟基丙酸合成关键酶基因过表达与NAD+再生的耦合[J]. 北京化工大学学报(自然科学版),2014,41(1):74-77.
[74] 王凤寰,杨建国,王晓楠,等. 利用甘油发酵耦联生产3-羟基丙酸及1,3-丙二醇重组菌的构建及筛选[J]. 微生物学通报,2011,38(11):1611-1617.
[75] KO Y,ASHOK S,ZHOU S,et al. Aldehyde dehydrogenase activity is important to the production of 3-hydroxypropionic acid from glycerol by recombinant Klebsiella pneumoniae[J]. Process Biochemistry,2012,47(7):1135-1143.
[76] KUMAR V,SANKARANARAYANAN M,JAE K,et al. Coproduction of 3-hydroxypropionic acid and 1,3-propanediol from glycerol using resting cells of recombinant Klebsiella pneumoniae J2B strain overexpression aldehyde dehydrogenase[J]. Applied Microbiology and Biotechnology,2012,96(2):373-383.
[77] KUMAR V,SANKARANARAYANAN M,DURGAPAL M,et al. Simultaneous production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol using resting cell system of D-lactic acid de fi cient mutant of Klebsiella pneumoniae with overexpression of KGSADH[J]. Bioresource Technology,2013,135:555-563.
[78] HUANG Y,LI Z,SHIMIZU K,et al. Simultaneous production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol by a recombinant strain of Klebsiella pneumoniae[J]. Bioresource Technology,2012,103 (1):351-359.
[79] 李清,黄艳娜,李志敏,等. 重组肺炎克雷伯菌发酵联产3-羟基丙酸和1,3-丙二醇 [J]. 过程工程学报,2014,14(1):133-138.
[80] LUO L H,SEO J W,OH B R,et al. Stimulation of reductive glycerol metabolism by overexpression of an aldehyde dehydrogenase in a recombinant Klebsiella pneumoniae strain defective in the oxidative pathway[J]. Journal of Industrial Microbiology and Biotechnology,2011:38 (8),991-999.
[81]L UO L H,SEO J W,BAEK J O,et al. Identi fi cation and characterization of the propanediol utilization protein PduP of Lactobacillus reuteri for 3-hydroxypropionic acid production from glycerol[J]. Applied Microbiology and Biotechnology,2011,89(3):697-703.
[82] LUO L H,K IM C H,SEO S Y,et al. Production of 3-hydroxypropionic acid through propionaldehyde dehydrogenase PduP mediated biosynthetic pathway in Klebsiella pneumoniae[J].Bioresource Technology,2012,103(1):1-6.
[83]Z HU C,JIANG X,ZHANG Y,et al. Improvement of 1,3-propanediol production in Klebsiella pneumoniae by moderate expression of puuC(encoding an aldehyde dehydrogenase)[J].Biotechnology Letters,2015,37 (9):1783-1790.
[84] ZHU J,JI X J,DU J,et al. Production of 3-hydroxypropionic acid by recombinant Klebsiella pneumoniae based on aeration and ORP controlled strategy[J]. Korean Journal of Chemical Engineering,2009,26(6):1679-1685.
[85]D ISHISHA T,PEREYRA L P,PYO S H,et al. Flux analysis of the Lactobacillus reuteri propanediol-utilization pathway for production of 3-hydroxypropionaldehyde,3-hydroxypropionic acid and 1,3-propanediol from glycerol[J]. Microbial Cell Factories,2014,13 (1):76.
[86] HERINRICH D,ANDREESSEN B,MADKOUR M H,et al.From waste to plastic:synthesis of poly(3-hydroxypropionate) in Shimwellia blattae[J]. Applied and Environmental Microbiology,2013,79(12):3582-3589.
[87]Z HOU S,CATHERINE C,RATHNASINGH C,et al. Production of 3-hydroxypropionic acid from glycerol by recombinant Pseudomonas denitri fi cans[J]. Biotechnology and Bioengineering,2013,110(12):3177-3187.
[88] BAR BIR ATO F,GRIVET J P,SOUCAILLE P,et al.3-Hydroxypropionaldehyde,an inhibitory metabolite of glycerol fermentation to 1,3-propanediol by Enterobacterial species[J].Applied and Environmental Microbiology,1996,62(4):1448-1451.
[89] HOLYOAK C D,STRATFORD M,MCMULLIN Z,et al. Activity of the plasma membrane H+-ATPase and optimal glycolytic fl ux are required for rapid adaptation and growth in the presence of the weak acid preservative sorbic acid[J]. Applied and Environmental Microbiology,1996,62:3158-3164.
[90] DOLEYRES Y,BECK P,VOLLENWEIDER S,et al. Production of 3-hydroxypropionaldehyde using a two-step process with Lactobacillus reuteri[J]. Applied Microbiology and Biotechnology,2005,68(4):467-474.
[91]W A R N ECK E T E,LY NCH M D,LIPSCOM B M L,et al. Identi fi cation of a 21 amino acid peptide conferring 3-hydroxypropionic acid stress-tolerance to Escherichia coli[J].Biotechnology and Bioengineering,2012,109(5):1347-1352.
[92] LIU M,HAN X,XIAN M,et al. Development of a 3-hydroxypropionate resistant Escherichia coli strain[J]. Bioengineered,2016,7(1):21-27.
[93] ULMER C,ZENG A P. Microbial production of 3-hydroxypropionaldehyde from glycerol bioconversion[J]. Chemistry and Biochemical Engineering Quarterly,2007,21(4):321-326.
[94] KO Y,ASHOK S,KUMAR S,et al. Coenzyme B12can be produced by engineered Escherichia coli under both anaerobic and aerobic conditions[J]. Biotechnology Journal,2014,9(12):1526-1535.
[95] KUMAR V,ASHOK S,PARK S. Recent advances in biological production of 3-hydroxypropionic acid[J]. Biotechnology Advances,2013,31(6):945-961.
Recent Advances in Biosynthesis of 3-Hydroxypropionate
FENG Xinjun,XIAN Mo,LIU Huizhou,ZHAO Guang
CAS Key Laboratory of Biobased Materials, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences,Qingdao 266101, China
3-Hydroxypropionate(3-HP)is a valuable platform chemical with widespread application. Biosynthesis is an important method to achieve 3-HP production with high ef fi ciency, which has developed rapidly in recent years. This article provides an overview and the current status on biological production of 3-HP by different natural and recombinant pathways, especially the recent advances utilizing cheap carbon source as glucose and glycerol. The main present problems,some suggestions and future prospects of 3-HP industrialization are also discussed.
3-hydroxypropionate; microbial fermentation; glucose; glycerol; malonyl-CoA
10.3969/j.issn.1674-0319.2017.06.005

赵广,博士,中国科学院青岛生物能源与过程研究所研究员,入选中科院“百人计划”,获国家自然基金委优秀青年科学基金、山东省自然科学杰出青年基金资助。目前主要从事生物基材料和化学品研究,利用生物质资源生产重要化学品,如异戊二烯、3-羟基丙酸及其聚酯等。E-mail:zhaoguang@qibebt.ac.cn
冯新军,博士,助理研究员。主要研究方向为微生物工程,已发表SCI等文章10余篇,申请发明专利10余项。E-mail:fengxj@qibebt.ac.cn
