纳豆激酶,一种潜在的用于预防与治疗心血管疾病的功能食品添加剂
2017-11-30李淑英辛凤姣王凤忠
李淑英,辛凤姣,王凤忠
中国农业科学院农产品加工研究所,北京 100193
纳豆激酶,一种潜在的用于预防与治疗心血管疾病的功能食品添加剂
李淑英,辛凤姣,王凤忠
中国农业科学院农产品加工研究所,北京 100193
纳豆激酶是一种具有高效纤维蛋白溶解活性的丝氨酸蛋白酶,由枯草属菌株、假单胞菌属菌株和海洋生物合成。与常规的纤维蛋白溶解酶相比,纳豆激酶具有高效、无毒、半衰期长、可以口服、成本低廉等优点,在功 能性食品添加剂和心血管疾病预防与治疗等方面极具应用潜力。对纳豆激酶及其生产菌株选育、发酵条件优化、重组表达、分子改造、分离纯化、功能研究和安全评估等方面进行了简单介绍,并归纳总结了纳豆激酶现有问题,同时就其生产和应用前景进行了展望。
纳豆;纳豆激酶;纤维蛋白;枯草芽孢杆菌;心血管疾病
纳豆激酶(NK,E C 3.4.21.62)是由枯草芽孢杆菌分泌表达的一种高效纤维蛋白溶解酶,最早从传统的日本大豆发酵食品——纳豆中发现[1]。NK由 aprN基因编码,基因开放阅读框全长1143bp,起始密码子为GTG,终止密码子为TAA。全蛋白由信号肽、前导肽和成熟肽组成:信号肽由29个氨基酸残基组成,引导NK跨膜分泌;前导肽由77个氨基酸残基组成,作为胞内分子伴侣辅助NK折叠;成熟肽由275个氨基酸残基组成,与NK的生物学功能相关,因此被称为功能肽[图1(a)]。NK成熟肽的分子量为27.7kDa、等电点6.60[2]。
以纳豆枯草芽孢杆菌NC2-1合成的NK成熟肽为模板,在NCBI序列文库中进行序列检索,获得同源性大于86%的序列100条。比对发现,NK之间,以及NK与丝氨酸蛋白酶、枯草杆菌蛋白酶(subtilisin)、肽酶(peptidase)、角蛋白酶(keratinase)、弹性蛋白酶(elastase)、纤维蛋白酶( fi brinolytic enzyme)、蛋白酶(protease)等蛋白之间序列同源性极高(大于86%)(表1)。NK成熟肽的结晶结构已经得到解析(PDB ID :4DWW 和 3VYV)[3][图1(b)]。其活性中心包括催化三联体(Asp32、His64和Ser221)、氧离子洞(Asn155)和底物结合位点(Ser125、Leu126和Gly127)[4]。NK因与枯草杆菌蛋白酶具有很高的序列和结构同源性,而被划分到碱性丝氨酸蛋白酶家族,但是只有NK对纤维蛋白显示了极高的底物特异性[5]。
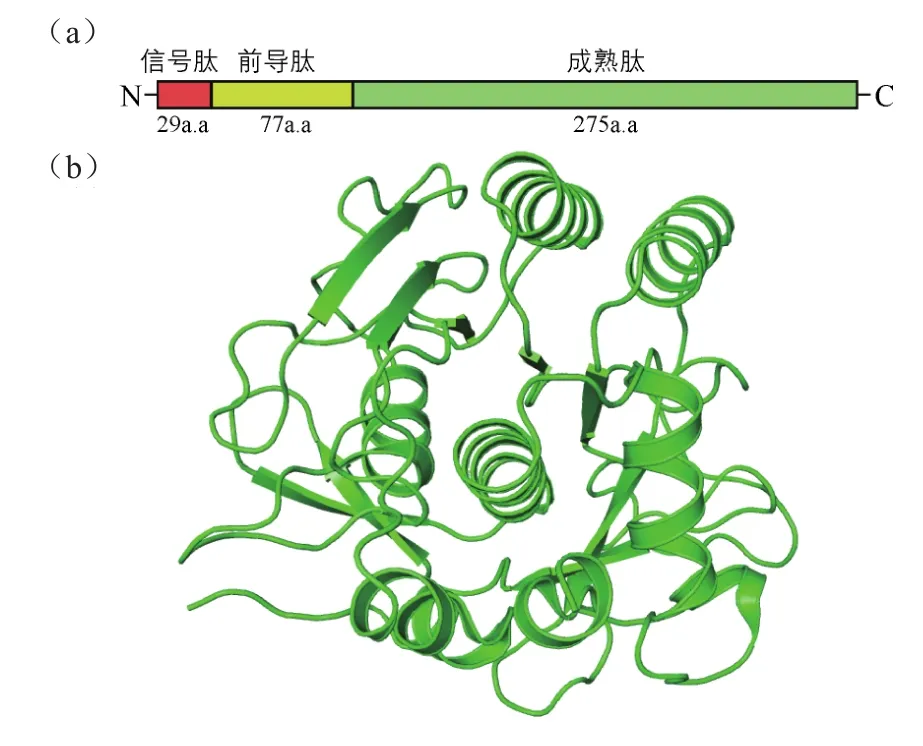
图1 NK序列结构图
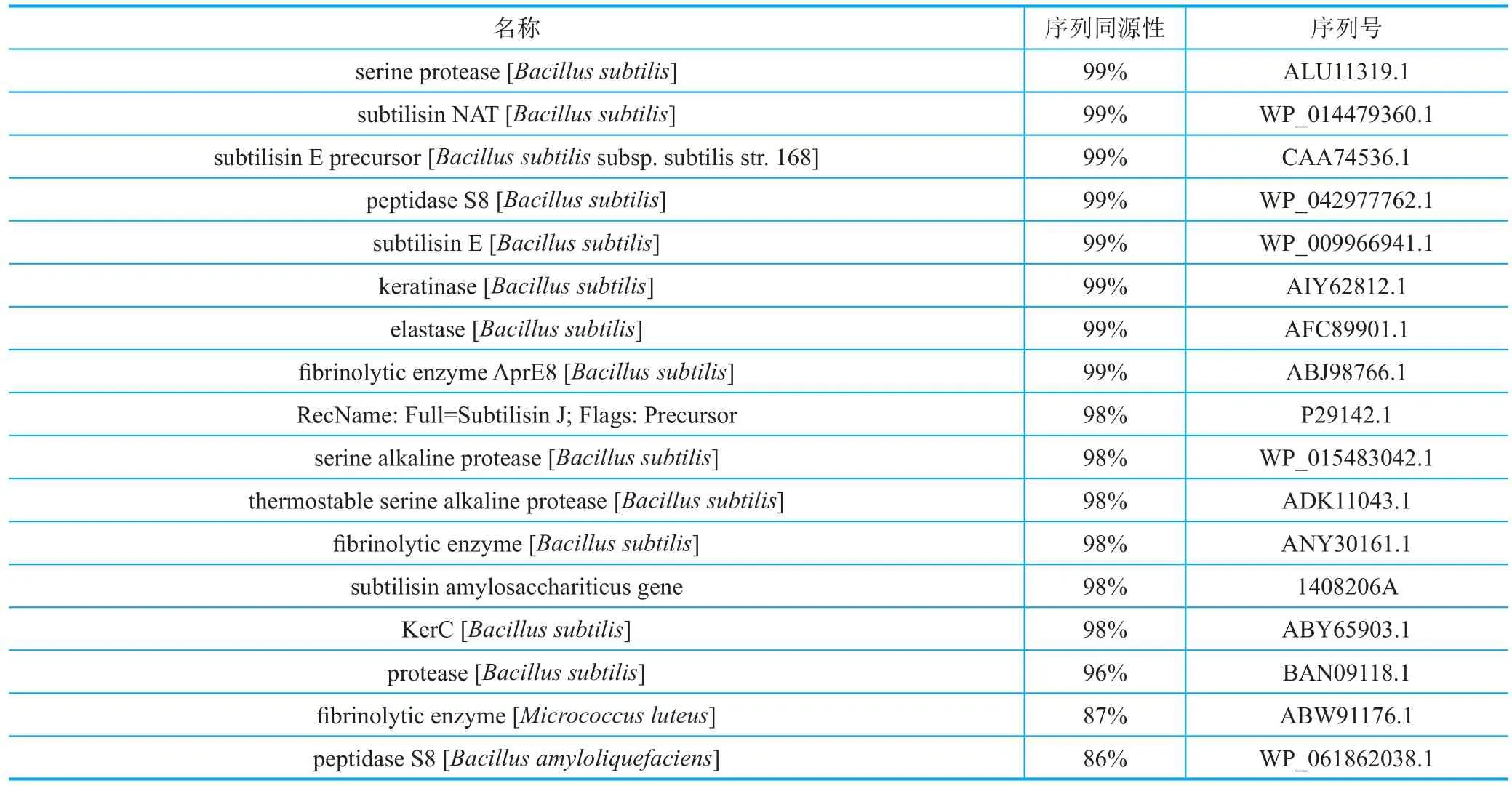
表1 NCBI序列文库中部分与NK高同源性序列汇总
NK不仅可以直接溶解交联状的血栓,还可以催化血纤维蛋白溶酶原转化为血纤维蛋白溶酶,增加体内血栓溶解因子诸如t-PA的合成,失活纤维蛋白溶解抑制剂(PAI-1)等,在体内呈现多重的血栓溶解活性[6]。NK具有pH和温度稳定性,在胃肠道中可稳定存在且可通过肠道吸收,在血液中存活时间长达3h[6]。与常规的溶栓药物相比,NK具有活性高、无毒副作用、半衰期长、可口服、价格低廉等很多优点[7]。这些优点都显示了NK在未来血栓治疗方面极大的应用潜力。
目前关于NK的研究主要集中于菌种选育、发酵条件优化、重组表达、分子改造、分离纯化、功能研究和安全评估等方面。以下将从这几个方面展开介绍。
1 NK生产菌株选育
合成NK的枯草菌株都是从传统的发酵食品中筛选获得,如中国的豆豉[8],韩国的大豆酱[9]和豆酱[10-11]。此外,研究人员发现假单胞菌属菌株[12]和一些海洋生物[13]也可以生产NK。
原始菌株NK的表达量一般较低,研究人员通常会通过诱变的方法,提高生产菌株的NK表达量、活力和稳定性等。如通过紫外诱变纳豆菌原生质体,使生产菌株NK的比活力提高16.6%,65℃处理15min后热稳定性提高20%[14];通过盐酸羟胺和紫外复合诱变使NK生产菌株的产酶能力提高68%[15];通过紫外诱变使NK生产菌株的活力提高了8.81%[16];笔者课题组前期研究,采用60Co-γ射线辐照诱变使得NK生产菌株的纤维蛋白水解活性提高了29.62%,热稳定性提高了82.31%[17];通过紫外诱变铜绿假单胞菌CMSS使得NK表达量提高2倍多[18]。
2 发酵条件优化
为了提高菌株的产酶能力,研究人员对菌株的发酵工艺进行了优化,主要针对发酵原料、接菌量、发酵温度、pH等方面。固态发酵一般用于生产发酵食品。以鹰嘴豆作为发酵原料,通过对发酵温度和湿度优化,可以显著提升解淀粉芽孢杆菌LSSE-62培养基中NK产量,最终在34℃、起始湿度50%时,该菌株表达NK的纤维蛋白水解活性高达39.28 FU/g[19]。在豆渣中补充3%的糖蜜和2%的谷氨酸,pH7.0、45℃发酵24h后,枯草芽孢杆菌GXA-28生产NK的纤维蛋白水解活性高达986 U/g[20]。
与固态发酵相比,液态发酵主要为了提高蛋白质的表达量。研究显示通过发酵条件优化可显著提高NK的表达量。通过统计学方法优化发酵配方和产酶条件,在最佳培养基中NK活性最高可达1300 U/mL,与原始培养基相比,增加了6倍[21]。研究发现,谷氨酸和金属离子是枯草芽孢杆菌合成NK的限制因素,通过补充谷氨酸盐和金属离子,NK的产量提高4倍(260mg/L)[22]。通过响应面法优化培养基组成(葡萄糖、蛋白胨、CaCl2和MgSO4),在最适培养基中枯草芽孢杆菌合成NK的纤维蛋白水解活性高达3194.25U/mL,比优化前提高2倍多[23]。通过调整葡萄糖和蛋白胨比例,进行高密度补料分批发酵条件优化,当葡萄糖与蛋白胨的比例为0.33∶1时,NK的纤维蛋白水解活性达到14 500U/mL,比之前提高4.3倍[24]。以上结果表明尽管研究人员采用的NK检测方法各异,无法进行横向比较,但是就菌株自身而言,发酵条件优化前后NK的表达量还是发生了显著变化。
3 重组表达与分子改造
为了增加NK的产量并简化下游纯化过程,NK基因被克隆并在各种表达系统中实现重组表达,如大肠杆菌[25]、枯草芽孢杆菌[26]、乳酸乳球菌[27]、酵母[28]、昆虫[29]和植物[30]。大肠杆菌因为遗传背景清楚、操作简便且培养周期短等优点,被用作NK重组表达的首选系统。然而,NK在大肠杆菌中主要以包涵体形式表达,大部分蛋白质在复性过程中丧失活性。通过将NK基因的信号肽与周质分泌信号肽PelB融合,使得NK在大肠杆菌中实现可溶性表达,但是所得NK的纤维蛋白溶解活性却显著低于天然分离的NK[31]。不过,2016年Ni等[27]研究发现,将NK包涵体与重折叠溶液直接混合时,蛋白质可以简单地恢复到天然活性蛋白水平。枯草芽孢杆菌作为NK的来源菌株、食品级表达系统及其分泌表达特性,也成为NK重组表达的首选系统。然而,枯草芽孢杆菌自身表达多种胞外蛋白酶,大量降解了该系统表达的重组蛋白质。研究人员已经通过8种胞外蛋白酶表达基因缺陷菌株解决了该类问题,显著提高NK表达水平[32]。此外,通过缺失枯草芽孢杆菌的多个裂解基因,可显著增强该菌株的生物量和NK表达量(增加了2.6倍)[33]。改造地衣芽孢杆菌表达系统信号肽和信号肽酶,可以显著改善NK的表达量,在AprE信号肽和I型信号肽酶sipV组合表达后,NK活性高达35.60FU/mL,比原始菌株增加4.68倍[34]。NK在真核表达系统实现了重组表达。NK在昆虫表达系统中实现了可溶性表达,且具有纤维蛋白水解活性[29],然而该系统生产成本高、持续时间长且其表达量极低。NK在烟叶中通过BeYDV系统实现可溶性表达,且具有纤维蛋白溶解活性,但是该重组NK会引起烟草叶片坏死[30]。
除了选择不同的表达系统和对宿主菌株进行遗传修饰外,表达原件的优化也是增加NK表达量的有效途径。将aprN基因启动子(PaprN)的-10元件(TACAAT)替换为共有原件(TATAAT),可显著提升NK的表达量(643mg/L)[35]。此外,通过启动子优化构建高效生产NK的自诱导表达系统的结果表明与最佳启动子P23组合下,NK的活性增加93.6 FU/mL[36]。
除了通过基因工程增强NK的表达量外,研究人员通过蛋白质工程定向进化该蛋白,改善NK的催化特性,特别是NK结构获得解析后,更加促进了该类工作的进展[3]。通过DNA family shuf fl ing构建突变文库,提高NK的催化活性,最后筛选所得突变株NK的催化活性比原始菌株提高2.3倍[37]。定点突变可显著提高NK的催化活性和抗氧化活性等。如使用具有相同特征的氨基酸残基替换101位Ser,可明显增强NK的纤维蛋白溶解活性[38];通过定点突变优化位于催化残基Ser221附近的氨基酸残基Met222,显著增加了NK的氧化稳定性[39];与野生型NK相比,将31位Ile残基替换为Leu使该酶的催化效率提高约2倍[40]。
4 NK分离纯化
除了日本国民食用鲜纳豆外,其余国家市售产品主要以NK粗酶胶囊为主,目前,尚无纯酶制剂实现产业化开发。从鲜纳豆或者生产菌株发酵液中提取和纯化NK将是一项极大的挑战。常规的蛋白质纯化方法,如有机溶剂分级、盐析、色谱层析和凝胶过滤,已被用于NK的分离纯化。然而,冗长的纯化过程、极低的蛋白质得率和复杂的操作过程等缺点严重阻碍了这些技术的实际应用[41]。
近年来,研究人员相继开发了几种有效NK纯化方法。如,使用膨胀床可高效地从发酵液中纯化NK,产量高达95%,比传统方法提高了约50%[42]。此外,研究人员开发了一种新型的膨胀床吸附剂Fastline PRO,结合pH和离子浓度优化,可以显著提高其对发酵液中NK的吸附能力[43]。使用AOT/异辛烷反胶束提取法纯化NK,提取率高达80%[44]。通过三相分配法可以从发酵液中纯化NK,而且纯化所得NK的pH和温度稳定性提高,在pH6.0和60℃下具有最大活性[45]。然而,不同的纯化方法对NK的活性影响不同。此外,纯化制品中保留的杂质成分可能会引起过敏反应,进而阻碍了其作为血栓治疗药物的应用[46]。NK产品的纯度问题已经引起了食品药品监督管理局的关注。目前,融合表达技术已经被广泛用来增加重组NK的产量和纯度。如在大肠杆菌中将NK或其前体与卵清蛋白的C末端接头多肽融合表达,然后通过温度诱导激活内含肽自剪接释放活性NK,同时切除前导肽[47]。
5 NK功能研究
动物试验[49-51]和人体试验[52]均证实:NK是用于治疗心血管疾病的安全、高效、低廉的纯天然补充剂[48-52]。①NK具有极强的纤维蛋白溶解能力。当给犬口服四粒NK胶囊(2000FU/胶囊)时,由化学诱导产生的腿静脉血栓在5h内完全溶解,恢复正常血液流动[51]。单剂量的NK也可有效裂解交联状的纤维蛋白[52]。在该研究中,12名健康的年轻男性随机服用1粒NK胶囊(2000FU),口服NK胶囊2h后,血中抗凝血酶浓度明显增加;服用NK 4h和6h后,NK激活机体多种不同纤维蛋白溶解和抗凝血途径。②与其他血栓溶解酶相比,NK具有更强的溶栓活性。经颈总动脉血栓的大鼠模型证实,NK处理的大鼠恢复了62%的动脉血流量;而经纤维蛋白溶解酶原、纤维蛋白溶解酶、纤溶酶或弹性蛋白酶等处理后,大鼠颈动脉血压分别只恢复的15%~0不等[49]。③NK无毒副作用。阿司匹林是临床上常用的降低血液黏度药物,但其经常会引发出血或胃溃疡;NK可以改善血液流动,但不会产生任何不良反应[52]。因子Ⅶ和Ⅷ是评价心血管疾病的常用风险因子。在人体试验中,三组(健康志愿者、携带有心血管危险因子的患者和接受透析的患者)每天口服两粒NK胶囊(2000FU/胶囊),两个月后观察到因子Ⅶ、Ⅷ和纤维蛋白原显著降低且趋势一致。期间没有检测到不良反应,心率、体重和尿酸水平保持稳定[53]。④NK可以口服且通过肠道吸收。与蚓激酶相同,NK对高度酸性的胃液有更强的耐受性,可以通过肠道被吸收。1995年,藤田等[49]证实NK可以被大鼠肠道吸收进入血液降解纤维蛋白原。随后,2013年,美国研究小组在口服摄入1粒NK胶囊(2000FU/100 mg)的健康人血清中检测到完整的NK[54]。
目前,在日本、中国、韩国、欧盟、加拿大和美国等国家和地区,已有商业化的NK产品作为食品补充剂,广泛应用于降低血液黏度、预防和治疗血栓及改善血液循环。还有研究表明,NK可以改善其他疾病,如高血压[54]、中风[55]、阿尔茨海默病[56]和动脉粥样硬化[57]等。目前正在开展Ⅱ期临床试验评估使用NK降低血栓形成风险、减缓动脉粥样硬化进程以及缓解认知功能衰退的潜力。
6 NK安全评估
纳豆在日本作为传统发酵食品已有一千多年的历史。据报道,纳豆可显著延长日本国民的寿命[1]。研究发现纳豆提取物可显著降低脂褐素的积累,延长秀丽隐杆线虫的寿命[58]。用纳豆和其生产菌株(1.51×109CFU/mL)接种大鼠没有产生任何毒性迹象。治疗14d后,通过组织病理学检查发现,在肺、肝、脑或肾中未观察到活的枯草芽孢杆菌残留。在14d的研究期间,当饲喂单剂量的NK(2000mg/kg)时,在急性毒性研究中未观察到明显的不良迹象或死亡率。当重复给予单次日剂量(1000mg/kg)的NK 90d时,临床没有检测到任何异常[59]。在临床研究中,当健康志愿者每日口服NK(10mg/kg),经连续28d测试,其尿液、血压、脉搏均无显著变化[59]。
7 前景与展望
上述研究已经证实纳豆激酶在未来的心血管疾病预防与治疗领域极具应用潜力。但NK在未来的食品和医药领域实现产业应用主要依赖于提高生产菌株的表达量、增强其特性、开发纯酶制剂等。首先,研究发现通过菌种选育、发酵条件优化、遗传改造和蛋白质工程等技术可使NK的表达量提高到毫克级,但是作为功能食品添加剂或者药品实现大规模的工业应用,产量达到克级在经济上才可行。NK生产菌种是此项技术的核心,高通量的筛选方法是选育高水平生产菌株的前提,进一步的研究可以集中在高通量筛选方法的搭建。其次是NK的特性,如催化效率、稳定性和口服半衰期等,决定该酶实现应用的致命因素。虽然已经开展了大量工作来改善NK的催化特性和稳定性,但是NK热稳定性的研究几乎毫无进展,而该特性在其分离提取、剂型开发和存储运输过程中起决定性作用。再者,NK从消化道运送到循环系统中的分子机制需要进一步阐明,这需要从NK的pH值、辅因子和胃肠道消化酶的耐受性入手,需要阐明这些特性与其结构的关系。最后,制备NK纯酶制剂是实现药物开发的前提。因此,需要开发新的分离提取工艺,以提高NK的得率、活性以及稳定性。相信在不久的将来,生物信息学、基因工程技术和蛋白质工程技术的飞速发展将为高纯度性能优良的NK从实验室到工业化生产铺平道路。
[1] SUMI H,HAMADA H,TSUSHIMA H,et al. A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto;a typical and popular soybean food in the Japanese diet[J]. Eeperientia,1987,43:1110-1111.
[2] NAKAMURA T,YAMAGATA Y,ICHISHIMA E. Nucleotide sequence of the subtilisin NAT gene,aprN,of Bacillus subtilis(natto)[J]. Biosci Biotechnol Biochem,1992,56(11):1869-1871.
[3] YANAGISAWA Y,CHATAKE T,CHIBA-KAMOSHIDA K,et al.Purification,crystallization and preliminary X-ray diffraction experiment of nattokinase from Bacillus subtilis natto[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun,2010,F66:1670-1673.
[4] ZHENG Z L,ZUO Z Y,LIU Z G,et al. Construction of a 3D model of nattokinase,a novel fi brinolytic enzyme from Bacillus natto. A novel nucleophilic catalytic mechanism for nattokinase[J]. J Mol Graph Model,2005,23(4):373-380.
[5] PENG Y,YANG X,ZHANG Y. Microbial fibrinolytic enzymes:an overview of source,production,properties,and thrombolytic activity in vivo[J]. Appl Microbiol Biotechnol,2005,69:126-132.
[6] TAI M. Nattokinase for prevention of thrombosis [J]. Am J Health-Syst Pharm,2006,63:1121-1123.
[7] JOVIN I S,MULLER B G. Inter-relationships between the fibrinolytic system and lipoproteins in the pathogenesis of coronary atherosclerosis[J]. Atherosclerosis. 2004,174:225-233.
[8] WANG C T,JI B P,LI B,et al. Puri fi cation and characterization of a fi brinolytic enzyme of Bacillus subtilis DC33,isolated from Chinese traditional Douchi[J]. J Ind Microbiol Biotechnol,2006,33(9):750-758.
[9] KIM W,CHOI K,KIM Y,et al. Purification and characterization of a fibrinolytic enzyme produced from Bacillus sp. strain CK 11-4 screened from Chungkook-Jang[J]. Appl Environ Microbiol,1996,62(7):2482-2488.
[10] CHOI NS,CHANG KT,JAE MAENG P,et al. Cloning,expression,and fibrin(ogen)olytic properties of a subtilisin DJ-4 gene from Bacillus sp. DJ-4[J]. FEMS Microbiol Lett,2004,236:325-331.
[11] PARK C S,KIM D H,LEE W Y,et al. Identi fi cation of fi brinogeninduced nattokinase WRL101 from Bacillus subtilis WRL101 isolated from Doenjang[J]. Afr J Microbiol Res,2013,7(19):1983-1992.
[12] WANG S L,CHEN H J,LIANG T W,et al. A novel nattokinase produced by Pseudomonas sp. TKU015 using shrimp shells as substrate[J]. J Leuk Biol,2009,44:70-76.
[13] MAHAJAN P M,NAYAK S,LELE S S. Fibrinolytic enzyme from newly isolated marine bacterium Bacillus subtilis ICTF-1:media optimization,puri fi cation and characterization[J]. J Biosci Bioeng,2012,113(3):307-314.
[14] 刘朔,姜梅,陈晓红,等. 纳豆激酶第36位氨基酸突变对其活性及热稳定性的影响[J]. 南京农业大学学报,2008,31(3):130-136.
[15] 关志炜,李志香,孙洪涛. 盐酸羟胺和紫外线复合诱变选育纳豆激酶高产菌株[J]. 食品与发酵工业,2009,35(6):71-74.
[16] 夏丽,沙维,张丽萍. 紫外线诱变选育高产纳豆激酶菌株的研究[J].农产品加工(创新版),2010,4:29-31.
[17] 李淑英,聂莹,杜欢,等.60Co-γ射线辐照诱变筛选纳豆激酶高活耐热菌株[J]. 核农学报,2013,6:782-785.
[18] CHANDRASEKARAN SD,VAITHILINGAM M,SHANKER R,et al. Exploring the in vitro thrombolytic activity of nattokinase from a new strain Pseudomonas aeruginosa CMSS[J]. Jundishapur J Microbiol,2015,8(10):e23567.
[19] WEI X,LUO M,XU L,et al. Production of fibrinolytic enzyme from Bacillus amyloliquefaciens by fermentation of chickpeas,with the evaluation of the anticoagulant and antioxidant properties of chickpeas[J]. J Agric Food Chem,2011,59(8):3957-3963.
[20] ZENG W,LI W,SHU L,et al. Non-sterilized fermentative co-production of poly(γ-glutamic acid)and fibrinolytic enzyme by a thermophilic Bacillus subtilis GXA-28[J]. Bioresour Technol,2013,142:697-700.
[21] LIU J G,XING J M,CHANG T S,et al. Optimization of nutritional conditions for nattokinase production by Bacillus natto NLSSE using statistical experimental methods[J]. Process Biochem,2005,40(8):2757-2762.
[22] CHEN P T,CHAO Y P. Enhanced production of recombinant nattokinase in Bacillus subtilis by the elimination of limiting factors[J]. Biotechnol Lett,2006,28(19):1595-1600.
[23] DEEPAK V,KALISHWARALAL K,RAMKUMARPANDIAN S,et al. Optimization of media composition for nattokinase production by Bacillus subtilis using response surface methodology[J]. Bioresour Technol,2008,99(17):8170-8174.
[24] KWON E Y,KIM K M,KIM M K,et al. Production of nattokinase by high cell density fed-batch culture of Bacillus subtilis[J].Bioprocess Biosyst Eng,2011,34(7):789-793.
[25] NI H,GUO P C,JIANG W L,et al. Expression of nattokinase in Escherichia coli and renaturation of its inclusion body[J]. J Biotechnol,2016,231:65-71.
[26] NGUYEN T T,QUYEN T D,LE H T. Cloning and enhancing production of a detergent-and organic-solvent resistant nattokinase from Bacillus subtilis VTCC-DVN-12-01 by using an eight-protease gene-de fi cient Bacillus subtilis WB800[J]. Microb Cell Fact,2013,12:79.
[27] LIANG X,ZHANG L,ZHONG J,et al. Secretory expression of a heterologous nattokinase in Lactococcus lactis[J]. Appl Microbiol Biotechnol,2007,75:95-101.
[28] 蔡立涛,徐祥,王婷婷,等. 纳豆激酶基因在毕赤酵母中的表达纯化及抗体制备[J]. 中国生化药物杂志,2010,31(1):10-13.
[29] LI X,WANG X,XIONG S,et al. Expression and purification of recombinant nattokinase in Spodoptera frugiperda cells[J].Biotechnol Lett,2007,29(10):1459-1464.
[30] WANG K,TULL L. Expression of blood clot-dissolving proteins in transgenic plant(LB852)[J]. Faseb J,2014,28.
[31] LIANG X,JIA S,SUN Y,et al. Secretory expression of nattokinase from Bacillus subtilis YF38 in Escherichia coli[J]. Mol Biotechnol,2007,37:187-194.
[32] WANG Y,CHEN Z,ZHAO R,et al. Deleting multiple lytic genes enhances biomass yield and production of recombinant proteins by Bacillus subtilis[J]. Microb Cell Fact,2014,13:129.
[33] CAI D,WEI X,QIU Y,et al. High level expression of nattokinase in Bacillus licheniformis by manipulating signal peptide and signal peptidase[J]. J Appl Microbiol,2016,121(3):704-712.
[34] WU S M,FENG C,ZHONG J,et al. Enhanced production of recombinant nattokinase in Bacillus subtilis by promoter optimization[J]. World J Microbiol Biotechnol,2011,27:99-106.
[35] GUAN C,CUI W,CHENG J,et al. Development of an efficient autoinducible expression system by promoter engineering in Bacillus subtilis[J]. Microb Cell Fact,2016,15:66.
[36] CAI Y,WEI B,JIANG S,et al. Directed evolution improves the fibrinolytic activity of nattokinase from Bacillus natto[J]. FEMS Microbiol Lett,2011,325(2):155-161.
[37] WU S,FENG C,ZHONG J,et al. Roles of s3 site residues of nattokinase on its activity and substrate speci fi city[J]. J Biochem,2007,142(3):357-364.
[38] WENG M,ZHENG Z,BAO W,et al. Enhancement of oxidative stability of the subtilisin nattokinase by site-directed mutagenesis expressed in Escherichia coli[J]. Biochim Biophys Acta,2009,1794(11):1566-1572.
[39] WENG M,DENG X,BAO W,et al. Improving the activity of the subtilisin nattokinase by site-directed mutagenesis and molecular dynamics simulation[J]. Biochem Biophys Res Commun,2015,465(3):580-586.
[40] DABBAGH F,NEGAHDARIPOUR M,BERENJIAN A,et al. Nattokinase:production and application[J]. Appl Microbiol Biotechnol,2014,98(22):9199-9206.
[41] HU H,YAO S,MEI L,et al. Partial puri fi cation of nattokinase from Bacillus subtilis by expanded bed adsorption[J]. Biotechnol Lett,2000,22(17):1383-1387.
[42] LU M,LIN D,WU Y,et al. Separation of nattokinase from Bacillus subtilis fermentation broth by expanded bed adsorption with mixedmode adsorbent[J]. Biotechnol Bioprocess Eng,2005,10(2):128-135.
[43] LIU J G,XING J M,CHANG T S,et al. Puri fi cation of nattokinase by reverse micelles extraction from fermentation broth:effect of temperature and phase volume ratio[J]. Bioprocess Biosyst Eng,2006,28(4):267-273.
[44] GARG R,THORAT B. Nattokinase purification by three phase partitioning and impact of t-butanol on freeze drying[J]. Adv Microb Physiol,2014,132:19-26.
[45] ITO K. Grain and legume allergy[J]. Chem Immunol Allergy,2015,101:145-151.
[46] CHIANG C J,CHEN H C,CHAO Y P,et al. Efficient system of artificial oil bodies for functional expression and purification of recombinant nattokinase in Escherichia coli[J]. J Agric Food Chemi,2005,53(12):4799-4804.
[47] FUJITA M,HONG K,ITO Y,et al. Transport of nattokinase across the rat intestinal tract[J]. Biol Pharm Bull,1995,18:1194-1196.
[48] FUJITA M,OHNISHI K,TAKAOKA S,et al. Antihypertensive effects of continuous oral administration of nattokinase and its fragments in spontaneously hypertensive rats[J]. Biol Pharm Bull,2011,34:1696-1701.
[49] SUMI H,HAMADA H,NAKANISHI K,et al. Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J]. Acta Haematol,1990,84:139-143.
[50] KUROSAWA Y,NIRENGI S,HOMMA T, et al. A single-dose of oral nattokinase potentiates thrombolysis and anti-coagulation pro fi les[J]. Sci Rep,2015,5:11601.
[51] JANG J Y,KIM T S,CAI J,et al. Nattokinase improves blood fl ow by inhibiting platelet aggregation and thrombus formation[J]. Lab Anim Res,2013,29:221-225.
[52] HSIA C H,SHEN M C,LIN J S, et al. Nattokinase decreases plasma levels of fi brinogen,factorⅦ,and factorⅧ in human subjects[J].Nutr Res,2009,29:190-196.
[53] ERE M P,NG C M,MIHAILOVSKI T,et al. A pilot study on the serum pharmacokinetics of nattokinase in humans following a single,oral,daily dose[J]. Altern Ther Health Med,2013,19:16-19.
[54] KIM J Y,GUM S N,PAIK J K,et al. Effects of nattokinase on blood pressure:a randomized,controlled trial[J]. Hypertens Res,2008,31(8):1583-1588.
[55] CHANG Y Y,LIU J S,LAI S L, et al. Cerebellar hemorrhage provoked by combined use of nattokinase and aspirin in a patient with cerebral microbleeds[J]. Intern Med,2008,47:467-469.
[56] FADL N N,AHMED H H,BOOLES H F,et al. Serrapeptase and nattokinase intervention for relieving Alzheimer’s disease pathophysiology in rat model[J]. Hum Exp Toxicol,2013,32:721-735.
[57] 任妮娜,陈鸿杰,李跃,等. 纳豆激酶对颈动脉粥样硬化和高血脂患者的疗效观察[J]. 中华医学杂志,2017,97(26):2038-2042.
[58] IBE S,KUMADA K,YOSHIDA K,et al. Natto(fermented soybean) extract extends the adult lifespan of Caenorhabditis elegans[J]. Biosci Biotechnol Biochem,2013,77:392-394.
[59] LAMPE B J,ENGLISH J C. Toxicological assessment of nattokinase derived from Bacillus subtilis var. natto[J]. Food Chem Toxicol,2016,88:87-99.
Nattokinase, a potential functional food additives for cardiovascular disease prevention and treatment
LI Shuying,XIN Fengjiao,WANG Fengzhong
Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences (CAAS), Beijing 100193, China
Nattokinase is a serine protease with a potent fi brin-degrading activity, and produced by Bacillus sp., Pseudomonas sp. and marine creatures. Compared with conventional fibrinolytic enzymes, nattokinase has many advantages such as high ef fi ciency, non-toxic, long half-life, oral administration and low cost, which shows high potential in the fi elds of functional food additives and cardiovascular disease prevention and treatment and so on. In this paper, the nattokinase was introduced brie fl y,and the breeding of the strains, the optimization of the fermentation conditions, the recombinant expression, the molecular transformation, the separation and puri fi cation, the function research and the safety assessment were also summarized. Finally, the existing problems of nattokinase were summarized and the prospect of production and application were also discussed.
natto; nattokinase; fi brin; Bacillus subtilis; cardiovascular disease
10.3969/j.issn.1674-0319.2017.05.014
李淑英,博士,副研究员。主要从事微生物发酵,功能成分的分离、提取、鉴定、大量制备、功能研究、机制探索、改造和生物合成等研究工作。E-mail:lishuying2000@163.com
王凤忠,研究员,硕士生导师,食品功能因子研究与利用创新团队首席科学家,现任中国农业科学院农产品加工研究所副所长。从事特色农产品加工及质量标准工作,围绕石斛等特色农产品开展相关的功能食品开发及风险评估研究。E-mail:wangfengzhong@sina.com
