罗格列酮对牙周炎大鼠牙龈脂联素受体表达的影响
2017-11-29刘洋王国芳岳二丽郭留云
刘洋 王国芳 岳二丽 郭留云
罗格列酮对牙周炎大鼠牙龈脂联素受体表达的影响
刘洋 王国芳 岳二丽 郭留云
目的探讨罗格列酮(ROS)对牙周炎大鼠牙龈脂联素受体1(AdipoR1)mRNA、脂联素受体2(AdipoR2)mRNA和TNF-α等炎症因子表达的影响及在牙周炎中对牙槽骨保护的潜能。方法50 只SD大鼠随机分为5 组(n=10),大鼠不干预处理作为空白对照,40 只大鼠用于制作牙周炎模型后分别用蒸馏水(牙周炎组)、1、3、10 mg/kg ROS(低、中、高剂量组)灌胃1 次/d,持续4 周。 然后取样,RT-PCR测定牙龈组织AdipoR1和AdipoR2 mRNA表达水平,ELISA测牙龈组织TNF-α、MMP-9和血浆脂联素浓度,标准化的数码摄影测量秞牙骨质界到牙槽骨嵴顶(CEJ-A)距离。结果牙周炎组和空白对照组相比,牙龈组织AdipoR1和AdipoR2 的mRNA表达水平显著降低(Plt;0.01),血浆脂联素水平无差异(Pgt;0.05),TNF-α和MMP-9浓度显著上升(Plt;0.01)。和牙周炎组相比,低、中、高剂量治疗组牙龈组织AdipoR1 mRNA表达均升高(Plt;0.05),TNF-α浓度显著降低(Plt;0.01);中、高剂量治疗组牙龈组织AdipoR2 mRNA表达显著升高(Plt;0.01),MMP-9浓度显著降低(Plt;0.01),血浆脂联素浓度升高(Plt;0.05),牙槽骨吸收量显著降低(Plt;0.01)。结论ROS可能通过上调牙龈组织中AdipoR1和AdipoR2 mRNA表达水平,降低TNF-α、MMP-9浓度,缓解牙周组织炎症,降低牙槽骨吸收。
牙周炎; 脂联素受体; 罗格列酮; 肿瘤坏死因子α; 基质金属蛋白酶9
炎症因子在牙周炎中扮演了重要的角色,牙周组织破坏主要是由组织破坏性的酶(MMPs)和炎症介质(PG,IL)造成的[1]。IL-1β和TNF-α等初级炎症介质诱导趋化因子和前列腺素等二级介质的合成,导致炎症加重、连接组织破坏和破骨细胞性骨吸收[2]。脂联素是脂肪细胞分泌的脂肪因子,作为一种负性调节因子在多种生理病理过程中起重要作用,例如抗炎、增加胰岛素敏感性、保护心血管。对器官有多重保护效应,抑制细胞分泌早期炎症因子TNF-α[3]。脂联素与其受体结合发挥其生理作用,脂联素受体(AdipoRs)主要有2 种:AdipoR1和AdipoR2,两者几乎在所有的组织器官中均有表达。Yamaguchi等[4]认为脂联素功能的降低可能加重牙周病的发展。PPAR-γ是II型核受体超家族成员,罗格列酮(ROS)是高效的PPAR-γ受体激动剂,有调节细胞炎症反应和免疫反应的功能,可控制炎症水平,尤其是炎症介质的产生[5],目前已在临床上被用于治疗哮喘等一些炎症性疾病。本实验研究ROS干预下牙周炎大鼠牙龈组织中AdipoR1和AdipoR2的mRNA表达水平改变,探讨其对牙周炎牙龈组织脂联素抵抗的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 4 周龄190~230 g雄性SD大鼠50 只(郑州大学实验动物中心提供)。随机分5 组,每组10 只:①空白对照组,不建立牙周炎模型,蒸馏水灌胃;②牙周炎组,建立牙周炎模型,蒸馏水灌胃;③低剂量治疗组,建立牙周炎模型,1 mg/kg ROS灌胃;④中剂量治疗组,建立牙周炎模型, 3 mg/kg ROS灌胃;⑤高剂量治疗组,建立牙周炎模型,10 mg/kg ROS灌胃。
1.1.2 主要试剂以及仪器 ChemiDoc MP凝胶成像系统(Bio-Rad,美国);SuperRT cDNA逆转录试剂盒,Drop PCR mix(康为,北京);ELISA试剂盒(西唐,上海);罗格列酮钠片(太极集团,重庆)。
1.2 方法
1.2.1 建立牙周炎模型 0.2 mm正畸钢丝置于大鼠左上颌第二磨牙的釉牙骨质界(CEJ)处,牙周炎建模参考了葛超等[6]的方法。
1.2.2 罗格列酮干预 罗格列酮钠片溶于蒸馏水,结扎前1 h对各组使用不同浓度的ROS溶液或等量蒸馏水灌胃,以后每天1 次持续4 周。全麻下腹主静脉取血,离心获得血浆。处死后取左上颌第二磨牙牙龈组织,上颌骨于10%中性甲醛溶液保存。
1.2.3 RT-PCR检测 Trizol提取牙龈组织总RNA,SuperRT cDNA逆转录试剂盒合成cDNA,引物序列如下:AdipoR1(398 bp)(5′-AACT GGACTATTCAGGGA-3′)和(5′-TGGTTCCAGTCTCATCAG-3′),AdipoR2(233 bp)(5′-ACCCACAACCTTCCTTCATC-3′)和(5′-GCTAGCC ATGAGCATTAGCC-3′),GAPDH(307 bp),(5-TGAACGGGAAG CTCACTGG-3′)和(5′-CCACCACCCTGTTG CTGTA-3′)。95 ℃预变性10 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,32 个循环,72 ℃终延伸5 min。电泳,凝胶成像仪拍照,目的基因与GAPDH灰度积分比值表示基因表达水平。
1.2.4 ELISA检测 称取牙龈组织,按比例加入PBS制备匀浆,离心取上清。ELISA测定牙龈组织匀浆TNF-α、MMP-9和血浆脂联素浓度,方法按照说明书。
1.2.5 牙槽骨吸收分析 标准化的数码摄影(standard digital photographs)测量牙槽骨吸收。步骤参考Cavagni等[7]的方法。Photoshop CS6软件测量上颌第二磨牙颊腭侧各5 个位点的CEJ-A(近中根2 个,根分叉1 个,远中根2 个),计算均值,结果以mm表示。
1.3 统计学分析

2 结 果
2.1 RT-PCR检测结果
和空白对照组相比,牙周炎组牙龈组织中AdiopoR1 mRNA和AdipoR2的mRNA表达水平下降(Plt;0.01)。和牙周炎组相比,低、中、高剂量治疗组牙龈组织AdipoR1 mRNA表达水升高(Plt;0.05),中、高剂量治疗组AdipoR2 mRNA表达水平升高(Plt;0.01)(图 1)。
2.2 ELISA检测结果
和空白对照相比,牙周炎组TNF-α和MMP-9浓度升高(Plt;0.01),血清脂联素水平无差异(Pgt;0.05)。和牙周炎组相比,低、中、高治疗组牙龈组织中TNF-α浓度下降(Plt;0.01);中、高剂量治疗组牙龈组织MMP-9浓度下降(Plt;0.01),血浆脂联素浓度上升(Plt;0.05)(图 2)。
2.3 牙槽骨吸收测定
和空白对照组相比,牙周炎组颊、腭侧牙槽骨吸收显著增加(Plt;0.01)。和牙周炎组相比,中、高剂量治疗组颊、腭侧牙槽骨吸收显著降低(Plt;0.01)(图 3)。
3 讨 论
脂联素通过抑制巨噬细胞功能和粒-单系组细胞生长抑制炎症介质的释放[8],抑制IL-6等前炎性细胞因子的同时诱导抗炎细胞因子IL-10分泌[9-10],Iwayama等[11]发现IL-1β存在的情况下,脂联素可抑制牙龈成纤维细胞分泌IL-6和IL-8,脂联素在牙周炎炎症控制方面可能起到了一定的作用。
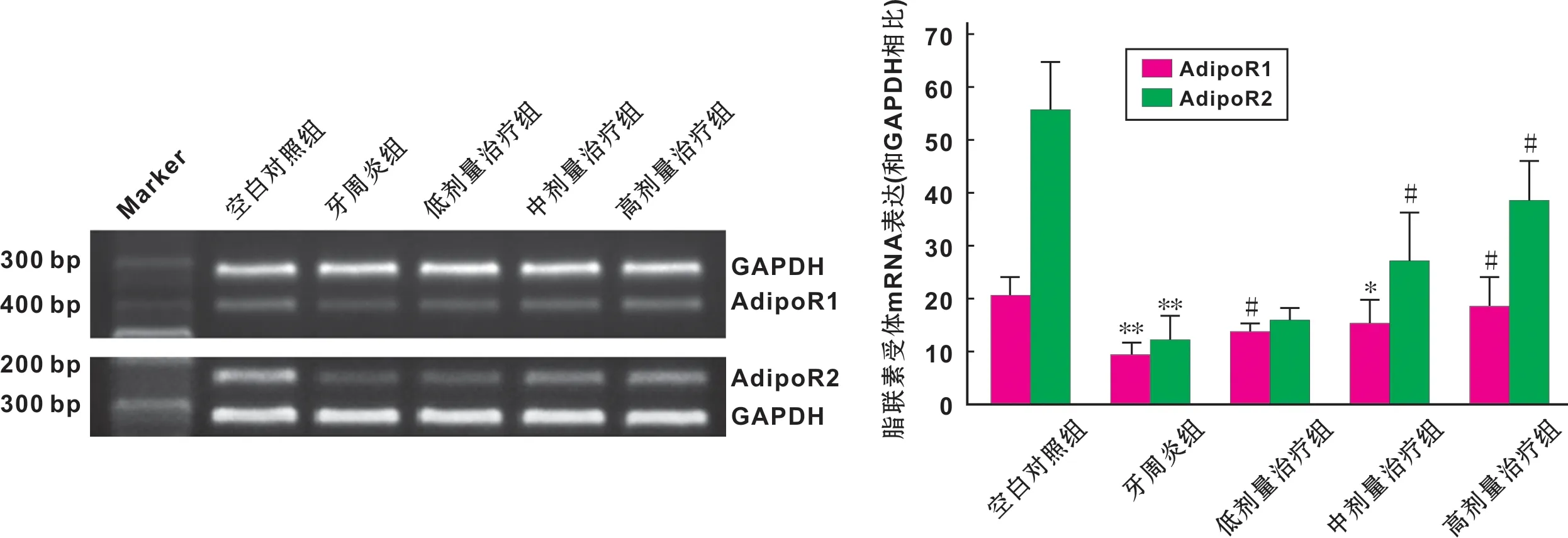
图 1 AdipoRs mRNA表达水平(与空白对照组相比,**:Plt;0.01;与牙周炎组相比, *:Plt;0.05,#:Plt;0.01)
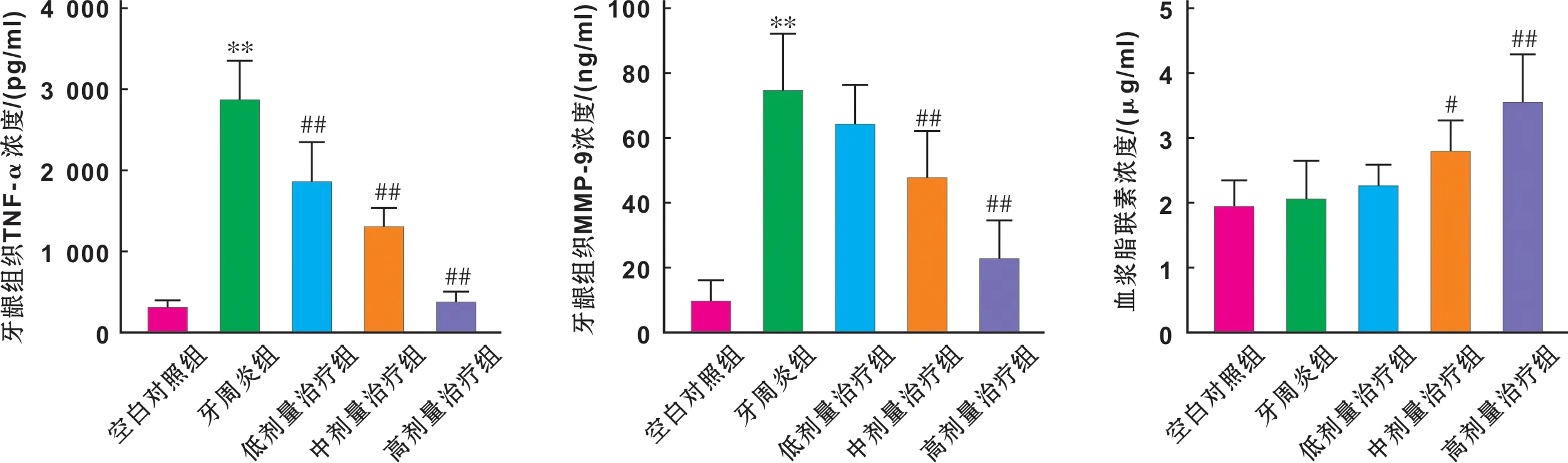
图 2 牙龈组织TNF-α,MMP-9和血浆脂联素浓度(与空白对照组相比,**:Plt;0.01;与牙周炎组相比,#:Plt;0.05,##:Plt;0.01)
Fig 2 Concentration of gingival TNF-α,MMP-9 and plasma adiponectin(vscontrol,**:Plt;0.01;vsperiodontitis group,#:Plt;0.05, ##:Plt;0.01)
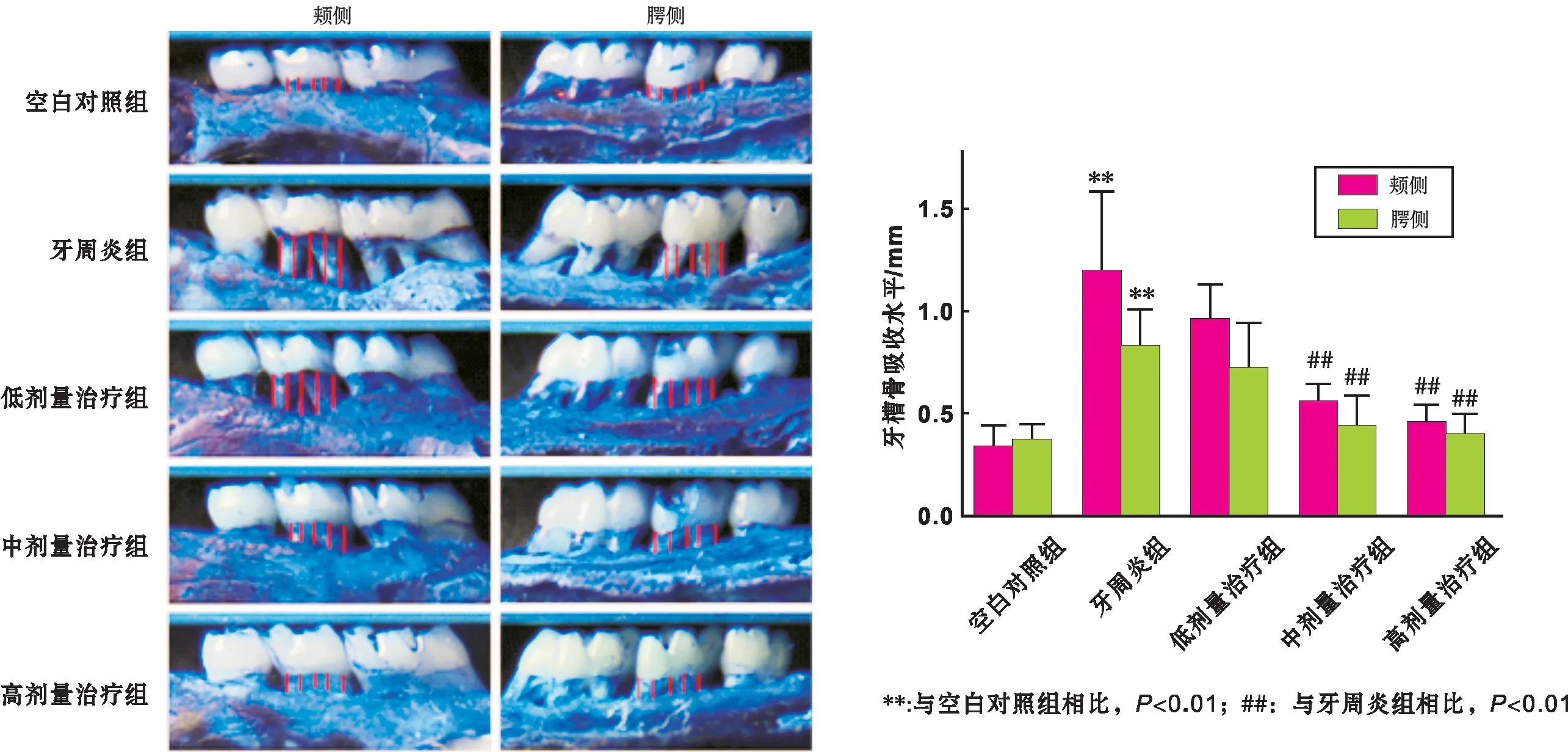
图 3 颊腭侧牙槽骨丧失测量(红线: 测量位点牙槽骨吸收水平)
炎症介质和脂联素信号通路之间有交联,高浓度的TNF-α可降低人牙龈成纤维细AdipoR1 mRNA的表达[4],本研究发现牙周炎可导致大鼠牙龈组织AdipoR1和AdipoR2 的mRNA表达下调,牙龈组织TNF-α浓度升高,推测牙周炎中牙龈组织TNF-α浓度增高可能是AdipoRs mRNA表达水平下调的原因。脂联素通过与受体结合发挥抗炎作用,AdipoRs表达水平降低可能是牙周疾病加重的原因之一,AdipoRs基因表达水平降低导致脂联素结合减少,生理学效应降低,靶组织对脂联素敏感性降低,这种现象叫脂联素抵抗。本研究中,牙周炎大鼠血浆脂联素和正常大鼠相比无差别,牙龈组织AdipoRs mRNA表达下调,提示单独牙周炎不能改变循环脂联素浓度,受体表达水平降低引发脂联素抵抗可能是牙周炎中脂联素功能下降的关键。
Iwaki等[12]提出人脂联素基因启动子包含了PPAR-γ反应元件(PPRE),PPAR-γ可提高脂联素基因启动子活性,PPAR-γ激动剂可以激活脂联素启动子增加脂联素mRNA表达,在本研究中,ROS干预上调了牙周炎大鼠血浆脂联素浓度和牙龈组织AdipoR1和AdipoR2 mRNA表达,提示ROS可通过上调循环脂联素水平及AdipoRs的表达缓解牙周炎中牙周组织的脂联素抵抗。 Sun等[13]认为PPAR-γ并不能直接与AdipoR2基因启动子上的PPAR反应元件结合激活其转录,Liu等[14]发现肝脏和脂肪组织中脂联素受体的表达和血浆TNF-α呈负相关,本实验牙龈组织中TNF-α浓度升高,推测罗格列酮可能通过降低牙龈组织中TNF-α浓度间接调节脂联素受体水平,但PPAR-γ激动剂对组织中脂联素受体mRNA表达上调的具体原因仍然需要更深层的研究。
ROS对牙周组织有保护作用,这可能和罗格列酮直接或间接通过降低TNF-α上调牙龈组织AdipoR1和AdipoR2的mRNA表达水平,提升循环脂联素浓度,缓解牙周炎中存在的脂联素抵抗,降低牙龈组织中MMP-9有关。罗格列酮有潜力作为传统牙周炎疗法的补充,但仍然需要进一步的临床对照实验来确定罗格列酮能否对牙周炎产生临床治疗效果。
[1] Elavarasu S, Sekar S, Murugan T. Host modulation by therapeutic agents[J]. J Pharm Bioallied Sci, 2012,4(Suppl 2):S256-259.
[2] Graves DT, Cochran D. The contribution of interleukin-1 and tumor necrosis factor to periodontal tissue destruction[J]. J Periodontol, 2003,74(3):391-401.
[3] Ouchi N, Walsh K. Adiponectin as an anti-inflammatory factor[J]. Clin Chim Acta, 2007,380(1-2):24-30.
[4] Yamaguchi N, Hamachi T, Kamio N, et al. Expression levels of adiponectin receptors and periodontitis[J]. J Periodontal Res, 2010,45(2):296-300.
[5] Issemann I, Green S. Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J]. Nature, 1990,347(6294):645-650.
[6] 葛超, 杨冬茹, 武明轩, 等. 槲皮素对实验性牙周炎大鼠牙周组织的保护作用[J]. 实用口腔医学杂志, 2015,31(5):619-622.
[7] Cavagni J, Wagner TP, Gaio EJ, et al. Obesity may increase the occurrence of spontaneous periodontal disease in Wistar rats[J]. Arch Oral Biol, 2013,58(8):1034-1039.
[8] Yokota T, Oritani K, Takahashi I, et al. Adiponectin, a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages[J]. Blood, 2000,96(5):1723-1732.
[9] Wolf AM, Wolf D, Rumpold H, et al. Adiponectin induces the anti-inflammatory cytokines IL-10 and IL-1RA in human leukocytes[J]. Biochem Biophys Res Commun, 2004,323(2):630-635.
[10]Ajuwon KM, Spurlock ME. Adiponectin inhibits LPS-induced NF-kappaB activation and IL-6 production and increases PPARgamma2 expression in adipocytes[J]. Am J Physiol Regul Integr Comp Physiol, 2005,288(5):R1220-1225.
[11]Iwayama T, Yanagita M, Mori K, et al. Adiponectin regulates functions of gingival fibroblasts and periodontal ligament cells[J]. J Periodontal Res, 2012,47(5):563-571.
[12]Iwaki M, Matsuda M, Maeda N, et al. Induction of adiponectin, a fat-derived antidiabetic and antiatherogenic factor, by nuclear receptors[J]. Diabetes, 2003,52(7):1655-1663.
[13]Sun X, Han R, Wang Z, et al. Regulation of adiponectin receptors in hepatocytes by the peroxisome proliferator-activated receptor-gamma agonist rosiglitazone[J]. Diabetologia, 2006,49(6):1303-1310.
[14]Liu S, Wu HJ, Zhang ZQ, et al. The ameliorating effect of rosiglitazone on experimental nonalcoholic steatohepatitis is associated with regulating adiponectin receptor expression in rats[J]. Eur J Pharmacol, 2011,650(1):384-389.
(收稿: 2016-10-09 修回: 2016-11-14)
Theeffectsofrosiglitazoneontheexpressionofadiponectinreceptoringingivaltissueofratswithexperimentalperiodontitis
LIUYang,WANGGuofang,YUEErli,GUOLiuyun.
450000,DepartmentofPeriodontology,Schoolofstomatology,ZhengzhouUniversity,China
Objective: To evaluate the effects of rosiglitazone(ROS) on the expression of adiponectin receptors(AdipoR1 and AdipoR2) mRNA in gingival tissue and inflammatory factors, and on the potential of bone loss in the rats with experimental periodontitis.Methods10 male Sprague-Dawley rats without treatment were used as the controls;40 were used for the creation of periodontis models and then treated by rosiglitazone at 0(periodontitis control),1,3,10 mg/kg(low, median and high dose groups) respectively 1/d for 4 weeks. RT-PCR was used to examine the expression of AdipoR1 and AdipoR2 mRNA in gingiva tissue. Levels of gingival TNF-α,MMP-9 and plasma adiponectin was measured by ELISA.CEJ-A was measured for the evaluation of alveolar bone loss by standard digital photographs.ResultsThe expression levels of gingival AdipoR1 and AdipoR2 mRNA in periodontitis group is lower than that in the control group(Plt;0.01). The concentration of plasma adiponectin had no significant difference between control group and periodontitis group(Pgt;0.05). The concentration of gingival TNF-α,MMP-9 in periodontitis group was significantly higher than that in control group(Plt;0.01). Compared with periodontitis group,ROS treatment increased the expression levels of AdipoR1 mRNA(Plt;0.05)and decreased the concentration of TNF-α in gingival tissue. Median and high dose treatment increased the expression levels of AdipoR2(Plt;0.01)and the concentration of plasma adiponectin(Plt;0.05),decreased the concentration of MMP-9 in gingival tissue(Plt;0.01)and the alveolar bone loss(Plt;0.01).ConclusionRosiglitazone treatment may reduce inflammatory response and suppress the bone resorption probably through up-regulation of the expression of adiponectin receptors and decrease of the concentration of TNF-α,MMP-9 in gingival tissue.
Periodontitis;Adiponectinreceptor;Rosiglitazone;TNF-α;MMP-9
河南省科技厅科技攻关项目(编号: 122300410367)
450000, 郑州大学附属河南省口腔医院牙周科
郭留云 E-mail:glyun@163.com
R781.4
A
10.3969/j.issn.1001-3733.2017.01.004
