葡萄风信子花青素3-O-葡糖基转移酶基因的克隆及其表达分析
2017-11-29杜灵娟陈凯利刘雅莉
杜灵娟,陈凯利,刘雅莉
(1.西北农林科技大学风景园林艺术学院,陕西 杨凌 712100; 2.旱区作物逆境生物学国家重点实验室(西北农林科技大学)农业部西北地区园艺作物生物学与种质创制重点实验室,陕西 杨凌 712100)
葡萄风信子花青素3-O-葡糖基转移酶基因的克隆及其表达分析
杜灵娟1,2,陈凯利1,2,刘雅莉1,2
(1.西北农林科技大学风景园林艺术学院,陕西 杨凌 712100; 2.旱区作物逆境生物学国家重点实验室(西北农林科技大学)农业部西北地区园艺作物生物学与种质创制重点实验室,陕西 杨凌 712100)
花青素3-O-葡糖基转移酶(3GT)是花青素苷合成最后一步的关键酶,可把不稳定的花青素催化成花青素苷。本研究利用PCR技术从蓝色葡萄风信子‘亚美尼亚’(Muscariarmeniacum)中克隆到一个3GT基因(Ma3GT),Ma3GTcDNA全长1 377 bp,编码458个氨基酸,与其他植物的3GT蛋白序列相似性达55%~64%。进化分析表明,Ma3GT与单子叶植物3GT聚为一类,与小苍兰(Freesiahybrida)、荷兰鸢尾(Irishollandica)3GT亲缘关系最近。荧光定量PCR分析发现,Ma3GT在‘亚美尼亚’花(S4)中高表达,在叶片中微量表达,根和鳞茎中几乎不表达,在‘白丽人’及‘粉日出’各个组织中均不表达。在‘亚美尼亚’中,Ma3GT的转录表达受花发育调控,开花早期(S1)几乎不表达,随着花发育表达量逐渐增加,至完全开放的时期(S4)达到最高峰。此外,Ma3GT在不同品种的花中转录表达不同,在蓝色品种‘亚美尼亚’中高表达,而在白色品种‘白丽人’和粉色品种‘粉日出’中几乎不表达。本研究为进一步研究Ma3GT基因在葡萄风信子花瓣呈色中的功能及其花色分子育种提供基因资源和依据。
葡萄风信子;花青素苷;Ma3GT;RT-PCR;糖基转移酶;糖基化;花色
花色是观赏植物最主要的品质特征之一。花青素苷是一类天然的水溶性色素,可使植物呈现出粉、红、紫和蓝等各种花色[1]。花青素苷有6种常见的基本苷元:天竺葵素苷元、矢车菊素苷元、飞燕草素苷元、芍药素苷元、锦葵素苷元和矮牵牛素苷元,是由一系列结构基因编码酶(CHS、CHI、F3H、F3′H、F3′5′H、DFR、ANS和UFGT)催化而成,最后经糖基化、酰基化和甲基化等修饰后转运至液泡等部位储存[2-4](图1)。糖基化及随后的酰基化在花色修饰中起到关键作用,可通过外部氢键绑定糖残基与周围水分子以增加疏水性 类黄酮的溶解性和稳定性[5]。
诸多糖基转移酶参与花青素苷的糖基化过程。糖基转移酶第一大类在其C末端包含44个氨基酸保守序列,即植物次生产物糖基转移酶信号序列(PSPG box),PSPG催化的糖基化可以提高复合物的溶解性,使其储存于液泡中,从而保持宿主植物的代谢平衡[6]。其中,研究最为广泛的是UDP-葡萄糖:花青素3-O-葡糖基转移酶(3GT)。3GT是参与花青素苷合成最后一步的酶(图1),它将UDP-葡萄糖上的葡糖基转移到花青素受体分子的C3羟基上,从而形成对应的结构稳定的花青素苷[6]。早期人们在玉米(Zeamays)、金鱼草(Antirrhinummajos)、大麦(Hordeumvulgare)、白苏(Perillafrutescens)、葡萄(Vitisvinifera)和草莓(Fragariaananassa)等植物中对3GT酶生物化学及分子生物学特征进行了研究[7-12]。近年来,人们在三花龙胆(Gentianatriflora)、矮牵牛(Petuniahybrida)、荷兰鸢尾(I.hollandica)、小苍兰(F.hybrida)、七彩竹芋(Indosasahispida)和中国水仙(Narcissustazettavar.chinensis)等观赏植物中克隆了3GT基因并对其功能进行了研究[6,13-17]。
葡萄风信子,多年生草本植物,是一种常见的单子叶球根花卉,花开春季,多蓝及蓝紫色系,因其植株低矮,常用作草地中或花坛、花境镶边材料,也可作地被植物,用于岩石园或林下[18]。本研究以葡萄风信子为研究材料,在实验室前期转录组测序的基础上,筛选一条3GT基因的序列展开研究。首先PCR技术克隆3GT cDNA序列全长,利用在线软件分析其基因特性;将其氨基酸序列与其他物种的GT序列进行同源性比对及进化分析;实时定量PCR技术分析了Ma3GT基因在葡萄风信子蓝、白、粉色3个不同品种中的时空表达模式,为后续研究Ma3GT基因在葡萄风信子花色形成中的功能提供基础,为进一步阐明葡萄风信子花青素苷代谢路径提供理论依据。
1 材料和方法
1.1植物材料
本研究于2016年4月至11月在西北农林科技大学旱区作物逆境生物学国家重点实验室进行。选择3个葡萄风信子品种[‘亚美尼亚’(M.armeniacum)、‘粉日出(M.armeniacum‘Pink Surprise’)及‘白丽人’(M.aucheri‘White Beauty’)]为材料。根据开花的时间,将葡萄风信子花分为5个不同发育时期(S1~S5),具体参照焦淑珍等描述[18]。2016年4月在试验田采集3个品种不同时期的花、根、鳞茎和叶,液氮速冻后快速置于-80 ℃冰箱中备用。
1.2方法
1.2.1葡萄风信子总RNA的提取与MaFLS1基因cDNA全长的克隆 分别从3个葡萄风信子品种的根、鳞茎、叶以及不同发育时期(S1~S5)的花蕾提取总RNA(Omega公司RNA试剂盒),反转录合成cDNA第一链。
依据转录组测序获得的3GT注释序列,设计特异引物3GT-F和3GT-R(表1),以蓝色葡萄风信子‘亚美尼亚’各个组织cDNA混合样为模板进行全长PCR扩增。反应程序:94 ℃预变性3 min,94 ℃变性30 s,67 ℃退火30 s,72 ℃延伸2 min;28个循环,72 ℃延伸5 min。电泳检测后回收预期大小片段的条带,连接pMD19-T载体,转化大肠杆菌感受态细胞,蓝白斑筛选后,挑选阳性克隆送北京奥科生物科技有限公司测序[19]。测序后拼接序列,获得葡萄风信子的3GT基因cDNA全长序列。

图1 葡萄风信子‘亚美尼亚’类黄酮物质代谢示意图
1.2.2葡萄风信子Ma3GT基因生物信息学分析 用NCBI中的ORF Finder在线工具查找葡萄风信子Ma3GT基因开放阅读框;用ExPASyProtParam在线预测Ma3GT氨基酸序列的组成成分及理化性质;用NCBI Blastp搜索同源序列,用ProtScale在线预测Ma3GT蛋白的亲水性/疏水性;用TMpred在线分析Ma3GT蛋白的跨膜结构域;用SignalP 4.1 Server分析Ma3GT蛋白信号肽;用SOPMA在线分析Ma3GT蛋白二级结构。用DNAMAN完成同源序列比对;用MEGA6.0软件完成系统进化树的构建[20-21]。

表1 葡萄风信子3GT基因克隆及表达分析所用的引物
1.2.3葡萄风信子Ma3GT基因的时空表达分析 为了研究Ma3GT在不同花色葡萄风信子的时空表达模式,根据扩增获得的Ma3GT基因全长序列设计实时定量PCR引物3GT-qPCR-F和3GT-qPCR-R,选取Actin为内参基因[19](引物如表1所列)。以3个品种葡萄风信子根、茎、叶,不同发育时期花(S1~S5)cDNA作为模板,进行实时定量PCR。参照荧光定量试剂盒SYBR®Premix Ex TaqTMⅡ(TaKaRa公司)说明书,在BIO-RAD Cycler IQ5荧光定量PCR仪上检测Ma3GT基因的相对表达量。反应体系(20 μL)为:SYBR®Premix Ex TaqⅡ 10 μL,PCR正反向引物(10 μmol·L-1)各0.8 μL,cDNA模板1 μL(约100 ng),ddH2O 7.4 μL,反应程序:94 ℃ 3 min,94 ℃ 15 s,58 ℃ 30 s,45个循环。数据读取由实时荧光定量PCR仪自动完成。每个样品3个生物学重复,用SigmaPlot 10.0软件进行数据处理及图形绘制[19]。
2 结果与分析
2.1葡萄风信子Ma3GT基因全长cDNA克隆与序列特征分析
为了解糖基化过程中重要的编码酶基因3GT在葡萄风信子花色形成的作用,在前期转录组测序的基础上,本研究选择一条3GT注释序列展开研究。以此条基因序列设计特异引物,以蓝色葡萄风信子品种‘亚美尼亚’各组织cDNA混合样为模板PCR扩增基因全长,获得一条长1 377 bp的条带(图2),转化测序后序列拼接,分析其为完整的开放阅读框,具有起始密码子和终止密码子,编码458个氨基酸,是一条完整的基因序列(图3)。命名此cDNA序列为Ma3GT。
在线工具ProtParam分析表明,Ma3GT理论分子量约为48.3 kD,理论等电点为5.69,蛋白不稳定系数为34.15,属于稳定蛋白。利用ProtScale分析,Ma3GT编码的蛋白亲水性/疏水性的最大值为2.111,最小值为-2.478,且亲水性氨基酸残基比疏水性氨基酸残基多,推测为亲水性蛋白(图4A)。TMHMM预测Ma3GT蛋白无跨膜区域(图4B)。SignalP4.1预测显示Ma3GT蛋白不具备信号肽位点(图4C)。SOPMA预测Ma3GT蛋白二级结构组成为38.21%的α螺旋、12.45%的β转角、33.19%无规则卷曲和16.16%延伸链(图4D)。

图2 Ma3GT cDNA全长扩增产物
注:M,DNA标准分子量;1,Ma3GTcDNA全长扩增结果。
Note:M, DNA marker; 1, The product ofMa3GTcDNA.
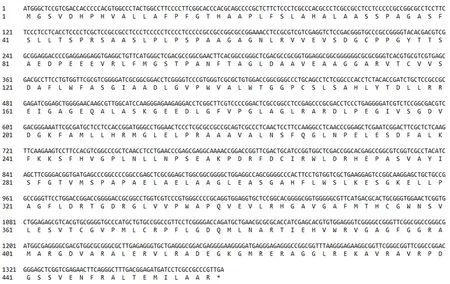
图3 Ma3GT基因的核苷酸序列及推导的氨基酸序列
2.2Ma3GT氨基酸序列同源性比对与进化分析
在NCBI上将葡萄风信子Ma3GT氨基酸序列进行Blastp比对,分析表明,Ma3GT与油棕(Elaeisguineensis)、海枣(Phoenixdactylifera)3GT同源性最高,可达63%~64%;与小苍兰、荷兰鸢尾、中国水仙、洋葱(Alliumcepa)、福士郁金香(Tulipafosteriana)、小果野芭蕉(Musaacuminatasubsp.malaccensis)等其他物种的同源性较高,达55%~61%,而与拟南芥、金鱼草和矮牵牛等常见模式植物的同源性不高。
用DNAMAN软件将葡萄风信子Ma3GT与其他物种已发表的3GT进行同源序列比对(图5),结果发现Ma3GT蛋白类似于其他3GT蛋白,C末端包含44个氨基酸的糖基转移酶的PSPG保守序列(从336个氨基酸到379个氨基酸),该序列参与绑定蛋白到糖核苷酸的UDP糖基过程,且其第22(Trp,W)、23(Asn,N)和44(Gln,Q)位氨基酸残基为葡糖基转移酶中的保守基序,在酶蛋白糖基供体特异性中起到决定性作用。这表明Ma3GT属于葡糖基转移酶,推测它与其他物种的3GT具有相同或相似的功能,待进一步实验验证。

图4 Ma3GT蛋白的生物信息学分析
注:,亲水性/疏水性分析;,氨基酸跨膜分析;Ⓒ,信号肽位点分析;,蛋白的二级结构预测;α为α-螺旋;β为β-转角;E为延伸链;R为无规则卷曲。
Note:, Analysis of hydrophilic and hydrophobic amino acids;, Transmembrane analysis; Ⓒ, Signal peptide analysis;, Secondary structures prediction; α, indicates alpha helix; β, indicates beta turn; E, indicates extend strand; R, indicates random coil.

图5 葡萄风信子Ma3GT基因编码的氨基酸序列与其他物种3GT氨基酸序列的比对
注:氨基酸序列相同及相似部分分别用黑、灰色阴影表示;下划线位置为PSPG保守序列。黑星号为PSPG保守序列的第22、23和44个氨基酸。Fh3GT(小苍兰FreesiahybridHM590645),Ih3GT(荷兰鸢尾IrishollandicaAB161175),Zm3GT(玉米ZeamaysAY167672),Hv3GT(大麦HordeumvulgareX15694),At3GT(拟南芥ArabidopsisthalianaAED92377),Ph3GT(矮牵牛PetuniahybridaAB027454)。
Note:The same and similar amino acid residues are highlighted in black and gray, respectively. Underline indicates the PSPGbox found in glycosyltransferases.
用MEGA6.0将葡萄风信子Ma3GT氨基酸与其他物种GT氨基酸(包括3GT、5GT等)构建系统进化树,结果显示,Ma3GT氨基酸序列首先与小苍兰、荷兰鸢尾的3GT聚为一支,再与玉米、大麦3GT聚为一类,而后与其他双子叶植物3GT聚为一大类,而与其他类葡糖基转移酶,如5GT的亲缘关系较远(图6)。据此结果,再次说明Ma3GT属于3GT成员,且属于单子叶植物亚类,与单子叶观赏植物小苍兰和荷兰鸢尾3GT亲缘关系最近。
2.3葡萄风信子Ma3GT基因时空表达模式分析
以葡萄风信子根、茎、叶及盛花期(S4)花的cDNA为模板,利用荧光定量PCR检测Ma3GT基因在葡萄风信子不同组织中的表达情况。结果显示,Ma3GT在蓝色葡萄风信子‘亚美尼亚’花(S4)中高表达,在叶片中微量表达,而根和鳞茎中几乎不表达(图7)。说明Ma3GT基因在蓝色葡萄风信子‘亚美尼亚’中为花特异表达的模式。此外,Ma3GT基因在白色葡萄风信子‘白丽人’及粉色葡萄风信子‘粉日出’各个组织中几乎不表达。
以蓝、白和粉色3个葡萄风信子品种5个不同时期花cDNA为模板,荧光定量PCR检测Ma3GT在不同花色葡萄风信子不同花发育时期的表达情况。结果显示(图8),在‘亚美尼亚’花中,Ma3GT在未着色的小花蕾时期(S1)几乎不表达,S2时期开始着色后Ma3GT表达量逐步迅速增加,到了完全着色的盛花期(S4),Ma3GT的表达量到达顶峰,S5时期花开始衰败后又有所下降。不同于‘亚美尼亚’,Ma3GT在‘白丽人’和‘粉日出’所有花发育时期几乎不表达。在测定葡萄风信子花青素苷物质时还发现,蓝色葡萄风信子‘亚美尼亚’不同时期的花蕾中均检测到大量的飞燕草素3-O-葡萄糖苷、矮牵牛素3-O-葡萄糖苷及天竺葵素3-O-葡萄糖苷及其他类花青素苷衍生物,而‘白丽人’花中并未检测到花青素3-O-葡萄糖苷物质存在。推测,Ma3GT基因表达与葡萄风信子花青苷物质,尤其是花青素3-O-葡萄糖苷的累积有密切的关系。

图6 Ma3GT蛋白与其他物种的GT蛋白的系统进化树
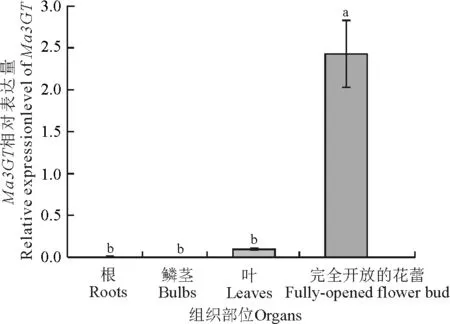
图7 Ma3GT在‘亚美尼亚’不同组织部位的表达分析
注:不同小写字母表示差异显著(P≤0.05)。下图同。
Note:Different lowercase letters indicate significant difference at the 0.05 level; similarly for the Fig. 8.

图8 Ma3GT在3个葡萄风信子品种5个花发育时期的表达分析
注:S1为未着色的花蕾;S2为开始着色的花蕾;S3为完全着色未开放的花蕾;S4为完全开放的花蕾;S5为衰败的花蕾。
Note:S1, Unpigmented flower bud; S2, Flower bud being Pigmented; S3, Pigmented flower bud just before bloom; S4, Fully-opened flower bud; S5, Declined flower bud.
3 讨论与结论
糖基化是重要的花色修饰过程,研究糖基化过程中重要的编码酶:花青素3-O-葡糖基转移酶(3GT)基因的功能,对于葡萄风信子花色分子育种具有重要的意义。本研究在前期转录组测序的基础上,采用PCR技术成功克隆到了单子叶观赏植物葡萄风信子的一条3GT基因(Ma3GT)cDNA全长。序列比对发现Ma3GT氨基酸C末端包含了糖基转移酶的PSPG保守序列。有研究表明,PSPG保守序列的第22、23和44位氨基酸残基在酶蛋白糖基供体的选择中具有重要作用。第22位若为色氨酸(Trp,W)可正确定位UDP-葡萄糖,而精氨酸(Arg,R)可正确定位UDP-葡萄糖醛酸;第23位的丝氨酸(Ser,S)在UDP-葡萄糖醛酸转移酶中相对保守;第44位如果为谷氨酰胺(Gln,Q),其糖供体为UDP-葡萄糖,而组氨酸(His,H)为UDP-半乳糖[22-24]。Ma3GT的第22、23和40氨基酸分别为Trp、Asn和Gln,因此可推测Ma3GT以UDP-葡萄糖为主要糖基供体。
早期人们对类黄酮的GTs进行进化分析,发现催化类黄酮3-O、5-O、7-O位置糖基化的GTs可形成三大进化支(3GTs、5GTs和7GTs)[25]。Ma3GT与其他物种中GTs蛋白聚类分析表明,Ma3GT同催化类黄酮3-O位置糖基化的3GTs聚为一支,推测Ma3GT应该参与了葡萄风信子花色修饰过程中3-O位置的糖基化过程。同时,它与单子叶观赏植物小苍兰、荷兰鸢尾3GT亲缘关系最近。
有研究表明,3GT的表达活性与花青素苷的积累呈正相关,例如葡萄[26]、荔枝(Litchichinesis)[27]和箭叶淫羊藿(Epimediumsagittatum)[23]中,花青素苷大量积累的组织检测到3GT高表达,而在少量积累和无花青素苷积累的组织中,3GT表达量极低或不表达。在本研究中,Ma3GT的表达也呈现相似的结果。在蓝色品种‘亚美尼亚’中,盛开期的蓝色花中Ma3GT高表达,叶片中有少量的表达,根、鳞茎几乎检测不到表达,说明Ma3GT在花青素苷大量积累的花中高表达,在该品种中具有花组织特异表达的模式。类似于小苍兰Fh3GT1[5]和草莓Fa3GT[28],Ma3GT的转录水平受发育调控,在未着色时期花蕾呈现绿色时,无Ma3GT的转录表达,随着花的逐渐发育,花青素苷的积累越来越多,至花蕾完全开放的时期,Ma3GT的表达达到最高峰。此外,Ma3GT在不同花色的葡萄风信子品种中转录表达不同,在蓝色花品种中高表达,而在白色花中几乎不表达,此结果与小苍兰[5]中的报道相似。而Ma3GT在粉色品种‘粉日出’5个不同时期的花中表达量类似于未着色的白色品种‘白丽人’,推测‘粉日出’中虽有少量的花青素苷存在使其着色,但无花青素3-O-葡萄糖苷物质存在,故无参与葡萄糖花青素3-O位置的糖基化过程的Ma3GT转录表达。
总之,本研究在葡萄风信子蓝色品种‘亚美尼亚’中克隆了一条Ma3GT基因,对其氨基酸序列进行同源比对、聚类分析和蛋白功能预测,分析了Ma3GT在葡萄风信子不同组织、花色品种5个不同发育时期的转录表达情况,为进一步研究Ma3GT基因在葡萄风信子花瓣呈色中的功能及其花色分子育种提供基础。
References:
[1] Tanaka Y,Ohmiya A.Seeing is believing:Engineering anthocyanin and carotenoid biosynthetic pathways.Current Opinion in Biotechnology,2008,19(2):190-197.
[2] 戴思兰,洪艳.基于花青素苷合成和呈色机理的观赏植物花色改良分子育种.中国农业科学,2016,49(3):529-542.
Dai S L,Hong Y.Molecular breeding for flower colors modification on ornamental plants based on the mechanism of anthocyanins biosynthesis and coloration.Scientia Agricultura Sinica,2016,49(3):529-542.(in Chinese)
[3] 祝志欣,鲁迎青.花青素代谢途径与植物颜色变异.植物学报,2016,51(1):107-119.
Zhu Z X,Lu Y Q.Plant color mutants and the anthocyanin pathway.Chinese Bulletin of Botany,2016,51(1):107-119.(in Chinese)
[4] Lou Q,Liu Y L,Qi Y Y,Jiao S Z,Tian F F,Jiang L,Wang Y J.Transcriptome sequencing and metabolite analysis reveals the role of delphinidin metabolism in flower colour in grape hyacinth.Journal of Experimental Botany,2014,65(12):3157-3164.
[5] Yoshida K,Toyama Y,Kameda K,Kondo T.Contribution of each caffeoyl residue of the pigment molecule of gentiodelphin to blue color development.Phytochemistry,2000,54(1):85-92.
[6] Sui X,Gao X,Ao M,Wang Q M,Yang D,Wang M,Fu Y,Wang L.cDNA cloning and characterization of UDP-glucose:Anthocyanidin 3-O-glucosyltransferase inFreesiahybrida.Plant Cell Reports,2011,30(7):1209-1218.
[7] Goto T,Kondo T,Tamura H,Imagawa H,Lino A,Takeda K.Structure of gentiodelphin,anacylated anthocyanin isolated fromGentianamakinoi,that is stable in dilute aqueous solution.Tetrahedron Letters,1982,23(36):3695-3698.
[8] Martin C,Gerats T.The control of flower coloration.//In:Jordan B(ed).Molecular Biology of Flowering.Wallingford,UK:CIB International,1992:219-255.
[9] Wise R P,Rohde W,Salamini F.Nucleotide sequence of theBronze-1 homologous gene fromHordeumvulgare.Plant Molecular Biology,1990,14(2):277-279.
[10] Gong Z,Yamazaki M,Sugiyama M,Tanaka Y,Saito K.Cloning and molecular analysis of structural genes involved in anthocyanin biosynthesis and expressed in a forma-specific manner inPerillafrutescens.Plant Molecular Biology,1997,35(6):915-927.
[11] Ford C M,Boss P K,Hoj P B.Cloning and characterization ofVitisviniferaUDP-glucose:Flavonoid 3-O-glucosyltransferase,a homologue of the enzyme encoded by the maizeBronze-1 locus that may primarily serve to glucosylate anthocyanidinsinvivo.The Journal of Biological Chemistry,1998,273(15):9224-9233.
[12] Almeida J R,D’Amico E,Preuss A,Carbone F,de Vos C H,Deiml B,Mourgues F,Perrotta G,Fischer T C,Bovy A G,Martens S,Rosati C.Characterization of major enzymes and genes involved in flavonoid and proanthocyanidin biosynthesis during fruit development in strawberry(Fragaria×ananassa).Archives Biochemistry Biophysics,2007,465(1):61-71.
[13] Tanaka Y,Yonekura K,Fukuchi-Mizutani M,Fukui Y,Fujiwara H,Ashikari T,Kusumi T.Molecular and biochemical characterization of three anthocyanin synthetic enzymes fromGentianatriflora.Plant Cell Physiology,1996,37(5):711-716.
[14] Yamazaki M,Yamagishi E,Gong Z,Fukuchi-Mizutani M,Fukui Y,Tanaka Y,Kusumi T,Yamaguchi M,Saito K.Two flavonoid glucosyltransferases fromPetuniahybrida:Molecular cloning, biochemical properties and developmentally regulated expression.Plant Molecular Biology,2002,48(4):401-411.
[15] Yoshihara N,Imayama T,Fukuchi-Mizutanic M,Okuhara H,Tanaka Y I,Yabuya T.cDNA cloning and characterization of UDP-glucose:Anthocyanidin 3-O-glucosyltransferase inIrishollandica.Plant Science,2005,169(3):496-501.
[16] 王毅,王晨晨,周旭,毕玮,杨宇明,王娟.七彩红竹中类黄酮-3-O-葡萄糖基转移酶基因的克隆及功能分析.广西植物,2015,35(2):244-249.
Wang Y,Wang C C,Zhou X,Bi W,Yang Y M,Wang J.Cloning and functional analysis of a flavonoid-3-O-glucosyltransferas gene fromIndosasahispida.Guihaia,2015,35(2):244-249.(in Chinese)
[17] 王伟英,李海明,戴艺民,邹晖,吴水金,李跃森,林江波.中国水仙类黄酮3-氧-葡糖基转移酶基因的克隆与序列分析.福建农业学报,2015,30(6):577-581.
Wang W Y,Li H M,Dai Y M,Zou H,Wu S J,Li Y S,Lin J B.Clong and expression analysis of flavonoid 3-O-glucosytransferase gene fromNarcissustazettavar. Chinensis.Fujian Journal of Agricultural Sciences,2015,30(6):577-581.(in Chinese)
[18] 焦淑珍,刘雅莉,娄倩,姜玲.葡萄风信子二氢黄酮醇4-还原酶基因(DFR)的克隆与表达分析.农业生物技术学报,2014,22(5):529-540.
Jiao S Z,Liu Y L,Lou Q,Jiang L.Cloning and expression analysis of dihydroflavonol 4-reductase gene(DFR) from Grape Hyacinth.Journal of Agricultural Biotechnology,2014,22(5):529-540.(in Chinese)
[19] 杜灵娟,陈凯利,刘雅莉.葡萄风信子FLS1基因克隆及其表达与花色性状之间的关联性分析.西北林学院学报,2017,32(1):106-113.
Du L J,Chen K L,Liu Y L.Cloning of Flavonol Synthase Gene (FLS1) and relativity analysis of its expression with the flower colorin Grape Hyacinth.Journal of Northwest Forestry University,2017,32(1):106-113. (in Chinese)
[20] 刘伟,张欣欣.碱茅PutSnRK2基因表达、克隆及其蛋白纯化.草业科学,2016,33(10):2004-2011.
Liu W,Zhang X X.Expression,cloning ofPutSnRK2 gene and its protein purification ofPuccunelliatenuiflora.Pratacultural Science,2016,33(10):2004-2011.(in Chinese)
[21] 董凤丽,刘杰,黄河,张蜜,周蕴薇,戴思兰.甘菊CBL基因的克隆与表达分析.草业科学,2014,31(7):1283-1289.
Dong F L,Liu J,Huang H,Zhang M,Zhou Y W,Dai S L.Cloning and expression analysis ofCBLgenes fromChrysanthemumlavandulifolium.Pratacultural Science,2014,31(7):1283-1289.(in Chinese)
[22] Kubo A,Arai Y,Nagashima S,Yoshikawa T.Alteration of sugar donor specificities of plant glycosyltransferases by a singlepointmutation.Archives Biochemistry Biophysics,2004,429(2):198-203.
[23] 王应丽,黄文俊,王瑛.箭叶淫羊藿EsUF3GT基因的克隆及表达分析.植物科学学报,2014,32(6):602-611.
Wang Y L,Huang W J,Wang Y.Cloning and expression analysis of theEsUF3GTgene inEpimediumsagittatum(Sieb. and Zucc.)Maxim.Plant Science Journal,2014,32(6):602-611.(in Chinese)
[24] 张传丽,陈鹏,仲月明,周长远,沈丹红,蒋菲.银杏类黄酮糖基转移酶基因全长序列克隆及表达分析.园艺学报,2012,39(10):1903-1912.
Zhang C L,Chen P,Zhong Y M,Zhou C Y,Shen D H,Jiang F.Full length cDNA cloning and expression analysis ofUFGTgene fromGinkgobiloba.ActaHorticulturae Sinica,2012,39(10):1903-1912.
[25] Sawada S,Suzuki H,Ichimaida F,Yamaguchi M,Iwashita T,Fukui Y,Hemmi H,Nishino T,Nakayama T.UDP-glucuronicacid:Anthocyaninglucuronosyl-transferase from red daisy(Bellisperennis)flowers.Enzymology and phylogenetics of a novel glucuronosyltransferase involved in flower pigment biosynthesis.Journal of Biological Chemistry,2005,280(2):899-906.
[26] Boss P K,Davies C,Robinson S P.Expression of anthocyanin biosynthesis pathway genes in red and white grapes.Plant Molecular Biology,1996,32(3):565-569.
[27] Zhao Z C,Hu G B,Hu F C,Wang H C,Yang Z Y,Lai B.The UDP glucose:Flavonoid-3-O-glucosyltransferase(UFGT) gene regulates anthocyanin biosynthesis in litchi(LitchichinesisSonn.)during fruit coloration.Molecular Biology Reports,2012,39(6):6409-6415.
[28] Griesser M,Hoffmann T,Bellido M L,Rosati C,Fink B,Kurtzer R,Aharoni A,Munoz-Blanco J,Schwab W.Redirection of fiavonoid biosynthesis through the down-regulation of an anthocyanidin glucosyltransferase in ripening strawberry fruit.Plant Physiology,2008,146(4):1528-1539.
(责任编辑 王芳)
Cloningandexpressionanalysisofanthocyanidin3-O-glucosyltransferasegeneinGrapehyacinth
Du Ling-juan1,2, Chen Kai-li1,2, Liu Ya-li1,2
(1.College of Landscape Architecture and Arts, Northwest A amp; F University, Yangling 712100, Shaanxi, China; 2.State Key Laboratory of Crop Stress Biology in Arid Areas/Key Laboratory of Horticultural Plant Biology and Germplasm Innovation in Northwest China, Northwest A amp; F University, Yangling 712100, Shaanxi, China)
Anthocyanidin 3-O-glucosyltransferase (3GT) is the last key enzyme in the anthocyanin biosynthetic pathway, which can catalyze unstable anthocyanidin into anthocyanin. In this study, we cloned a 3GT gene (designated asMa3GTfromMuscariarmeniacum) using the PCR technique. The gene’s cDNA was 1 377 bp long and encoded an open reading frame of 458 aminoacids.Ma3GTshowed 55%~64% similarity with the other 3GTs. Phylogenetic analysis indicated that Ma3GT was classified into monocot subgroups of 3GTs, and had the closest relationship with the 3GTs ofFreesiahybridandIrishollandica. QRT-PCR analysis detected transcripts ofMa3GTin different organs ofM.armeniacum. The expression level of this gene was high in the fully opened petals (stage S4), very low in the leaves, and almost zero in the roots and bulbs ofM.armeniacum. Andit almost had no expression in all the organs ofM.aucheri‘White Beauty’ andM.armeniacum‘Pink Surprise’. The gene expression was related to the floral developmental stages inM.armeniacum. The transcript level was rarely detectablein the unpigmented buds (stage S1), but increased during the pigment accumulation stages and peaked in the fully opened petals (S4). The expression had significant differences in three cultivars of different colors. The expression level was high in the petals ofM.armeniacum, and rarely detectable in the petals of ‘White Beauty’ and ‘Pink Surprise.’ This research will provide informationand theoretical support for the functional study of theMa3GTgene.
Muscari; anthocyanin;Ma3GTgene; RT-PCR; glucosyltransferase; glycosylation; flower color
Liu Ya-li E-mail:lyl6151@126.com
10.11829/j.issn.1001-0629.2017-0049
杜灵娟,陈凯利,刘雅莉.葡萄风信子花青素3-O-葡糖基转移酶基因的克隆及其表达分析.草业科学,2017,34(11):2235-2244.
Du L J,Chen K L,Liu Y L.Cloning and expression analysis of anthocyanidin 3-O-glucosyltransferase gene in Grape hyacinth.Pratacultural Science,2017,34(11):2235-2244.
Q943.2
A
1001-0629(2017)11-2235-10
2016-12-19接受日期2017-03-20
陕西省自然科学基金青年项目(2017JQ3019);中央高校基本科研业务费(Z109021603);国家自然科学基金青年项目(31700625)
杜灵娟(1980-),女,河南孟州人,讲师,博士,主要从事园林植物分子育种研究。E-mail:9511083@qq.com
刘雅莉(1960-),女,陕西西安人,教授,硕士,主要从事园林植物分子育种研究。E-mail:lyl6151@126.com
