广东果蔗宿根矮化病菌检测
2017-11-29窦志敏潘玲玲邓权清王凯莉陈培寿沈万宽
窦志敏, 潘玲玲, 邓权清, 王凯莉, 陈培寿, 沈万宽,2*
(1. 华南农业大学农学院, 农业部华南地区作物栽培科学观察实验站, 广州 510642; 2. 华南农业大学农学院, 广东省微生物信号与病害防控重点实验室, 广州 510642)
广东果蔗宿根矮化病菌检测
窦志敏1, 潘玲玲1, 邓权清1, 王凯莉1, 陈培寿1, 沈万宽1,2*
(1. 华南农业大学农学院, 农业部华南地区作物栽培科学观察实验站, 广州 510642; 2. 华南农业大学农学院, 广东省微生物信号与病害防控重点实验室, 广州 510642)
为探明广东果蔗宿根矮化病发生情况,为果蔗健康种苗生产及推广应用提供科学依据,本研究采用常规PCR与巢式PCR技术分别对广东韶关和广州南沙果蔗产区的主栽品种‘黑皮果蔗’(‘Badila’)及华南农业大学甘蔗育种基地新引进的果蔗品种‘内江蜜蔗’、‘甜城21号’、‘甜城22号’和‘甜城99号’等进行宿根矮化病菌的检测。结果表明,巢式PCR检测的阳性检出率达88.6%,明显高于常规PCR检测(40.4%);广东韶关果蔗产区‘黑皮果蔗’宿根矮化病阳性率为86.8%;广州南沙果蔗产区‘黑皮果蔗’宿根矮化病阳性率为92.7%;华南农业大学甘蔗育种基地新引进的果蔗品种除‘甜城22号’外,其他3个品种‘内江蜜蔗’、‘甜城21号’和‘甜城99号’均感染宿根矮化病菌。甘蔗宿根矮化病已在广东主要果蔗产区普遍发生,健康种苗研究与应用十分必要。
果蔗; 宿根矮化病; 常规PCR; 巢式PCR
甘蔗宿根矮化病(ratoon stunting disease, RSD)是由一种寄居甘蔗木质部的细菌——木质部赖氏菌木质部亚种Leifsoniaxylisubsp.xyli(Lxx)引起的病害[1-2]。该病造成甘蔗产量损失达29%,在干旱等不良环境条件下引起的损失则更为严重[3]。甘蔗RSD是一种种苗传播的病害,主要通过带菌蔗种和收获工具如蔗刀传播,其病原菌可在蔗种及宿根蔗头中存活较长时间[4]。由于感病的蔗株一般不表现典型的外部症状[5],单从外观上难以诊断,使得病害发生较为隐蔽,极易造成病原菌任意传播扩散,严重危害甘蔗生产[6]。
RSD的诊断方法经历了剖茎检视[7],相差显微镜镜检[8],免疫学检测[9]和PCR检测[10]等阶段。PCR检测技术具有快速、灵敏等优点,现已广泛应用于甘蔗宿根矮化病菌的检测。Lopes等[10]、Fegan等[11]及Pan等[12]分别建立了检测RSD致病菌的PCR体系,并对引物的特异性及灵敏度进行了研究;周丹等[13]对检测甘蔗宿根矮化病菌的PCR方法进一步优化,使其检测灵敏度、效率及稳定性比优化前更高,更加适合于快速检测田间大批量样品;沈万宽等[14]利用细菌16S-23S rDNA内转录间隔区(ITS)通用引物ITS1/ITS2及甘蔗RSD特异引物Lxx1/Lxx2,建立了检测RSD致病菌的巢式PCR技术,其灵敏度更高,检测更加准确。2013年,Pelosi等[15]建立了RSD病原菌Lxx的实时荧光定量PCR检测技术。
果蔗即鲜食水果型甘蔗,皮薄、茎脆、汁多,富含人体所需的多种维生素和氨基酸,具有生津解渴,消除疲劳的功效。广东韶关、广州南沙区是广东传统果蔗产区,年种植面积8 000~10 000 hm2,占广东果蔗种植面积的70%。近年来,随着市场需求和种植效益的提高,果蔗生产发展迅速,种植面积不断扩大。然而,我国果蔗品种单一(以热带原种‘Badila’,即‘黑皮果蔗’为主),且种植年代久,品种抗性较差,较容易感染宿根矮化病、花叶病等种苗传播病害,导致果蔗产量和品质下降,种植效益降低[16]。生产、推广和应用脱毒健康种苗是防治甘蔗RSD的主要措施,种植脱毒健康种苗不仅可以有效地脱除RSD致病菌,还有利于提高甘蔗单产和蔗糖分[17]。探明蔗区RSD发生危害情况,是科学防控甘蔗RSD的关键。目前,有关我国糖蔗RSD检测及调查分析的报道不少[18-20],但有关果蔗RSD的检测及调查分析鲜有报道[21]。基于此,本研究应用常规PCR和巢式PCR检测技术分别对广东两大果蔗产区主栽果蔗品种及新引进的果蔗品种进行宿根矮化病菌的检测,对比分析两种PCR技术检测结果,明确病害发生情况,为果蔗RSD的诊断及健康种苗的推广应用提供科学依据。
1 材料和方法
1.1 试验材料
2016年10月-11月,分别在广东韶关和广州南沙果蔗主产区随机采集株龄8个月以上的‘黑皮果蔗’主茎,同时在华南农业大学甘蔗育种基地采集新引进自四川省内江农科院的果蔗或糖果兼用品种‘内江蜜蔗’、‘甜城21号’、‘甜城22号’和‘甜城99号’等株龄8个月以上的主茎,共114份样品(表1)。阳性对照为Lxx的基因组DNA,由本实验室保存。
1.2 主要试剂及仪器
TaqDNA聚合酶、dNTPs、10×Buffer(含Mg2+)、DL2000 DNA Marker及EB替代物均购自TaKaRa宝生物工程(大连)有限公司;琼脂糖购自广州健阳生物科技有限公司。PCR仪为BIO-RAD热循环仪;凝胶成像系统为Tanon-1600。
1.3 样品处理与总DNA的提取
参照沈万宽等[22]的方法,取样品蔗茎基部1个或2个节,用利刀削去蔗皮,用手持蔗汁压榨器压汁,每个样品取300 μL以上蔗汁于1.5 mL离心管中,每取完1个样后,要用清水反复冲洗刀和压榨器,防止样品交叉污染,取汁后的离心管及时放入-20℃冰箱保存,蔗汁用于提取总DNA。
采用CTAB法提取蔗汁总DNA,每个样品取300 μL蔗汁于1.5 mL灭菌离心管中,加入600 μL 2% CTAB提取缓冲液(含0.2%β-巯基乙醇),65℃温浴45 min,其间不时摇动;加入600 μL的氯仿/异戊醇(24∶1),剧烈振荡30 s,12 000 r/min、4℃离心10 min;转移上清到一个新的1.5 mL灭菌离心管中,加入等体积的氯仿/异戊醇(24∶1),轻缓多次颠倒混匀,12 000 r/min、4℃离心10 min;将上层水相转入一个新的1.5 mL灭菌离心管中,加入1 /10体积3 mol/L的NaAc(pH 5.2)和等体积冷的异丙醇,混匀,-20℃下静置30 min;12 000 r/min、4℃离心10 min;弃上清,沉淀分别用70%乙醇和无水乙醇各洗1次;风干后用50 μL的TE缓冲液溶解,-20℃保存。
1.4 常规PCR检测
采用Pan等[12]报道的甘蔗宿根矮化病菌特异引物Lxx1: 5′-CCGAAGTGAGCAGATTGACC-3′和Lxx2: 5′-ACCCTGTGTTGTTTTCAACG-3′进行检测。引物委托生工生物工程(上海)有限公司合成。以总DNA为模板进行PCR扩增,反应体系20.0 μL:模板1.0 μL,10×Buffer(含Mg2+)2.0 μL,dNTPs (2.5 mmol/L)1.6 μL,引物Lxx1/Lxx2 (5 μmol/L)各1.0 μL,TaqDNA聚合酶(5 U/μL)0.2 μL,用ddH2O补足至20.0 μL。扩增程序为:94℃预变性2 min;94℃变性30 s,54℃退火30 s,72℃延伸60 s,进行35个循环;最后72℃延伸5 min。扩增产物经1.2%琼脂糖凝胶电泳,在凝胶成像系统中观察结果并拍照保存。
1.5 巢式PCR检测
参照沈万宽等[14]的巢式PCR检测方法,利用细菌ITS通用引物ITS1/ITS2(ITS1: 5′-AGTCGTAACAAGGTAGCCGT-3′;ITS2:5′-GTGCCAA-GGCATCCACC-3′)和特异引物Lxx1/Lxx2进行检测。引物委托生工生物工程(上海)有限公司合成。以总DNA为模板,以ITS1/ITS2为引物进行第一轮PCR扩增,反应体系及扩增程序参见1.4,其中退火温度为56℃,循环30次。以第一轮扩增产物为模板,利用引物Lxx1/Lxx2进行第二轮PCR扩增,反应体系及扩增程序均同1.4。扩增产物经1.2%琼脂糖凝胶电泳,在凝胶成像系统中观察结果并拍照保存。
1.6 序列测定与分析
PCR产物核苷酸序列委托生工生物工程(上海)有限公司测定,同源性比较在NCBI数据库中通过BLAST程序进行,序列分析应用DNAStar软件进行。
2 结果与分析
2.1 常规PCR检测
利用引物Lxx1/Lxx2对114份样品的蔗汁总DNA进行常规PCR检测,阳性样品的PCR产物电泳后可见单一的扩增条带,大小与预期一致,为438 bp,且空白对照(无菌水)无扩增条带(图1)。PCR产物经测序,BLAST比对及DNAStar软件分析,其序列与来自澳大利亚、美国和中国福建等地的Lxx株系或分离物(GenBank登录号为AF034641,AF056003,EU723209)相应核苷酸序列的同源性为99%~100%,确认该扩增序列为Lxx基因组片段序列。表明具有该目的条带的样品为感染甘蔗宿根矮化病菌的样品。
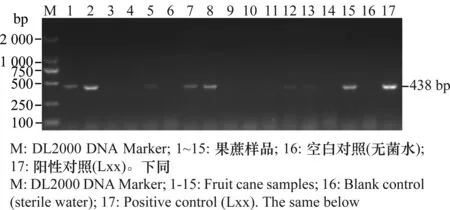
图1 部分果蔗样品常规PCR检测结果Fig.1 Detection of partial fruit cane samples by conventional PCR
2.2 巢式PCR检测
利用引物ITS1/ITS2和Lxx1/Lxx2对114份样品的蔗汁总DNA进行巢式PCR检测,经过两轮扩增,产物电泳后,可见单一明亮条带,大小与预期一致,为438 bp,且空白对照(无菌水)无扩增条带(图2)。对第二轮PCR产物进行测序,通过BLAST比对及DNAStar软件分析,其序列与来自巴西、澳大利亚和美国等地的Lxx株系或分离物(GenBank登录号为AE016822,AF034641,AF056003)相应核苷酸序列同源性为99%~100%的一致性,确认该扩增序列为Lxx基因组片段序列。表明具有该目的条带的样品为感染甘蔗宿根矮化病菌的样品。
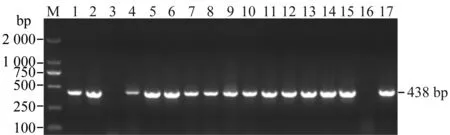
图2 部分果蔗样品巢式PCR检测结果Fig.2 Detection of partial fruit cane samples by nested PCR
2.3 常规PCR与巢式PCR检测结果比较分析
对114份样品分别进行常规PCR和巢式PCR检测,常规PCR有46份呈阳性反应,阳性检出率为40.4%;巢式PCR有101份呈阳性反应,阳性检出率为88.6%。46份常规PCR检测为阳性的样品,巢式PCR检测均为阳性;有55份常规PCR检测为阴性的样品,巢式PCR检测为阳性;仅13份样品常规PCR和巢式PCR检测均为阴性(表1~表2)。结果表明,相较于巢式PCR,常规PCR漏检率为54.5%。
2.4 广东果蔗宿根矮化病发生情况
114份样品宿根矮化病检测结果显示,广东韶关果蔗产区‘黑皮果蔗’宿根矮化病阳性率为86.8%;广州南沙果蔗产区‘黑皮果蔗’宿根矮化病阳性率为92.7%;华南农业大学甘蔗育种基地的5个果蔗品种中有4个感染宿根矮化病,阳性率为80%,其中新引进的果蔗品种除‘甜城22号’外,其他3个品种‘内江蜜蔗’、‘甜城21号’和‘甜城99号’均感染宿根矮化病(表1~表2)。
表1新引进果蔗品种宿根矮化病菌检测结果
Table1DetectionofLeifsoniaxylisubsp.xyli(Lxx)fromintroducedfruitcanecultivars
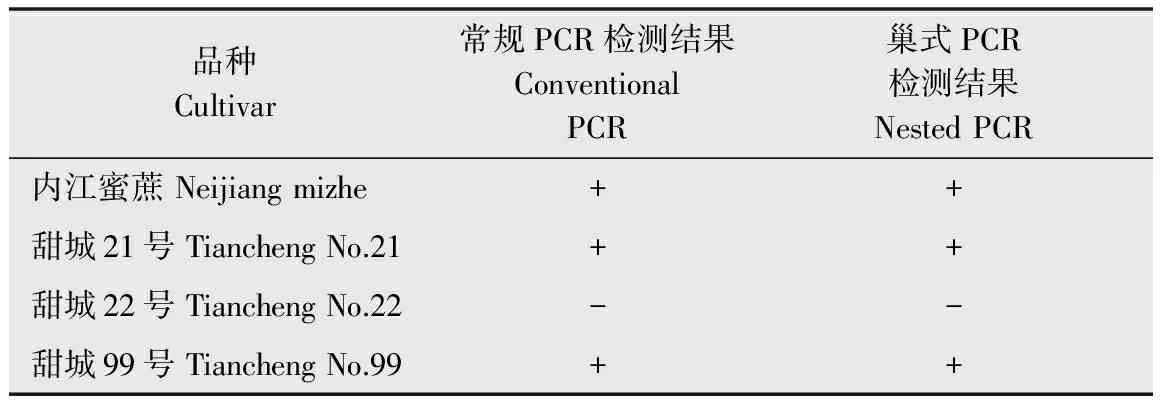
品种Cultivar常规PCR检测结果ConventionalPCR巢式PCR检测结果NestedPCR内江蜜蔗Neijiangmizhe++甜城21号TianchengNo.21++甜城22号TianchengNo.22--甜城99号TianchengNo.99++
表2广东果蔗宿根矮化病菌检测结果
Table2DetectionofLeifsoniaxylisubsp.xyli(Lxx)fromfruitcanecultivarsinGuangdong
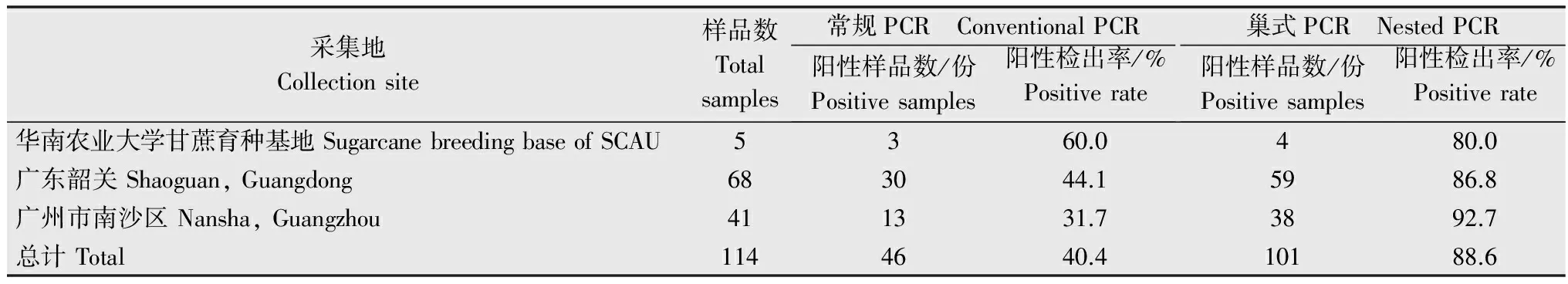
采集地Collectionsite样品数Totalsamples常规PCR ConventionalPCR阳性样品数/份Positivesamples阳性检出率/%Positiverate巢式PCR NestedPCR阳性样品数/份Positivesamples阳性检出率/%Positiverate华南农业大学甘蔗育种基地SugarcanebreedingbaseofSCAU5360.0480.0广东韶关Shaoguan,Guangdong683044.15986.8广州市南沙区Nansha,Guangzhou411331.73892.7总计Total1144640.410188.6
3 讨论
与常规PCR相比,巢式PCR对靶标DNA进行两轮扩增,可显著提高检测灵敏度。沈万宽等[14]报道的甘蔗RSD致病菌巢式PCR检测技术可检测出10 fg Lxx基因组DNA,较常规PCR检测灵敏度提高100倍。Liu等[23]报道的油茶炭疽病菌巢式PCR检测技术,灵敏度可达10 ag,较常规PCR检测灵敏度提高至少1万倍。鹿连明等[24]设计8对引物比较分析柑橘黄龙病菌常规PCR检测与巢式PCR检测技术的灵敏度,发现巢式PCR检测的灵敏度均比常规PCR检测至少高1 000倍。李本金等[25]建立的荔枝霜疫霉巢式PCR检测技术,灵敏度可达100 fg,较常规PCR提高1 000倍。本研究分别利用常规PCR和巢式PCR技术对果蔗宿根矮化病菌进行检测,常规PCR检测的阳性检出率为40.4%,而巢式PCR检测的阳性检出率达88.6%,这与巢式PCR较常规PCR检测灵敏度更高相一致。
据报道,甘蔗宿根矮化病已广泛发生于广东、广西及云南等糖蔗产区,黄孟群等[18]对广东甘蔗宿根矮化病进行调查,共抽查162片蔗田,发现只有13.5%的田块不发病,‘粤糖57/423’、‘粤糖71/210’和‘台糖134’的感病率分别达到77.3%、92%和95.5%;邓展云等[19]对广西部分蔗区进行抽查,主栽品种‘桂糖11号’RSD阳性率达 86%;王晓燕等[20]对云南省18个蔗区的RSD发生危害情况进行系统调查,18个蔗区均检测出甘蔗宿根矮化病菌,阳性检出率为56.4%~88%;张荣跃等[26]对广西和云南几个甘蔗主产区主栽糖蔗品种RSD发生情况进行调查,阳性率达到59.54%,检测的20个主栽糖蔗品种中有19个品种感病。杨湛端等[21]对番禺果蔗宿根矮化病进行初步调查,发现大田种植的‘黄皮果蔗’和‘黑皮果蔗’RSD阳性率分别为95%和93%。本研究对广东韶关、广州南沙果蔗产区的主栽品种‘黑皮果蔗’检测发现,其RSD阳性率分别达86.8%和92.7%;华南农业大学甘蔗育种基地的5个果蔗品种中有4个感染宿根矮化病,阳性率为80%。虽然,果蔗宿根矮化病调查仍处于起步阶段,但从上述已有的调查结果可以看出果蔗宿根矮化病发生率普遍高于糖蔗,可能的原因是果蔗为热带原种(主要为‘Badila’,即‘黑皮果蔗’),未经过杂交改良,品种抗性较差;而糖蔗品种为甘蔗属种间杂交种,导入了甘蔗野生种的优良抗性基因,具有较强的抗逆性。同时,在实际生产中,果蔗品种单一、连续种植年代久、农民长期无性繁殖自留种茎造成病菌逐年累积,也是果蔗宿根矮化病发病率高的原因之一。
本调查表明宿根矮化病已在广东果蔗产区普遍发生,严重影响果蔗产量和品质,阻碍果蔗产业可持续发展。因此,有必要及时研究和推广应用果蔗健康种苗,促进果蔗产业健康发展。
[1] Davis M J, Gillaspie A G, Vidaver A K, et al.Clavibacter: a new genus containing some phytopathogenic coryneform bacteria, includingClavibacterxylisubsp.xylisp. nov., subsp. nov. andClavibacterxylisubsp.cynodontissubsp. nov., pathogens that cause ratoon stunting disease of sugarcane and Bermuda grass stunting disease[J]. International Journal of Systematic Bacteriology, 1984, 34(2): 107-117.
[2] Evtushenko L I, Dorofeeva L V, Subbotin S A, et al.Leifsoniapoaegen. nov., sp. nov., isolated from nematode galls onPoaannua, and reclassification of ‘Corynebacteriumaquaticum’ Leifson 1962 asLeifsoniaaquatica(exLeifson 1962) gen. nov., nom. rev., comb. nov. andClavibacterxyliDavis et al. 1984 with two subspecies asLeifsoniaxyli(Davis et al. 1984) gen. nov., comb. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 371-380.
[3] Johnson S S, Tyagi A P.Effect of ratoon stunting disease (RSD) on sugarcane yield in Fiji [J]. The South Pacific Journal of Natural and Applied Sciences, 2010, 28(1): 69-73.
[4] Comstock J, Shine Jr J M, Davis M J, et al. Relationship between resistance toClavibacterxylisubsp.xylicolonization in sugarcane and spread of ratoon stunting disease in the field [J]. Plant Disease, 1996, 80(6): 704-708.
[5] Hughes C G. Ratoon stunting disease of sugar cane [J]. Journal of the Australian Institute of Agricultural Science, 1955, 21: 3-9.
[6] Comstock J C. Ratoon stunting disease [J]. Sugar Tech, 2002, 4(1): 1-6.
[7] Gillaspie A G, Irvine J E, Steere R L. Ratoon stunting disease virus. Assay technique and partial purification[J]. Phytopathology, 1966, 56: 1426-1427.
[8] Gillaspie A G, Davis R E, Worley J F.Diagnosis of ratoon stunting disease based on presence of a specific microorganism [J]. Plant Disease Reporter, 1973, 57(12): 987-990.
[9] Gillaspie A G. Ratoon stunting disease of sugarcane: serology [J]. Phytopathology, 1978, 68(3): 529-532.
[10] Lopes S A, Damann K E.PCR amplification of DNA from bacterial pathogens of sugarcane [J].Phytopathology,1993,83:1398-1401.
[11] Fegan M, Croft B J, Teakle D S, et al. Sensitive and specific detection ofClavibacterxylisubsp.xyli, causal agent of ratoon stunting disease of sugarcane, with a polymerase chain reaction-based assay [J].Plant Pathology,1998,47(4):495-504.
[12] Pan Y B, Grisham M P, Burner D M, et al. A polymerase chain reaction protocol for the detection ofClavibacterxylisubsp.xyli, the causal bacterium of sugarcane ratoon stunting disease [J]. Plant Disease, 1998, 82(3): 285-290.
[13] 周丹, 谢晓娜, 陈明辉, 等. 甘蔗宿根矮化病PCR检测技术优化分析[J]. 南方农业学报, 2012, 43(5): 616-620.
[14] 沈万宽, 刘睿, 邓海华. 甘蔗宿根矮化病菌巢式PCR检测[J]. 植物保护学报, 2012, 39(6): 508-512.
[15] Pelosi C S, Lourenco M V, Silva M, et al. Development of a Taqman real-time PCR assay for detection ofLeifsoniaxylisubsp.xyli[J].Tropical Plant Pathology,2013,38:343-345.
[16] 王继华,曹干, 张剑亮, 等. 我国果蔗产业的现状与可持续发展[J]. 甘蔗糖业, 2013(5): 56-61.
[17] 游建华, 曾慧, 李松, 等. 甘蔗脱毒健康种苗田间比较试验[J]. 中国糖料, 2005(2): 12-15.
[18] 黄孟群, 肖镇杰. 广东甘蔗宿根矮化病调查报告[J]. 甘蔗糖业, 1987(2): 39-40.
[19] 邓展云, 王伯辉, 刘海斌, 等. 广西甘蔗宿根矮化病的发生及病原检测[J]. 中国糖料, 2004(3): 35-38.
[20] 王晓燕,李文凤,黄应昆,等.云南甘蔗宿根矮化病发生危害调查与病原检测[J].中国农学通报,2015,31(31):208-212.
[21] 杨湛端, 刘睿, 沈万宽, 等. 番禺果蔗宿根矮化病调查与分析[J]. 广东农业科学, 2012(9): 75-76.
[22] 沈万宽, 周国辉, 邓海华, 等. 甘蔗宿根矮化病菌PCR检测及目的片段核苷酸序列分析[J]. 中国农学通报, 2006, 22(12): 413-416.
[23] Liu Junang, Li He, Zhou Guoying. Specific and rapid detection ofCamelliaoleiferaanthracnose pathogen by nested-PCR [J]. African Journal of Biotechnology, 2009, 8(6): 1056-1061.
[24] 鹿连明,胡秀荣,张利平,等.常规和巢式PCR对柑橘黄龙病菌的检测灵敏度比较[J].热带作物学报,2010,31(8):1280-1287.
[25] 李本金,刘裴清,刘小丽,等.荔枝霜疫霉巢式PCR和LAMP检测方法的建立[J].农业生物技术学报,2016,24(6):919-927.
[26] 张荣跃, 黄应昆, 李文凤, 等. 甘蔗主栽品种宿根矮化病调查及病原检测[J]. 中国糖料, 2014(2): 26-27.
(责任编辑: 杨明丽)
信息公告
2017曾士迈张树榛奖励基金评选结果公告
为弘扬曾士迈、张树榛先生的奉献、爱国、科学精神,促进植物病理学发展而设立的“曾士迈张树榛奖励基金”已于2017年初启动,每年奖励一名做出突出贡献的科技人员以及两名优秀青年工作者。现已圆满完成2017年的评奖工作。经基金管理委员会评审,决定将“曾士迈张树榛未来之星奖”授予梁俊敏和曹学仁两位同志,并奖励每人2万元人民币,以表彰他们在植物病害流行学研究中的工作,激励他们在未来的工作中大胆创新,积极进取,做出更大贡献。
曾士迈张树榛奖励基金管理委员会
二〇一七年十一月十日
秘书处联系人:吴波明 电话:18510081892 E-mail: bmwu@cau.edu.cn
DetectionofLeifsoniaxylisubsp.xyli,causalbacteriumofsugarcaneratoonstuntingdisease,fromfruitcaneplantingareasinGuangdong
Dou Zhimin1, Pan Lingling1, Deng Quanqing1, Wang Kaili1, Chen Peishou1, Shen Wankuan1,2
(1.CollegeofAgronomy,SouthChinaAgriculturalUniversity,ScientificObservingandExperimentalStationofCropCultivationinSouthChina,MinistryofAgriculture,Guangzhou510642,China; 2.CollegeofAgronomy,SouthChinaAgriculturalUniversity,GuangdongKeyLaboratoryofMicrobialSignalsandDiseaseControl,Guangzhou510642,China)
This study aimed to understand the occurrence situation of ratoon stunting disease (RSD) in Guangdong fruit cane planting areas and provide scientific basis for the production and application of healthy seedlings. Conventional PCR and nested PCR were used to detectLeifsoniaxylisubsp.xyli, the causal bacterium of ratoon stunting disease, from fruit cane cultivars, including ‘Badila’, ‘Neijiang mizhe’, ‘Tiancheng No.21’, ‘Tiancheng No.22’ and ‘Tiancheng No.99’. Samples of ‘Badila’ used as the main fruit cane cultivar were collected from Shaoguan City and Nansha District of Guangdong Province. Samples of introduced fruit cane cultivars ‘Neijiang mizhe’, ‘Tiancheng No.21’, ‘Tiancheng No.22’ and ‘Tiancheng No.99’ were collected from the sugarcane breeding base of South China Agricultural University (SCAU). The results showed that the positive detection rate was 88.6% by nested PCR, significantly higher than that by conventional PCR, which was 40.4%. The RSD positive rate of ‘Badila’ was 86.8% in Shaoguan and 92.7% in Nansha of Guangzhou, respectively. The introduced fruit cane cultivars from the sugarcane breeding base of SCAU were all infected by RSD pathogen except the ‘Tiancheng No.22’. The sugarcane ratoon stunting disease has occurred widely in the major fruit cane planting areas of Guangdong. It is necessary to carry out the research and application of healthy fruit cane seedlings.
fruit cane; ratoon stunting disease; conventional PCR; nested PCR
2017-02-23
2017-04-19
广州市科技计划项目(201604020087);华南农业大学人才引进启动项目(13009)
* 通信作者 E-mail:wkshen@scau.edu.cn
S 435.661
A
10.3969/j.issn.0529-1542.2017.06.028
