IL-37b通过抑制树突状细胞相关的免疫应答缓解感染性休克
2017-11-29李梦媛燕正强韦荣飞杨星九朱瑞敏
李梦媛,燕正强,韦荣飞,杨星九,朱瑞敏,高 苒*
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2.定西市中医院骨伤一科,甘肃 定西 743000)
IL-37b通过抑制树突状细胞相关的免疫应答缓解感染性休克
李梦媛1,燕正强2,韦荣飞1,杨星九1,朱瑞敏1,高 苒1*
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2.定西市中医院骨伤一科,甘肃 定西 743000)
目的表达IL-37b重组蛋白,研究其在调节机体免疫应答方面的作用机制。方法构建原核表达载体pET28/IL-37b,诱导表达的IL-37b重组蛋白由Ni2+-NTA凝胶进行纯化。将IL-37b作用于C57BL/6 J小鼠,注射LPS诱导感染性休克,检测小鼠血清中IL-1β、IL-6、IFN-γ的表达水平。分离并培养小鼠树突状细胞,用IL-37b处理,经LPS诱导活化,检测细胞表面CD40、CD80、MHCII等标志物分子表达情况,以及培养上清中IL-1β、IL-10、IL-12、TNF-α的表达水平。分离小鼠CD4+T细胞,检测IL-37b对LPS诱导的T细胞培养上清中IFN-γ、TNF-α、IL-10的抑制作用。结果IL-37b能够降低感染性休克的小鼠血清中促炎性细胞因子的表达;并抑制小鼠树突状细胞共刺激分子和促炎性细胞因子的表达,以及CD4+T细胞表达促炎性细胞因子。结论纯化的IL-37b具备生物学活性,能够通过抑制树突状细胞活化及相关的T细胞免疫应答缓解机体感染性休克。
IL-37b;纯化;树突状细胞;免疫应答;感染性休克
细胞因子IL-37属IL-1家族成员,曾经被命名为IL-1F7[1],其在人体多种组织、器官中都有表达[2-4],但小鼠体内并没有被发现有其同类细胞因子的表达[5]。IL-37的基因序列包含6个外显子,外显子1~3编码IL-37前体蛋白的N末端,外显子4~6编码C末端IL-1样细胞因子结构[6]。IL-37的编码产物有a、b、c、d、e共5种亚型,其中IL-37b是五种亚型中序列最长的一个,共有218个氨基酸,含有外显子1、2、4、5、6[7]。近年来,大量研究已证实IL-37b具有生物学活性,能够作为炎症抑制因子在多种炎症性疾病中发挥功能,调节固有免疫应答[8-11]。树突状细胞(dendritic cells,DCs)表面具有丰富的抗原递呈分子,是机体功能最强的专职抗原递呈细胞(antigen presenting cells,APC),能够高效地摄取、加工处理和递呈抗原。成熟的DCs能够激活初始型T细胞,启动并调控免疫应答,是机体免疫反应的关键调控者[12]。
本实验通过构建原核表达载体大量表达IL-37b重组蛋白,研究IL-37b对DCs活化及其相关的免疫应答的影响,并进一步研究IL-37b对机体炎症反应发挥抑制作用的机制。
1 材料和方法
1.1实验动物与原核表达质粒
7~8周龄SPF级雌性C57BL/6 J小鼠18只购自北京华阜康生物科技股份有限公司 [SCXK (京) 2014-0004],饲养于中国医学科学院医学实验动物研究所动物实验室 [SYXK (京) 2014-002]。该实验研究经由实验动物使用与管理委员会批准(IACUC:GR16002)。
含有全长IL-37b基因的重组质粒pET28/IL-37b由本实验室制备并保存。
1.2主要试剂与用品
酵母提取物、干粉蛋白胨、琼脂粉购自Oxiod公司;质粒提取试剂盒购自Qiagen公司;Ni2+-NTA凝胶购自Novagen公司;尿素、Tris-HCl、NaH2PO4、考马斯亮蓝等化学试剂购自Amresco公司;PBS、RPMI-1640培养基、胎牛血清、青链霉素双抗溶液、胰蛋白酶等购自Gibco公司;脂多糖(lipopolysaccharide,LPS)购自Sigma公司;重组小鼠粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)和白细胞介素4(interleukin-4,IL-4)购自Peprotech公司;无菌细胞筛网、红细胞裂解液、流式CBA细胞因子检测试剂盒购自BD公司;荧光标记的细胞表面标志分子检测抗体购自eBioscience公司;预染蛋白分子量Marker、BCA蛋白浓度检测试剂盒购自Thermo公司。引物合成及测序等服务由英潍捷基(上海)公司提供。
1.3实验方法
1.3.1 蛋白纯化
将制备好的能够稳定表达重组质粒pET28/IL-37b的大肠杆菌甘油菌冻存液均匀涂布于具有卡那霉素抗性的LB平板表面,于37℃培养箱中倒置培养过夜,复苏菌种。次日,挑取单个菌落接种至3~4 mL LB液体培养基中,37℃,200 r/min振摇培养8 h。将培养的菌液按1∶500的体积比接种到1 L LB液体培养基中,继续37℃,200 r/min振摇,扩大培养。培养至菌液A600值达到0.5~0.6时,加入终浓度1 mmol/L的IPTG诱导菌体表达蛋白,继续培养。16~18 h后,以4℃、4000 r/min条件离心30 min,收集菌体沉淀。用PBS溶液重悬沉淀,超声破碎菌体,12 000 r/min再次离心20 min,分别取裂解产物的上清与沉淀进行SDS-PAGE电泳,电泳结果显示菌体裂解产物的上清和沉淀中都有外源性重组蛋白表达的条带,表明重组IL-37b具有可溶性和包涵体两种表达形式,其中沉淀中的目的重组蛋白较多,故收集菌体沉淀进行纯化[13]。
因重组IL-37b蛋白带有6个His标签,故采用Ni2+-NTA凝胶进行变性条件下的亲和层析纯化。变性结合缓冲液为8 mol/L尿素,0.1 mol/L NaH2PO4,0.01 mol/L Tris-HCl,pH 8.0;变性漂洗缓冲液为8 mol/L尿素,0.1 mol/L NaH2PO4,0.01 mol/L Tris-HCl,pH 6.3;变性洗脱缓冲液为8 mol/L尿素,0.1 mol/L NaH2PO4,0.01 mol/L Tris-HCl,pH 4.5。纯化完成后,对收集到的重组蛋白溶液进行透析复性,并除去其中的尿素,于4℃环境透析24 h,每2~3 h更换一次透析液。
将蛋白纯化过程中收集的各组分溶液样品进行SDS-PAGE电泳。电泳结束后,小心地将有条带的分离胶部分切下来,用考马斯亮蓝染色30 min~1 h,至能明显观察到marker与蛋白条带后,将其放入乙酸脱色液中洗涤脱色至蛋白条带清晰。在紫外显影仪下观察蛋白条带大小位置并拍照记录。
1.3.2 IL-37b重组蛋白对LPS诱导的机体感染性休克的抑制作用
LPS是革兰氏阴性菌细胞壁外表层的内毒素脂多糖,能够引起发热、微循环障碍、感染性休克等症状[14]。将C57BL/6 J小鼠分为实验组与对照组两组,每组6只;实验组按照体重腹腔注射10 mg/kg的IL-37b重组蛋白溶液,对照组注射相同体积的PBS溶液;2 h后按体重给每只小鼠腹腔注射10 mg/kg的LPS。注射18~20 h后,进行眼眶取血,将全血室温静置1~2 h,待血凝后离心收集血清。采用CBA细胞因子检测试剂盒检测小鼠血清中IL-1β、IL-6、IFN-γ的表达水平。按照试剂盒说明书进行操作,配制含有上述3种细胞因子对应的捕获微球混合溶液,每个血清样品取50 μL,与同体积的微球混合液混匀,室温作用1 h;配制含有上述3种细胞因子对应的PE标记的荧光抗体混合溶液,取50 μL,逐一加入上一步的样品中并混匀,室温避光继续作用1 h;1500 r/min离心5 min,洗涤一次,将样品重悬后通过流式细胞仪检测血清中IL-1β、IL-6、IFN-γ 3种细胞因子的表达量。
1.3.3 小鼠骨髓树突状细胞的分离与培养
取3只C57BL/6 J小鼠,颈椎脱臼处死后,浸入75%乙醇中灭菌,在生物安全柜中解剖分离股骨与胫骨,用注射器抽取PBS溶液吹洗骨髓腔得到骨髓悬液;将骨髓悬液流过70 μm孔径的细胞筛网,收集细胞悬液,以1500 r/min离心5 min,弃去上清溶液;加入5 mL配制好的红细胞裂解液,重悬细胞,4℃静置5 min,去除红细胞;随后1500 r/min离心5 min,弃去上清溶液,用PBS溶液以相同的条件离心洗涤细胞,再次弃去上清溶液;用RPMI-1640完全培养基重悬细胞,接种于无菌培养皿中;DCs半贴壁生长,用工作浓度20 ng/mL的GM-CSF与10 ng/mL IL-4共同诱导培养,37℃培养6 d,每3 d更换一次培养基,补充细胞因子。GM-CSF能够诱导DCs扩增分化,并在体外环境下维持其生存;IL-4可抑制巨噬细胞克隆形成,诱导DCs生长成熟。该方法得到的DCs可达到细胞总数的90%以上[15]。
1.3.4 IL-37b重组蛋白对小鼠树突状细胞活化的抑制作用
将培养6 d的DCs制成浓度为2 × 106个/mL的细胞悬液,接种于24孔细胞培养板,37℃继续培养。LPS能够促进DCs活化或进一步成熟,实验组细胞先采用工作浓度500 ng/mL的IL-37b单独作用,2 h后加入工作浓度为500 ng/mL的LPS,与重组蛋白共同作用于细胞;对照组细胞则采用与重组蛋白溶液同体积的PBS溶液与500 ng/mL的LPS共同作用。37℃培养18~20 h后,分别收集细胞与培养上清。
1.3.5 流式细胞术检测树突状细胞表面的标志物分子表达情况
通过流式细胞仪检测DCs表面标志分子CD40、CD80、MHCII的表达情况。配制含有不同荧光标记的CD40(PE)、CD80(PE-Cyanine5)、MHCII(FITC)抗体混合溶液,加入离心收集到的细胞沉淀中并将其重悬,4℃避光反应30 min;1500 r/min离心5 min,弃去上清,加入PBS溶液离心洗涤细胞一次,再将细胞重悬;用200目筛网过滤细胞,通过流式细胞仪检测DCs表面CD40、CD80、MHCII的表达水平。
1.3.6 流式细胞术检测树突状细胞培养上清中的细胞因子表达水平
采用CBA细胞因子检测试剂盒检测1.3.4中收集的DCs培养上清中IL-1β、IL-10、IL-12、TNF-α的表达量。按照试剂盒说明书进行操作,步骤同1.3.2。
1.3.7 分离小鼠脾脏CD4+ T细胞
取3只C57BL/6 J小鼠,颈椎脱臼处死后,浸入75%乙醇中灭菌,在生物安全柜中解剖取脾脏,浸入PBS溶液。用无菌注射器活塞研磨至细胞释出,将细胞悬液流过70 μm孔径的细胞筛网,收集细胞悬液,以1500 r/min离心5 min,弃去上清溶液;加入红细胞裂解液去除红细胞,步骤同1.3.3。配制CD4+(FITC)抗体溶液,加入离心后的细胞沉淀中并将其重悬,避光反应30 min;反应结束后离心去除上清,并加入PBS溶液离心洗涤细胞一次,再将细胞重悬;用200目筛网过滤细胞,通过流式细胞仪对细胞悬液中的CD4+ T细胞进行分选。
1.3.8 IL-37b重组蛋白对小鼠CD4+T细胞活化的抑制作用
将分选后的小鼠CD4+T细胞接种于24孔细胞培养板,实验组与对照组分别采用工作浓度500 ng/mL的IL-37b与同体积的PBS溶液单独作用,2 h后加入工作浓度为500 ng/mL的LPS,共同孵育培养。37℃培养18 h后,离心收集细胞培养上清,采用CBA细胞因子检测试剂盒检测培养上清中IFN-γ、TNF-α、IL-10的表达量。按照试剂盒说明书进行操作,步骤同1.3.2。
1.4统计学方法

2 结果
2.1蛋白纯化
SDS-PAGE电泳结果如图1所示,在25 × 103左右处有一条高表达的外源性蛋白条带,与预期IL-37b重组蛋白的分子量相符合;并且纯化后的蛋白溶液中除该目的条带外未见其他条带。
2.2小鼠血清中促炎性细胞因子的表达
通过流式细胞仪检测经LPS诱导感染性休克的小鼠血清中细胞因子表达水平。与PBS对照组比较,经IL-37b重组蛋白预处理后,小鼠血清中的IL-1β、IL-6与IFN-γ的表达水平均显著下降,如图2所示。表明纯化的重组IL-37b蛋白具备生物学活性,能够抑制LPS引起的机体炎症反应。
2.3小鼠树突状细胞表面标志物分子的表达
通过流式细胞仪检测经LPS作用后的小鼠DCs表面CD40、CD80、MHCII等表面标志物分子的表达水平。实验结果显示,在相同数量的细胞中,经IL-37b预处理的DCs表面CD40、CD80与MHCII所占的百分比低于未经蛋白作用的组别,其中CD40、CD80的下降趋势差异有显著性,如图3所示。

图1 IL-37b纯化的SDS-PAGE分析Fig.1 SDS-PAGE analysis of IL-37b purification and identification
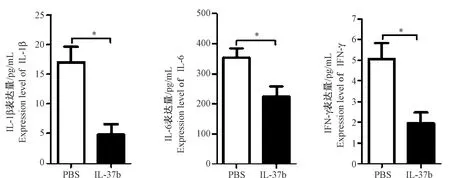
注:n=6;与PBS对照组比较,* P< 0.05。图2 血清中促炎性细胞因子的表达 Note. n=6; Compared with the PBS control group,*P< 0.05.Fig.2 Expression levels of proinflammatory cytokines in the serum of mice with LPS-induced septic shock
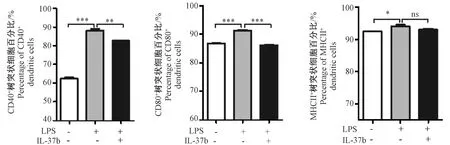
注:n=3;* P< 0.05,**P< 0.01,***P< 0.001。图3 树突细胞表面抗原的表达Note. n=3;*P< 0.05,**P< 0.01,***P< 0.001.Fig.3 Surface antigen expression on dendritic cells
2.4小鼠树突状细胞培养上清中促炎性细胞因子的表达
通过流式细胞仪检测经LPS作用后小鼠DCs培养上清中IL-1β、IL-10、IL-12、TNF-α的表达水平。实验结果显示,与未经蛋白预处理的对照组相比,经IL-37b作用的细胞培养上清中,上述4种细胞因子的表达量全部降低,其中IL-1β、IL-12与TNF-α显著下降,如图4所示。
2.5小鼠CD4+T细胞培养上清中细胞因子的表达
通过流式细胞仪检测经LPS作用后小鼠脾脏CD4+T细胞培养上清中IFN-γ、TNF-α、IL-10的表达水平。实验结果显示,与未经IL-37b预处理的对照组相比,经IL-37b作用的细胞培养上清中,上述3种细胞因子的表达量明显下降,如图5所示。
3 讨论
人DCs起源于造血干细胞,DCs表面具有丰富的抗原递呈分子,如组织相容性复合物MHCI与MHCII,共刺激因子CD80/B7-1、CD86/B7-2、CD40/CD40L,以及粘附因子ICAM-1、ICAM-2、ICAM-3等。未成熟的DCs具有较强的迁移能力与抗原吞噬能力,而成熟的DCs表面高表达共刺激分子与粘附因子,处于启动、调控、维持免疫应答的中心环节[12]。DCs使T细胞活化需要三个信号:第一个信号是DCs表面高表达MHCI或MHCII分子,其与被捕获并加工处理后的抗原肽结合后,共同递呈给T细胞;第二个信号是DCs表面高表达的共刺激分子CD80、CD86、CD40等,能够促进T细胞活化,启动免疫应答;第三个信号即活化的DCs大量分泌的IL-1β、IL-12、TNF-α、IL-10和IL-6等细胞因子,这些细胞因子能够激活T细胞分化增殖并影响其分化方向[16],故DCs能够介导T细胞免疫应答。
Nold[17]等用IL-37转基因小鼠进行实验,证实IL-37能够抑制LPS引起的机体感染性休克;并且,IL-37也能够在体外抑制LPS刺激引起的人外周血单核细胞和上皮细胞促炎性细胞因子的表达。本实验采用IL-37b重组蛋白对野生型(wild type,WT)小鼠进行预处理,随后通过LPS诱导其感染性休克,证实IL-37b重组蛋白能够明显抑制血清中的IL-1β、IL-6与IFN-γ等促炎性细胞因子的表达,说明原核表达的IL-37b具备生物学活性,能够抑制机体感染性休克。

注:n=3;*P< 0.05,**P< 0.01,***P< 0.001。图4 树突细胞培养上清中细胞因子的表达Note. n=3;*P< 0.05,**P< 0.01,***P< 0.001.Fig.4 Expression of cytokines in culture supernatants of dendritic cells
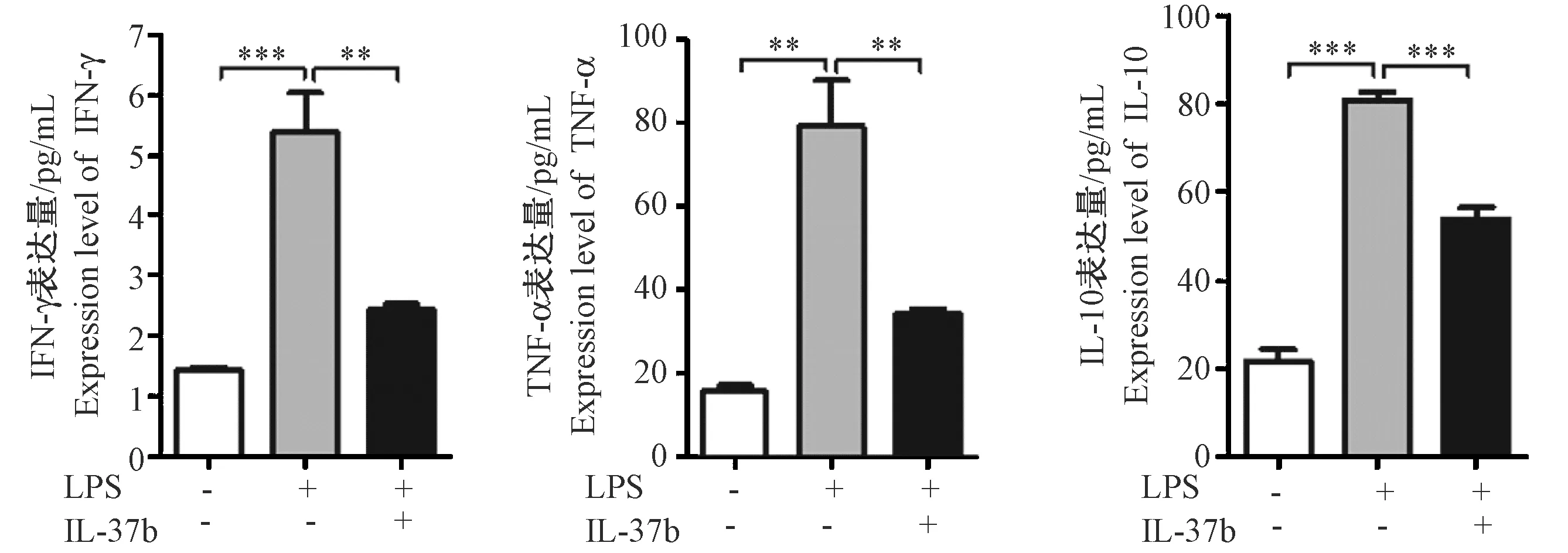
注:n=3;*P< 0.05,**P< 0.01,***P< 0.001。图5 CD4+ T细胞培养上清中细胞因子的表达Note. n=3;*P< 0.05,**P< 0.01,***P< 0.001.Fig.5 Expression of cytokines in culture supernatants of CD4+ T cells
LPS能够促进DCs进一步活化并分泌大量促炎性细胞因子,从而促进T细胞免疫应答[18]。Nold[17]等通过流式细胞术检测了感染性休克小鼠脾脏DCs中CD86和MHCII分子双阳性细胞所占的比例,这些表面分子的大量表达可以引发T细胞免疫应答。实验中,WT小鼠CD86和MHCII分子双阳性细胞所占的比例是73%,而IL-37转基因小鼠CD86和MHCII分子双阳性细胞所占的比例仅为47%,表明IL-37能够抑制LPS引起的DCs活化。CD4+T细胞是免疫调节的核心细胞群体,不同的CD4+T细胞通过分泌不同的细胞因子,对免疫系统的整体功能具有重要的调控作用[19]。成熟的DCs是IL-1β的重要来源,在某些情况下,DCs可通过分泌以IL-1β为主的细胞因子,促进T细胞活化。IL-12和TNF-α是促进辅助性T细胞(T helper cells,Th)向Th1分化的主要细胞因子,IL-6和IL-10则促进Th向Th2分化,这些细胞因子表达量的变化对Th0的分化起着重要作用[12, 20]。Th1与Th2同属于CD4+T细胞亚群,Th1能够分泌TNF-α、IFN-γ等细胞因子,促进炎症介质的进一步合成;而Th2可产生IL-10等细胞因子,这些细胞因子的适量表达有利于控制、阻断急性炎症的发展,因而对体内的炎症反应起下调作用[21]。本实验中,经IL-37b预处理的小鼠DCs培养上清中的IL-1β、IL-10、IL-12、TNF-α表达量全部降低,DCs表面的共刺激分子表达下降,证实IL-37b能够抑制DCs活化,且抑制其传达使T细胞活化的信号;并且,IL-37b能够降低CD4+T细胞表达的IFN-γ、TNF-α、IL-10等细胞因子,抑制T细胞免疫应答反应的进程。
综上,IL-37b能够抑制T细胞的活化与其向Th1、Th2分化的进程,从而抑制T细胞免疫应答。证实IL-37b能够通过抑制DCs活化及相关的T细胞免疫应答反应缓解LPS引起的机体感染性休克。
[1] Dinarello C, Arend W, Sims J, et al. IL-1 family nomenclature [J]. Nat Immunol, 2010, 11(11): 973.
[2] Akdis M, Burgler S, Crameri R, et al. Interleukins, from 1 to 37, and interferon-γ: receptors, functions, and roles in diseases [J]. J Allergy Clin Immunol, 2011, 127(3): 701-721, e1-e70.
[3] Gao W, Kumar S, Lotze MT, et al. Innate immunity mediated by the cytokine IL-1 homologue 4 (IL-1H4/IL-1F7) induces IL-12-dependent adaptive and profound antitumor immunity [J]. J Immunol, 2003, 170(1): 107-113.
[4] Kumar S, Hanning CR, Brigham-Burke MR, et al. Interleukin-1F7B (IL-1H4/IL-1F7) is processed by caspase-1 and mature IL-1F7B binds to the IL-18 receptor but does not induce IFN-γ production [J]. Cytokine, 2002, 18(2): 61-71.
[5] Boraschi D, Lucchesi D, Hainzl S, et al. IL-37: a new anti-inflammatory cytokine of the IL-1 family [J]. Eur Cytokine Netw, 2011, 22(3): 127-147.
[6] Kumar S, McDonnell PC, Lehr R, et al. Identification and initial characterization of four novel members of the interleukin-1 family [J]. J Biol Chem, 2000, 275(14): 10308-10314.
[7] Sharma S, Kulk N, Nold MF, et al. The IL-1 family member 7b translocates to the nucleus and down-regulates proinflammatory cytokines [J]. J Immunol, 2008, 180(8): 5477-5482.
[8] McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37 expression protects mice from colitis [J]. Proc Natl Acad Sci U S A, 2011, 108(40): 16711-16716.
[9] Zhao PW, Jiang WG, Wang L, et al. Plasma levels of IL-37 and correlation with TNF-α, IL-17A, and disease activity during DMARD treatment of rheumatoid arthritis [J]. PLoS One, 2014, 9(5): e95346.
[10] Bulau AM, Fink M, Maucksch C, et al.Invivoexpression of interleukin-37 reduces local and systemic inflammation in concanavalin A-induced hepatitis [J]. ScientificWorldJournal, 2011, 11: 2480-2490.
[11] Lunding L, Webering S, Vock C, et al. IL-37 requires IL-18Rα and SIGIRR/IL-1R8 to diminish allergic airway inflammation in mice [J]. Allergy, 2015, 70(4): 366-373.
[12] 杨文博, 赵堃. 树突状细胞的研究进展 [J]. 医学综述, 2011, 17(15): 2279-2281.
[13] Gu J, Gao X, Pan X, et al. High-level expression and one-step purification of a soluble recombinant human interleukin-37b inEscherichiacoli[J]. Protein Expr Purif, 2015, 108: 18-22.
[14] 郭萌, 李冠民, 黄清泉. 细菌内毒素研究进展 [J]. 中国实验动物学报, 2009, 17(5): 397-401.
[15] 马东霞, 赵越, 向莹, 等. 小鼠骨髓源性树突状细胞的体外诱导扩增和鉴定 [J]. 华中科技大学学报(医学版), 2013, 42(4): 386-390.
[16] 夏清, 谭洪毅, 潘频华, 等. 神经生长因子在诱导树突状细胞分化中的作用 [J]. 中南大学学报(医学版), 2015, 40(8): 829-836.
[17] Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamental inhibitor of innate immunity [J]. Nat Immunol, 2010, 11(11): 1014-1022.
[18] 陈松, 卢利莎, 王伟强, 等. 脂多糖通过调控树突状细胞存活和分泌细胞因子促进CD4+T细胞增殖 [J]. 细胞与分子免疫学杂志, 2016, 32(9): 1153-1157, 1163.
[19] 周洲, 冯娟, 王宪. 调节性T细胞的分化及其影响因素 [J]. 生物物理学报, 2012, 28(2): 93-111.
[20] Lombardi V, Akbari O. Dendritic cell modulation as a new interventional approach for the treatment of asthma [J]. Drug News Perspect, 2009, 22(8): 445-451.
[21] 郝钰, 赵斌, 郭钰琪, 等. 脂多糖诱导小鼠内皮损伤早期T细胞亚群的变化 [J]. 中国免疫学杂志, 2011, 27(6): 488-491.
IL-37balleviatessepticshockthroughinhibitionofimmuneresponsesrelatedtodendriticcells
LI Meng-yuan1, YAN Zheng-qiang2, WEI Rong-fei1, YANG Xing-jiu1, ZHU Rui-min1, GAO Ran1*
(1.Institute of Laboratory Animal Sciences, Chinese Academy of Medical Sciences (CAMS) & Comparative Medicine Center, Peking Union Medical College (PUMC), Beijing 100021, China; 2.Department of Orthopedics,Dingxi Hospital of Traditional Chinese Medicine,Dingxi 743000,China)
ObjectiveTo express the recombinant IL-37b protein and to investigate its role in the regulation of immune responses.MethodsThe prokaryotic expression vector pET28/IL-37b was constructed. The recombinant IL-37b protein was induced to be expressed and was purified using Ni2+-NTA gel column. C57BL/6 J mice were treated with IL-37b and injected with lipopolysaccharide (LPS) to induce septic shock, and the expression levels of IL-1β, IL-6, IFN-γ in the serum of the mice were detected. Dendritic cells from bone marrow of the mice were isolated and cultured, and were treated with IL-37b. After LPS-induced activation, the expression levels of marker molecules such as CD40, CD80 and MHCII on the cell surface, and cytokines such as IL-1β, IL-10, IL-12 and TNF-α in the culture supernatants were detected by flow cytometry. The CD4+T cells from mice were isolated and the inhibitory effects of IL-37b on the expression of IFN-γ, TNF-α and IL-10 in the culture supernatants of T cells after induction by LPS were detected.ResultsIL-37b reduced the expression levels of proinflammatory cytokines in the serum of septic shock mice. IL-37b also inhibited the expression of co-stimulatory molecules and proinflammatory cytokines of the mouse dendritic cells, and suppress the activation of CD4+T cellsinvitro.ConclusionsPurified recombinant IL-37b protein has high bioactivity, and can alleviate septic shock in organisms through inhibiting the activation of dendritic cells and related T cell immune responses.
IL-37b; Purification; Dendritic cells; Immune responses; Septic shock
中国医学科学院医学与健康科技创新工程-重大协同创新项目-协同创新团队资助(编号:2016-I2M-3-019)。
李梦媛(1988-),女,研究方向:免疫学。E-mail: limengyuan767@126.com
高苒(1980 -),女,研究方向:肿瘤学、免疫学。E-mail: gaoran26@hotmail.com
R-33
A
1671-7856(2017) 11-0044-06
10.3969.j.issn.1671-7856. 2017.11.009
2017-03-23
