心脏磁共振T2*WI在检测心肌病变中的临床应用
2017-11-28王文斌李裕丹陈秋智胡杉杉杨智杨帆李春平
王文斌, 李裕丹, 陈秋智, 胡杉杉, 杨智, 杨帆, 李春平
·综述·
心脏磁共振T2*WI在检测心肌病变中的临床应用
王文斌, 李裕丹, 陈秋智, 胡杉杉, 杨智, 杨帆, 李春平
T2*WI成像是心脏磁共振(CMR)成像的新技术之一,与T2弛豫通过自旋回波采集信号的方式不同,T2*驰豫是通过梯度回波来采集信号。心脏T2*WI序列对磁场的均匀性要求高,对微小的影响磁场均匀性的改变都能敏感的检测,明显提高微小病变的检出率。另一方面,通过测量T2*值可以间接反映组织生化成分的变化,不仅可以用作某些疾病的早期诊断,更能用于某些疾病的定量诊断。本文综述心脏T2*WI序列成像的原理、在心肌病变中的临床应用价值及其的优势与不足。
磁共振成像; 成像原理; 临床应用
心脏磁共振(cardiac magnetic resonance,CMR)T2*WI成像通过梯度回波采集信号,一方面,其对磁场的均匀性要求较高,不论是顺磁性物质还是反磁性物质,只要磁场均匀性发生改变,该序列都能敏感的检测,提高了对微小病变的检出率[1];另一方面,T2*值可以间接反映组织生化成分的改变,不仅可以用于某些疾病的早期诊断,更能用于某些疾病的定量诊断[2]。本文就CMR T2*WI的原理、在心肌病变中的临床应用及成像的优势与不足等方面进行综述。
CMR T2*WI成像原理
T2*WI成像与常规T2WI成像原理并不相同,两者的不同之处在于T2WI成像是射频脉冲关闭后,通过180度聚焦脉冲剔除主磁场不均匀因素,只反映组织本身横向磁化矢量的衰减,T2*WI成像是在射频脉冲关闭后,使用梯度切换来重聚信号,同时反映组织本身以及主磁场不均匀的所导致的横向磁化矢量衰减,而这种横向磁化矢量的衰减,也称为T2*弛豫时间值或T2*值,而T2*值是T2*WI成像的一个可量化的指标,与T2值存在联系[3],可用公式表示:1/T2*= 1/T2+γ·ΔBinhom;其中γ是磁旋比,△Binhom是磁场变化幅度。假定静态磁场是均匀的(B0=0),则T2*值就由“γ·△Binhom”影响,而“γ·△Binhom”仅由局部磁场的均匀性决定,因此T2*值受局部磁场均匀性影响。影响局部磁场不均匀性的因素有很多,如心肌顺磁性物质铁微量沉积,心肌血管内去氧血红蛋白浓度[5],心肌组织的出血性病变等[6-7]。通过联合心电门控及呼吸门控,在多次屏气下, 联合CMR T2*WI快速扫描,获取心脏T2*图像[8-9]。
临床应用
1.CMR T2*WI成像在心脏铁过载相关疾病的临床应用
铁广泛分布于人体各个组织及细胞,是人体生存不可缺少的物质。然而,铁过载会打破体内铁的平衡状态。铁过载的病因包括[10]:①肠道吸收过量的铁,利用转铁蛋白通过门静脉将铁转移至门静脉周围的肝细胞中,而对于严重的患者,过量的铁也会沉积在人体的许多器官中,如心脏、胰腺及垂体中;②反复输血时,大量的铁首先会沉积在人体脾脏、肝脏及骨髓的内皮网状系统中,而在后期,过量的铁便会沉积在人体心脏、胰腺及内分泌器官等对于铁的毒性作用很敏感的实质细胞中;③人体内却没有一种清除机制除去体内多余的铁,只能以血清铁和含铁血黄素的形式储存在人体组织中。心脏铁过载的病理生理机制[11]主要表现为当人体内转铁蛋白结合力耗尽时,便会出现游离铁(non-transferrin bound iron,NTBI),而NTBI促进羟自由基的形成,从而导致细胞膜脂质及蛋白质的氧化损伤,在心脏中,将会使线粒体呼吸链功能受损,临床表现为心力衰竭。当心脏内铁含量累积到一定阈值将出现中毒表现,如果没有积极的去铁治疗,这些患者常常死于铁沉积引起的心率失常、心脏衰竭等严重并发症[12]。
因此监测患者心脏铁的含量非常重要。由于人体内铁的分布是不均匀的,血清铁、肝脏铁与心脏铁的含量并无明显的相关性,同时传统的心功能评估也只能在晚期的患者中发现[10],无疑,直接监测心脏铁的含量显得尤为重要。心脏铁过载的临床测量方法是穿刺活检,此方法被称为测量心脏铁的含量的金标准,但是由于穿刺活检操作起来非常危险,且结果存在较大的抽样误差和多变性,然而MRI具有敏感度高、可行性和可重复性好、数据采集方便等优点,决定了它在心脏铁沉积评估中的重要性。
那么,心脏铁过载在MRI中的影像表现又有那些变化呢?在人体组织中,随着回波时间增大,横向磁化矢量逐渐衰减,图像变暗。若组织中铁含量越高,主磁场的不均匀性越明显,组织的T2*值会越小,图像随着回波时间变暗的速度也越快。参考许多国外文献,总结了在1.5T磁共振中,有关心脏铁过载T2*WI成像的主要参数(表1)。可以看出这些参数并不完全一致,显然以下参数小的改变并不会影响对心脏铁沉积的监测。
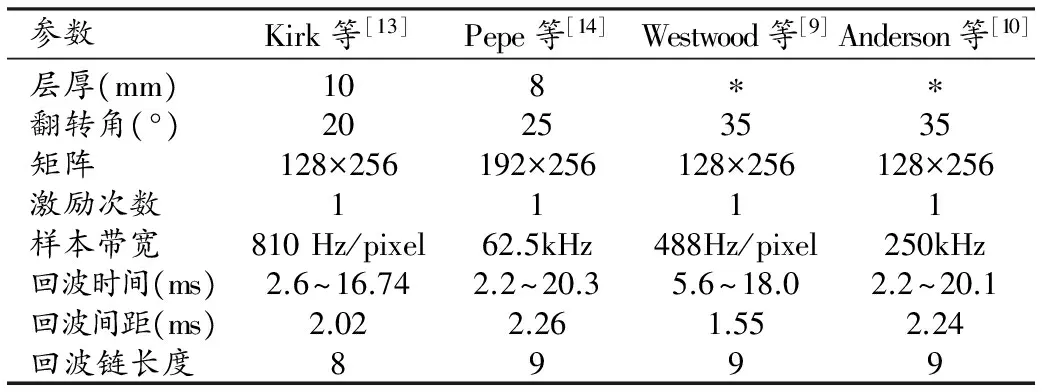
表1 不同研究者对CMR T2*WI成像的主要成像参数设定
注:*表示文献中未提及。
临床中心脏铁过载常见于遗传性血色素沉着病[15-16],需要长期输血来预防贫血的重型地中海贫血[17]等,这些患者大部分需要定期摄入大量的血红素铁。早期在动物试验中,Wood等[18]对沙鼠进行建模,发现心脏T2*值与心脏铁沉积呈负相关;随后,Wang等[19]和Quatre等[20]分别在人体上评估了左心室的射血分数与T2*间的关系:T2*gt;20 ms的患者射血分数是正常的;T2*值为10~20 ms的患者存在铁沉积,但尚不危及心功能;T2*lt;10 ms的患者存在铁沉积并危及心功能,需要去铁治疗。Carpenter等[21]在全球27个研究中心调查了3095例重型地中海型贫血患者,并用1.5T磁共振测量了心脏T2*值,指出T2*gt;20 ms时,表现为无明显铁过载,T2*在10~20 ms时,表现为明显铁过载,而当T2*lt;10 ms时,表现为重度铁过载,其发生心功能衰竭及死亡的几率明显增高;尽管在3.0T磁共振中,运用T2*WI序列对心脏铁过载的研究还未进行一个大样本的统计报道,但是在1.5T磁共振中CMR T2*WI成像已然成为了临床上预测、评估及治疗对于铁过载相关疾病的患者心脏功能受损严重程度的一项可靠指标。
2.CMR T2*WI成像在缺血性及非缺血性心脏病中的临床应用
CMR T2*WI成像也可用于缺血性心脏病中,主要表现在磁共振功能成像(functional magnetic resonance imaging,fMRI)[22],如血氧水平依赖(blood oxygenation-level dependent,BOLD)磁共振成像。其借助内源性对比剂——去氧血红蛋白,BOLD-CMR 成为一种可对心肌组织氧代谢进行无创性评价的检查方法。BOLD-CMR又分为静息态与药物负荷态两种形式。其药物负荷显像类似与心脏超声负荷显像,通过静脉注射扩张冠状动脉药物,如腺苷[23],利用其扩张冠状动脉,增加心肌血流量,故称其为负荷显像。Wacker等[24]及Manka等[5]研究了在缺血性心脏病患者中BOLD-CMR对于心肌缺血的反应,发现在静息态及药物负荷态BOLD-CMR均能检测缺血心肌节段(管腔狭窄≥50%)、非缺血心肌节段(管腔狭窄lt;50%)及正常心肌节段[25],随着冠脉狭窄程度越大,其静息态及药物负荷态T2*值越小,而药物负荷态T2*值的改变越显著;因而药物负荷态BOLD-CMR在识别心肌缺血敏感性及特异性高于静息态BOLD-CMR。Manka等[5]同时发现只有在正常心肌节段中,药物负荷态BOLD-CMR才能显著提高T2*值,而在缺血心肌节段及非缺血心肌节段中T2*值并无明显提高,由此提示,在缺血心肌节段及非缺血心肌节段中存在另一种病理机制,即微血管病变[26],表现为内皮细胞和内膜纤维增生,毛细血管基底膜增厚,血管管腔变窄等。故而BOLD-CMR也可用于非缺血性心肌病中,如糖尿病心肌病[27],其定义为无明显主要冠状动脉损害而呈现类似心肌病样的病理改变,糖尿病心肌病逐步发展将导致心肌僵硬、心室顺应性减退、心室壁节段运动异常,最终心肌细胞破坏、大量心肌收缩成分丧失,致使心肌收缩能力减弱。而其基本病理表现[28]:微血管病变,心肌肥厚,心肌纤维化和微血管血栓;在微血管病变主要表现为内皮细胞和内膜细胞纤维增生,毛细血管基膜增厚,血管腔变窄,心肌发生广泛而持久的慢性缺血缺氧。Paulu等[28]研究了31例2型糖尿病患者,通过联合磁共振波谱(magnetic resonance spectroscopy,MRS),BOLD-CMR及心肌灌注显像,指出随着心脏做功量的增加,冠状动脉微血管损伤会加重心脏能量代谢紊乱。
3.心肌再灌注出血的临床应用
心肌再灌注损伤中一个重要的因素就是心肌再灌注出血[7],由于出血的产物具有很强的顺磁性效应,如去氧血红蛋白、正铁血红蛋白或含铁血黄素都能导致T2*WI序列上信号的丢失[29],这些顺磁性效应能够造成局部磁场均匀性的改变,并缩短T2*磁豫时间。因此CMR T2*WI成像能够敏感的检测影响局部磁场均匀性改变的心肌微小出血。Kumar等[7]通过造模动物心肌梗死,发现通过CMR T2*WI成像能准确的发现并能量化在心肌梗死区出现的心肌再灌注出血,认为出血会导致更加严重的梗死相关的心肌损伤。Kali等[6]发现CMR T2*WI成像对于检出及定性急性心肌再灌注出血较CMR T2WI成像更加合适。在临床中,对于急性心肌梗死患者,如论是行经皮冠状动脉成形术(percutaneous transluminal coronary angioplasty,PTCA),还是行药物溶栓治疗,梗死心肌总有可能出现缺血-再灌注损伤,而对于作为一个重要的损伤因素,即再灌注出血,如果能在急性心肌梗死治疗后及时的监测到再灌注出血的存在,那么将可以指导临床治疗提供及时有效的应对措施,从而有助于挽救梗死心肌。
优势及不足
CMR T2*WI成像以其方便快速的成像速度,能无创性监测及评估心脏铁沉积、心肌缺血及出血等改变,显示了它在临床应用中的极大优势;通过单次呼吸控制及多回波采集数据,选取更短的TR及TE,加快了成像的速度,缩短了数据采集的时间;通过对心肌T2*值的测量,更有利于定量的评价心肌组织的生理或病理状态。
然而,CMR T2*WI成像也有其不足之处,由于目前对于心脏T2*值的测量,都是手动标记心肌兴趣区,故而容易产生抽样误差,而且由于磁敏感伪影、呼吸运动伪影及部分容积效应[30-31]的影响,故而降低了测量的准确性;由于其采用小翻转角激励,其回波幅度常常不如SE序列,故而其信噪比明显降低;由于目前国内外众多学者用于CMR T2*WI成像的后处理软件很多,无疑,软件的拟真度对试验的结果和结论有重要的影响[32]。
CMR T2*WI成像有着广泛应用前景,作为一项新兴的技术,具有无创、可靠、灵敏度高等优点,尤其对于心脏铁过载相关疾病的诊断,具有重要的诊断价值;而对于在缺血性及非缺血性心肌病以及再灌注出血方面的研究,尽管其缺乏一个大样本的研究分析,无法精确定量T2*值与缺血程度之间的关系,但是也在一定程度上对于指导临床治疗提供了一定的影像参考价值。相信在不久的就来,CMR T2*WI序列在临床的应用范围将会越来越广。
[1] Werring DJ.Cognitive dysfunction in patients with cerebral microbleeds on T2*-weighted gradient-echo MRI[J].Brain,2004,127(10):2265-2275.
[2] Mamisch TC,Hughes T,Mosher TJ,et al.T2star relaxation times for assessment of articular cartilage at 3T:a feasibility study[J].Skeletal Radiol,2012,41(3):287-292.
[3] Chavhan GB,Babyn PS,Thomas B,et al.Principles,techniques,and applications of T2*-based MR imaging and Its special applications1[J].Radiographics,2009,29(5):1433-1449.
[4] Carpenter JP,He T,Kirk P,et al.On T2*magnetic resonance and cardiac iron[J].Circulation,2011,123(14):1519-1528.
[5] Manka R,Paetsch I,Schnackenburg B,et al.BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia[J].J Cardiovasc Magn Reson,2010,12(1):54.
[6] Kali A,Tang RL,Kumar A,et al.Detection of acute reperfusion myocardial hemorrhage with cardiac MR imaging:T2versus T2[J].Radiology,2013,269(2):387-395.
[7] Kumar A,Green JD,Sykes JM,et al.Detection and quantification of myocardial reperfusion hemorrhage using T2*-weighted CMR[J].JACC Cardiovasc Imaging,2011,4(12):1274-1283.
[8] Pepe A,Lombardi M,Positano V,et al.Evaluation of the efficacy of oral deferiprone in beta-thalassemia major by multislice multiecho T2*[J].Eur J Haematol,2006,76(3):183-192.
[9] Westwood M,Anderson LJ,Firmin DN,et al.A single breath-hold multiecho T2*cardiovascular magnetic resonance technique for diagnosis of myocardial iron overload[J].J Magn Reson Imaging,2003,18(1):33-39.
[10] Anderson LJ,Holden S,Davis B,et al.Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload[J].Eur Heart J,2001,22(23):2171-2179.
[11] Hershko C,Link G,Cabantchik I.Pathophysiology of iron overload[J].Ann N Y Acad Sci,1998,850:191-201.
[12] Kirk P,Roughton M,Porter JB,et al.Cardiac T2*magnetic resonance for prediction of cardiac complications in thalassemia major[J].Circulation,2009,120(20):1961-1968.
[13] Kirk P,Smith GC,Roughton M,et al.Myocardial T2*is not affected by ageing,myocardial fibrosis,or impaired left ventricular function[J].J Magn Reson Imaging,2010,32(5):1095-1098.
[14] Pepe A,Positano V,Santarelli MF,et al.Multislice multiecho T2*cardiovascular magnetic resonance for detection of the heterogeneous distribution of myocardial iron overload[J].J Magn Reson Imaging,2006,23(5):662-668.
[15] Nijjar PS,Vongooru H,Tamene A,et al.Improvement in left ventricular function despite no change in T2*with iron chelation in secondary hemochromatosis[J].Minn Med,2015,98(7):47.
[16] Fleming RE,Ponka P.Iron overload in human disease[J].N Engl J Med,2012,366(4):348-359.
[17] Chen X,Zhang Z,Zhong J,et al.MRI assessment of excess cardiac iron in thalassemia major:when to initiate[J].J Magn Reson Imaging,2015,42(3):737-745.
[18] Wood JC,Otto-Duessel M,Aguilar M,et al.Cardiac iron determines cardiac T2*,T2,and T1in the gerbil model of iron cardiomyopathy[J].Circulation,2005,112(4):535-543.
[19] Wang ZJ,Lian L,Chen Q,et al.1/T2 and magnetic susceptibility measurements in a gerbil cardiac iron overload model[J].Radiology,2005,234(3):749-755.
[20] Quatre A,Jacquier A,Petit P,et al.MRI monitoring of myocardial iron overload:use of cardiac MRI combined with hepatic MRI in a cohort of multi-transfused patients with thalassaemia[J].Diagn Interv Imaging,2014,95(11):1065-1069.
[21] Carpenter JP,Roughton M,Pennell DJ.International survey of T2*cardiovascular magnetic resonance in beta-thalassemia major[J].Haematologica,2013,98(9):1368-1374.
[22] 孙倩,于瀛,胡玉川,等.2型糖尿病脑改变的fMRI研究进展[J].放射学实践,2016,31(2):138-140.
[23] Manka R,Paetsch I,Schnackenburg B,et al.BOLD cardiovascular magnetic resonance at 3.0 tesla in myocardial ischemia[J].J Cardiovasc Magn Reson,2010,12(1):54.
[24] Wacker CM,Hartlep AW,Pfleger S,et al.Susceptibility-sensitive magnetic resonance imaging detects human myocardium supplied by a stenotic coronary artery without a contrast agent[J].J Am Coll Cardiol,2003,41(5):834-840.
[25] Cerqueira MD,Weissman NJ,Dilsizian V,et al.Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart.A statement for healthcare professionals from the cardiac imaging committee of the council on clinical cardiology of the American heart association[J].Circulation,2002,105(4):539-542.
[26] Maseri A,Crea F,Kaski JC,et al.Mechanisms of angina pectoris in syndrome X[J].J Am Coll Cardiol,1991,17(2):499-506.
[27] Levelt E,Rodgers CT,Clarke WT,et al.Cardiac energetics,oxygenation,and perfusion during increased workload in patients with type 2 diabetes mellitus[J].Eur Heart J,2016,37(46):3461-3469.
[28] Paulus WJ,Tschope C.A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation[J].J Am Coll Cardiol,2013,62(4):263-271.
[29] Morioka T,Nishio S,Mihara F,et al.Usefulness of T2*weighted magnetic resonance image in the diagnosis of head injury on chronic stage[J].No To Shinkei,1999,51(8):703-708.
[30] Westwood M,Anderson LJ,Firmin DN,et al.A single breath-hold multiecho T2*cardiovascular magnetic resonance technique for diagnosis of myocardial iron overload[J].J Magn Reson Imaging,2003,18(1):33-39.
[31] Atalay MK,Poncelet BP,Kantor HL,et al.Cardiac susceptibility artifacts arising from the heart-lung interface[J].Magn Reson Med,2001,45(2):341-345.
[32] Roghi A,Poggiali E,Pedrotti P,et al.Myocardial and hepatic iron overload assessment by region-based and pixel-wise T2*mapping analysis:technical pitfalls and clinical warnings[J].J Comput Assist Tomogr,2015,39(1):128-133.
637007 四川,川北医学院附属医院放射科(王文斌、李裕丹、陈秋智、胡杉杉、杨帆、李春平);611130 成都,成都市第五人民医院放射科(杨智)
王文斌(1990-),男 ,湖南省常德市人,硕士,住院医师,主要从事胸部影像学研究。
李春平,E-mail:lichunping_1@163.com
四川省医学会青年创新课题(Q15023)
R445.2; R542.2
A
1000-0313(2017)11-1205-04
10.13609/j.cnki.1000-0313.2017.11.023
2016-12-07)